

2. 山西大学中医药现代研究中心,山西 太原 030006
2. Modern Research Center for Traditional Chinese Medicine, Shanxi University, Taiyuan 030006, China
肺动脉高压(pulmonary hypertension,PH)是由多种发病机制引起肺血管结构和功能改变,从而导致肺动脉压力超过一定界值的一种疾病状态。其诊断标准为:在海平面(不同海拔高度可换算成海平面),静息状态下,右心导管法测肺动脉平均压(mean pulmonary artery pressure,mPAP)≥25 mmHg[1]。2018年召开的第六届世界肺动脉高压大会上将PH分为五类,其中第三类就是肺部疾病和(或)低氧相关性肺动脉高压。
低氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)多发于慢性阻塞性肺疾病、间质性肺疾病和睡眠呼吸障碍患者,是一种由长期缺氧引起的肺动脉高压。HPH临床主要表现为劳动性呼吸困难、乏力晕厥等,有时还会引发心绞痛。临床病理特征为右心超负荷、右心室肥大等,严重的患者可出现右心衰竭,甚至死亡。
PH病理机制复杂,主要病理变化表现为肺血管持续性收缩引起的肺动脉张力增加,肺动脉内膜增生与中膜肥厚,导致的管腔狭窄。目前,已上市的治疗药物缺乏对HPH的针对性,因此,结合HPH的病理特点,寻找具有针对性的药物靶点和治疗药物,是治疗HPH的重要需求。本文综述HPH的病理机制、治疗药物及新药研发进展,以期为新药开发和拓展药物新用途提供思路。
1 HPH病理机制目前,普遍被认可的HPH的病理机制包括低氧刺激肺血管持续性收缩和不可逆重塑,所涉及的细胞结构包括血管内膜中的肺动脉内皮细胞(pulmonary artery endothelial cells,PAECs)和血管中膜中的肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)。当低氧发生时,肺血管收缩成为HPH发生的病理生理基础,占据HPH前期主要地位;而持续的收缩将导致肺血管发生不可逆重塑,成为HPH发展且难以治愈的主要原因。
1.1 低氧性肺血管持续收缩在机体缺氧初期,发生代偿适应性肺血管收缩,其生理意义在于减少缺氧肺泡周围的血流,使这部分血流转向通气充分的肺泡。但长期缺氧会使机体产生一种病理状态,导致肺动脉压力升高,最终发展成为肺动脉高压。其机制可能是缺氧刺激PAECs,引发内皮功能障碍,内皮素-1(endothelin-1,ET-1)和血栓素(thromboxanA2,TXA2)分泌增加,一氧化氮(nitric oxide,NO) 和前列环素(prostacyclin,PGI2)分泌减少,导致血管持续性收缩。同时,ET-1又可通过旁分泌的方式刺激PASMCs,使得细胞内Ca2+浓度升高引起血管收缩。
1.1.1 缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)与肺血管持续收缩HIF是一种调节氧稳态的转录因子,研究发现HIF可通过激活多种信号分子引起肺血管持续性收缩,从而诱发HPH[2]。HIF家族中的HIF-1α和HIF-2α均对HPH有影响,其中HIF-1α作用更加广泛,不仅诱导肺血管持续性收缩还影响肺血管重塑。
在PAECs中,短暂的缺氧会促使HIF-1α刺激ET-1分泌,ET-1与ET-B受体相结合促进NO释放。但PAECs长期缺氧时,ET-1会抑制诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)表达,NO释放减少,引起血管收缩。在PASMCs中,HIF-1α通过抑制电压门控钾通道(voltage-gated K+,Kv)开放,促进PASMCs去极化和钙通道开放,使得Ca2+内流,细胞内Ca2+浓度升高,从而引起肺血管收缩。此外,HIF-1α还可通过刺激瞬时受体电位阳离子通道(transient receptor potential channel,TRPC)高表达,诱导肺血管收缩[3]。
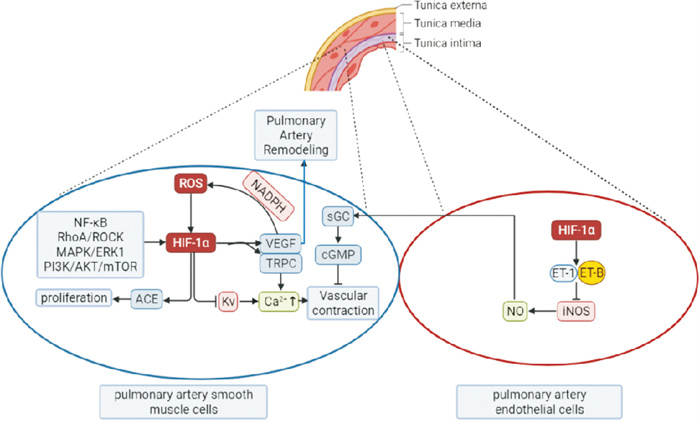
|
| Fig 1 Mechanism of HIF-1α in pathological process of hypoxic pulmonary hypertension |
eNOS可以特异性催化L-精氨酸生成L-瓜氨酸,同时释放NO,于1991年首次被Forstermann和Pollock在内皮细胞中发现。在肺脏中,NO由PAECs释放,经扩散到达PASMCs,激活可溶性鸟苷酸环化酶(soluble guanylate cyclase,sGC),促使三磷酸鸟苷酸(GMP)转化成环磷酸鸟苷酸(cGMP),从而舒张血管。缺氧发生时,eNOS活性降低,使得NO释放减少,血管舒张作用减弱。
1.1.3 15-脂氧合酶(15-lipoxygenase,15-LO)与肺血管持续收缩15-LO是一种催化脂质过氧化物生成的关键酶,可以催化花生四烯酸产生15-羟基二十碳四烯酸(15-hydroxyeicosatetraenoic acid,15-HETE)。研究发现,15-LO和15-HETE在HPH的病理进程中发挥着重要的作用。在缺氧时,15-LO的活性增强,底物15-HETE水平升高。
在PAECs中,15-HETE通过抑制eNOS的活性,或激活Rho相关丝氨酸/苏氨酸激酶(Rho-associated serine/threonine kinase,ROCK)通路,以及细胞外信号调节激酶1/2 (extracellular signal-regulated kinase 1/2,ERK1/2),引起肺血管收缩。在PASMCs中,15-HETE则是通过抑制Kv开放,或激活L型Ca2+通道,从而引起肺血管收缩[4]。此外,在PASMCs中,15-HETE还可促进细胞增殖,诱导肺血管重塑。
1.2 肺血管重塑在HPH的病程中,肺血管重塑发挥着重要作用,易造成不可逆性肺动脉高压。肺血管重塑主要表现为肺动脉内皮增厚、肺小动脉肌化、管腔狭窄和PASMCs异常增殖等。影响肺血管重塑的因素包括HIF-1α、炎症因子、细胞表型转换、骨形态发生蛋白信号、微小RNA和糖酵解等。
1.2.1 HIF-1α与肺血管重塑HIF-1α通过激活下游信号通路,促进细胞增殖和表型转换。在PAECs中,白介素-33(interleukin-33,IL-33)与其受体ST2结合激活HIF-1α,进而促进血管内皮生长因子-A(vascular endothelial growth factor-A,VEGF-A)释放,加快肺血管生成与重塑[5]。在PASMCs中,免疫球蛋白超家族成员黏附分子CD-146通过激活NF-κB,促进HIF-1α转录,同时,HIF-1α正反馈于CD-146,诱导细胞增殖,引起肺血管重塑。
研究表明CD-146-HIF-1α存在交叉调节,在调控PASMCs向合成表型转化和诱导细胞迁移中发挥着关键作用[6]。另有研究表明,在缺氧时,HIF-1α可通过激活P-选择素来促进PASMCs由收缩型向增殖表型转化。此外,HIF-1α还可通过破坏脑-肠-肺轴平衡、血管紧张素转化酶(angiotensin-converting enzyme,ACE)和血管紧张素转化酶2(angiotensin-converting enzyme-2,ACE-2)之间的平衡,诱导肺血管重塑。
1.2.2 炎症因子与肺血管重塑炎症因子与PH的发生密切相关,在PH中,炎症因子首先损伤的是PAECs,随后促进PASMCs增殖导致肺血管重塑。在低氧情况下,PAECs中白介素-17(interleukin-17,IL-17)表达增加,激活Wnt3a/β-catenin/细胞周期蛋白D1(cyclin D1,CCND1)信号通路,加快血管新生、细胞增殖与粘附[7]。在PASMCs中,缺氧通过激活caspase-1/IL-18/IL-6/信号转导和转录激活因子3(signal transducer and activator of transcription3,STAT3)通路,促进细胞增殖[8]。此外,白介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎症因子表达水平的升高,也可能会影响肺血管重塑。
1.2.3 细胞表型转换与肺血管重塑细胞表型转化是肺血管重塑的重要特征之一,主要表现为细胞增殖能力增强和特异性收缩蛋白表达水平降低。半乳糖凝集素家族-3(galectin-3,Gal-3)是凝集素家族的重要成员,广泛参与HPH的发生发展。在缺氧时,Gal-3表达增加,促进PAECs内皮间质转化(endothelial-mesenchymal transition,EndMT),同时还可引起PASMCs增殖和表型转换[9]。
此外,在PAECs中,低氧抑制骨形态发生蛋白受体2(bone morphogenetic protein receptor type 2,BMPR2)和Smad1/5的表达,诱导EndMT。在PASMCs,低氧通过抑制lncRNA CASC2的表达,促进PASMCs增殖和迁移,同时也诱导PASMCs由收缩型向合成型转化。
1.2.4 微小RNA(microRNA,miRNA)与肺血管重塑miRNA是一种非编码RNA,从表观遗传学上参与HPH,参与多种细胞信号通路的调节。在PAECs中,miR-27a通过抑制骨形态发生蛋白信号(bone morphogenetic protein,BMP)转导,减弱了DNA结合抑制因子2(inhibitior of DNA binding,Id2)对Snail和Twist的抑制作用,诱导EndMT[10]。在PASMCs中,低氧通过抑制miR150的表达,激活蛋白质丝氨酸苏氨酸激酶(protein-serine-threonine kinase,Akt)/雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路,促进细胞增殖[11]。此外,miR-26b的表达降低,可激活血清响应因子(SRP)和结缔组织生长因子(connective tissue growth factor,CTGF),诱导细胞周期由G0/G1期向S期转换,促进PASMCs增殖[12]。
1.2.5 其他信号通路参与肺血管重塑PASMCs异常增殖是引起肺血管重塑的重要原因之一,在PASMCs中,多种信号通路通过影响细胞增殖参与肺血管重塑。如:BMP2/转化生长因子-β(transforming growth factor-β,TGF-β)-Smad通路[13],磷酸肌醇3-激酶(phosphatidylinositol-3-kinases,PI3K)-叉头框蛋白M1(forkhead box protein M1,FoxM1)通路,PI3K/Akt和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK) / ERK1/2通路,氨基末端激酶(Jun N-terminal kinase,JNK) -STAT3-TGFβ-IL6通路和腺苷酸活化蛋白激酶α2(adenosine monophosphate-activated protein kinase α2,AMPKα2) -mTOR通路等。此外,低氧可促进PASMCs中己糖激酶2(hexokinase-2,HK2)的表达[14],激活糖酵解诱导肺血管重塑。
另有研究表明,PH还伴随着肺组织纤维化[15]。细胞焦亡(pyroptosis)是近年来发现并证实的一种坏死性和炎症性的新的细胞程序性死亡方式。在PASMCs中,低氧诱导胶质瘤相关癌基因蛋白-1 (glioma-associated oncogene family zinc finger 1,GLI1)高表达,激活细胞凋亡相关斑点样蛋白(apoptosis-associated speck-like,ASC),促进核苷酸结合寡聚化结构域样受体蛋白3 (nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)、Caspase-1和IL-18的表达,引起细胞焦亡。当细胞焦亡发生时,肺部组织发生纤维化,相关研究表明,细胞焦亡可能与HPH的发生密切相关[16]。同时,细胞凋亡也与肺组织纤维化密切相关,据报道,HPH发生时伴随着PAECs凋亡。
2 治疗药物及药物作用靶点目前,HPH的临床治疗药物主要以舒血管药物为主,但因缺乏具有肺动脉特异性的药物,治疗效果不佳。根据《中国肺动脉高压诊断与治疗指南(2021版)》提示,目前PH的治疗手段有多种,包括一般措施、基础治疗、特异性治疗、靶向药物联合治疗和药物间相互作用、球囊房间造口术及肺移植和心肺联合移植等。但临床上,PH的治疗主要以药物治疗为主。
目前,临床应用的治疗药物主要分为三大类:前列腺素I2受体激动剂,内皮素受体拮抗剂和磷酸二酯酶5抑制剂[17]。这些药物的主要作用都在于抑制肺血管收缩,对肺血管重塑影响较小。近年来的研究表明,肺血管重塑在HPH中占据着重要地位,抑制或延缓肺血管重塑成为HPH治疗药物研发的重要策略。
2.1 肺动脉高压的临床治疗药物现状见Tab 1。
| Target | Drug | Chemical structure | Administration | Institution |
| Endothelial receptor antagonist | Bosentan Hydrate |  |
p.o. | Actelion |
| Ambrisentan |  |
p.o. | Gilead | |
| Macitentan | 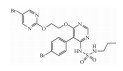 |
p.o. | Actelion | |
| Sitaxentan sodium | 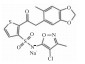 |
p.o. | Pfizer Canada Ulc | |
| Prostaglandin I2 receptor agonist | Beraprost sodium | 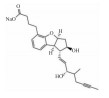 |
p.o. | Toray |
| Iloprost | 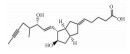 |
inhale | Bayer | |
| Treprostinil sodium |  |
i.v. p.o. inhale s.c. | United Therapeutics | |
| Selexipag | 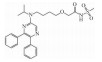 |
p.o. | Actelion | |
| Epoprostenol sodium | 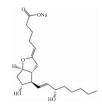 |
i.v. | Glaxosmithkline | |
| Phosphodiesterase-5 inhibitor | Sildenafil | 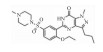 |
p.o. i.v. | Pfizer |
| Tadalafil | 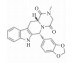 |
p.o. | Lilly | |
| Soluble guanylate cyclase stimulators | Riociguat | 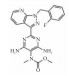 |
p.o. | Bayer |
| α receptor retardant | Tolazoline hydrochloride | 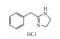 |
p.o. i.v. | Novartis |
目前,已上市的前列腺素I2受体激动剂有依前列醇钠(Epoprostenol sodium)、贝前列素钠(Beraprost sodium)、伊洛前列素(Iloprost)、曲前列尼尔钠(Treprostinil sodium)和司来帕格(Selexipag)等,它们与前列腺素受体相结合,舒张血管,降低肺动脉压力。以上药物是临床常用药物,但其疗效具有一定局限性。
2.1.2 内皮素受体拮抗剂内皮素受体拮抗剂通过与ET竞争性结合内皮素受体,阻断了ET的缩血管功能,临床用药包括:波生坦(Bosentan hydrate)、安贝生坦(Ambrisentan)、马西腾坦(Macitentan)和西他生坦钠(Sitaxentan sodium)等。这类药物临床应用较为广泛,治疗效果也需要进一步评价。
2.1.3 磷酸二酯酶5抑制剂PDE5是目前已确定PH的作用靶点,西地那非(Sildenafil)是国内首个上市用于治疗PH的PDE5抑制剂,此外,还有他达拉非(Tadalafil),它们都通过抑制PDE5的活性,降低PDE5对cGMP的抑制作用,促进血管舒张。这类药物是近年来研究的热点,也是目前认为降低肺动脉压比较有效的药物。
2.1.4 其他sGC激动剂利奥西呱(Riociguat)和α受体阻滞剂盐酸妥拉唑林(Tolazoline hydrochloride)在临床上也用于PH的治疗。
2.1.5 联合用药临床上使用单一抗肺动脉高压药物往往效果不佳,目前临床上,鼓励使用联合治疗的方式治疗肺动脉高压。联合用药的用药特点是作用于不同靶点,发挥共同作用。联合用药的优点是安全、可靠、易耐受,不仅能够降低疾病的临床恶化率,而且还能改善患者的生活质量,缺点是仍不能降低该疾病的病死率。
3 治疗HPH的药物研发现状 3.1 作用于已知靶点药物 3.1.1 eNOS激动剂研究表明,苹果多酚[18](Apple polyphenol)是从苹果中提取的一种酚类混合物,在PAECs中通过激活eNOS,促进NO的释放,刺激血管舒张。
3.1.2 抑制PI3K/AKT信号通路PI3K/AKT信号通路作用宽泛,与多种疾病的发病机制相关,包括参与肺血管重塑、PASMCs增殖与迁移等。据报道多种化合物都可通过抑制PI3K/AKT信号通路对HPH发挥预防及治疗作用,如白藜芦醇[19](Resveratrol)、丹参酮IIA磺酸钠[20](Sodium Tanshinone II Sulfonate A)、盐藻多糖[21](Fucoidan)和黄芩苷[22](Baicalin)等。
3.1.3 BMP2/TGF-β-Smad信号通路小檗碱[15](Berberine)是从黄连中提取出的一种生物碱,在PASMCs中通过调节BMP2/TGF-β-Smad信号通路,抑制细胞增殖。此外,芍药苷(Paeoniflorin)有上调BMPR2表达的作用。
3.2 作用于新靶点药物 3.2.1 15-LO抑制剂去甲二氢愈创木酸[23](Nordihydroguaiaretic acid)是一种15-LO抑制剂,通过抑制15-LO的活性,使15-HETE的水平降低。15-HETE下调加快了PASMCs凋亡,从而逆转缺氧引起的肺血管内皮增厚。
3.2.2 硒蛋白(SeP)抑制剂SeP抑制剂血根碱[24](Sanguinarine)通过抑制SeP的表达,抑制PASMCs增殖,改善肺血管重塑。
3.3 老药新用 3.3.1 HIF-1α抑制剂HIF-1α作用范围广,参与肺血管收缩和肺血管重塑。有研究表明,在PASMCs中,拓扑替康[3](Topotecan)可通过降低HIF-1α和TRPC1/4/6的表达,阻止Ca2+流入细胞,防止PASMCs表型转化,从而减慢肺血管重塑的发展。
3.3.2 RhoA/ROCK信号通路法舒地尔[25](Fasudil)和阿托伐他汀(Atorvastatin)都可通过抑制RhoA/ROCK通路,降低细胞内Ca2+浓度,促进血管舒张。
3.3.3 其它信号通路伊马替尼(Imatinib)通过抑制酪氨酸激酶的活性,抑制细胞增殖。17-β雌二醇(17β-Estradiol)可通过雌激素受体减弱肺血管的收缩作用。替吡法尼[26](Tipifarnib)通过抑制法尼基转移酶的活性,改善HPH。另有研究发现,埃他卡林[27] (Iptakalim)可通过激活eNOS,防止PAECs功能损伤。3-溴丙酮酸[16](3-Bromopyruvate)和葛根素[28](Puerarin)分别通过抑制糖酵解,减少自噬阻止肺血管重塑。此外,有文献报道,氯喹(Chloroquine)和硫酸脱氢表雄酮(Dehydroepiandrosterone sulphate)具有治疗HPH的作用,松果菊苷(Echinacoside)有预防HPH的作用。
经网站查询和文献调研发现,治疗HPH的药物只有较少数进入临床研究阶段,如羧基麦芽糖铁等。其他药物的研究尚未在临床上开展,目前还处于临床前研究阶段,研究药物如Tab 2。
| Chemical compound | Mechanism | Chemical structure | Administration | Dose |
| Topotecan | HIF-1 alpha inhibitor | 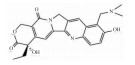 |
- | - |
| Apple polyphenol | activation eNOS | compound | i.p. | 20 mg·kg-1·(2d)-1 |
| Iptakalim | activation eNOS | 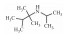 |
i.g. | 1.5 mg·kg-1·d-1 |
| Nordihydroguaiaretic acid | 15-LO inhibition | 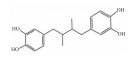 |
i.g. | 650 mg·kg-1·d-1 |
| Paeoniflorin | EMT inhibition | 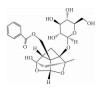 |
i.g. | 300 mg·kg-1·d-1 |
| Berberine | BMP2/TGF-β-Smad | 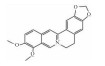 |
i.p. | 20-100 mg·kg-1·d-1 |
| 3-Bromopyruvate | HK-2 inhibition | 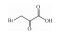 |
i.p. | 15 mg·kg-1·(2d)-1 |
| Sodium Tanshinone II Sulfonate A | PI3K/AKT/mTOR inhibition | 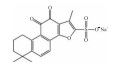 |
i.p. | 10-30 mg·kg-1·d-1 |
| Resveratrol | PI3K/AKT/mTOR inhibition | 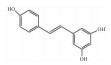 |
i.g. | 40 mg·kg-1·d-1 |
| Baicalin | CXCL-12/CXCR4/PI3K/AKT inhibition | 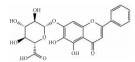 |
i.p. | 60 mg·kg-1·d-1 |
| Fucoidan | PI3K/Akt/mTOR/p70S6K inhibition | 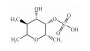 |
i.p. | 25 mg·kg-1·d-1 |
| Puerarin | autophagy inhibition | 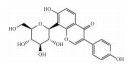 |
i.g. | 80 mg·kg-1·d-1 |
| S-(2-boronoethyl)-L-cysteine[29] | Arginase inhibitor | 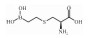 |
i.g. | 0.386 mg·kg-1·d-1 |
| Tetramethyl pyrazine[30] | TRPC inhibition | 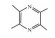 |
i.g. | 100 mg·kg-1·d-1 |
| Fasudi | RhoA/ROCK inhibitor | 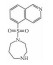 |
i.p. | 15 mg·kg-1·d-1 |
| Atorvastatin | RhoA/ROCK inhibitor | 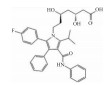 |
i.g. | 10 mg·kg-1·d-1 |
| Tipifarnib | farnesyltransferase inhibitor | 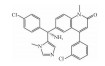 |
i.g. | 100 mg·kg-1·d-1 |
| Sanguinarine | Sep inhibitor | 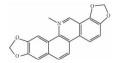 |
i.p. | 5 mg·kg-1·d-1 |
| Imatinib | tyrosine kinase inhibitor | 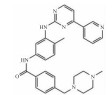 |
- | - |
近年来,随着对肺动脉高压病理机制研究的不断深入,研究者发现了多个疾病预防和治疗的潜在靶点及候选药物。作为肺动脉高压的其中一类,HPH疾病有其独特的特点,临床上需要在解决原发病的基础上,对HPH进行针对性治疗。然而目前临床使用药物局限于血管舒张药物,未考虑HPH疾病本身特点。疾病新靶点的发现,将弥补临床上缺乏改善低氧诱导的肺血管重塑的药物的不足,为HPH治疗药物的开发提供方向。此外,研究发现多种已上市药物在临床前HPH研究中取得比较好的药效,为老药新用提供思路。尽管许多候选药物尚未开展临床试验,但是我们相信随着研究的不断深入,HPH针对性治疗药物计日可待。
| [1] |
谢万木, 王辰. 肺动脉高压的概念与临床分类[M]//王辰, 翟振国, 杨媛华, 主编. 肺动脉高压. 第1版. 北京: 人民卫生出版社, 2014: 1-1. Xie W M, Wang C. Concept and clinical classification of pulmonary hypertension[M]//Wang C, Zhai Z G, Yang Y H, editor. Pulmonary hypertension. 1st edition. Beijing: People's Medical Publishing House, 2014: 1-1. |
| [2] |
Pullamsetti S S, Mamazhakypov A, Weissmann N, et al. Hypoxia-inducible factor signaling in pulmonary hypertension[J]. J Clin Invest, 2020, 130(11): 5638-51. doi:10.1172/JCI137558 |
| [3] |
Jiang Y, Zhou Y, Peng G, et al. Topotecan prevents hypoxia-induced pulmonary arterial hypertension and inhibits hypoxia-inducible factor-1α and TRPC channels[J]. Int J Biochem Cell Biol, 2018, 104: 161-70. doi:10.1016/j.biocel.2018.09.010 |
| [4] |
Lopez N C, Ebensperger G, Herrera E A, et al. Role of the RhoA/ROCK pathway in high-altitude associated neonatal pulmonary hypertension in lambs[J]. Am J Physiol Regul Integr Comp Physiol, 2016, 310(11): R1053-63. doi:10.1152/ajpregu.00177.2015 |
| [5] |
Liu J, Wang W, Wang L, et al. IL-33 initiates vascular remodelling in hypoxic pulmonary hypertension by up-regulating HIF-1α and VEGF expression in vascular endothelial cells[J]. EBioMedicine, 2018, 33: 196-210. doi:10.1016/j.ebiom.2018.06.003 |
| [6] |
Luo Y, Teng X, Zhang L, et al. CD146-HIF-1α hypoxic reprogramming drives vascular remodeling and pulmonary arterial hypertension[J]. Nat Commun, 2019, 10(1): 3551. doi:10.1038/s41467-019-11500-6 |
| [7] |
Wang L, Liu J, Wang W, et al. Targeting IL-17 attenuates hypoxia-induced pulmonary hypertension through downregulation of β-catenin[J]. Thorax, 2019, 74(6): 564-78. doi:10.1136/thoraxjnl-2018-211846 |
| [8] |
Udjus C, Cero F T, Halvorsen B, et al. Caspase-1 induces smooth muscle cell growth in hypoxia-induced pulmonary hypertension[J]. Am J Physiol Lung Cell Mol Physiol, 2019, 316(6): L999-1012. doi:10.1152/ajplung.00322.2018 |
| [9] |
Hao M, Li M, Li W. Galectin-3 inhibition ameliorates hypoxia-induced pulmonary artery hypertension[J]. Mol Med Rep, 2017, 15(1): 160-8. doi:10.3892/mmr.2016.6020 |
| [10] |
Liu T, Zou XZ, Huang N, et al. MiR-27a promotes endothelial-mesenchymal transition in hypoxia-induced pulmonary arterial hypertension by suppressing BMP signaling[J]. Life Sci, 2019, 227: 64-73. doi:10.1016/j.lfs.2019.04.038 |
| [11] |
Li Y, Ren W, Wang X, et al. MicroRNA-150 relieves vascular remodeling and fibrosis in hypoxia-induced pulmonary hypertension[J]. Biomed Pharmacother, 2019, 109: 1740-9. doi:10.1016/j.biopha.2018.11.058 |
| [12] |
Zhou S, Sun L, Cao C, et al. Hypoxia-induced microRNA-26b inhibition contributes to hypoxic pulmonary hypertension via CTGF[J]. J Cell Biochem, 2018, 119(2): 1942-52. doi:10.1002/jcb.26355 |
| [13] |
Chen M, Shen H, Zhu L, et al. Berberine attenuates hypoxia-induced pulmonary arterial hypertension via bone morphogenetic protein and transforming growth factor-β signaling[J]. J Cell Physiol, 2019, 234(10): 17482-93. doi:10.1002/jcp.28370 |
| [14] |
Chen F, Wang H, Lai J, et al. 3-Bromopyruvate reverses hypoxia-induced pulmonary arterial hypertension through inhibiting glycolysis: In vitro and in vivo studies[J]. Int J Cardiol, 2018, 266: 236-41. doi:10.1016/j.ijcard.2018.03.104 |
| [15] |
陈迪, 方莲花, 杜冠华. 黄酮类化合物抗肺动脉高压的研究进展[J]. 中国药理学通报, 2019, 35(3): 297-300. Chen D, Fang L H, Du G H. Research progress of flavonoids against pulmonary hypertension[J]. Chin Pharmacol Bull, 2019, 35(3): 297-300. |
| [16] |
He S, Ma C, Zhang L, et al. GLI1-mediated pulmonary artery smooth muscle cell pyroptosis contributes to hypoxia-induced pulmonary hypertension[J]. Am J Physiol Lung Cell Mol Physiol, 2020, 318(3): L472-82. doi:10.1152/ajplung.00405.2019 |
| [17] |
王辰, 翟振国. 中国肺动脉高压诊断与治疗指南(2021版)[J]. 中华医学杂志, 2021, 101(1): 11-51. Wang C, Zhai Z G. Guidelines for the diagnosis and treatment of pulmonary hypertension in China (2021 edition)[J]. Natl Med J China, 2021, 101(1): 11-51. |
| [18] |
Hua C, Zhao J, Wang H, et al. Apple polyphenol relieves hypoxia-induced pulmonary arterial hypertension via pulmonary endothelium protection and smooth muscle relaxation: In vivo and in vitro studies[J]. Biomed Pharmacother, 2018, 107: 937-44. doi:10.1016/j.biopha.2018.08.080 |
| [19] |
Xu D, Li Y, Zhang B, et al. Resveratrol alleviate hypoxic pulmonary hypertension via anti-inflammation and anti-oxidant pathways in rats[J]. Int J Med Sci, 2016, 13(12): 942-54. doi:10.7150/ijms.16810 |
| [20] |
Bao Y R, Chen J W, Jiang Y, et al. Sodium tanshinone Ⅱ sulfonate A ameliorates hypoxia-induced pulmonary hypertension[J]. Front Pharmacol, 2020, 11: 687. doi:10.3389/fphar.2020.00687 |
| [21] |
Novoyatleva T, Kojonazarov B, Owczarek A, et al. Evidence for the fucoidan/P-selectin axis as a therapeutic target in hypoxia-induced pulmonary hypertension[J]. Am J Respir Crit Care Med, 2019, 199(11): 1407-20. doi:10.1164/rccm.201806-1170OC |
| [22] |
Huang X, Wu P, Huang F, et al. Baicalin attenuates chronic hypoxia-induced pulmonary hypertension via adenosine A2A receptor-induced SDF-1/CXCR4/PI3K/AKT signaling[J]. J Biomed Sci, 2017, 24(1): 52. doi:10.1186/s12929-017-0359-3 |
| [23] |
Ma J, Liang S, Wang Z, et al. ROCK pathway participates in the processes that 15-hydroxyeicosatetraenoic acid (15-HETE) mediated the pulmonary vascular remodeling induced by hypoxia in rat[J]. J Cell Physiol, 2010, 222(1): 82-94. doi:10.1002/jcp.21923 |
| [24] |
Kikuchi N, Satoh K, Kurosawa R, et al. Selenoprotein P promotes the development of pulmonary arterial hypertension: Possible novel therapeutic target[J]. Circulation, 2018, 138(6): 600-23. doi:10.1161/CIRCULATIONAHA.117.033113 |
| [25] |
Sun X Z, Li S Y, Tian X Y, et al. Effect of Rho kinase inhibitor fasudil on the expression ET-1 and NO in rats with hypoxic pulmonary hypertension[J]. Clin Hemorheol Microcirc, 2019, 71(1): 3-8. doi:10.3233/CH-160232 |
| [26] |
Duluc L, Ahmetaj S B, Mitchell J, et al. Tipifarnib prevents development of hypoxia-induced pulmonary hypertension[J]. Cardiovascular research, 2017, 113(3): 276-87. doi:10.1093/cvr/cvw258 |
| [27] |
Zhu R, Bi LQ, Wu SL, et al. Iptakalim attenuates hypoxia-induced pulmonary arterial hypertension in rats by endothelial function protection[J]. Mol Med Rep, 2015, 12(2): 2945-52. doi:10.3892/mmr.2015.3695 |
| [28] |
Zhang X, Liu Q, Zhang C, et al. Puerarin prevents progression of experimental hypoxia-induced pulmonary hypertension via inhibition of autophagy[J]. J Pharmacol Sci, 2019, 141(2): 97-105. doi:10.1016/j.jphs.2019.09.010 |
| [29] |
Chu Y, Xiang Li X, Niu H, et al. Arginase inhibitor attenuates pulmonary artery hypertension induced by hypoxia[J]. Mol Cell Biochem, 2016, 412(1-2): 91-9. doi:10.1007/s11010-015-2611-z |
| [30] |
Chen Y, Lu W, Yang K, et al. Tetramethylpyrazine: A promising drug for the treatment of pulmonary hypertension[J]. Br J Pharmacol, 2020, 177(12): 2743-64. doi:10.1111/bph.15000 |

