

中药药性理论是中药最重要的基本理论之一, 目前对中药单体有效成分药性的研究仍不完善, 结合早期学者提出的“药性分子假说”中对有效成分药性的阐释[1], 以及其后匡海学等[2]提出的“中药性味理论新假说”中提倡的从有效成分层面探讨中药药性, 基于以上假说和思想, 我们推测作为人参属中药中主要有效成分的人参单体皂苷也应该具有各自相应的药性(气), 并期望建立出人参单体皂苷的药性(气)评价方法。考虑到临床经验总结分析中药药性对机体的生理功能有不同作用, 本实验室前期对中药药性与细胞增殖关系的研究[3], 以及研究者对中药药性与能量代谢关系的研究[4], 本研究拟通过进行人参单体皂苷与药性相关性分析, 并测定人参皂苷对人肝细胞LO2与猪大脑皮层Na+/K+-ATPase活力影响来评价人参单体皂苷药性。若本研究结果与中医临床理论一致, 与现有研究成果一致, 即温热药性的人参单体皂苷呈兴奋作用, 寒凉药性的人参单体皂苷呈抑制作用, 则表明该评价方法可行, 从而提出人参单体皂苷的药性(气)评价方法。
1 材料与方法 1.1 药物与试剂人肝细胞LO2(中国科学院上海细胞库);猪大脑皮层ATPase(批号:SLBN7649V美国Sigma);人参皂苷R-Rg3、Ro、Rb1、Rd、Re、Rg1、F11、Rf、Rb2、Rb3、Rc、Rg2、Rh1、三七皂苷R1和齐墩果酸(OA)均为本实验室分离自制, 纯度均>95%;R-Rh2(批号:HG027746198宝鸡市辰光生物科技有限公司);去乙酰毛花苷注射液(批号:161105上海禾丰制药有限公司);四甲基偶氮唑蓝(批号:1117X0514北京Solarbio公司);二甲基亚砜(批号:520C0313美国SIGMA公司);RPMI1640培养基(批号:8117244美国Gibco公司);0.25%胰蛋白酶(批号:1860129美国Gibco公司);胎牛血清(批号:1050B5061上海李记生物科技有限公司);双抗(批号:J160035美国Hyclone公司);PBS磷酸盐缓冲液(批号:1016K022北京Solarbio公司);超微量Na+/K+-ATPase试剂盒(批号:20180529南京建成);总ATPase试剂盒(批号:20171219南京建成);蛋白定量试剂盒(批号:20180504南京建成)
1.2 仪器可调式移液器(美国RAININ公司);KQ-250DE超声波清洗器(昆山市超声仪器有限公司);UV-2100紫外分光光度计(上海UNICO公司);HH-S型电热恒温水浴锅(巩义市予华仪器有限责任公司);NU-4750型CO2培养箱(美国NUAIRE公司);HD2-BCN-1360B生物洁净工作台(北京东联哈尔仪器制造有限公司);AE31EF型倒置显微镜(Motic公司);Caretium酶标仪(深圳市凯特生物医疗电子科技有限公司);U570-86 Premium系列超低温冰箱(-80 ℃)(美国NBS公司);TDZ4-WS低速台式离心机(湘仪离心机);滤器(0.22 μm)(Millex.GP);96孔无菌培养板(Corning公司);6孔无菌培养板(Corning公司);BXM-30R型立式压力蒸汽灭菌器(上海博迅实业有限公司)
1.3 主要试剂的配制(1) 10% RPMI1640培养液:取适量RPMI1640培养基, 并加入1%双抗和10%于56 ℃灭活胎牛血清, 0.22 μm滤膜过滤, 4 ℃冰箱保存备用。(2)MTT溶液:称取50 mg MTT, 用10 mL的PBS(pH 7.4, 0.01 mol·L-1)将MTT溶解, 用0.22 μm的微孔滤器过滤除菌, 分装, -20 ℃避光保存备用。(3)待测液的配制:各单体皂苷储备液采用DMSO配置, -20 ℃冷冻保存备用。
1.4 利用双变量相关分析评价人参皂苷药性(气)通过检索关于三七、红参、人参、西洋参、人参叶皂苷含量测定相关文献[5-6], 收集整理5种中药中Rg1、Re、Rb1、Rc、Rb2、Rd、Rg2、Rf、Ro、Rg3、F11、R1含量数据, 依据中国药典中含量测定项下规定, 剔除不满足药典规定样品, 得出满足药典规定的每种中药各十批样品中皂苷类成分含量数据(Tab 1)。同时将药性赋值[7], 即寒-2、凉-1、微温0.5、温1。将药性属性由寒到温依次从小到大编秩, 相同药性秩次X相加求平均值得秩次Y, 如Tab 2所示, 将各药材皂苷含量及药性录入SPSS 17.0软件, 做双变量相关分析, 得出药性(气)与各皂苷含量之间相关性。
| Rg1 /mg·g-1 |
Re /mg·g-1 |
Rb1 /mg·g-1 |
Rc /mg·g-1 |
Rb2 /mg·g-1 |
Rd /mg·g-1 |
Rg2 /mg·g-1 |
Rf /mg·g-1 |
Ro /mg·g-1 |
Rg3 /mg·g-1 |
F11 /mg·g-1 |
R1 /mg·g-1 |
|
| NG1 | 39.10 | 5.10 | 30.39 | 1.45 | 0 | 6.97 | 1.57 | 0.80 | 0 | 0 | 0 | 6.76 |
| NG2 | 42.40 | 6.30 | 26.70 | 2.90 | 0 | 9.50 | 1.30 | 1.60 | 0 | 0 | 0 | 11.20 |
| NG3 | 42.00 | 6.20 | 36.70 | 3.00 | 0 | 12.70 | 1.10 | 1.70 | 0 | 0 | 0 | 7.90 |
| NG4 | 36.10 | 6.50 | 22.60 | 3.00 | 0 | 7.70 | 1.00 | 0.40 | 0 | 0 | 0 | 10.10 |
| NG5 | 41.10 | 6.30 | 27.20 | 3.00 | 0 | 9.10 | 1.40 | 1.90 | 0 | 0 | 0 | 13.40 |
| NG6 | 44.10 | 4.40 | 39.60 | 3.00 | 0 | 7.00 | 1.00 | 0.40 | 0 | 0 | 0 | 10.00 |
| NG7 | 37.60 | 6.80 | 27.20 | 3.10 | 0 | 10.20 | 1.50 | 2.10 | 0 | 0 | 0 | 13.60 |
| NG8 | 42.50 | 5.80 | 29.60 | 2.80 | 0 | 10.40 | 0.80 | 1.50 | 0 | 0 | 0 | 9.10 |
| NG9 | 36.00 | 6.10 | 26.20 | 3.10 | 0 | 9.20 | 1.90 | 1.60 | 0 | 0 | 0 | 9.20 |
| NG10 | 25.90 | 4.90 | 37.20 | 3.00 | 0 | 7.30 | 0.80 | 0.40 | 0 | 0 | 0 | 8.20 |
| RG1 | 2.17 | 2.96 | 3.24 | 2.32 | 2.81 | 0.70 | 1.14 | 0.61 | 0.50 | 0.05 | 0 | 0 |
| RG2 | 3.00 | 1.50 | 3.60 | 1.70 | 1.20 | 1.30 | 1.40 | 1.50 | 0.50 | 0.30 | 0 | 0 |
| RG3 | 3.30 | 1.70 | 3.40 | 1.90 | 1.20 | 1.30 | 1.51 | 1.70 | 0.57 | 0.30 | 0 | 0 |
| RG4 | 3.50 | 1.70 | 3.80 | 1.90 | 1.40 | 1.40 | 1.70 | 1.70 | 0.62 | 0.30 | 0 | 0 |
| RG5 | 3.20 | 2.00 | 3.10 | 1.40 | 1.10 | 1.20 | 1.31 | 2.00 | 0.52 | 0.30 | 0 | 0 |
| RG6 | 3.30 | 2.10 | 4.30 | 2.20 | 1.40 | 1.50 | 1.47 | 2.10 | 0.68 | 0.40 | 0 | 0 |
| RG7 | 2.51 | 1.14 | 2.82 | 1.43 | 1.70 | 0.38 | 1.29 | 0.54 | 0.57 | 0.08 | 0 | 0 |
| RG8 | 3.20 | 1.60 | 3.40 | 1.90 | 1.30 | 1.30 | 1.39 | 1.60 | 0.67 | 0.30 | 0 | 0 |
| RG9 | 3.30 | 1.80 | 4.10 | 1.90 | 1.30 | 1.30 | 1.16 | 1.80 | 0.61 | 0.40 | 0 | 0 |
| RG10 | 3.40 | 1.70 | 3.70 | 1.90 | 1.30 | 1.40 | 1.39 | 1.70 | 0.69 | 0.30 | 0 | 0 |
| GS1 | 2.93 | 2.12 | 3.82 | 3.62 | 3.27 | 1.84 | 0.27 | 1.00 | 2.71 | 0 | 0 | 0.03 |
| GS2 | 3.44 | 2.27 | 2.73 | 2.27 | 1.97 | 0.84 | 0.26 | 1.15 | 3.14 | 0 | 0 | 0.80 |
| GS3 | 2.79 | 3.65 | 5.36 | 2.48 | 3.92 | 0.64 | 0.30 | 0.76 | 1.97 | 0 | 0 | 0.97 |
| GS4 | 3.87 | 3.13 | 5.40 | 1.43 | 4.08 | 0.96 | 0.36 | 1.09 | 3.68 | 0 | 0 | 0.60 |
| GS5 | 3.14 | 3.29 | 4.19 | 3.84 | 3.05 | 1.46 | 0.33 | 1.15 | 3.83 | 0 | 0 | 0.60 |
| GS6 | 3.20 | 2.95 | 4.37 | 3.08 | 2.65 | 1.18 | 0.31 | 1.06 | 4.44 | 0 | 0 | 0.50 |
| GS7 | 2.76 | 1.55 | 2.95 | 2.61 | 2.71 | 1.54 | 0.12 | 0.85 | 4.06 | 0 | 0 | 0.70 |
| GS8 | 2.32 | 2.26 | 3.10 | 2.80 | 1.87 | 1.03 | 0.27 | 0.88 | 2.43 | 0 | 0 | 0.40 |
| GS9 | 2.92 | 2.99 | 4.90 | 3.12 | 3.89 | 1.30 | 0.29 | 0.82 | 2.57 | 0 | 0 | 0.56 |
| GS10 | 2.45 | 2.03 | 3.64 | 2.92 | 2.34 | 1.36 | 0.22 | 0.75 | 2.49 | 0 | 0 | 0.40 |
| AG1 | 4.70 | 13.00 | 26.30 | 3.00 | 2.80 | 6.10 | 3.00 | 0 | 0 | 0 | 1.30 | 0 |
| AG2 | 4.70 | 13.00 | 18.50 | 3.40 | 2.80 | 5.20 | 2.90 | 0 | 0 | 0 | 1.40 | 0 |
| AG3 | 4.60 | 14.10 | 25.70 | 3.20 | 2.80 | 6.20 | 2.80 | 0 | 0 | 0 | 1.50 | 0 |
| AG4 | 5.20 | 14.80 | 21.20 | 4.00 | 2.80 | 6.50 | 3.00 | 0 | 0 | 0 | 2.00 | 0 |
| AG5 | 4.80 | 11.80 | 21.10 | 3.70 | 2.80 | 6.10 | 2.90 | 0 | 0 | 0 | 2.10 | 0 |
| AG6 | 4.80 | 12.10 | 25.00 | 3.50 | 2.80 | 6.40 | 2.80 | 0 | 0 | 0 | 1.60 | 0 |
| AG7 | 4.80 | 13.20 | 21.30 | 3.40 | 2.80 | 6.60 | 3.00 | 0 | 0 | 0 | 1.60 | 0 |
| AG8 | 4.80 | 13.60 | 19.60 | 3.40 | 2.80 | 5.60 | 2.90 | 0 | 0 | 0 | 1.80 | 0 |
| AG9 | 4.70 | 13.10 | 14.80 | 3.20 | 2.80 | 5.20 | 2.80 | 0 | 0 | 0 | 1.40 | 0 |
| AG10 | 4.60 | 14.70 | 22.00 | 3.10 | 2.80 | 6.10 | 2.80 | 0 | 0 | 0 | 1.30 | 0 |
| GL1 | 11.50 | 30.90 | 2.70 | 0 | 5.50 | 12.90 | 0 | 0 | 0 | 0.09 | 0 | 0 |
| GL2 | 15.11 | 31.09 | 5.40 | 0 | 4.92 | 14.86 | 0 | 0 | 0 | 0 | 0 | 0 |
| GL3 | 16.94 | 40.26 | 2.16 | 4.25 | 6.36 | 5.40 | 0 | 0 | 0 | 0 | 0 | 0 |
| GL4 | 10.80 | 29.00 | 2.40 | 0 | 4.70 | 11.40 | 0 | 0 | 0 | 0 | 0 | 0 |
| GL5 | 12.20 | 28.90 | 1.30 | 0 | 5.50 | 18.50 | 0 | 0 | 0 | 0 | 0 | 0 |
| GL6 | 16.70 | 37.30 | 1.60 | 0 | 3.30 | 8.80 | 0 | 0 | 0 | 0 | 0 | 0 |
| GL7 | 9.76 | 23.06 | 1.30 | 0 | 4.65 | 27.71 | 0 | 0 | 0 | 0 | 0 | 0 |
| GL8 | 17.00 | 37.90 | 3.10 | 0 | 8.70 | 17.00 | 0 | 0 | 0 | 0 | 0 | 0 |
| GL9 | 14.50 | 35.50 | 3.50 | 0 | 8.40 | 17.10 | 0 | 0 | 0 | 0 | 0 | 0 |
| GL10 | 11.20 | 26.60 | 1.30 | 0 | 5.90 | 15.40 | 0 | 0 | 0 | 0 | 0 | 0 |
| Sample No | Rank order X | medicine nature | Rank order Y | Sample No | Rank order X | medicine nature | Rank order Y |
| 1 | -2 | -2 | 2.5 | 21 | 0.5 | 0.5 | 5 |
| 2 | -1 | -2 | 2.5 | 22 | 1.5 | 0.5 | 5 |
| 3 | 0 | -2 | 2.5 | 23 | 2.5 | 0.5 | 5 |
| 4 | 1 | -2 | 2.5 | 24 | 3.5 | 0.5 | 5 |
| 5 | 2 | -2 | 2.5 | 25 | 4.5 | 0.5 | 5 |
| 6 | 3 | -2 | 2.5 | 26 | 5.5 | 0.5 | 5 |
| 7 | 4 | -2 | 2.5 | 27 | 6.5 | 0.5 | 5 |
| 8 | 5 | -2 | 2.5 | 28 | 7.5 | 0.5 | 5 |
| 9 | 6 | -2 | 2.5 | 29 | 8.5 | 0.5 | 5 |
| 10 | 7 | -2 | 2.5 | 30 | 9.5 | 0.5 | 5 |
| 11 | -1 | -1 | 3.5 | 31 | 1 | 1 | 5.5 |
| 12 | 0 | -1 | 3.5 | 32 | 2 | 1 | 5.5 |
| 13 | 1 | -1 | 3.5 | 33 | 3 | 1 | 5.5 |
| 14 | 2 | -1 | 3.5 | 34 | 4 | 1 | 5.5 |
| 15 | 3 | -1 | 3.5 | 35 | 5 | 1 | 5.5 |
| 16 | 4 | -1 | 3.5 | 36 | 6 | 1 | 5.5 |
| 17 | 5 | -1 | 3.5 | 37 | 7 | 1 | 5.5 |
| 18 | 6 | -1 | 3.5 | 38 | 8 | 1 | 5.5 |
| 19 | 7 | -1 | 3.5 | 39 | 9 | 1 | 5.5 |
| 20 | 8 | -1 | 3.5 | 40 | 10 | 1 | 5.5 |
为评价各成分贡献大小, 原始数据的变换采用初值化变换法。以中药药性赋值作为母序列(赋值分别为寒-2、凉-1、微温0.5、温1), 中药中各批次的成分含量作为子序列。按照灰色关联度计算方法计算灰色关联度。
1.6 利用网络药理学预测不同药性的人参属五种常用中药对于代谢通路的调节作用 1.6.1 人参属五种常用中药主要活性成分提取利用中药系统药理学数据库与分析平台TCMSP (http://lsp.nwu.edu.cn/tcmsp.php), 以口服生物利用度(OB)≥30%和类药性(DL)≥0.18作为阈值对结果进行筛选, 分别查找5种中药的主要活性成分及与主要活性成分相关的潜在靶点。
1.6.2 人参属五种常用中药中皂苷成分提取利用数据库TCMSP, 分别查找5种中药中皂苷成分及与其相关的潜在靶点。
1.6.3 人参属五种常用中药靶点预测利用TCMSP数据库和SwissTargetPrediction (http://www.swisstargetprediction.ch/)数据库, 将1.6.2项下获得的活性成分转化为标准SMILES格式, 导入平台分析, 设置属性为“homo sapiens”, 将靶点概率值不小于0的分子作为该成分有效靶点。
1.6.4 KEGG通路富集分析利用R 3.6.3 (https://www.r-project.org)软件中Bioconductor (org.Hs.eg.db)合集对各药材不同蛋白模块的靶点进行KEGG信号通路富集分析, 分别得到五种中药所涉及的代谢通路。在此基础上, 通过对比去重的方法剔除寒凉、温性中药共同涉及的代谢通路, 得到寒凉性中药和温性中药的特异性代谢通路。
1.7 人参皂苷对人肝细胞内Na+/K+-ATPase活力调控作用研究利用MTT法筛选对细胞无抑制作用人参皂苷浓度进行Na+/K+-ATPase活力测定, 取对数生长期人肝细胞LO2, 以1×108·L-1密度将其接种于6孔培养板上, 每孔2 mL, 置于5% CO2培养箱中培养24 h待细胞贴壁后, 更换新鲜培养液。分别加入含终质量浓度分别为1、10 μmol·L-1含人参皂苷R-Rg3、S-Rg3、Re、Rb1、Rg1、Rd、OA、Ro和PPT的培养液, 空白对照组只加培养液, 每个处理组设3个重复, 继续培养细胞48 h。将各处理组细胞用0.25%胰酶消化, 1 000 r·min-1离心5 min收集细胞, 生理盐水洗2遍以除掉残留的培养液或磷酸缓冲盐溶液, 弃上清, 留下层细胞, 用生理盐水制备109-1010 ·L-1的细胞悬液(500 μL), 经超声波细胞破碎机破碎细胞后(功率10%, 4 s/次, 间隔8 s, 重复8~10次), 按照Na+/K+-ATPase试剂盒说明书进行测定, 同时采用BCA法检测细胞总蛋白浓度。
1.8 人参皂苷对猪大脑皮层ATPase活力调控作用研究分别将终蛋白浓度为12.5 mg·L-1的猪大脑皮层ATP酶与终浓度为100、10、1、0.1 μmoL·L-1的Rb1、Rb2、Rb3、Rc、Rd、R-Rg3、R-Rh2、Ro、Re、Rg1、、Rf、Rg2、Rh1、三七皂苷R1、Deslanoside和齐墩果酸(OA)溶液混合后制成待测样本, 每个浓度设3个重复, 按照Na+/K+-ATPase试剂盒说明书操作步骤进行。
1.9 数据处理数据采用2016 OFFICE EXCEL按照试剂盒说明书中公式进行计算后采用SPSS 17.0统计软件, 采用One-Way ANOVA进行比较。
2 结果 2.1 双变量相关分析结果及灰色关联度法评价结果当Kendall相关系数>0时表明与温热药性相关, Kendall相关系数 < 0则与寒凉药性相关(Tab 3)。其中与温热药性相关的人参皂苷的相关程度顺序为Rf>R1>Rg3>Rg2>Rb1>Ro, 与寒凉药性相关的人参皂苷的相关程度顺序为Rb2>Re>Rd>F11, 另外Rg1、Rc与寒热药性无显著性相关, 可能为平性。灰色关联度分析结果表明, 人参皂苷含量对人参属中药药性的贡献程度为F11>Re>Rg2>Rd>Rb2>Rb1>Rg1>Rc>Rg3>R1>Rf>Ro。
| Ginsenosides | Kendall correlation coefficient | Correlation degree |
| Rf | 0.714** | 0.635 2 |
| R1 | 0.475** | 0.643 2 |
| Rg3 | 0.410** | 0.646 9 |
| Rg2 | 0.293** | 0.673 9 |
| Rb1 | 0.285** | 0.664 9 |
| Ro | 0.237* | 0.627 9 |
| Rc | -0.001 | 0.655 3 |
| Rg1 | -0.165 | 0.655 5 |
| F11 | -0.317* | 0.717 2 |
| Rd | -0.335** | 0.673 8 |
| Re | -0.641** | 0.682 6 |
| Rb2 | -0.758** | 0.670 4 |
| A significant correlation at the *P < 0.05 level (bilateral), A significant correlation at the **P < 0.01 level (bilateral) | ||
检索数据库TCMSP, 共筛选到三七成分20个, 红参19个, 人参41个, 西洋参27个, 人参叶33个。经过KEGG信号通路富集分析, 并对结果对比去重后, 分别得到温性和寒凉性药物组特异性代谢通路27个和13个。由Fig 1~2可知, 性温的三七与红参及性微温的人参与AMPK信号通路、ErbB信号通路、FoxO信号通路与MAPK信号通路等相关, 而性凉的西洋参与性寒的人参叶参与钙信号通路、NOD样受体信号通路与VEGF信号通路等相关。其中AMPK信号通路与ATP的生成与消耗相关, 而ATPase在物质运输、信息传递和能量代谢等方面起着重要作用, 随着Na+-K+-ATPase活力增加, 能量消耗和热量产生也随之增加, 因此进一步肯定了可以通过测定Na+-K+-ATPase活力评价药性。
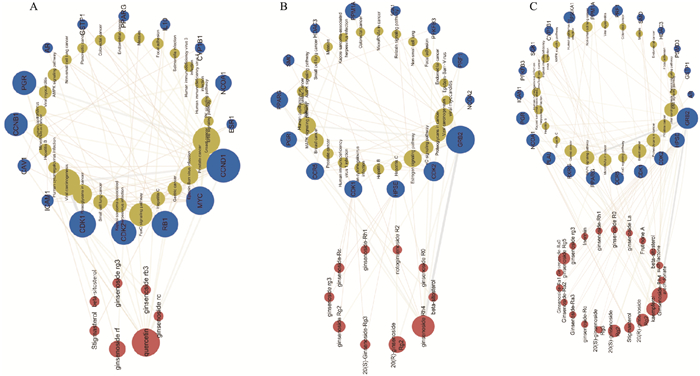
|
| Fig 1 Effective components of warm ginseng traditional Chinese medicine - key targets - pathway diagram A: Panax notoginseng; B: Red ginseng; C: Ginseng. The red part was the active ingredient, the yellow part was the pathway, and the blue part was the target. |
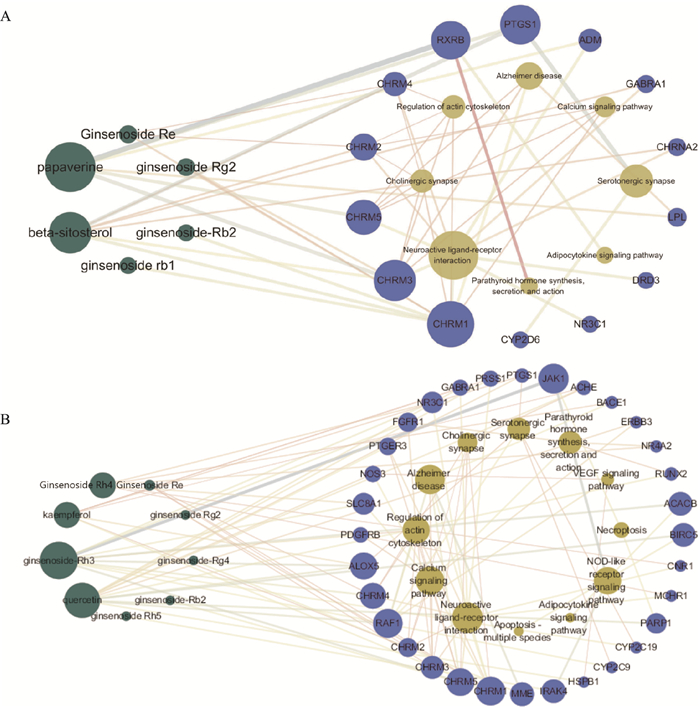
|
| Fig 2 Effective components of cold ginseng traditional Chinese medicine - key targets-pathway map A: American ginseng; B: ginseng leaves. The green part was the active ingredient, the yellow part was the pathway, and the blue part was the target. |
由Fig 3B可知, 人参皂苷Rg3、Re、Rd与Ro对肝细胞内Na+/K+-ATPase活力呈抑制作用, 可能为寒凉药性, 人参皂苷Rb1、Rg1对其呈促进趋势, 可能为温热药性, 而OA对其无明显作用, 可能为平性。但考虑到Rg3与Ro的抑制作用可能与其细胞毒性有关(Fig 3A), 细胞内Na+/K+-ATPase活力评价药性有一定局限性, 则后续利用市售猪大脑皮层ATPase对人参单体皂苷药性进行评价。
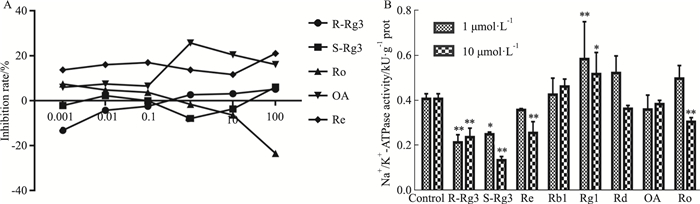
|
| Fig 3 Effect of ginsenoside on proliferation of human hepatocytes(A), and effect of ginsenoside on Na+/K+-ATPase activity in human hepatocytes (B) *P < 0.05, **P < 0.01 vs control group |
以去乙酰毛花苷(Deslanoside)为阳性对照, 由Fig 4可知, Deslanoside能有效抑制猪大脑皮层Na+/K+-ATPase活力, 证实该酶活力正常。在0.1 ~100 μmol·L-1浓度范围内, 人参皂苷Rb1、Rb3、Rc、Rf、Rg2、Rg1与Rh1能够增强Na+/K+-ATPase活力, 而Rg3、R1与Ro在0.1 μmol·L-1时能够增强Na+/K+-ATPase活力, 但随着浓度升高表现出抑制的作用。人参皂苷Rb2、Rd、Rh2、Re及OA均具有抑制Na+/K+-ATPase活力的作用, 且随着浓度增高, 抑制作用增强。
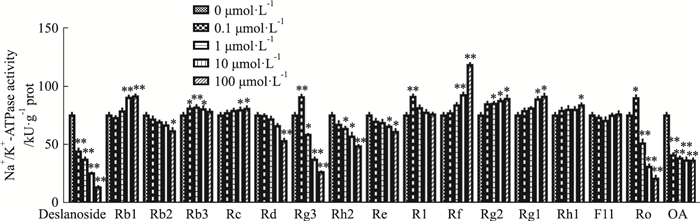
|
| Fig 4 Effect of ginsenoside on Na+/K+-ATPase activity in porcine cerebral cortex *P < 0.05, **P < 0.01 vs 0 μmol·L-1 |
基于该实验评价人参皂苷药性规律为, 温热药在低浓度条件下增强Na+/K+-ATPase活力, 随着浓度升高, 其对Na+/K+-ATPase活力的影响可能表现为增强或抑制, 而寒凉药无论在何种浓度下, 均抑制Na+/K+-ATPase活力。
3 讨论本实验双变量相关分析结果表明,与温热和寒凉药性相关皂苷的相关程度分别为Rf>R1>Rg3>Rg2>Rb1>Ro和Rb2>Re>Rd>F11。灰色关联度分析结果表明,其贡献程度顺序为F11>Re>Rg2>Rd>Rb2>Rb1>Rg1>Rc>Rg3>R1>Rf>Ro。对Na+/K+-ATPase活力影响结果表明人参皂苷Rb1、Rb3、Rc、Rf、Rg2、Rg1、Rh1、Rg3、R1和Ro药性呈现为温热, 能增强Na+/K+-ATPase活力, 人参皂苷Rb2、Rd、Rh2、Re和齐墩果酸药性呈现为寒凉, 能抑制Na+/K+-ATPase活力。
现有诸多文献在中枢神经系统、自主神经系统、内分泌系统、机体物质代谢以及抗感染、抗肿瘤等方面均反映出各人参单体皂苷成分的药性。通常温热药性的人参单体皂苷对机体能量、物质代谢呈促进作用, 寒凉药性则呈抑制作用。现有研究表明,三七皂苷R1能通过恢复凋亡相关基因BAX与BCL2的平衡, 保护大鼠皮质星形胶质细胞免于过氧化氢诱导的凋亡作用, 人参皂苷Rg2能通过海马BDNF信号通路兴奋中枢神经系统从而发挥抗抑郁作用, Rf能有效缓解大鼠神经性疼痛的痛觉过敏反应中抑郁表现[8], 反映出三七皂苷R1与人参皂苷Rg2、Rf温热的药性。Rg3能调节表皮细胞增殖周期[9]。Ro能剂量依赖性地增加急性运动挑战后的握力和耐力游泳时间, 显著增加总蛋白、葡萄糖水平与腓肠肌糖原含量。Rf能显著提高肝脏载脂蛋白A-Ⅰ和C-Ⅲ mRNA的基础水平[10]。人参皂苷Rb1能够通过增强术后疲劳综合征大鼠骨骼肌中Na+-K+-ATPase和SDH的活性改善能量代谢[11], 人参皂苷Rb3可提高SOD、Na+-K+-ATPase和Ca2+-Mg2+-ATPase活力, 对大鼠实验性脑缺血起明显保护作用[12]。这种对能量代谢与物质代谢各种酶和产物的上调作用反映了Rg3、Ro、Rf、Rb1与Rb3的温热药性。人参皂苷Rd、Re对神经胶质瘤细胞增殖表现为抑制, 为寒凉药性, 而人参皂苷Rc的抑制作用不明显[13], 从侧面反映出Rc并非寒凉药性, 结合Na+-K+-ATPase实验结果分析Rc可能为温热药性。而人参皂苷Rg1对多种中枢神经系统疾病具有治疗作用, 影响神经递质的合成与释放, 促进神经细胞生长和神经干细胞分化等, 也表现为温热药性[14]。Rh2能通过抑制Na+/K+- ATPase促进血液循环[15], Rd能通过抑制血管平滑肌细胞的受体调控性及钙通道介导的钙内流降低血压[16], 还能减少ROS的生成从而减轻过氧化氢对星形胶质细胞的损伤, 表现为寒凉药性。此外, Rb2能降低总胆固醇, 游离胆固醇、低密度脂蛋白、甘油三酯水平及中枢镇静作用。Re能够显著抑制人宫颈癌细胞的增殖, 降低细胞内乳酸脱氢酶, 琥珀酸脱氢酶, 葡萄糖-6-磷酸脱氢酶和丙酮酸脱氢酶的活性。这些对物质代谢的抑制作用可能与Rb2、Re药性寒凉有关。以上文献表明, 三七皂苷R1与人参皂苷Rg2、Rf、Rg3、Ro、Rf、Rb1与Rb3药性温热, 而Rh2、Rd、Rb2与Re药性寒凉, 该分析结果与本研究结论相符, 进一步从现有文献的研究结果角度佐证了本研究结果的准确性, 也说明了本评价方法有一定的可行性和客观性。
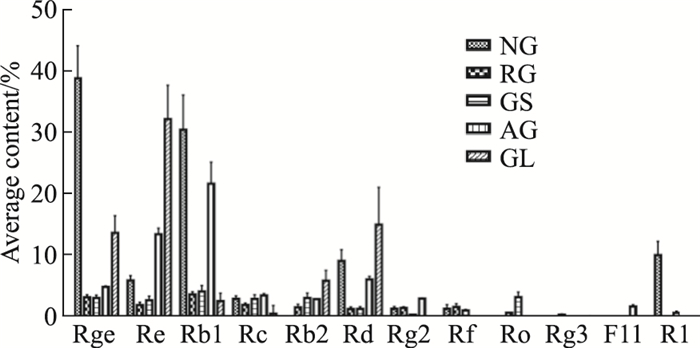
另外, 通过计算5种中药中人参皂苷平均含量, 发现三七中Rg1、Rb1及三七皂苷R1含量较高;而红参中主要含有Rg1、Rb1、Re及稀有皂苷Rg3等[17];人参中主要皂苷含量Rb1>Rg1>Re;西洋参中主要皂苷含量Rb1>Re>Rd>Rg1, 其Rg1含量远低于人参[18];人参叶中主要含有Re、Rg1、Rd与Rb2, 其中Re浓度较高(Fig 5)。另外根据《中国药典》中含量测定标准, 并结合相关分析与人参皂苷对Na+/K+-ATPase活力影响结果分析, 发现三七性温可能与温热药性显著相关的Rb1和R1以及能够促进Na+/K+-ATPase活力的Rg1有关, 红参性温可能与Rb1、Rg1有关, 人参药性可能与高含量的温热药性显相关的Rb1和促进Na+/K+-ATPase活力的Rg1及相对含量较低的与寒凉药性显著相关的Re有关, 故表现为微温。此外红参中含有的稀有皂苷, 如Rg3与温热药性显著相关, 故红参温性强于人参。西洋参性凉可能与高含量的寒凉药性显著相关的Re、Rd及与温热药性显著相关的Rb1有关, 其中Re与Rd在灰色关联度中对药性的贡献程度均较高。而人参叶性寒可能与高浓度的与寒凉药性显著相关的Re、Rd与Rb2有关。因此可知温热药性人参属中药中含Rb1、Rg1、R1较多, 而寒凉药性人参属中药中含Rb2、Rd、Re较多。以上结果一方面与匡海学等人提出的中药性味可拆分性、可组合性理论相符合, 进一步作证了中药单体成分与单味药相类似的也具有对应的药性, 并且其含量对人参属各中药的药性产生一定影响, 另一方面与本研究的结果相一致, 说明本研究实现了从有效成分层面分析中药药性, 为中药药性理论做出进一步补充。
|
| Fig 5 Average content of saponins in Panax notoginseng, red ginseng, ginseng, American ginseng and ginseng leaves |
综合以上结果, 人参皂苷的药性(气)评价可以利用Na+/K+-ATPase活力结合人参皂苷含量与中药药性相关性分析, 该方法具有一定可行性。
| [1] |
李石生, 邓京振, 赵守训, 等. 中药现代化研究的关键在于建立科学的现代中药理论体系——分子药性假说的提出[J]. 中国中西医结合杂志, 2000, 20(2): 83-4. Li S S, Deng J Z, Zhao S X, et al. The key to the research on the modernization of traditional Chinese medicine lies in the establishment of a scientific theoretical system of modern traditional Chinese medicine -- the proposal of the hypothesis of molecular drug properties[J]. Chin J Integr Med, 2000, 20(2): 83-4. |
| [2] |
匡海学, 程伟. 中药性味的可拆分性、可组合性研究——中药性味理论新假说与研究方法的探索[J]. 世界科学技术(中医药现代化), 2019, 11(6): 768-71. Kuang H X, Cheng W. Studies on the capability of properties and flavors of Chinese medicine to be split and combined-a new assumption on the theory of properties and flavors of Chinese medicine and the research method[J]. Mod Tradit Chin Med Mater Med-World Sci Technol, 2019, 11(6): 768-71. |
| [3] |
王亚男, 窦德强. 细胞学方法评价6种中药的寒热药性[J]. 辽宁中医杂志, 2017, 44(3): 558-60. Wang Y N, Dou D Q. Evaluation on heat and cold characteristics of six TCM herbs by cytological method[J]. Liaoning J Tradit Chin Med, 2017, 44(3): 558-60. |
| [4] |
王艳艳, 孙雪, 裴晓蕾, 等. 中药寒热药性与线粒体能量代谢关系研究[J]. 中医药信息, 2013, 30(4): 48-50. Wang Y Y, Sun X, Pei X L, et al. Advances in researches on relations between cold and hot properties of TCM and mitochondrial energy metabolism[J]. Inf Tradit Chin Med, 2013, 30(4): 48-50. |
| [5] |
Wan J, Li S, Chen J, et al. Chemical characteristics of three medicinal plants of the Panax genus determined by HPLC-ELSD[J]. J Sep Sci, 2015, 30(6): 825-32. |
| [6] |
Wan J, Peng L, Li S, et al. Simultaneous determination of 11 saponins in Panax notoginseng using HPLC-ELSD and pressurized liquid extraction[J]. J Sep Sci, 2015, 29(14): 2190-6. |
| [7] |
杨文国, 姚俊宏, 陈军, 等. 33种辛味中药挥发油皮肤细胞毒性与药性特征的关联性研究[J]. 南京中医药大学学报, 2017, 33(6): 597-602. Yang W G, Yao J H, Chen J, et al. Study on association between skin cell toxicity of 33 pungent essential oils and drug property characteristics of Chinese materia medica[J]. J Nanjing Univ Tradit Chin Med, 2017, 33(6): 597-602. |
| [8] |
Li Y, Chen C, Li S, et al. Ginsenoside Rf relieves mechanical hypersensitivity, depression behavior, and inflammatory reactions in chronic constriction injury rats[J]. Phytother Res, 2019, 33(4): 1095-103. doi:10.1002/ptr.6303 |
| [9] |
李静平, 顾雯, 倪艺榕, 等. 人参皂苷Rg3对糖尿病大鼠难愈创面表皮细胞及血管新生的影响[J]. 中国药理学通报, 2019, 35(4): 551-6. Li P J, Gu W, Ni Y R, et al. Effects of ginsenoside Rg3 on epidermal cells and angiogenesis in impaired diabetic wound rats[J]. Chin Pharmacol Bull, 2019, 35(4): 551-6. |
| [10] |
Lee H, Gonzalez F, Yoon M. Ginsenoside Rf, a component of ginseng, regulates lipoprotein metabolism through peroxisome proliferator-activated receptor[J]. Biochem Biophys Res Commun, 2006, 339(1): 196-203. doi:10.1016/j.bbrc.2005.10.197 |
| [11] |
Tan S J, Li N, Zhou F, et al. Ginsenoside Rb1 improves energy metabolism in the skeletal muscle of an animal model of postoperative fatigue syndrome[J]. J Surg Res, 2014, 191(2): 344-9. |
| [12] |
张宏伟, 孙伟伦, 李凤, 等. 人参皂苷Rb3对大鼠实验性脑缺血的保护作用[J]. 人参研究, 2013, 25(3): 2-5. Zhang W H, Sun W L, Li F, et al. The protective effect of ginsengoside Rb3 on experimental cerebral ischemia in rats[J]. Ginseng Res, 2013, 25(3): 2-5. |
| [13] |
田静, 任雨贺, 刘淑莹, 等. 人参皂苷Rc, Rd, Re对神经胶质瘤细胞增殖作用的影响[J]. 中成药, 2020, 42(3): 751-4. Tian J, Ren Y H, Liu S Y, et al. Effects of ginsenoside Rc, Rd and Re on the proliferation of glioma cells[J]. Chin Tradit Pat Med, 2020, 42(3): 751-4. |
| [14] |
高妍, 薛薇, 李敏, 等. 人参皂苷Rg1的中枢药理作用及多靶点机制研究进展[J]. 中国临床药理学与治疗学, 2016, 21(1): 107-11. Gao Y, Xue W, Li M, et al. Progress in the study of the central pharmacological effects of ginsenoside Rg1 and multiple target mechanism[J]. Chin J Clin Pharmacol Ther, 2016, 21(1): 107-11. |
| [15] |
Chen Ronald JY, Chung T Y, Li F Y, et al. Steroid-like compounds in Chinese medicines promote blood circulation via inhibition of Na+/K+-ATPase[J]. Acta Pharmacol Sin, 2010, 31(6): 696-702. |
| [16] |
Guan Y, Zhou J, Zhang Z, et al. Ginsenoside-Rd from panax notoginseng blocks Ca2+ influx through receptor- and store-operated Ca2+ channels in vascular smooth muscle cells[J]. Eur J Pharmacol, 2006, 548(1-3): 129-36. |
| [17] |
Zhu L, Luan X, Dou D, et al. Comparative analysis of Ginsenosides and Oligosaccharides in White Ginseng (WG), red Ginseng (RG) and Black Ginseng (BG)[J]. J Chromatogr Sci, 2019, 57(5): 403-10. |
| [18] |
Ludwiczuk A, Wolski T, Berbe S. Chromatographic analysis of Ginsenosides Occurring in the roots of American Ginseng (Panax Quinquefolium L.) and in Asian Ginseng (Panax Ginseng C.A. Mayer) preparations[J]. JPC - J Planar Chromatogr - Mod TLC, 2002, 15(2): 147-50. |

