

脑卒中是人类致死和致残的主要病因之一,《美国心脏学会2020年心脏病和卒中统计报告》显示,由于人口老龄化和风险因素的积累,卒中平均终生风险由1990年的22.8%增加至2016年的24.9%[1]。《中国心血管健康与疾病报告2020概要》推算我国脑卒中患病人数为1 300万,远高于冠心病和心力衰竭[2]。
实验动物疾病模型是研究人类疾病病理机制、治疗方法、药物疗效和药理作用的重要条件,建立能够反映人类生理、病理和药理特点,且重复性良好,指标严格可控的实验动物模型,对脑血管疾病的研究意义重大。在实际科研工作中,针对不同的研究内容,选择合适的动物模型,是实现研究目标的重要保障。
1 常用脑缺血实验动物模型主要类型目前在临床前实验中应用的脑缺血实验动物模型种类很多,根据不同的分类方法,主要分为以下类型。
1.1 根据缺血程度分类根据脑缺血程度不同,可以分为急性脑缺血、慢性脑缺血、完全性脑缺血、局灶性脑缺血、低灌注性脑缺血、缺血/再灌注等。不同的模型可以反映人类脑缺血的不同疾病特点,可以用于不同机制研究。一般对于卒中的研究,常用急性局灶性脑缺血或急性局灶性脑缺血/再灌注模型。
1.2 根据缺血部位分类目前常用的脑缺血动物模型根据发生部位不同,可分为全脑缺血、弥散性脑缺血和局灶性脑缺血。全脑缺血动物模型主要用于慢性缺血研究,急性全脑缺血动物模型可以用于损伤和保护机制的研究。局灶性缺血是研究脑卒中的主要模型,也是近年来研究最多的实验动物模型,在缺血性脑卒中的临床前研究中应用广泛。弥散性脑缺血主要用于慢性腔隙性脑缺血的研究,但制备方法仍有一定局限性。
2 脑缺血动物模型的制备方法和特点脑缺血动物模型种类很多,制备方法各有不同,有些模型制备简单,成功率高。有些模型制作过程复杂,操作要求高,影响因素多,本文将详细说明制备方法。
通过不同方式制备脑缺血动物模型,达到脑部血流减少或中止的目的,常用方法可以分为血管阻断法,如脑动脉的结扎、夹闭或熔断等;血管堵塞法,如人工血栓法、自体血栓法、物理栓塞法、电凝法等。由于具体模型与研究内容有关,制备方法也有明显不同,主要根据研究目的进行动物模型的设计,选择适宜的模型制备方法。
2.1 全脑缺血全脑缺血可以分为急性全脑缺血和慢性全脑缺血(Tab 1)。
| Classification | Models | Methods | Advantages | Limitations | Reference |
| Acute global cerebral ischemia | Four-vessel occlusion | Both of the common carotid and vertebral arteries were blocked | Reproducible,Severe ischemia | Surgical trauma,difficulty in postoperative recovery | [3, 4] |
| Three-vessel occlusion | One vertebral artery and both common carotid arteries were blocked | Reproducible reperfusion | Surgical trauma,serious traction of the surrounding tissue | [5] | |
| Two-vessel occlusion | Bilateral common carotid arteries were blocked or combined with antihypertensive drugs or bloodletting | Operability,low mortality | Side-effect due to the blood pressure medications | [6] | |
| Asphyxia | Asphyxia cardiac arrest | Mimic clinical cardiac arrest | Animal damage,poor stability and reproducibility | [7] | |
| Chronic global cerebral ischemia | Bilateral common carotid artery stenosis | Ligation of bilateral common carotid arteries | Simple operation and good stability | Acute ischemia,impaired visual function and high mortality | [8] |
| Bilateral internal carotid artery obstruction | Ligation of bilateral internal carotid arteries | Mild ischemia and no impairment to visual function | Complicated operation | [8] | |
| Carotid arteriovenous fistula | Proximal ligation of internal carotid artery and external jugular vein | Moderate ischemia | Possible local cerebral tissue perfusion and reflux disorder caused by complicated operation | [9] | |
| Micro coil | Microcoils were inserted to block both common carotid arteries | Controllable | Fast declined blood flow,and less damage to cerebral cortex | [10] | |
| Control blood vessel diameter | Reduce the diameter of bilateral common carotid arteries | Quantitative control of the degree of vascular stenosis | Unstable blood flow changes,poor repeatability | [11] | |
| Focal cerebral ischemia | Cerebrovascular electrocoagulation | Electric coagulation craniotomy | Visibility,short formation time of infarct foci and controllable infarct location | Intense lesion,inreperfusion | [12-13] |
| Photochemically induced coagulation | Photosensitive substances and laser irradiation the vessel wall is pasted with FeO filter paper | Simple operation,little trauma,high reproducibility,low mortality | Easy to cause early blood-brain barrier opening and brain edema,which is not consistent with human cerebral ischemia | [14-15] | |
| Chemically induced coagulation | FeCl3 | Simple operation,less damage to meninges and periarterial cortex,low mortality | Not suitable for thrombolytic therapy | [14-15] | |
| Microemboli block | Stable microemboli Autothrombotic method | Clinical relevance and suitable for studying thrombolysis | Easy to cause multi-focal ischemia,easy to appear cerebral hemorrhage,high mortality | [16-17] | |
| Self thrombus forms cerebral embolism | Current stimulates the common carotid artery,forming a self-clot | Mimic clinic pathological conditions,suitable for evaluating suppository | Not suitable for ischemia-reperfusion due to poor reproducibility and uncontrolled lesion location and size | [18-19] | |
| Suture method | Permanent cerebral ischemia and ischemia reperfusion | Slight damage,easy operation,accurate control of reperfusion time | Poor recurrence,easy to cause subarachnoid hemorrhage,high mortality | [20-21] | |
| Multiple cerebral ischemia | Thrombosis | Thrombus suspension or synthetic microspheres were injected | Mimic human natural embolism,high success rate,small trauma | Complicated operation,and un-controllable infarct size and location | [22-23] |
| Iron powder | Fe3O4 solution was injected intravenously | Controllable infarct site | Complicated operation,and impact of iron powder on local brain | [22-23] | |
| Lacunar cerebral ischemia | Lauric acid | Sodium laurate was injected | Specific injury of perforator artery endothelial cells had no effect on middle cerebral artery | High standard in the dosage and time | [24] |
急性全脑缺血实验动物模型主要有小鼠断头处死法,小鼠窒息致死法,大鼠窒息致死法等,还有二血管、三血管和四血管闭塞法,这些脑缺血实验动物模型能够模拟全脑急性脑缺血特点,但与临床常见脑梗死(多为单一血管闭塞)病因和表现有较大差距,主要用于缺血病理机制研究和药物作用研究。
慢性全脑缺血的实验动物模型包括颈总动脉部分结扎制备的全脑低灌注模型,放血降低血容和灌注压制备的全脑缺血模型等,在药物作用机制研究方面有重要价值。
2.2 局灶性缺血局灶性脑缺血动物模型是与人类卒中的发生最为接近的实验模型,包括永久性和短暂性两种,后者模拟脑缺血/再灌注损伤。局灶性脑缺血模型常用于研究脑缺血损伤后的病理生理变化以及药物作用机制,后文将全面介绍该模型。局灶性脑缺血动物模型主要包括开颅电凝法、光化学诱导法、微栓子阻断法、电凝法、线栓法。
2.2.1 开颅电凝法1981年,Tamura和Bederson采用开颅法,手术暴露大脑中动脉并阻断中动脉血流,在基底核和皮质区形成恒定梗死灶[12-13]。该模型是在可视条件下对大脑中动脉(MCA)进行闭塞,缺血效果可靠,可导致皮质与尾壳核同时栓塞。但开颅创伤大,操作技术要求高,且难以实现再灌注,应用较少。
2.2.2 光化学和化学诱导法Coyle在1982年及Waston在1985年均成功建立光化学法诱导脑皮质梗死动物模型[14-15]。光波照射光敏物质,在血管内引起光化学反应,导致内皮细胞损伤、血小板黏附聚集,进而形成血栓。该模型与临床脑血栓形成过程具有相似性,但毛细血管损伤所形成的血栓和人类脑血栓的发生仍存在一定差异,且造成终末动脉永久性闭塞,无法实现再灌注,影响观察扩血管药疗效。
2.2.3 微栓子阻断法将同源血凝块制备成微栓子悬液,经颈总动脉(CCA)、颈内动脉(ICA)进入MCA,致同侧脑区梗死。该方法创伤小,且类似于人类血栓的形成过程。但由于血凝块栓子具有一定随机性,脑组织缺血程度不一,梗死部位及梗死体积无法预测[16-17]。
2.2.4 自体血栓血管内形成法分离大鼠CCA、ICA和颈外动脉(ECA),同时夹闭ECA,电击CCA形成血管内血栓。然后利用自身血流从颈总动脉将血栓冲入颈内动脉。该模型利用动物自身血液凝聚后形成的血栓造成局灶性脑缺血,更好地模拟了临床上由于血小板聚集血栓形成阻断脑血流导致脑缺血的发病过程,更适用于研究溶栓药物和复杂机制治疗局灶性脑缺血的药物。动物死亡率和脑缺血损伤严重程度与电凝时间和血栓夹碎程度密切相关[18-19]。
2.2.5 线栓法Koizumi和Zea-Longa等[20-21]用顶端烫成球形的尼龙线经颈内动脉插入,成功制成大脑中动脉闭塞。该方法在不开颅的情况下,将尼龙线自颈外动脉导入直进至颈内动脉的颅内段MCA起始部,阻断MCA血流,造成MCA供血区缺血,通过抽出尼龙线进行再灌注。MCA闭塞效果较理想,缺血与再灌注时间亦能准确控制。但是大鼠个体差异、线栓插入深度均会明显影响模型的成功率。
2.3 多发性脑梗死和腔隙性脑梗死血管内栓塞的塞子可以是空气、浮石、血凝块、玻璃球、石蜡、铁粉、丝线、硅橡胶、尼龙线等,目前常用血凝块和石蜡栓塞等。取无菌且自然干燥的同种大鼠血凝块研碎过筛,制成混悬液,推注栓子盐水混悬液,造成多灶性脑梗死模型[22-23]。腔隙性脑梗死由脑部深穿动脉及其分支的特殊病变所致,Toshima等[24]通过在大鼠颈内动脉注入月桂酸钠,制备腔隙性脑梗死模型。
3 脑缺血实验动物模型的检测指标和评价标准实验动物模型制备的目的是进行科学研究,选择适当的检测指标,可以评价实验动物模型的病理状态,能够通过模型观察药物作用和治疗效果。因此,选择合适的检测指标是实现实验目的的关键。
3.1 自主运动行为评价采用计算机采集、记录并分析动物自发活动,分析动物在各区域活动轨迹、路程、时间等,用于定量评价脑缺血后功能损伤。神经功能缺损评分,目前普遍使用的主要是Zea-Longa评分法和Bederson分级法[13, 20]。
3.2 运动协调能力评价转棒实验,最早由Dunham和Miya建立[25]。用动物在转棒上停留的时间,衡量其运动功能,评估平衡和协调能力。平衡木实验,Feeney等[26]将走横木实验作为判断脑缺血动物运动整合性和协调性的指标。伸爪试验,1986年Whishaw等[27]建立评价大鼠肢体运动功能的方法,通过分析动物摄食过程,辨别肢体损伤与修复的差别。圆筒实验,将动物置于透明圆筒中记录其活动,通过对探索过程中受重情况的分析评价前肢不对称性[28]。
3.3 学习记忆功能评价中枢神经系统的海马神经元对缺血缺氧损伤较敏感,且与学习记忆功能密切相关,人类脑卒中导致的海马神经元损伤会伴随着认知与记忆功能障碍,在脑缺血动物模型中也需要考察动物的认知、记忆功能。
Morris水迷宫实验,经过训练后的动物,利用空间记忆和视觉线索寻找水下平台,全程记录并分析动物到达平台的时间、轨迹和路程。旋臂迷宫实验,动物依靠其空间感,以期耗费最少精力,使用最短时间,最大限度获得食物与水。被动和主动回避实验,根据动物进入暗室错误次数和避暗潜伏期,判断其学习记忆能力。
缺血性脑损伤通常与运动、感觉和认知功能障碍有关,单一行为学测试不能充分反映神经功能,常采用多种行为学测试,综合评估动物的感觉运动功能、认知和探索行为。
3.4 脑组织形态和功能的检测脑梗死体积测定,脑梗死体积是反映抗脑缺血损伤药物药效最直接的指标,梗死体积的大小,代表缺血的严重程度。病理检测常用苏木精-伊红染色法全面观察正常和病变组织的形态结构。脑水肿百分比测定,评价脑缺血损伤后胶原组织的水肿程度。脑电图分析,反映MCA供血区和非供血区的脑电图变化,评估脑缺血的范围和脑梗死的程度。局部脑血流量测定,测定MCA供血中心区缺血后各时间点脑血流变化。软脑膜微循环观察,通过测量微血管的管径及血流速度,考察软脑膜微循环血液的灌流状况。
3.5 其他检测指标根据模型特点和研究目的,设计合适的检测指标,包括生理指标、病理指标、组织形态、分子生物学变化等。不同模型的特点及适宜的检测指标见Tab 2。
| Classification | Models | Application | Evaluation indexes |
| Acute global cerebral ischemia | Vessel occlusion | Energy metabolism,pathogenesis of ischemic brain injury,curative effect of anti-cerebral ischemia drugs | Behavioral test,pathological evaluation,the basic function. |
| Asphyxia | Screening for brain or ischemic protective agents | Survival time/number of open-mouth breaths | |
| Chronic global cerebral ischemia | Two-vessel occlusion carotid arteriovenous fistula micro coil | Motor impairment,cognitive impairment,damage of white matter,degeneration of hippocampal neurons,nerve signaling and angiogenesis | Behavioral test,evaluation of learning and memory,histomorphological detection,glial cell,changes in neurotransmitters |
| Focal cerebral ischemia |
Electrocoagulation Photochemical Micro emboli Autothrombus Suture |
Nerve function defect and interventional treatment Antiplatelet, antithrombotic and endothelial cell protection Thrombus formation process, thrombolysis effect observation Platelet aggregation, thrombosis, thrombolytic ability To simulate various states of permanent and transient focal cerebral ischemia in ischemic cerebrovascular disease and evaluate reperfusion studies and drug efficacy |
Neurological deficit score, infarct volume, percentage of cerebral edema, local blood flow |
| Multiple cerebral ischemia | Thrombosis iron powder | Cognitive dysfunction | Behavioral test,evaluation of learning and memory, pathological evaluation |
| Lacunar cerebral ischemia |
Lauric acid | Endothelial cell injury, the formation of local microthrombus |
Behavioral test, histological examination |
2015年,本实验室报道了自体血栓中动脉阻塞法,仰卧位固定大鼠,钝性分离血管组织和血管,分离CCA并置入血栓生成仪的血管电击夹沟槽中,电流强度为1.00 mA,持续刺激225 s后将所形成的血栓用钝性且表面光滑的镊子夹碎后,利用自身血流,将血栓从CCA冲入ICA,冲入后立即用动脉夹夹闭颈总动脉近心端15 min,然后打开所有动脉夹,恢复血流。利用动物自身血液凝聚后形成的血栓造成局灶性脑缺血,更好地模拟了临床上由于血小板聚集血栓形成阻断脑血流导致脑缺血的发病过程[18-19]。
线栓法,用顶端烫成球形的尼龙线经ICA插入,制成MCA闭塞。仰卧位固定大鼠,颈正中线切口约2 cm,钝性分离组织与血管,将尼龙线由ECA插入后导入ICA,松开ICA夹,继续将尼龙线插入至其颅内段,自CCA分叉处插入的尼龙线长约20 mm,阻断MCA。再灌注时将线栓抽出,结扎ECA残端,松开CCA。本方法在不开颅的情况下,将尼龙线自ECA导入进至ICA的颅内段MCA起始处,阻断MCA血流,造成MCA供血区缺血,通过抽出尼龙线实现再灌注。
4.2 模型评价标准 4.2.1 神经功能缺损评分神经行为学评价反映了模型病理生理发生发展的过程。脑缺血损伤发生后缺血半暗带的病理发展在有限时间内是可逆的,随缺血时间延长,缺血中心区扩大到半暗带,病理损伤不可逆发展。目前,应用最普遍的神经症状评分方法是Zea-Longa评分法和Bederson分级法[13, 20]。
对模型动物进行神经功能缺损评分,排除无症状及不能自发行走的动物后,随机分组,进行后续实验。然而,Zausinger等[29]发现,大鼠脑缺血90 min后再灌注,48 h皮层梗死体积与分级评分存在相关性,72 h全脑梗死体积与分级评分存在相关性。因此,现有的神经行为学评分尚不能全面反映脑缺血的生理病理状态,不同种属大鼠在相同损伤程度下其神经行为学评价也可能存在差异。
一般在线栓法制备局灶性脑缺血模型中,模型组大鼠神经行为学评分显著升高,实验时应选取Longa评分达到2分或3分的动物参加实验,剔除意识不清与无症状动物,以保证实验结果的稳定性。
4.2.2 脑梗死体积脑梗死体积是反映抗脑缺血损伤药物药效最直接的指标,梗死体积的大小,代表缺血严重程度。在线栓法制备局灶性脑缺血模型中,模型组大鼠脑梗死体积显著升高,缺血90 min再灌注24 h大鼠缺血脑半球出现梗死,梗死体积由27.39%变化到45.09%,低于20%说明模型可能没有成功,Fig 1。
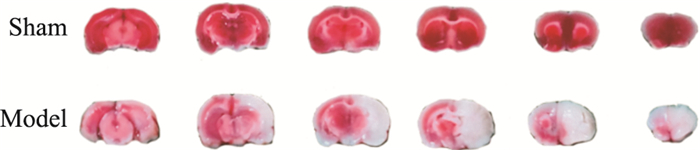
|
| Fig 1 Cerebral infarct after ischemia 90 min/reperfusion 24 h |
经过对近年来发表的带有TTC染色的92篇文章的统计分析发现,文献中脑梗死体积差异很大。缺血/再灌注时间主要集中于缺血60、90、120 min,再灌注24 h, Fig 2。
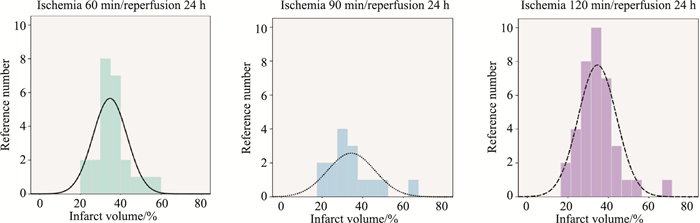
|
| Fig 2 Infarct volume distribution for ischemia 60, 90, 120 min/reperfusion 24 h |
采用相同的实验方法,得到梗死体积最高达73%,最低为19%。实验过程中许多因素直接影响着实验研究的结果,包括大鼠个体差异、线栓插入深度均会明显影响模型的成功率及梗死体积。除此之外,所用统计方法、切片厚度与统计片数、计算公式、是否校正水肿等均可能对实验结果造成影响,甚至导致偏差。
在我们所统计的92篇文章中,所使用的统计软件主要包括:Image-Pro Plus 6.0,ImageJ,Motic Med 6.0,NIH Image Analyzer,AutoCAD,PhotoShop CS4,Motic Med 6.0。文章展示的切片数从1~8片不等。所使用的计算方法包括:①梗死体积/同侧半球总体积。②梗死体积/对侧半球总体积。③梗死体积/全脑总体积。④ [对侧半球总体积-(同侧半球总体积-梗死体积)]/对侧半球总体积。⑤ [梗死体积-(同侧半球总体积-对侧半球总体积)]/对侧半球总体积。⑥测量的梗塞面积×(1-[(同侧半球面积-对侧半球面积)/对侧半球面积])。⑦ E=(ΣVR-ΣVL)/(ΣVL+ΣVR)×100%计算水肿率(E)。ΣVR和ΣVL分别是右侧(缺血)和左侧(非缺血)半球的体积。使用以下等式计算背景:B=ΣVS/ΣVT×100%,其中ΣVS是假手术组中未染色的白质的体积,ΣVT是总脑容量。考虑到水肿和背景的影响,使用以下等式间接确定梗塞体积并表示为整个脑的百分比:I=[ΣVI×(1-E)/ΣVT×(1-B)]×100%,其中ΣVI是未用TTC染色的组织的体积,Fig 3。
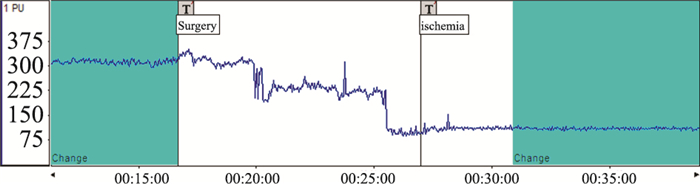
|
| Fig 3 Cerebral blood flow changes |
每只动物的大脑在切片前称取湿重,染色后收集切片,于95 ℃干燥24 h至恒重,称取每只动物大脑干重,比较各组动物的脑含水量。在线栓法制备局灶性脑缺血模型中,模型组大鼠脑含水量升高,缺血90 min再灌注24 h缺血半球水肿程度增加21.6%到30.4%。
4.2.4 测定大脑皮质局部脑血流量(rCBF)研究表明脑血流量随缺血时间进行性降低,各时间点差异有显著性,回归分析示rCBF与时间呈负相关。在线栓法制备局灶性脑缺血模型中,插入线栓后脑血流显著降低,与自身术前脑血流相比,降低60%到80%则认为模型成功。
5 总结近几十年来,国内外学者对脑缺血模型从动物的选择、模型的分类及方法制备等方面进行有益探索和不断完善,明显提高了模型的成功率和脑梗死灶的稳定性,使得脑缺血模型制备日趋完善。在今后的研究中,不仅应重视缺血损伤的可控性和重复性,严格控制各种干扰因素,减少其对实验结果的影响,还应从实验动物、模型选择、实验条件、实验流程、评价指标与测试等方面构建一系列统一的标准体系,使得实验方法和实验流程等方面进一步科学化、标准化、规范化。
模拟人类脑血管疾病的发病进程,建立稳定易重复,生理指标严格可控的动物模型,对脑血管病的研究具有重要意义,恰当的评价指标是研究过程的重要环节。目前仍存在一些问题:①对实验性脑缺血不同阶段未进行深入研究,缺血后不同阶段,由于损伤可逆、自我修复以及正常代偿的存在,如果采用较单一的神经行为学缺损评分进行评价,容易误导实验结果的产生。因此,脑缺血不同时间点应分别采用何种评价方式是亟须解决的问题。②感觉运动评估方式对实验员的主观能动性,动物自身的饮食和活泼度均有一定的要求。因此,如何更客观、量化且操作性及重复性强的进行评估,同样有待解决。
脑缺血损伤后的评价体系正在逐步成熟,不同的评价方法以不同程度和形式考察大鼠脑缺血后多种类型的行为改变,将行为学评分、学习记忆与脑梗死体积、病理学检测进行有效、合理地组合,不仅利于实验者的分析比较,更易于展现治疗因素的优势。建立标准化、规范化的动物模型,以及信度、效度、反应度和可行性较好的评价指标令人期待。
| [1] |
Virani S S, Alonso A, Benjamin E J, et al. Heart disease and stroke statistics-2020 update: A report from the American heart association[J]. Circulation, 2020, 141(9): e139-96. |
| [2] |
中国心血管健康与疾病报告编写组. 中国心血管健康与疾病报告2020概要[J]. 中国循环杂志, 2021, 35(6): 521-45. The writing committee of the report on cardiovascular health and diseases in China. Report on cardiovascular health and diseases burden in China: An updated summary of 2020[J]. Chin Circ J, 2021, 35(6): 521-45. doi:10.3969/j.issn.1000-3614.2021.06.001 |
| [3] |
Pulsinelli W A, Brierley J B. A new model of bilateral hemispheric ischemia in the unanesthetized rat[J]. Stroke, 1979, 10(3): 267-72. doi:10.1161/01.STR.10.3.267 |
| [4] |
Yamaguchi M, Calvert J W, Kusaka G, et al. One-stage anterior approach for four-vessel occlusion in rat[J]. Stroke, 2005, 36(10): 2212-4. doi:10.1161/01.STR.0000182238.08510.c5 |
| [5] |
Kameyama M, Suzuki J, Shirane R, et al. A new model of bilateral hemispheric ischemia in the rat-three vessel occlusion model[J]. Stroke, 1985, 16(3): 489-93. doi:10.1161/01.STR.16.3.489 |
| [6] |
Sanderson T H, Wider J M. 2-Vessel occlusion/hypotension: A rat model of global brain ischemia[J]. J Vis Exp, 2013, 76: e50173. |
| [7] |
Jackson D L, Dole W P. Total cerebral ischemia: A new model system for the study of post-cardiac arrest brain damage[J]. Stroke, 1979, 10(1): 38-43. doi:10.1161/01.STR.10.1.38 |
| [8] |
Sekhon L H, Morgan M K, Spence I, et al. Chronic cerebral hypoperfusion and impaired neuronal function in rats[J]. Stroke, 1994, 25(5): 1022-7. doi:10.1161/01.STR.25.5.1022 |
| [9] |
Emilene D F F, Cássia V R, Cypriano P E, et al. Sildenafil provides sustained neuroprotection in the absence of learning recovery following the 4-vessel occlusion/internal carotid artery model of chronic cerebral hypoperfusion in middle-aged rats[J]. Brain Res Bull, 2013, 90: 58-65. doi:10.1016/j.brainresbull.2012.08.010 |
| [10] |
Zhou D, Meng R, Li S J, et al. Advances in chronic cerebral circulation insufficiency[J]. CNS Neurosci Ther, 2018, 24(1): 5-17. doi:10.1111/cns.12780 |
| [11] |
Horecky J, Baciak L, Kasparova S, et al. Minimally invasive surgical approach for three-vessel occlusion as a model of vascular dementia in the rat-brain bioenergetics assay[J]. J Neurol Sci, 2009, 283(1-2): 178-81. doi:10.1016/j.jns.2009.02.348 |
| [12] |
Tamura A, Graham D I, McCulloch J, et al. Focal cerebral ischaemia in the rat: 1. description of technique and early neuropathological consequences following middle cerebral artery occlusion[J]. J Cereb Blood Flow Metab, 1981, 1(1): 53-60. doi:10.1038/jcbfm.1981.6 |
| [13] |
Bederson J B, Pitts L H, Tsuji M, et al. Rat middle cerebral artery occlusion: Evaluation of the model and development of a neurologic examination[J]. Stroke, 1986, 17(3): 472-6. doi:10.1161/01.STR.17.3.472 |
| [14] |
Coyle P. Middle cerebral artery occlusion in the young rat[J]. Stroke, 1982, 13(6): 855-9. doi:10.1161/01.STR.13.6.855 |
| [15] |
Watson B D, Dietrich W D, Busto R, et al. Induction of reproducible brain infarction by photochemically initiated thrombosis[J]. Ann Neurol, 1985, 17(5): 497-504. doi:10.1002/ana.410170513 |
| [16] |
郑冲, 吴钢. 局灶性脑缺血动物模型制作方法的概述[J]. 中国卒中杂志, 2008, 3(8): 603-7. Zhang C, Wu G. Overview of the methods for making model of focal cerebral ischemia[J]. Chin J Stroke, 2008, 3(8): 603-7. doi:10.3969/j.issn.1673-5765.2008.08.013 |
| [17] |
Zhang L, Zhang R L, Jiang Q, et al. Focal embolic cerebral ischemia in the rat[J]. Nat Protoc, 2015, 10(4): 539-47. doi:10.1038/nprot.2015.036 |
| [18] |
马寅仲, 杜冠华. 血管内成栓脑梗死模型的制备及评价[J]. 中国药理学通报, 2015, 31(11): 1620-3. Ma Y Z, Du G H. Establishment and evaluation of intravascular thrombosis used for cerebral embolism model[J]. Chin Pharmacol Bull, 2015, 31(11): 1620-3. doi:10.3969/j.issn.1001-1978.2015.11.027 |
| [19] |
Ma Y Z, Li L, Song J K, et al. A novel embolic middle cerebral artery occlusion model induced by thrombus formed in common carotid artery in rat[J]. J Neurol Sci, 2015, 359(1-2): 275-9. doi:10.1016/j.jns.2015.09.362 |
| [20] |
Koizumi J I, Min Z, Imanaka T, et al. Temperature-dependent plasmid integration into and excision from the chromosome of bacillus-stearothermophilus[J]. J Gen Microbiol, 1986, 132(7): 1951-8. |
| [21] |
Longa E Z, Weinstein P R, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. doi:10.1161/01.STR.20.1.84 |
| [22] |
Kaneko D, Nakamura N, Ogawa T. Cerebral infarction in rats using homologous blood emboli: Development of a new experimental model[J]. Stroke, 1985, 16(1): 76-84. doi:10.1161/01.STR.16.1.76 |
| [23] |
Chen S T, Hsu C Y, Hogan E L, et al. A model of focal ischemic stroke in the rat: Reproducible extensive cortical infarction[J]. Stroke, 1986, 17(4): 738-43. doi:10.1161/01.STR.17.4.738 |
| [24] |
Toshima Y, Satoh S I, Ikegaki I, et al. A new model of cerebral microthrombosis in rats and the neuroprotective effect of a rho-kinase inhibitor[J]. Stroke, 2000, 31(9): 2245-50. doi:10.1161/01.STR.31.9.2245 |
| [25] |
Dunham N W, Miya T S. A note on a simple apparatus for detecting neurological deficit in rats and mice[J]. J Am Pharm Assoc Am Pharm Assoc, 1957, 46(3): 208-9. doi:10.1002/jps.3030460322 |
| [26] |
Feeney D M, Gonzalez A, Law W A. Amphetamine, haloperidol, and experience interact to affect rate of recovery after motor cortex injury[J]. Science, 1982, 217(4562): 855-7. doi:10.1126/science.7100929 |
| [27] |
Whishaw I Q, Pellis S M. The structure of skilled forelimb reaching in the rat: A proximally driven movement with a single distal rotatory component[J]. Behav Brain Res, 1990, 41(1): 49-59. doi:10.1016/0166-4328(90)90053-H |
| [28] |
Schaar K L, Brenneman M M, Savitz S I. Functional assessments in the rodent stroke model[J]. Exp Transl Stroke Med, 2010, 2(1): 13. doi:10.1186/2040-7378-2-13 |
| [29] |
Zausinger S, Hungerhuber E, Baethmann A, et al. Neurological impairment in rats after transient middle cerebral artery occlusion: A comparative study under various treatment paradigms[J]. Brain Res, 2000, 863(1-2): 94-105. doi:10.1016/S0006-8993(00)02100-4 |

