


动脉粥样硬化性心血管疾病目前仍然严重威胁人类健康,已成为国人的重要死因之一[1]。陈可冀院士带领研究团队基于中医“血瘀”理论,结合多年临床实践经验,采用循证医学的方法证实了活血化瘀法治疗动脉粥样硬化性心血管疾病的显著疗效,并结合急性心血管事件的发生特点和动脉粥样硬化易损斑块的病理生理特点创新性提出“瘀毒致易损斑块”的理论[2]及活血解毒治法的临床应用优势,为拓展血瘀证及活血化瘀研究领域奠定了理论与实践支撑。
当归-金银花作为清热解毒与散瘀养血兼顾的配伍,在清热活血解毒历代名方中均有广泛应用,如四妙勇安汤、仙方活命饮、托里消毒散等,现今仍被广泛应用于“异病同治”多种证属热毒血瘀范畴的疾病,其中四妙勇安汤在动脉粥样硬化性心血管疾病,尤其是辨证属“瘀毒互结”的治疗中的探究较为全面[3]。现代药理研究发现,金银花在体外具有抗炎、抗血小板聚集的作用[4],当归可以改善冠脉循环,保护心肌细胞,其有效成分阿魏酸钠同样被证实在抗血小板聚集方面疗效确切[5]。
本文运用网络药理学方法[6]对当归-金银花配伍有效活性成分和动脉粥样硬化疾病相关靶点进行筛选及预测分析,并用分子对接技术验证筛选出的活性物质与作用靶点的结合情况,为当归-金银花配伍和AS的后续研究提供基础。
1 材料与方法 1.1 “当归-金银花”药物成分及潜在作用靶点筛选以当归、金银花为关键词检索TCMSP数据库(https://tcmspw.com/tcmsp.php),根据口服生物利用度OB≥30%、药物相似性DL≥0.18两个参数对药物成分进行筛选,获得活性成分及作用的蛋白质靶点,并根据已发表的文献对未预测到及口服利用度低但具有良好治疗作用的成分及靶点进行补充。利用Uniprot蛋白质数据库对当归-金银花活性成分对应的靶点进行基因标准化处理,限定物种为“Homo Sapiens”。
1.2 动脉粥样硬化相关靶点筛选以“atherosclerosis”为关键词检索Gene Cards数据库获取动脉粥样硬化的相关靶点基因,并通过OMIM数据库及Drugbank数据库进行补充。合并3个数据库基因靶点并删除重复值,最终获得对动脉粥样硬化相关靶点。
1.3 “当归-金银花”与动脉粥样硬化靶点蛋白相互作用网络构建根据已获取的药物和疾病相关靶点,利用Venny 2.1将当归-金银花作用靶点与动脉粥样硬化靶点取交集并绘制韦恩图,得到共同靶点。将共同靶点导入String 11.0数据库,生物种类设为“Homo sapiens”,最小相互作用评分设定为>0.9,其余设置默认并对游离节点进行隐藏,构建靶点蛋白互作(protein-protein interaction,PPI)网络。
1.4 基因本体(Gene ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG) 通路富集分析利用Metascape平台对当归-金银花抗动脉粥样硬化的靶点进行GO功能和KEGG通路富集分析,物种选择“H.sapiens”,选取P<0.01的GO生物学过程和KEGG通路,通过Omicshare和Bioinformatics平台实现可视化。
1.5 “药物核心成分-靶点-通路”网络构建将已获得的当归-金银花药物活性成分、作用靶点、相关通路整理后导入Cytoscape 3.8.2软件,利用内置分析工具进行分析其网络拓扑参数,选取度值前10位的有效成分、作用靶点及度值前20位的通路建立“药物核心成分-靶点-通路”网络图。
1.6 分子对接验证分别选取Cytoscape 3.8.2软件分析结果中度值前10位的有效成分与潜在作用靶点,在PubChem和RCSB PDB平台获取小分子配体和蛋白受体,以分辨率高和参考文献支持为筛选条件。通过ChemOffice对小分子配体进行能量最小化处理,PyMOL软件对蛋白配体移除水分子、小分子配体,AutoDockTools加氢、计算电荷并设置为刚性分子。最后选中所有活性位点,通过AutoDockTools设置对接盒子进行分子对接,OpenBabel软件与PLIP平台确定结合位点并进行可视化处理。
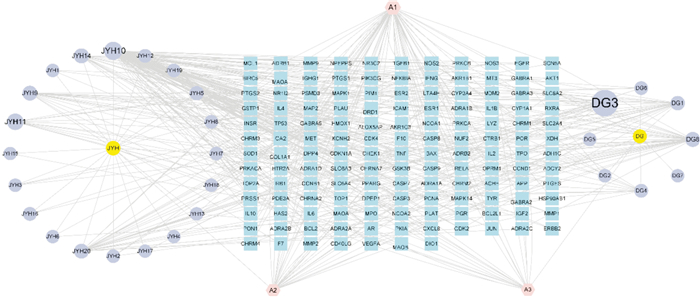
2 结果 2.1 “当归-金银花”活性化合物筛选及活性成分-靶点网络构建在TCMSP数据库中按OB值和DL值进行筛选及阅读文献补充[7],共得到当归-金银花药对活性成分31种,其中当归有效成分11种、金银花23种,共同成分3种(Tab 1),靶点509个。将数据导入Cytoscape 3.8.2软件,得到“活性成分-靶点”网络图(Fig 1),分别用不同形状、颜色代表中药成分及靶点基因。Fig 1共包含542个节点,820条边,运用软件中Analyse Network计算,按度值大小顺序排列节点。
| ID | MOLID | Compound name | OB% | DL |
| JYH1 | MOL001494 | Mandenol | 42 | 0.19 |
| JYH2 | MOL002914 | (2R)-2-(3,4-dihydroxyphenyl)-5,7-dihydroxy-2,3-dihydrochromen-4-one | 41.35 | 0.24 |
| JYH3 | MOL003006 | (-)-(3R,8S,9R,9aS,10aS)-9-ethenyl-8-(beta-D-glucopyranosyloxy)-2,3,9,9a,10,10a-hexahydro-5-oxo-5H,8H-pyrano[4,3-d]oxazolo[3,2-a]pyridine-3-carboxylic acid_qt | 87.47 | 0.23 |
| JYH4 | MOL003014 | secologanic dibutylacetal_qt | 53.65 | 0.29 |
| JYH5 | MOL002773 | beta-carotene | 37.18 | 0.58 |
| JYH6 | MOL003036 | Stigmasterol glucoside | 43.83 | 0.76 |
| JYH7 | MOL003044 | Chrysoeriol | 35.85 | 0.27 |
| JYH8 | MOL003095 | Corymbosin | 51.96 | 0.41 |
| JYH9 | MOL000422 | kaempferol | 41.88 | 0.24 |
| JYH10 | MOL000006 | luteolin | 36.16 | 0.25 |
| JYH11 | MOL000098 | quercetin | 46.43 | 0.28 |
| JYH12 | MOL003066 | neochlorogenic acid | 10.65 | 0.33 |
| JYH13 | MOL001680 | loganin | 5.90 | 0.44 |
| JYH14 | MOL000415 | rutin | 3.20 | 0.68 |
| JYH15 | MOL001877 | isochlorogenic acid B | 1.78 | 0.69 |
| JYH16 | MOL001875 | isochlorogenic acid A | 1.79 | 0.69 |
| JYH17 | MOL003118 | isochlorogenic acid C | 1.78 | 0.69 |
| JYH18 | MOL008377 | galuteolin | 2.70 | 0.79 |
| JYH19 | MOL003065 | 4-caffeoylquinic acid | 10.48 | 0.33 |
| JYH20 | MOL000414 | Caffeic acid | 54.97 | 0.05 |
| DG1 | MOL002665 | ferulic acid | 40.43 | 0.06 |
| DG2 | MOL011782 | Ligustilide | 23.50 | 0.07 |
| DG3 | MOL001780 | L-Tryptophane | 75.93 | 0.08 |
| DG4 | MOL007745 | Phthalic acid | 17.74 | 0.04 |
| DG5 | MOL002200 | levistolide A | 9.96 | 0.82 |
| DG6 | MOL001941 | imperatorin | 34.55 | 0.22 |
| DG7 | MOL002122 | (Z)-3-butylidenephthalide | 53.72 | 0.07 |
| DG8 | MOL002189 | 3-Butylphthalide | 47.90 | 0.07 |
| A1 | MOL000358 | beta-sitosterol | 36.91 | 0.75 |
| A2 | MOL000449 | Stigmasterol | 43.83 | 0.76 |
| A3 | MOL001955 | chlorogenic acid | 11.93 | 0.33 |
| DG: Angelica Sinensis; JYH: Lonicerae Japonicae Flos; A: Common composition | ||||
|
| Fig 1 Chinese medicine herb-compound-target network of angelica sinensis-lonicerae japonicae flos purple: Chinese medicine herb-compound; blue: target gene; pink: common composition; yellow: drugs; DG: Angelica Sinensis; DG1-8: unique ingredients of Angelica Sinensis; JYH: Lonicerae Japonicae Flos; JYH1-20 : unique ingredients of Lonicerae Japonicae Flos |
通过Gene Cards数据库得到动脉粥样硬化相关靶点4623个,按Relevance Score值从高到低排序,取前1/2的目标靶点,即Relevance Score>1为动脉粥样硬化潜在靶点,再结合OMIM、Drugbank数据库补充相关靶点,删除重复值,最终得到2118个动脉粥样硬化相关靶点。
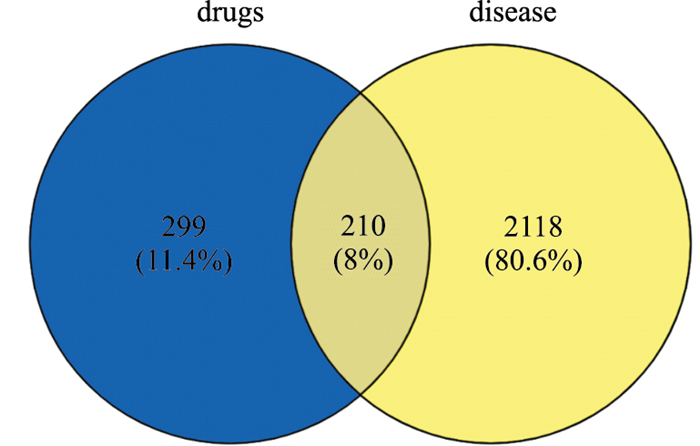
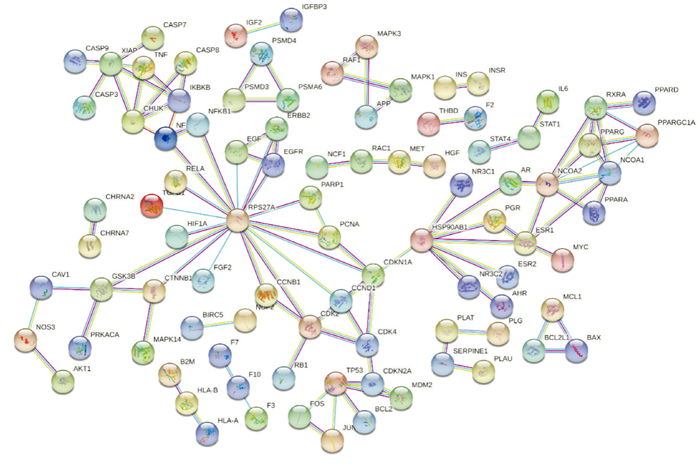
2.3 关键作用靶点筛选与靶点蛋白互作网络构建及拓扑分析通过Venny 2.1将当归-金银花活性成分靶点与动脉粥样硬化靶点取交集,并绘制韦恩图(Fig 2),得到共同靶点210个,约占靶点总数的8%。将共同靶点上传至String 11.0平台构建PPI网络,设置置信度>0.900,“Network Type”选择“physical network”,清除游离节点,共形成248个节点,1 266条边,节点代表作用靶点,“边”代表作用靶点之间的关联(Fig 3)。
|
| Fig 2 Ingredients of angelica sinensis-lonicerae japonicae flos target of atherosclerosis Venn map |
|
| Fig 3 PPI network of angelica sinensis-lonicerae japonicae flos atherosclerosis target |
将PPI网络导入Cytoscape3.8.2,利用Analyse Network进行计算,得到平均节点度值约为11.25,平均介度约为0.008 96,平均紧密度约为0.367,按≥2倍平均值的节点度值和介度、大于平均值的紧密度值筛选得到20个靶点,认为是当归-金银花配伍发挥抗动脉粥样硬化的关键靶点(Tab 2)。
| Gene | Degree | Closeness | Betweenness |
| MAPK1 | 45 | 0.475 | 0.066 |
| APP | 44 | 0.450 | 0.103 |
| JUN | 43 | 0.469 | 0.055 |
| TP53 | 43 | 0.435 | 0.050 |
| AKT1 | 43 | 0.44 | 0.053 |
| MAPK3 | 41 | 0.472 | 0.039 |
| RELA | 40 | 0.466 | 0.029 |
| TNF | 40 | 0.465 | 0.049 |
| RPS27A | 38 | 0.425 | 0.047 |
| NFKB1 | 35 | 0.462 | 0.043 |
| MAPK14 | 31 | 0.447 | 0.070 |
| IL6 | 30 | 0.441 | 0.034 |
| MAPK8 | 30 | 0.450 | 0.024 |
| CXCL8 | 29 | 0.434 | 0.040 |
| CTNNB1 | 29 | 0.432 | 0.037 |
| VEGFA | 27 | 0.442 | 0.023 |
| FOS | 26 | 0.431 | 0.019 |
| EGFR | 26 | 0.433 | 0.019 |
| NR3C1 | 25 | 0.421 | 0.019 |
| F2 | 24 | 0.397 | 0.049 |
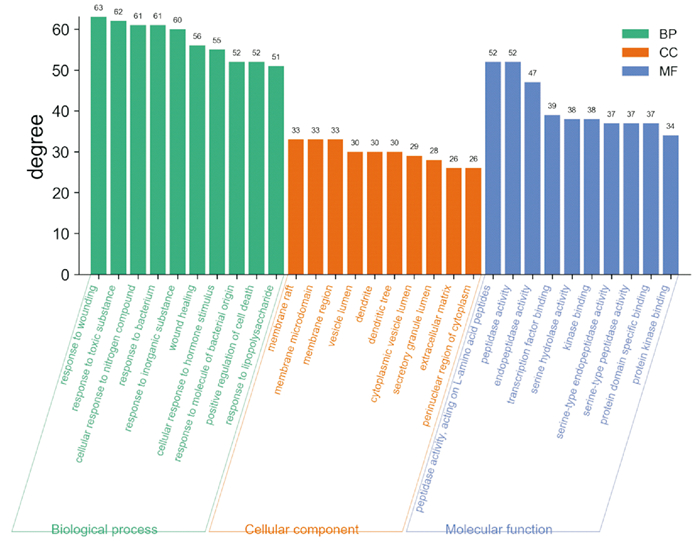
运用metascape平台对筛选到的靶点进行GO注释分析,共有条目3 354个,GO-BP生物过程(biological process,BP)2 961个,GO-CC细胞组成(cellular component,CC)151个,GO-MF分子功能(molecular function,MF)242个,筛选排名前10的功能(Fig 4)。
|
| Fig 4 GO enrichment analysis of potential targets of main components in angelica sinensis-lonicerae japonicae flos |
结果可见生物过程涉及应对受伤、细胞对氮化合物的反应、创伤修复、细胞死亡的积极调控、脂多糖的应答等;细胞组成主要涉及膜筏、树突、树突树、胞质囊腔、分泌颗粒内腔、细胞外基质、胞质核周区域等;分子功能主要体现在肽酶活力、作用于l -氨基酸肽、丝氨酸水解酶活性、酪氨酸激酶结合蛋白、丝氨酸蛋白酶内肽酶活力、丝氨酸蛋白酶肽酶活力。
KEGG通路富集结果显示,潜在的当归-金银花协同抗动脉粥样硬化治疗靶点富集在250条通路上,选取排名前20通路,运用omicshare平台(https://www.omicshare.com/)绘制气泡图行可视化分析(Fig 5)。气泡大小表示基因数目,颜色差异代表基因富集的显著性大小。可以看出与当归-金银花抗动脉粥样硬化相关的排名靠前的关键通路有磷脂酰肌醇3激酶-蛋白激酶B(PI3K-Akt)信号通路(靶标数43)、腺苷酸活化蛋白激酶(MAPK)信号通路(靶标数37)、流体剪切应力和动脉粥样硬化(靶标数36)、糖尿病并发症中的AGE-RAGE信号通路(靶标数35)、IL-17信号通路(靶标数29)、细胞衰老(靶标数28)、肿瘤坏死因子(TNF)信号通路(靶标数28)、细胞凋亡(靶标数28)等,提示当归-金银花配伍的活性成分主要是通过这些通路在抗动脉粥样硬化过程中发挥作用的。
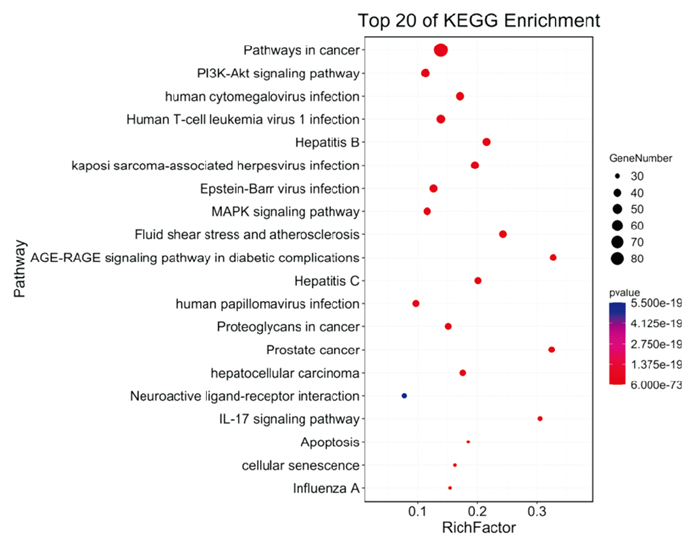
|
| Fig 5 Bubble diagram of analysis of KEGG enrichment in top 20 pathways |
采用Cytoscape 3.8.2软件对筛选出的活性成分、疾病靶点及通路进行可视化分析(Fig 6)。列出度值前10位的活性成分,见Tab 3。随着技术发展,筛选药物靶标的方法也逐渐多样,多种方法相结合可以相互佐证,提高筛选效率与准确性。L-色氨酸(L-Tryptophane,50)、槲皮素(quercetin,39)、木犀草素(luteolin,31)、山奈酚(kaempferol,25)、阿魏酸(ferulic acid,23)、β-胡萝卜素(beta-carotene,21)、beta-谷甾醇(beta-sitosterol,20)、3-丁基-1(3H)-异苯并呋喃酮(3-Butylphthalide,14)、咖啡酸(caffeic acid,14)、芦丁(rutin,14)是当归-金银花配伍发挥作用的主要活性成分,前文PPI预测结果中前20位中有MAPK1、MAPK3、AKT1等3个靶点仍排在通路富集靶点的前10位中[8],因此可能是发挥作用的主要靶点。
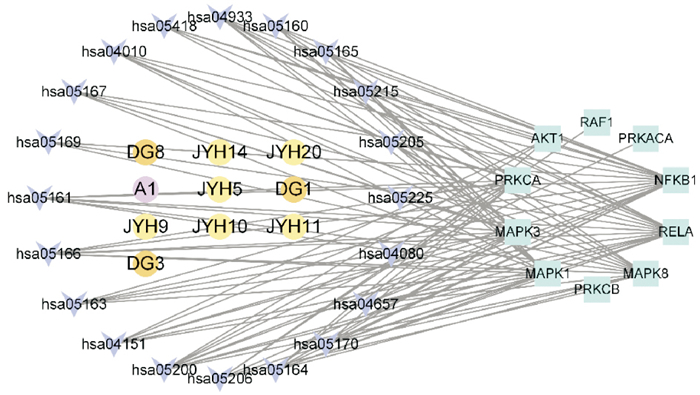
|
| Fig 6 Network of compound-pathway-target |
| MOLID | ID | Compound name | Degree | Betweenness | Closeness |
| MOL001780 | DG3 | L-Tryptophane | 50 | 0.094 | 0.343 |
| MOL000098 | JYH11 | Quercetin | 37 | 0.031 | 0.384 |
| MOL000006 | JYH10 | luteolin | 34 | 0.030 | 0.386 |
| MOL000422 | JYH9 | kaempferol | 25 | 0.035 | 0.364 |
| MOL002665 | DG1 | ferulic acid | 23 | 0.023 | 0.335 |
| MOL002773 | JYH5 | beta-carotene | 21 | 0.020 | 0.360 |
| MOL000358 | A1 | beta-sitosterol | 20 | 0.024 | 0.381 |
| MOL000414 | JYH20 | Caffeic acid | 14 | 0.010 | 0.332 |
| MOL000415 | JYH14 | rutin | 14 | 0.008 | 0.323 |
| MOL002189 | DG8 | 3-Butylphthalide | 14 | 0.007 | 0.315 |
根据之前分析结果,取当归-金银花度值前10位有效成分与潜在作用靶点前10位,利用AutoDock软件进行分子对接,运用PyMOL软件进行可视化呈现(Fig 7、8)。结果显示,山奈酚(kaempferol)、槲皮素(quercetin)、芦丁(rutin)、beta-谷甾醇(beta-sitosterol)、木犀草素(luteolin)是与疾病靶点结合较好的活性成分;MAPK3、AKT1、PRCKB是有效成分作用较好的疾病靶点。小分子配体与蛋白受体结合能越低,结合分子之间越稳定,提示分子之间发生相互作用的可能性越大,Fig 8中展示了其中对接结果较好的4组。
| Gene | Degree | Betweenness | Closeness | Gene | Degree | Betweenness | Closeness | |
| MAPK1 | 108 | 0.054 574 | 0.434 116 | PRKACA | 66 | 0.037 659 | 0.396 211 | |
| MAPK3 | 107 | 0.053 496 | 0.433 333 | RELA | 65 | 0.019 610 | 0.389 789 | |
| PRKCA | 89 | 0.060 581 | 0.418 99 | NFKB1 | 65 | 0.017 24 | 0.384 185 | |
| AKT1 | 87 | 0.038 735 | 0.418 261 | PRKCB | 61 | 0.028 042 | 0.394 262 | |
| RAF1 | 75 | 0.023 989 | 0.398 179 | MAPK8 | 61 | 0.018 350 | 0.386 035 |
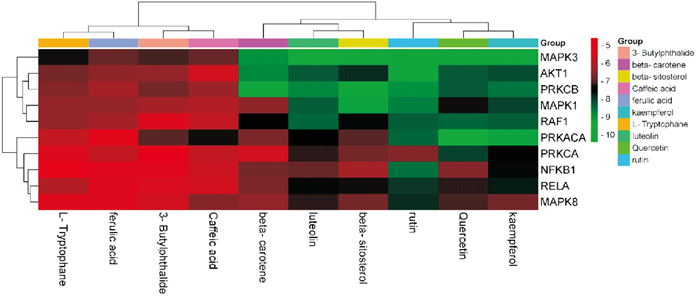
|
| Fig 7 Heatmap of molecular docking with high scores of potential targets and main compounds in angelica sinensis-lonicerae japonicae flos |
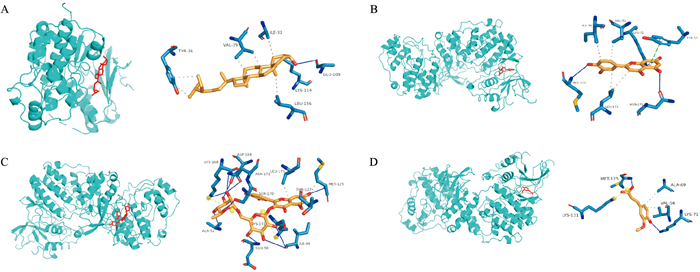
|
| Fig 8 Molecular docking with high scores of potential targets and four ingredients in angelica sinensis-lonicerae japonicae flos A: beta-sitosterol-MAPK1; B: luteolin-MAPK3; C: rutin-MAPK3; D: ferulic acid- MAPK3 |
一直以来,AS与冠心病及急性冠脉综合征等严重心血管不良事件的发生密不可分,脂蛋白代谢紊乱和炎症是一直是受到广泛关注的经典理论。当归-金银花是在临床应用中使用频率较高的活血解毒中药配伍,且已有实验证实,在BV-2小胶质细胞中,金银花的活性成分能够抑制脂多糖刺激的一氧化氮(NO)和前列腺素E2(prostaglandin E2)的产生,显著抑制p38丝裂原活化蛋白激酶(mito-genactivated protein kinase,p38 MAPK)和PI3K-Akt,从而发挥抗炎的作用[9];当归可以通过降低大鼠血清中NO含量,改善心肌缺血损伤[10],其有效成分阿魏酸能够抗血小板聚集、抑制胆固醇的合成,发挥抗血栓的功效。
本研究首先通过网络药理学方法,分析了当归-金银花配伍有效成分与动脉粥样硬化疾病相关靶点,初步筛选出槲皮素、木犀草素、芦丁、阿魏酸等重要活性成分。槲皮素与山奈酚都属于黄酮醇类化合物,槲皮素能够降低血液中的总胆固醇和低密度脂蛋白,提高抗氧化能力,还具有降低血糖的治疗潜力。木犀草素主要通过抑制炎症与氧化应激发挥抗动脉粥样硬化的作用[11],通过调节Nrf2介导的氧化应激和NF-κB介导的炎症反应保护链脲霉素诱导的糖尿病小鼠的心脏组织,并且能够通过抑制NF-κB的过度磷酸化和下调p38、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)磷酸化保护小鼠心肌细胞缺血损伤,抑制心肌细胞的凋亡[12]。在心肌梗死小鼠的实验中发现,阿魏酸具有很强的抗氧化和心脏保护作用,可以通过调节自噬来抑制心肌细胞凋亡。动物实验发现,阿魏酸可能是通过抑制炎症因子、减少氧化低密度脂蛋白的生成,调节血脂,减少泡沫细胞形成等机制发挥抗动脉粥样硬化作用[13]。芦丁能够显著提高超氧化物歧化酶和过氧化氢酶的活性,平衡心脏的氧化和抗氧化系统;通过增加内皮细胞一氧化氮的产生而改善内皮功能,减轻血管平滑肌细胞的早衰[14],从而减轻动脉粥样硬化负担并稳定斑块。beta-谷甾醇则有利于改善脂蛋白状况和主动脉功能[15],能明显抑制TNF-α刺激的人类主动脉内皮细胞(human artery endothelial cells,HAECs)中血管黏附分子1和细胞内黏附分子1的表达,以及U937细胞与TNF-α刺激的HAEC的结合,削弱NF-κB p65的磷酸化,从而发挥药效。
为了进一步确证当归-金银花在治疗动脉粥样硬化中发挥作用的药效基础,接下来采用分子对接技术对筛选得到的重要成分进行验证。一般认为结合能≤-5.0 kJ·mol-1时表明配体与受体结合发生作用的可能性较大,且构象越稳定时能量越低[16]。根据筛选结果,将前10位有效成分与前10位靶点蛋白分别进行对接,发现MAPK3和MAPK1与重要成分的对接结果均较满意,芦丁与MAPK3(-10.4 kJ·mol-1)、木犀草素与MAPK3(-9.5 kJ·mol-1)、芦丁与AKT1(-9.3 kJ·mol-1)、阿魏酸与MAPK3(-6.9 kJ·mol-1)是对接较好的组合,说明当归-金银花可能通过抗炎、调节细胞自噬、调节细胞分化与迁移等多方面发挥作用。
本文研究发现,根据PPI及KEGG通路富集靶点预测均显示MAPK1、MAPK3、AKT是当归-金银花配伍作用于AS的关键靶点,其次分别涉及APP、JUN、TP53与PRKCA、MAPK8、RAF1等靶点,说明MAPK家族成员在当归-金银花抗动脉粥样硬化过程中扮演重要角色。经过p38激活的MAPK通路,在大鼠心肌缺血/再灌注期间会增加不良心血管事件的发生。PRKCA参与调节细胞增殖、分化、迁移、心肌细胞肥大和炎症等,有研究发现其是小鼠心肌细胞内心肌收缩力和Ca2+稳态的关键调节因子,PRKCA过表达会降低心肌收缩力,而PRKCA缺乏则能预防心力衰竭[17],但其在动脉粥样硬化中的具体机制还有待进一步探索。有动物实验研究表明,PI3K-Akt信号通路与冠心病过程中的抗炎和抗凋亡有关[18]。综合以上结果推测,当归-金银花有效成分可能通过调控MAPK、PRKCA、PI3K-Akt信号通路,发挥抗炎、抗细胞凋亡、调控细胞自噬最终起到抗动脉粥样硬化的作用。
本文通过网络药理学和分子对接技术,初步预测活血解毒中药配伍(当归-金银花)的有效成分及其在抗动脉粥样硬化的作用中发挥作用的可能靶点,为后续开展实验验证奠定基础。
| [1] |
中国心血管健康与疾病报告2019概要[J]. 中国循环杂志, 2020, 35(9): 833-54. Report on Cardiovascular Health and Diseases in China 2019: an Updated Summary[J]. Chin Circul J, 2020, 35(9): 833-54. |
| [2] |
张京春, 陈可冀. 瘀毒病机与动脉粥样硬化易损斑块相关的理论思考[J]. 中国中西医结合杂志, 2008, 28(4): 366-8. Zhang J C, Chen K J. Theoretical thinking on relationship between toxic-stasis pathogenicity and atherosclerotic vulnerable plaque[J]. Chin J Integr Tradit West Med, 2008, 28(4): 366-8. doi:10.3321/j.issn:1003-5370.2008.04.022 |
| [3] |
刘璐, 徐士欣, 张军平, 等. 基于网络药理学方法探讨四妙勇安汤治疗动脉粥样硬化的作用机制[J]. 中华中医药学刊, 2019, 37(3): 572-8, 773-5. Liu L, Xu S X, Zhang J P, et al. Mechanism of SimiaoYong'an decoction for atherosclerosis based on network pharmacology[J]. Chin Arch Tradit Chin Med, 2019, 37(3): 572-8, 773-5. |
| [4] |
吴娇, 王聪, 于海川. 金银花中的化学成分及其药理作用研究进展[J]. 中国实验方剂学杂志, 2019, 25(4): 225-34. Wu J, Wang C, Yu H C. Chemical constituents and pharmacological effect of lonicerae japonicae flos[J]. Chin J Exp Tradit Med Form, 2019, 25(4): 225-34. |
| [5] |
邓雪琪, 管小军, 黄娜娜, 等. HPLC法同时测定当归中8种成分[J]. 中成药, 2020, 42(8): 2075-9. Deng X Q, Guan X J, Huang N N, et al. Simultaneous determination of eight constituents in Angelica sinensis by HPLC[J]. Chin Tradit Pat Med, 2020, 42(8): 2075-9. doi:10.3969/j.issn.1001-1528.2020.08.020 |
| [6] |
Li S, Zhang B. Traditional Chinese medicine network pharmacology: Theory, methodology and application[J]. Chin J Nat Med, 2013, 11(2): 110-20. |
| [7] |
陈健, 张越, 王洪兰, 等. 当归标准汤剂HPLC指纹图谱及多指标成分定量研究[J]. 中草药, 2019, 50(20): 4942-9. Chen J, Zhang Y, Wang H L, et al. Fingerprint and multi-components content determination of standard decoction of Angelicae Sinensis Radix[J]. Chin Tradit Herbal Drugs, 2019, 50(20): 4942-9. doi:10.7501/j.issn.0253-2670.2019.20.015 |
| [8] |
李静, 高丽, 高耀, 等. 基于网络药理学的款冬花止咳化痰活性成分靶点探究[J]. 中草药, 2018, 49(1): 179-87. Li J, Gao L, Gao Y, et al. Exploration in targets action of antitussive and expectorant bioactive components from Farfarae Flos based on network pharmacology[J]. Chin Tradit Herbal Drugs, 2018, 49(1): 179-87. |
| [9] |
Kwon S H, Ma S X, Hong S I, et al. Lonicera japonica THUNB. Extract inhibits lipopolysaccharide-stimulated inflammatory responses by suppressing NF-κB signaling in BV-2 microglial cells[J]. J Med Food, 2015, 18(7): 762-75. doi:10.1089/jmf.2014.3341 |
| [10] |
蒲双双, 牛小伟, 张钲. 当归多糖改善大鼠急性心肌缺血损伤作用的研究[J]. 心肺血管病杂志, 2020, 39(3): 338-42. Pu S S, Niu X W, Zhang Z. Application of impedance-based real time cellular analyzer to explore the effect of angelica sinensis polysaccharides on ischemic injury after acute myocardial infarction[J]. J Cardiovascular Pulmonary Dis, 2020, 39(3): 338-42. doi:10.3969/j.issn.1007-5062.2020.03.027 |
| [11] |
王清岑, 殷新, 周罗慧, 等. 木犀草素心血管保护作用研究进展[J]. 中国现代医学杂志, 2020, 30(11): 57-60. Wang Q C, Yin X, Zhou L H, et al. New advances in studies on cardioprotective effects of luteolin[J]. Chin J Mod Med, 2020, 30(11): 57-60. doi:10.3969/j.issn.1005-8982.2020.11.012 |
| [12] |
Li L, Luo W, Qian Y, et al. Luteolin protects against diabetic cardiomyopathy by inhibiting NF-κB-mediated inflammation and activating the Nrf2-mediated antioxidant responses[J]. Phytomedicine, 2019, 59: 152774. doi:10.1016/j.phymed.2018.11.034 |
| [13] |
刘畅, 邱夏, 刘国栋, 等. 动脉粥样硬化的炎症机制及阿魏酸钠的干预作用[J]. 扬州大学学报(农业与生命科学版), 2012, 33(1): 18-22. The inflammation mechanism of atherosclerotic and intervention effects of sodium ferulate[J]. J Yangzhou Univ (Agric & Life Sci. ), 2012, 33(1): 18-22. |
| [14] |
Xianchu L, Lan Z, Ming L, et al. Protective effects of rutin on lipopolysaccharide-induced heart injury in mice[J]. J Toxicol Sci, 2018, 43(5): 329-37. doi:10.2131/jts.43.329 |
| [15] |
Liang Y T, Wong W T, Guan L, et al. Effect of phytosterols and their oxidation products on lipoprotein profiles and vascular function in hamster fed a high cholesterol diet[J]. Atherosclerosis, 2011, 219(1): 124-33. doi:10.1016/j.atherosclerosis.2011.06.004 |
| [16] |
张田义, 赖新星, 李婷婷, 等. 基于网络药理学和分子对接技术探讨功劳叶、仙鹤草药对治疗缺血性中风的作用机制[J]. 中国药理学通报, 2021, 37(11): 1607-13. Zhang T Y, Lai X X, Li T T, et al. A network pharmacology and molecule docking approach to investigating active compounds and mechanisms of gonglaoye-xianhecao herbal pair for ischemic stroke[J]. Chin Pharmacol Bull, 2021, 37(11): 1607-13. |
| [17] |
Braz J C, Gregory K, Pathak A, et al. PKC-alpha regulates cardiac contractility and propensity toward heart failure[J]. Nat Med, 2004, 10(3): 248-54. doi:10.1038/nm1000 |
| [18] |
Chen X, Wang R, Chen W, et al. Decoy receptor-3 regulates inflammation and apoptosis via PI3K/AKT signaling pathway in coronary heart disease[J]. Exp Ther Med, 2019, 17(4): 2614-22. |

