

2. 吉林省过敏性常见疾病免疫与靶向研究重点实验室,吉林 延吉 133002
2. Jilin Provincial Key Laboratory of Immunization and Targeting of Common Allergic Diseases, Yanji, Jilin 133002, China
心血管疾病是指由于心血管和心脏病变而引起的一系列疾病。对人类健康的危害极为严重,尤其对于老年人来说,是名副其实的隐形杀手。1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)在多种心血管疾病中发挥广泛有效的作用,参与疾病的发生发展过程,也能在疾病产生后起到治疗和促进恢复的作用,所以S1P在心血管疾病具有研究价值。
1 1-磷酸鞘氨醇 1.1 S1P概述S1P是鞘氨醇脂的代谢物,主要来源于红细胞、血小板和内皮细胞,能调控细胞的增殖、分化、迁移、凋亡、血管新生和炎症等生命活动。S1P作为第二信使调节细胞内钙离子浓度及其移动,作用细胞膜上的S1P受体,调节粘附基因的表达以及激活单核细胞粘附内皮细胞。S1P是血浆中的多效信号脂质分子,与高密度脂蛋白(high-density lipoprotein,HDL)结合具有高亲密性,是高密度脂蛋白中含量最高的脂质成分[1]。鞘磷脂酶把鞘磷脂水解为神经酰胺(ceramide,Cer),神经酰胺酶把神经酰胺转化为S1P的前体鞘氨醇(sphingosine,Sph)。鞘氨醇激酶1和2(SphK1,2)把Sph磷酸化生成S1P。S1P通过可逆去磷酸化和鞘氨醇化降解,或通过磷酸水解酶不可逆裂解成磷酸乙醇胺和十六烷基化合物被降解[2]。SphK是S1P合成的关键限速酶。S1P胞内活性受SphK分布影响,SphK1和SphK2催化鞘氨醇产生S1P,抑制或敲除SphK1、2基因处理后,SphK1和SphK2对血液中S1P浓度的影响起相反作用,SphK1降低了血液中S1P浓度,而SphK2使血液中S1P浓度增加。
1.2 S1PRsS1PRs启动的信号属于G蛋白偶联受体超家族(G protein coupled receptors,GPCRs),由G蛋白的偶联受体介导,发挥多种生物效应,共分5种S1PR1-5。S1PR1-3在人体大多数组织如心血管、神经、肝脏和免疫系统中均有表达,S1PR4在淋巴组织中特异表达,S1PR5在神经系统中特异表达[3]。信号分子与细胞表面的受体结合,以G蛋白为核心的信号传递系统把信息从胞外传递到胞内,是细胞中最常见的信号传递方式。S1P通过与不同亚型的G蛋白偶联,广泛参与细胞信号转导和细胞功能调控,S1PR1能与Gi/o结合;S1PR2广泛表达,能与Gi/o、Gs、Gq和G12/13;S1PR3能与Gq、Gi/o和G12/13蛋白结合;S1PR4和S1PR5能与Gs、Gq和G12/13结合。虽然S1P有细胞内作用,但S1P主要是通过激活细胞膜S1PRs由自分泌或旁分泌方式来产生大部分生物效应。在心脏中S1PR1-3主要表达[4]。
2 S1P对心血管系统的作用 2.1 影响血管内皮细胞通透性和屏障作用S1P对血管内皮细胞(endothelial cells,ECs)的作用,主要是调节血管张力及影响血管内皮细胞的通透性和屏障功能。S1P结合S1PR1、3激活磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)促使内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)磷酸化起到舒血管和抑炎症的作用。与S1PR1、3对内皮细胞的保护作用相反,S1PR2激活小GTP结合蛋白(small GTP binding protein,Rho)/Rho相关卷曲螺旋形成蛋白激酶(Rho-associated coiled helices form protein kinases,Rock)和第10号染色体缺失性磷酸酶张力蛋白同源物基因(phosphatase and tensin homology deleted on chromosome ten,PTEN)通路抑制AKT磷酸化破坏粘附连接,增加细胞旁通透性。Rho、Rock和PTEN都是RAS相关的C3肉毒素底物1(Ras-associated C3 botulinum substrate 1,Rac1)的负调控因子,被S1PR2激活后会破坏S1PR1、3的屏障保护功能[5]。高血糖条件下,S1P表达增加,结合S1PR2诱导内皮细胞功能障碍,拮抗S1PR2可激活PI3K/AKT信号通路抑制NO的产生,恢复S1P诱导的内皮功能损伤。S1PR1、3通过AKT/糖原合成激酶3β(glycogen synthesis kinase-3β,GSK-3β)信号通路导致线粒体凋亡在逆转高糖诱导的ECs损伤中表现为活性氧减少、NO增加和形态发生逆转[6]。以上结果表明S1P结合S1PR1、3对EC调控与S1PR2具有相反的作用,增强S1PR1、3,拮抗S1PR2的作用达到最优的血管内皮完整性和通透性保护和抑制炎症的作用。
2.2 影响血管平滑肌细胞迁移和增殖S1P在血管平滑肌细胞(vascular smooth muscle cells,VSMCs)中的主要作用是影响血管平滑肌细胞的迁移和增殖。S1P结合S1PR1表达响应血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)通过H2O2介导的APE/Ref1易位,H3组蛋白乙酰化和脱嘌呤(apurinic/apyrimidinic endonuclease,APE)/脱嘧啶核酸内切酶/氧化还原因子-1(redox factor-1,Ref-1)在S1PR1启动子上的结合增加,诱导的VSMCs迁移和血管新生内膜形成[7]。Kerage等[8]发现, eNOS-KO和抑制组的S1P组小鼠的动脉中被破坏的程度与WT小鼠相似,S1P结合S1PR2、3介导血管收缩,通过介导血管壁内NO依赖的PI3K/AKT信号通路促使eNOS磷酸化,降低NO的含量抑制血管炎症反应和平滑肌增殖。S1P结合S1PR3增强Rac1活性,增加了VSMCs的迁移能力;而结合S1PR2通过激活Rho/Rock途径抑制Rac1活性,导致VSMCs功能的显著降低。HDL携带的S1P通过S1PR3介导主动脉和血管中NO依赖的扩张引起血管发生和内皮保护,抑制VSMCs的迁移,对心肌缺血再灌注损伤有保护作用。S1PR1促迁移,S1PR3既有促进也有抑制作用,确定S1PR3抑制作用的靶点,通过S1PR2、3作用降低NO含量抑制VSMCs迁移和增殖能有效的对抗心血管疾病。
3 S1P与心血管疾病 3.1 S1P与动脉粥样硬化动脉粥样硬化(atherosis,AS)是指动脉病变发展到足以阻塞动脉腔的黄色粥样脂质,导致动脉所供应的组织或器官缺血或坏死。在AS中,HDL能发挥促进血管内皮功能和心脏保护作用,S1P与HDL结合促进S1PR1-β-抑制素2复合物的形成,降低肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),伴促炎因子核转录因子-κB(nuclear transcription factor-κB,NF-κB)和ICAM-1的水平抑制巨噬细胞凋亡,减少动脉粥样硬化斑块的形成,发挥抵抗AS的作用[9]。Euerborn等[10]发现的HDL-S1P通过S1PR2/S1PR3信号通路激活转录激活因子3(signal transducer and activator of transcription,STAT3),促进survivin表达,从而抑制巨噬细胞凋亡,起到保护AS作用。S1P结合S1PR2激活G12/13,NF-κB增加ICAM-1/VCAM-1表达促进炎症反应抑制血管平滑肌生长和迁移,发挥抗AS的作用。敲S1PR2后IL-1β,IL-18水平升高,能刺激血管VSMCs向内皮迁移,诱导AS产生。但是最近的研究发现,S1P对AS并不是完全的保护作用,与白蛋白结合的S1P通过S1PR2/Rho/Rock/NF-κB途径增加纤溶酶原激活抑制剂1的表达,促进AS[11],打破了传统S1P对AS仅有保护作用的观念,深入研究S1P相关NF-κB达到最有效的治疗方式。
3.2 S1P与心肌缺血与再灌输损伤心肌缺血与再灌输损伤(ischemia/reperfusion,I/R)中缺血是指冠状动脉供血减少,导致心肌的缺血。再灌输损伤是指缺血的心肌阻塞又重新畅通时呈现更加严重的病理反应。S1P是心肌缺血预处理的重要内源性保护因子,S1P信号传导过程涉及线粒体功能障碍下调、凋亡组装以及再灌注损伤补救激酶(reperfusion injury recovery kinase,RISK)和生存活化因子(survival activating factor,SAFE)促生存途径,这两种途径分别涉及信号传感器和STAT3、AKT的激活。它还调节内皮功能障碍和免疫细胞行为,以控制缺血/再灌注损伤部位的血管渗透性和免疫细胞浸。Deshpande等[12]通过研究S1P介导细胞内损伤的促生存途径,发现该途径能减少抗血友病因子(antihemophilic factor,AHF)水平,对心脏血管屏障损伤有改善作用。Yung等[13]研究发现,S1P通过与Gα13的偶联激活RhoA及其下游效应物PKD,S1P治疗减少了野生型(WT)心脏缺血/再灌注引起的梗死面积,在S1PR3-KO和抑制剂组小鼠心脏中发现保护作用被取消,证明了S1PR3对S1P介导的体外I/R损伤的心脏保护作用。目前在I/R的研究通过S1PRs的作用还尚待发掘,后续研究应继续在S1PRs-KO水平上进行研究。
3.3 S1P与心肌梗死心肌梗死(myocardial infarction,MI)是冠状动脉闭塞,血流中断,使部分心肌因严重的持久性缺血而发生局部坏死。脂肪源间充质干细胞的外泌体通过促进M2型巨噬细胞极化下调MI诱导的炎症反应,同时外泌体抑制MI诱导的心肌细胞凋亡和纤维化。Ohkura等[14]研究发现,S1P/S1PR1介导外泌体通过负调控炎症、抑制心肌凋亡和纤维化参与了MI后的心脏保护。下调S1PR1可抑制M2型巨噬细胞极化,导致白细胞介素1β(interleukin 1β,IL1β)、6、10,TNF-α,干扰素-γ(interferon-γ,IFN-γ)炎症因子上调,促进M1型巨噬细胞极化和NF-κB上调。S1P结合S1PR1促进M2型巨噬细胞的极化,减轻炎症反应;介导转化生长因子-β(transforming growth factor-beta,TGF-β)/Smad信号通路抑制M2型巨噬细胞的极化。S1P预处理可显著增强脂肪组织来源的间充质干细胞(adipose tissue-derived mesenchymal stem cells,AT-MSCs)的迁移和抗凋亡作用。Chen等[15]研究发现,AT-MSCs中S1P结合S1PR2通过激活ERK1/2-MMP-9促进AT-MSCs迁移,通过激活AKT抑制AT-MSCs凋亡,,发挥对MI的保护作用。Deng等[16]在I/R实验中,缺失S1PR2和S1PR3增加了梗死面积S1PR3-KO心脏缺血后功能恢复减弱,梗死面积比例增加,证实了该受体的心脏保护作用。缺血前血管内给药S1P使WT和S1PR3-KO心脏心功能恢复恶化并增加梗死面积,尽管S1PR3缺乏可减弱冠状动脉灌注。这些发现强调了S1P在心肌中具有相反的作用:从缺血心肌释放的S1P具有心脏保护作用,而通过冠状循环作用的S1P则对心脏有害,提示我们在MI的治疗中,综合考虑S1P的来源和作用,以及M2型巨噬细胞的极化,增强保护作用,减少对心脏的损害。
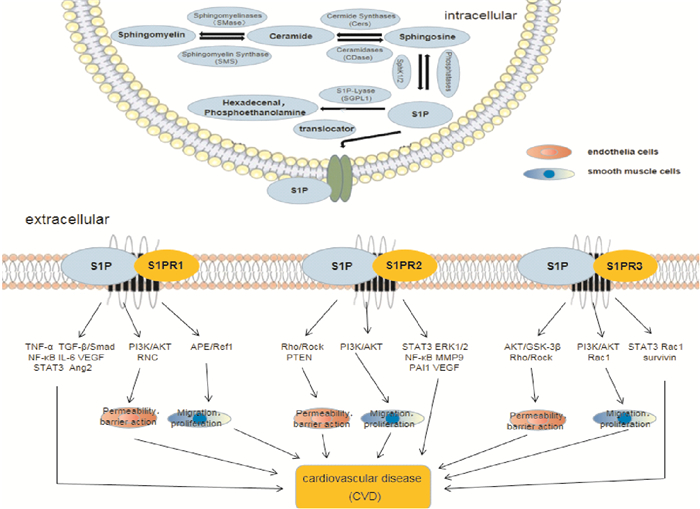
|
| Fig 1 S1P metabolism and function of S1P combining S1PRs involved in cardiovascular diseases (CVD) S1P is produced by the coexistence of the neogenesis pathway and the sphingomyelipid (SMase) pathway. The ceramide precursor produces sphingosine via the ceramidase. Sphingosine is phosphorylated to S1P by sphingosine kinases 1 and 2(SphK1 and SphK2), dephosphorylated by S1P phosphatases 1 and 2(SPPs) in cells, or dephosphorylated by exoenzymes lipid phosphatases (LPPs) on the cell surface. S1P can also be cleaved and irreversibly degraded in cells by S1P lyase (SGPL1).The undegraded S1P can be transported out of the cell through spinster homolog 2 (SPNS2) or ATP binding cassette transporters, and binds to S1PRs on the cell membrane as a ligand, playing biological effects. S1P combined with S1PR1 protects the permeability integrity and barrier function of endothelial cells, inhibits inflammation and the generation of cardiovascular diseases, promotes the migration and proliferation of smooth muscle cells and promotes the generation of diseases. S1P combined with S1PR2 destroys permeability integrity and barrier function to promote endothelial inflammation and inhibit smooth muscle cell migration and growth to fight disease. S1PR3 protects the permeability integrity and barrier function of endothelial cells, inhibits inflammation and cardiovascular diseases, selectively inhibits the migration and growth of smooth muscle cells to fight diseases. S1P combined with S1PR1-3 plays both promoting and inhibitory roles in cardiovascular diseases through the action of signaling pathways and inflammatory factors. |
心肌纤维化(myocardial fibrosis,MF),是由中到重度的冠状动脉粥样硬化性狭窄引起心肌纤维持续性或反复加重的心肌缺血缺氧所致。T细胞中S1P结合S1PR1对MF和心功能具有双重作用:在正常生理条件下,外周存在T细胞是维持心脏胶原稳态所必需的,而在慢性病理条件下,T细胞通过激活促纤维化信号增强胶原沉积。TGF-β表达在S1PR1-KO小鼠糖尿病心脏中受到抑制,内源性S1P/S1PR1轴能促进TGF-β1的产生,诱导MF产生。Magaye等[17]研究发现,外源性二氢鞘氨醇(dihydrosphingosine,dhSph)显著减少TGF-β刺激的胶原合成,dhSph对Smad2和AKT磷酸化来减少胶原合成。而在TGF-β存在的情况下,dhSph的胶原减少作用是不明显的,并且可以归因于在新生合成途径中增加的鞘脂,如二氢1-磷酸鞘氨醇(dihydrosphingosine-1-phosphate,dhS1P)。与需要APOM的S1P相比,dhS1P能够以非特异性方式与血浆中的HDL结合。细胞外dhS1P通过JAK/STAT-基质金属蛋白酶组织抑制剂1(matrix metalloproteinase tissue inhibitor 1,TIMP1)信号通路增加了STAT1、3蛋白的磷酸化水平,促进TGF-β和TIMP1表达的增加。增加心肌成纤维细胞中的胶原合成,从而导致MF,与S1P/S1PR1信号产生的作用相反[18]。在体外,抑制PI3K可减少dhS1P诱导的心肌成纤维细胞中的胶原合成。抑制PI3K/AKT-mTOR信号通路导致COLlA1和TGF-β的翻译受损,并抑制TIMP1的转录和翻译。在心肌细胞中,PI3K抑制通过降低α-SMA的表达,以及GSK-3β表达,抑制蛋白质翻译,增加ECM的降解而具有抗增殖和抗纤维化作用[19]。S1P介导的TGF-β和AKT是纤维化的研究中非常经典的,现最新研究的S1P前体dhS1P在MF相关研究表现更佳,可以更深入探索dhS1P的作用。
3.5 S1P与心肌重塑心肌重塑(myocardial remodeling,MR),是指心肌细胞、非心肌细胞及细胞外基质在基因表达改变的基础上所发生的变化,使心脏的结构、代谢和功能改建的过程。根据心肌梗死的阶段和心肌细胞类型的不同,S1P对MR调控有双重作用,早期起心脏保护作用,后期促MR。TGF-β刺激S1P使胶原蛋白含量上升,加快重塑。在重塑过程中,S1PR1发挥促进作用,产生Ang Ⅱ、IL-6,并且增加心肌内胶原的积累沉积。Deng等[20]研究发现,在心肌梗死后,心脏S1P增加,这是由于SphK1和S1PR1上调所致,在心肌梗死后4周,SphK1/S1P/S1PR1信号通路增加,SphK1抑制剂对S1P抑制改善了心功能不全。Ouyang等[21]发现,SphK1/S1P/S1PR1信号通路能激活心肌细胞的促炎症反应,NF-κB,信号转导和STAT3、IL-6、TNF-α,以及重塑基因心钠肽、脑钠肽、肌球蛋白重链上调,引起心肌梗死后慢性心脏炎症的发生。使用S1PR1调节剂FTY720对S1PR1的全身抑制可以减少心肌梗死后的白细胞浸润,能够拮抗心肌梗死后心功能障碍和保护心肌的重塑。综上所述,确保S1P在心肌重塑早期发挥保护作用,抑制SphK1/S1P/S1PRs轴在MR的治疗中发挥了关键作用,对该轴下游的研究具有重大价值。
3.6 S1P与血管新生血管新生(angiogenesis)是指从已有的毛细血管或血管后静脉发展而形成新的血管,血管新生是促血管形成因子和抑制因子相互协调作用的过程。Yao等[22]的研究表明,S1P在血管内皮生长因子(vascular endothelial growth factor,VEGF)水平较低时能诱导血管新生,说明激活S1PR1信号会抑制VEGF的产生,S1PR1信号的缺乏会导致局部组织缺氧,增强VEGF的产生和VEGF依赖的内皮增殖和发芽血管新生,在当VEGF通路抑制与S1PR1结合时,血管新生和血管密度显著降低。VEGF刺激内皮细胞可导致细胞上的S1PR1过表达,并在离体动脉中增强S1P介导的血管舒张和eNOS磷酸化,促进毛细血管内皮细胞的生存和血管新生。Jin等[23]研究发现,HDL中S1P通过S1PR3依赖性上调和VEGFR2的激活诱导的内皮细胞增殖、迁移和管形成的调节促进血管新生,S1PR1抑制使血管对VEGFR2抑制更加敏感,使血管更加依赖于VEGF信号,以提高血管对VEGFR靶向的敏感性。Zahra等[24]研究发现,VEGF和S1P激活RhoA参与细胞增殖、迁移和血管的形成。敲除RhoA减弱了VEGF和S1P诱导的内皮细胞增殖,以及诱导细胞迁移和血管的形成。在血管新生中,VEGF扮演着重要的角色,S1P可通过VEGF内皮细胞增殖,迁移和管形成促心血管新生在心血管疾病的治疗中是重要的,包括心肌梗死、缺血、动脉粥样硬化都需要新血管形成进行修复,进一步研究血管新生发掘心血管疾病治疗的新方法。
4 展望随着S1P和其受体的作用不断被发现,我们对其生物学的了解正在迅速加深,S1P作为动态平衡和发病机制的强大的调节系统越来越受到重视。在心血管疾病的治疗中,S1P能发挥广泛有效的作用,特别是FTY720已经被批准用于复发性多发性硬化症的治疗,S1P的药物对于心血管疾病的研究是具有价值的,介入S1P信号通路的调控可为治疗心血管疾病提供新思路。在已知的研究中发现S1P在心血管疾病中调节作用是多方面的,S1PRs的多样性、差异表达和细胞特异性,使我们要考虑更多问题,怎样去联系它们之间的关系,构建更加庞大的治疗体系。更深入的研究S1P的作用调节机制,进一步研究和探索S1P家族,可以在心血管领域获得更高的临床治疗价值。
| [1] |
Obinata H, Hla T. Sphingosine 1-phosphate and inflammation[J]. Int Immunol, 2019, 31(9): 617-25. doi:10.1093/intimm/dxz037 |
| [2] |
卜妍红, 吴虹, 孙明慧, 等. 1-磷酸鞘氨醇及其信号通路在炎症相关性疾病中的作用[J]. 中国药理学通报, 2019, 35(8): 1041-6. Bo Y H, Wu H, Sun M H, et al. The role of 1-phosphosphingosphenol and its signaling pathway in inflammatory diseases[J]. Chin Pharmacol Bull, 2019, 35(8): 1041-6. doi:10.3969/j.issn.1001-1978.2019.08.002 |
| [3] |
Cannavo A, Liccardo D, Komici K, et al. Sphingosine kinases and sphingosine 1-phosphate receptors: Signaling and actions in the cardiovascular system[J]. Front Pharmacol, 2017, 8: 556. doi:10.3389/fphar.2017.00556 |
| [4] |
Cartier A, Leigh T, Liu C H, et al. Endothelial sphingosine 1-phosphate receptors promote vascular normalization and antitumor therapy[J]. Proc Natl Acad Sci USA, 2020, 117(6): 3157-66. doi:10.1073/pnas.1906246117 |
| [5] |
Winkler M S, Nierhaus A, Poppe A, et al. Sphingosine-1-phosphate: A potential biomarker and therapeutic target for endothelial dysfunction and sepsis?[J]. Shock, 2017, 47(6): 666-72. doi:10.1097/SHK.0000000000000814 |
| [6] |
Liu H, Peng H, Chen S, et al. S1PR2 antagonist protects endothelial cells against high glucose-induced mitochondrial apoptosis through the Akt/GSK-3β signaling pathway[J]. Biochem Biophys Res Commun, 2017, 490(3): 1119-24. doi:10.1016/j.bbrc.2017.06.189 |
| [7] |
Lee D Y, Won K J, Lee K P, et al. Angiotensin Ⅱ facilitates neointimal formation by increasing vascular smooth muscle cell migration: Involvement of APE/Ref-1-mediated overexpression of sphingosine-1-phosphate receptor 1[J]. Toxicol Appl Pharmacol, 2018, 347: 45-53. doi:10.1016/j.taap.2018.03.032 |
| [8] |
Kerage D, Gombos R B, Wang S, et al. Sphingosine 1-phosphate-induced nitric oxide production simultaneously controls endothelial barrier function and vascular tone in resistance arteries[J]. Vascul Pharmacol, 2021, 140: 106874. doi:10.1016/j.vph.2021.106874 |
| [9] |
Keul P, Polzin A, Kaiser K, et al. Potent anti-inflammatory properties of HDL in vascular smooth muscle cells mediated by HDL-S1P and their impairment in coronary artery disease due to lower HDL-S1P: A new aspect of HDL dysfunction and its therapy[J]. FASEB J, 2019, 33(1): 1482-95. doi:10.1096/fj.201801245R |
| [10] |
Gonzalez L, Qian A S, Tahir U, et al. Sphingosine-1-phosphate receptor 1, expressed in myeloid cells, slows diet-induced atherosclerosis and protects against macrophage apoptosis in Ldlr ko mice[J]. Int J Mol Sci, 2017, 18(12): 2721. doi:10.3390/ijms18122721 |
| [11] |
Kurano M, Yatomi Y. Sphingosine 1-phosphate and atherosclerosis[J]. J Atheroscler Thromb, 2018, 25(1): 16-26. doi:10.5551/jat.RV17010 |
| [12] |
Deshpande G P, Imamdin A, Lecour S, et al. Sphingosine-1-phosphate(S1P) activates STAT3 to protect against de novo acute heart failure(AHF)[J]. Life Sci, 2018, 196: 127-32. doi:10.1016/j.lfs.2018.01.023 |
| [13] |
Yung B S, Brand C S, Xiang S Y, et al. Selective coupling of the S1P3 receptor subtype to S1P-mediated RhoA activation and cardioprotection[J]. J Mol Cell Cardiol, 2017, 103: 1-10. doi:10.1016/j.yjmcc.2016.12.008 |
| [14] |
Ohkura S I, Usui S, Takashima S I, et al. Augmented sphingosine 1 phosphate receptor-1 signaling in cardiac fibroblasts induces cardiac hypertrophy and fibrosis through angiotensin Ⅱ and interleukin-6[J]. PLoS One, 2017, 12(8): e0182329. doi:10.1371/journal.pone.0182329 |
| [15] |
Chen R, Cai X, Liu J, et al. Sphingosine 1-phosphate promotes mesenchymal stem cell-mediated cardioprotection against myocardial infarction via ERK1/2-MMP-9 and Akt signaling axis[J]. Life Sci, 2018, 215: 31-42. doi:10.1016/j.lfs.2018.10.047 |
| [16] |
Deng S, Zhou X, Ge Z, et al. Exosomes from adipose-derived mesenchymal stem cells ameliorate cardiac damage after myocardial infarction by activating S1P/SK1/S1PR1 signaling and promoting macrophage M2 polarization[J]. Int J Biochem Cell Biol, 2019, 114: 105564. doi:10.1016/j.biocel.2019.105564 |
| [17] |
Magaye R R, Savira F, Xiong X, et al. Dihydrosphingosine driven enrichment of sphingolipids attenuates TGFβ induced collagen synthesis in cardiac fibroblasts[J]. Int J Cardiol Heart Vasc, 2021, 35: 100837. |
| [18] |
Magaye R R, Savira F, Hua Y, et al. Exogenous dihydrosphingosine 1 phosphate mediates collagen synthesis in cardiac fibroblasts through JAK/STAT signalling and regulation of TIMP1[J]. Cell Signal, 2020, 72: 109629. doi:10.1016/j.cellsig.2020.109629 |
| [19] |
Magaye R R, Savira F, Hua Y, et al. Attenuating PI3K/AKT- mTOR pathway reduces dihydrosphingosine 1 phosphate mediated collagen synthesis and hypertrophy in primary cardiac cells[J]. Int J Biochem Cell Biol, 2021, 134: 105952. doi:10.1016/j.biocel.2021.105952 |
| [20] |
Deng S, Zhou X, Ge Z, et al. Exosomes from adipose-derived mesenchymal stem cells ameliorate cardiac damage after myocardial infarction by activating S1P/SK1/S1PR1 signaling and promoting macrophage M2 polarization[J]. Int J Biochem Cell Biol, 2019, 114: 105564. doi:10.1016/j.biocel.2019.105564 |
| [21] |
Ouyang J, Shu Z, Chen S, et al. The role of sphingosine 1-phosphate and its receptors in cardiovascular diseases[J]. J Cell Mol Med, 2020, 24(18): 10290-301. doi:10.1111/jcmm.15744 |
| [22] |
Yao X, Xie L, Zeng Y. MiR-9 promotes angiogenesis via targeting on sphingosine-1- phosphate receptor 1[J]. Front Cell Dev Biol, 2020(8): 755. |
| [23] |
Jin F, Hagemann N, Sun L, et al. High-density lipoprotein(HDL) promotes angiogenesis via S1P3-dependent VEGFR2 activation[J]. Angiogenesis, 2018, 21(2): 381-94. |
| [24] |
Zahra F T, Sajib M S, Ichiyama Y, et al. Endothelial RhoA GTPase is essential for in vitro endothelial functions but dispensable for physiological in vivo angiogenesis[J]. Sci Rep, 2019, 9(1): 11666. |

