

2. 齐鲁工业大学(山东省科学院)生物研究所,山东省科学院药物筛选技术重点实验室,山东 济南 250103
靳梦(1985-),女,博士,研究员,研究方向:神经系统疾病模型建立和神经药理学,E-mail:mjin1985@hotmail.com。
2. Biology Institute, Qilu University of Technology (Shandong Academy of Sciences), Key Laboratory for Drug Screening Technology of Shandong Academy of Sciences, Jinan 250103, China
帕金森病(Parkinson′s disease,PD),是世界第二大神经退行性疾病,其患病率随着患者年龄的增加而上升。主要表现出行动迟缓、静止性震颤、肌肉僵直等症状。.造成PD的主要原因为脑内多巴胺神经元的减少,进而对纹状体分泌多巴胺(dopamine,DA)产生影响[1]。DA主要通过多巴胺受体(dopamine receptor,DR)发挥正常功能。DR包括激活性受体D1类(DRD1和DRD5)和抑制性受体D2类(DRD2、DRD3和DRD4)[2]。其中,DRD1、DRD2和DRD3常见于黑质-纹状体和中脑-边缘系统,并且在脑内有丰富的表达量,主要参与行为和情绪的调控[3];DRD4主要分布于海马区,对神经传递起到调节作用[4];DRD5是信息传递和神经冲动传递的重要功能性受体[5]。
临床大多采用化学制剂治疗PD,虽然PD症状在一定程度上有所缓解,但长期服用会出现一系列不良反应,药效也会逐渐减退。此外,这些药物无法修复多巴胺神经元的损伤,也不能缓解多巴胺神经元的退化。在现代医学中,PD的发病机制尚不明确,大多认为与多巴胺神经元有关。杜仲是中国特有的木本植物,广泛生长于中国中南部。早在2000多年前,杜仲已有入药记载,并且杜仲在保护神经元方面具有较好的效果。因此,研究杜仲可能具有抗PD活性。
网络药理学以中医理念为基本研究方法,是阐明活性成分和中药潜在机制的可行策略。斑马鱼模型是一种新型生物模型,因其体积小,繁殖快且产量大,身体透明易于观察等特点已广泛应用于活性评价中。此外,斑马鱼神经系统结构和发育过程与人类高度相似,实验中常用来模拟人类相关疾病研究。本研究根据网络药理学结果,对杜仲抗PD可能存在的活性成分、作用靶点和通路进行预测,然后利用斑马鱼PD模型进行检验,明确杜仲抗PD的相关作用机制。
1 材料 1.1 药物提取将干燥的杜仲进行磨粉处理,将粉末和纯净水按照1 ∶10的比例进行回流提取,回流2次,每次2 h,回流结束后将得到的混合液进行离心,取上清液进行抽滤,将抽滤后得到的液体进行旋蒸,待旋蒸瓶内的水分全部旋出,将其放入抽真空箱24 h,最终得到较为纯净的杜仲干燥粉末。以上药物提取在山东省科学院药物化学实验室完成并检测。
1.2 仪器北京爱生公司斑马鱼养殖系统,Viewpoint公司Zebrabox斑马鱼行为分析仪;罗氏有限公司实时荧光定量PCR仪器、蔡司光学有限公司荧光显微镜、伯乐生命医学产品有限公司C1000 Touch梯度PCR仪、基因有限公司超微量分光光度计。
1.3 动物野生型斑马鱼AB和转基因斑马鱼Vmat: GFP由山东省科学院生物研究所提供,在恒温28 ℃的斑马鱼养殖系统中进行饲养,遵循照明黑暗14 h:10 h的生物节律,定点投食。
2 方法 2.1 杜仲活性成分筛选在药理学数据库与分析平台TCMSP(http://lsp.nwsuaf.edu.cn/tcmsp.php),以“杜仲”为关键词对其化学成分进行检索。然后根据口服生物利用度(oral bioavailability,OB)≥30%,药物相似性(drug likeness,DL)≥0.18筛选有效活性成分。
2.2 杜仲活性成分潜在靶点收集在TCMSP中收集杜仲活性成分的相应靶点信息,然后通过Uniprot数据库进行分析转化,获取与活性成分作用的相关靶点(人源)。
2.3 PD疾病相关靶点的筛选与收集以“Parkinson′s disease”为关键词,在DISGENET数据库(http://www.disgenet.org/)中进行检索,收集PD相关疾病靶点,筛选条件为:得分(score值)>0.1。
2.4 杜仲活性成分-潜在靶点-PD疾病靶点网络构建根据TCMSP数据库筛选出与杜仲活性成分相关的潜在靶点,利用cytoscape 3.7.2软件绘制出杜仲活性成分-潜在靶点网络图,再将其结果与PD疾病靶点进行比对,生成杜仲活性成分-PD疾病网络图,并利用FUNRICHNEW.exe绘制杜仲和PD共有靶点的韦恩图。
2.5 蛋白质相互作用网络构建(protein-protein interaction,PPI)在STRING数据库(http://string-db.org/cgi/inputPl)输入杜仲和PD共有的交集靶点蛋白名称,获取交集靶点蛋白信息,收集数据导入Cytoscape 3.7.2软件,根据Drgee值拓扑分析构建出PPI网络图。
2.6 杜仲对治疗PD靶点蛋白的GO功能富集分析和KEGG通路富分析为了表明杜仲的药物靶蛋白在基因功能中的作用,利用Metascape数据库(https://metascape.org/gp/index.html)对PPI网络中筛选出的核心靶点进行GO功能富集分析。之后使用Metascape对KEGG通路富集分析进行筛选,探讨其缓解PD的作用通路并进一步对富集信号通路进行分析,获得各通路相关网络图。
2.7 动物实验方法 2.7.1 实验分组及处理上午10时将1 dpf(day post fertilization,dpf)的胚胎进行脱膜处理,脱膜后的斑马鱼用养鱼水反复冲洗2-3次,洗掉多余的脱膜剂。放入孵育箱2-3 h,使其适应温度。本实验分为以下3组: 空白对照组、50 μmol·L-1 1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-terahydropyridine,MPTP)处理组、50 μmol·L-1 MPTP与25 mg·L-1的杜仲共处理组。每日按时换药,换完药后放入培养箱进行培养。
2.7.2 行为学监测在6 dpf时,用48孔板进行斑马鱼行为学实验,每孔1条,放入Zebrabox斑马鱼行为分析仪中,先使其适应环境10 min。之后开始检测,检测时间为20 min。运用Zeblab软件进行数据处理,计算每条鱼游动总距离和平均速度。
2.7.3 斑马鱼脑内多巴胺神经元检测本实验从1 dpf时给药,连续给药3 d,在3 dpf时用蔡司显微镜观察转基因斑马鱼Vmat:GFP多巴胺神经元的发育情况。
2.7.4 荧光定量PCR(quantitative real-time PCR,qRT-PCR)在6 dpf时,每组选取30条斑马鱼幼鱼进行qRT-PCR检测,将斑马鱼按组别放入EP管中,用清水冲洗2-3次,洗去多余的药物残留,最后将EP管中的水全部吸出,加入裂解液,在破碎机中研磨,使其完全裂解,然后将研磨后的裂解物放入离心机中离心,取上清液。RNA提取后,利用超微量分光光度计检测所有组RNA的浓度,之后对RNA进行反转,将反转得到的cDNA进行稀释,然后加入相应的引物用实时荧光定量PCR仪对各个基因进行扩增。扩增结束后,计算各组基因的相对表达量。
2.7.5 统计学处理利用Graphpad prism 7.0软件对实验结果进行One-way ANOVA检验,并以x±s表示。
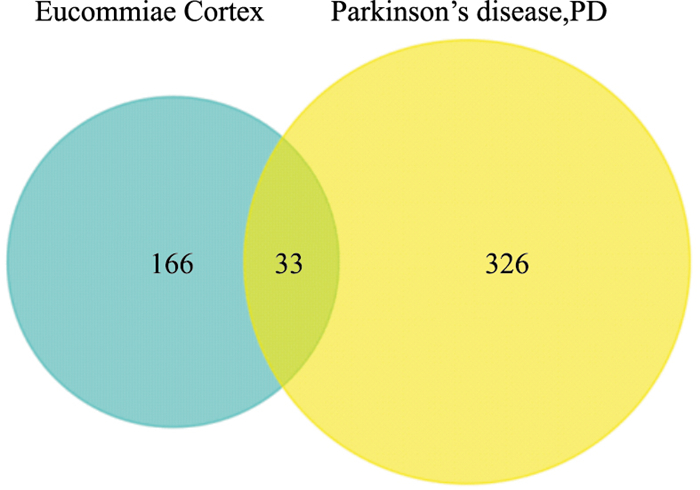
3 结果 3.1 杜仲抗PD有效成分及与PD靶点应用TCMSP数据分析平台对杜仲活性成分进行收集,以类药性五原则、OB≥30%、DL≥0.18为筛选条件。筛选结果去除重复项后,共得到26个杜仲有效活性成分(Tab 1),包括β-谷甾醇(beta-sitosterol)、槲皮素(quercetin)和β-胡萝卜素(beta-carotene)等。通过DISGENET数据库检索“Parkinson′s disease”,共挖掘到359个PD靶点。最终得到杜仲抗PD的潜在作用靶点共33个(Fig 1),包括DRD1、DRD2、DRD3等。
| Mol ID | Molecule name | OB (%) | DL |
| MOL002058 | 40957-99-1 | 57.2 | 0.62 |
| MOL000211 | Mairin | 55.38 | 0.78 |
| MOL000358 | beta-sitosterol | 36.91 | 0.75 |
| MOL000422 | kaempferol | 41.88 | 0.24 |
| MOL004367 | olivil | 62.23 | 0.41 |
| MOL000443 | Erythraline | 49.18 | 0.55 |
| MOL005922 | Acanthoside B | 43.35 | 0.77 |
| MOL006709 | AIDS214634 | 92.43 | 0.55 |
| MOL007059 | 3-beta-Hydroxymethyllenetanshiquinone | 32.16 | 0.41 |
| MOL000073 | ent-Epicatechin | 48.96 | 0.24 |
| MOL007563 | Yangambin | 57.53 | 0.81 |
| MOL009007 | Eucommin A | 30.51 | 0.85 |
| MOL009009 | (+)-medioresinol | 87.19 | 0.62 |
| MOL009015 | (-)-Tabernemontanine | 58.67 | 0.61 |
| MOL009027 | Cyclopamine | 55.42 | 0.82 |
| MOL009029 | Dehydrodiconiferyl alcohol 4, gamma′-di-O-beta-D-glucopyanoside_qt | 51.44 | 0.4 |
| MOL009031 | Cinchonan-9-al, 6′-methoxy-, (9R)- | 68.22 | 0.4 |
| MOL009042 | Helenalin | 77.01 | 0.19 |
| MOL009047 | (+)-Eudesmin | 33.29 | 0.62 |
| MOL009053 | 4-[(2S, 3R)-5-[(E)-3-hydroxyprop-1-enyl]-7-methoxy-3-methylol-2, 3-dihydrobenzofuran-2-yl]-2-methoxy-phenol | 50.76 | 0.39 |
| MOL009055 | hirsutin_qt | 49.81 | 0.37 |
| MOL009057 | liriodendrin_qt | 53.14 | 0.8 |
| MOL000098 | quercetin | 46.43 | 0.28 |
| MOL002773 | beta-carotene | 37.18 | 0.58 |
| MOL008240 | (E)-3-[4-[(1R, 2R)-2-hydroxy-2-(4-hydroxy-3-methoxy-phenyl)-1-methylol-ethoxy]-3-methoxy-phenyl]acrolein | 56.32 | 0.36 |
| MOL011604 | Syringetin | 36.82 | 0.37 |
|
| Fig 1 Venn diagram of Eucommia ulmoides anti-PD target Venn diagram of anti-PD targets of Eucommia ulmoides; Blue: The number of active components of Eucommia ulmoides was 199; Yellow: The number of PD targets was 359; Green: The number of intersection targetswas 33. |
通过STRING数据库对筛选出的杜仲抗PD的33个潜在作用靶点进行分析,获取靶点相互作用信息(Fig 2),得到33个节点和189条边,提示杜仲抗PD的多靶点、多通路的作用特点。

|
| Fig 2 PPI network of anti-PD targets of Eucommia ulmoides |
对杜仲抗PD潜在靶点进行GO功能富集分析,共富集到41条结果,生物过程方面包括调节神经递质(regulation of neurotransmitter levels),分子功能方面涉及多巴胺神经受体活性(dopamine neurotransmitter receptor activity)(Tab 2),提示多巴胺能神经系统的调节可能参与杜仲抗PD功能。
| Serial number | Category | Description | Count | Log10(P) |
| GO: 0009636 | Biological Processes | response to toxic substance | 16 | -19.08 |
| GO: 1901699 | Biological Processes | cellular response to nitrogen compound | 16 | -17.35 |
| GO: 0072593 | Biological Processes | reactive oxygen species metabolic process | 13 | -17.43 |
| GO: 0001505 | Biological Processes | regulation of neurotransmitter levels | 13 | -16.35 |
| GO: 0051272 | Biological Processes | positive regulation of cellular component movement | 13 | -13.22 |
| GO: 0045596 | Biological Processes | negative regulation of cell differentiation | 13 | -12.02 |
| GO: 0048638 | Biological Processes | regulation of developmental growth | 12 | -14.93 |
| GO: 2001233 | Cellular Components | Postsynapse | 8 | -6.43 |
| GO: 0048732 | Cellular Components | Dendrite | 8 | -6.37 |
| GO: 0071900 | Cellular Components | membrane raft | 7 | -7.07 |
| GO: 0070201 | Cellular Components | secretory granule lumen | 5 | -4.46 |
| GO: 0006979 | Cellular Components | side of membrane | 4 | -2.26 |
| GO: 0008015 | Cellular Components | dendritic spine | 3 | -2.93 |
| GO: 0070661 | Molecular Functions | protein homodimerization activity | 8 | -6.1 |
| GO: 1902532 | Molecular Functions | protease binding | 7 | -9.81 |
| GO: 1901653 | Molecular Functions | protein kinase binding | 7 | -5.03 |
| GO: 0042803 | Molecular Functions | protein domain specific binding | 7 | -4.9 |
| GO: 0042063 | Molecular Functions | cytokine receptor binding | 5 | -4.83 |
| GO: 0048511 | Molecular Functions | protein kinase activity | 5 | -3.37 |
| GO: 0004952 | Molecular Functions | dopamine neurotransmitter receptor activity | 3 | -7.83 |
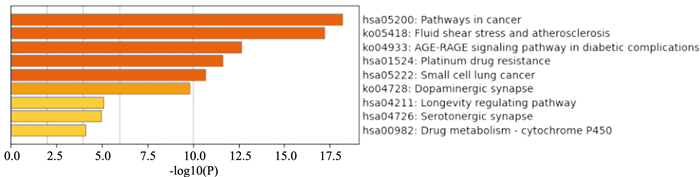
共富集得到10条通路与杜仲改善PD相关,包括癌症的途径(Pathways in cancer)、流体剪切应力与动脉粥样硬化(fluid shear stress and atherosclerosis)、糖尿病并发症中的AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications)、铂耐药(platinum drug resistance)、小细胞肺癌(small cell lung cancer)、多巴胺能突触(dopaminergic synapse)等(Tab 3和Fig 3)。值得注意的是,多巴胺能突触相关信号通路与PD密切相关。
| Serial number | Category | Description | Count | Log10(P) |
| hsa05200 | KEGG Pathway | Pathways in cancer | 16 | -18.18 |
| ko05418 | KEGG Pathway | Fluid shear stress and atherosclerosis | 11 | -17.19 |
| ko04933 | KEGG Pathway | AGE-RAGE signaling pathway in diabetic complications | 8 | -12.64 |
| hsa01524 | KEGG Pathway | Platinum drug resistance | 7 | -11.62 |
| hsa05222 | KEGG Pathway | Small cell lung cancer | 7 | -10.67 |
| ko04728 | KEGG Pathway | Dopaminergic synapse | 7 | -9.83 |
| hsa04211 | KEGG Pathway | Longevity regulating pathway | 4 | -5.1 |
| hsa04726 | KEGG Pathway | Serotonergic synapse | 4 | -4.95 |
| hsa00982 | KEGG Pathway | Drug metabolism-cytochrome P450 | 3 | -4.12 |
|
| Fig 3 Bar chart of KEGG pathway enrichment analysis |
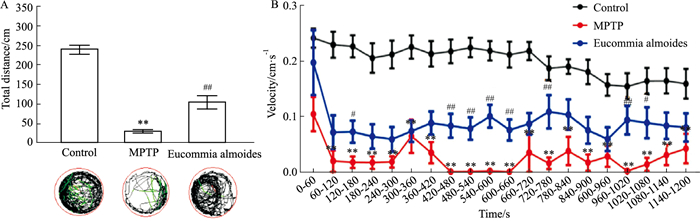
斑马鱼PD模型行为会表现出与PD患者类似的运动迟缓等现象,为了验证杜仲的抗PD活性,本研究利用行为学进行验证,结果如Fig 4。Fig 4A表示不同实验组(n=10)斑马鱼游动的总距离,与空白对照组相比,造模组斑马鱼的游动距离明显减少,游动速度也明显降低(Fig 5B);与造模组相比,杜仲处理组的游动总距离明显增加(Fig 4A,杜仲处理组所示),游动速度明显变快(Fig 4B,杜仲处理组所示),差异具有统计学意义。研究结果显示,杜仲可以改善由MPTP造成的斑马鱼PD样行为。
|
| Fig 4 Eucommia ulmoides improved PD-like behavior of zebrafish A: The total swimming distance of zebrafish. B: The average speed of a zebrafish in the dark. The total distance of each zebrafish was analyzed by Zeblab software (**P < 0.01 vs blank control group; #P < 0.05, ##P < 0.01 vs Eucommia ulmoides treatment group). |
|
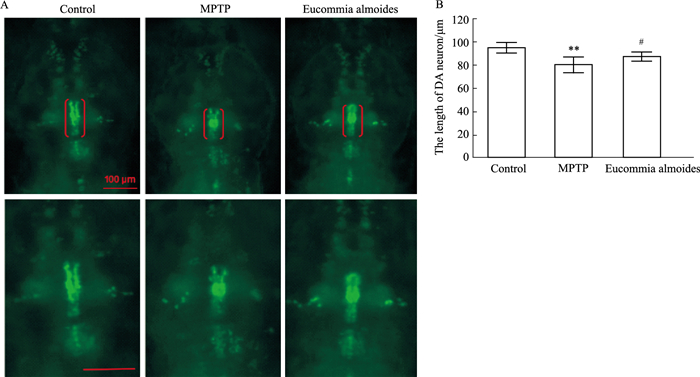
| Fig 5 Statistics of length of dopamine neurons in each group of zebrafish A: The picture shows the length of dopaminergic neurons in the head of each group of zebrafish given 3 dpf. The scale: 100 μm. B: **P < 0.01 vs blank control group; #P < 0.05 vs model group. |
多巴胺神经元损伤是PD特征之一,本研究通过观察斑马鱼脑内多巴胺神经元损伤情况来验证杜仲抗PD的活性(Fig 5)(n=8)。与空白对照组相比,造模组斑马鱼脑内多巴胺神经元长度明显减少;与造模组相比,杜仲处理组斑马鱼脑内的多巴胺神经元长度有所恢复。该实验表明,杜仲可以缓解斑马鱼脑内多巴胺神经元的损伤。本研究以行为和多巴胺神经元两个指标对杜仲缓解PD样症状进行验证,结果提示杜仲具有抗PD活性。
3.7 杜仲改善斑马鱼PD样症状——DA相关基因验证为进一步验证和挖掘杜仲抗PD活性的作用机制,本研究利用qRT-PCR对不同实验组的PD相关基因drd1、drd2和drd3进行检测(Fig 6)。与空白对照组相比,造模组中的drd1、drd2和drd3的表达明显下调,具有统计学意义;与造模组相比,杜仲处理组中drd1和drd2的表达明显增加,drd3虽不具有统计学意义,但也出现了上调的趋势。研究结果表明,杜仲可以对DA相关基因的异常表达进行调控。
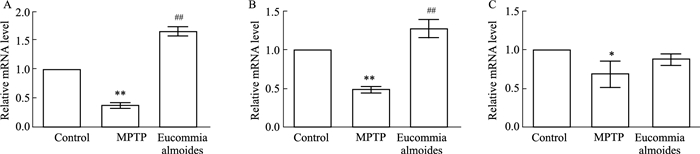
|
| Fig 6 Expression of dopamine-related genes in PD A: gene drd1, B: gene drd2, C: gene drd3. *P < 0.05, **P < 0.01 vs blank control group; ##P < 0.01 vs model group |
通过网络药理学方法,本研究筛选得到了26个杜仲有效成分,构建杜仲活性成分-潜在靶点网络,并从中预测β-谷甾醇、槲皮素和β-胡萝卜素为杜仲抗PD的重要有效成分。以往研究表明[6],β-谷甾醇具有抗炎、抗氧化和神经保护功效。槲皮素可以通过降低神经元活性氧水平,增加谷胱甘肽的表达发挥抗氧化功能,从而起到保护神经的作用[7]。研究发现[8],PD患者血清中α-胡萝卜素和β-胡萝卜素水平均明显降低,且与病情严重程度相关,推测PD的发生与血清中类胡萝卜素的水平有关。因此上述成分可能作为杜仲改善PD的有效药物成分。
本课题组前期研究发现[9-10],斑马鱼PD模型在运动能力方面出现运动迟缓、游动总距离降低、游动速度变慢等现象。杜仲叶显著降低了斑马鱼PD模型脑中多巴胺能神经元和神经血管的丢失,改善了运动障碍,减少了脑部细胞凋亡数量。机制研究发现杜仲叶可以激活自噬,促进α-syn降解,从而减轻斑马鱼PD样症状。有研究发现[11],MPTP诱导的小鼠PD模型与健康组小鼠相比,自主运动能力、协调性和耐受力都有所下降。崔爽等[12]研究发现,在6-羟基多巴胺诱导的大鼠PD模型中,杜仲可以减轻氧化应激反应,使多巴胺能神经元细胞减少。本研究结果显示,造模组多巴胺神经元长度比对照组明显减少,运动距离和运动速度明显降低,造模成功,杜仲处理组与造模组相比多巴胺神经元长度显著增长,游动总距离明显增加,游动速度明显变快。研究结果表明,杜仲可以缓解多巴胺神经元损伤,改善斑马鱼PD样行为。斑马鱼多巴胺神经元分布在中脑中缝核、室旁器官神经丛、前直肠神经丛、下丘脑中间神经丛等[13],本研究以中缝核区多巴胺神经元的长度作为评价指标,对该多巴胺神经元区域长度进行了统计分析,但未开展神经元数量、突触密度、树突和轴突等指标的检测,今后我们将进一步完善这方面的不足。
PPI结果提示,杜仲抗PD作用是通过多靶点、多通路实现的,且各靶点之间存在密切的联系。例如,肿瘤坏死因子(TNF)和白细胞介素-1(IL-1B)之间存在相互作用。有研究显示[14],炎性因子IL-1B可以刺激TNF产生,使炎性反应加重。此外TNF-α还可诱导IL-1、IL-6等炎性因子激活。B淋巴细胞瘤-2(Bcl-2)和半胱氨酸蛋白酶(CASPASE-3)之间具有相互作用关系[15],Bax/Bcl-2的表达比率决定着细胞凋亡的进程,其比值增加会将细胞凋亡的关键因子caspase-3激活。另有研究显示[16],蛋白激酶B(AKT)和糖原合成酶-3(GSK-3β)之间相互作用,AKT的激活可以促进GSK-3β的表达。
杜仲抗PD的GO富集分析结果显示,杜仲具有调节神经递质水平、多巴胺神经递质受体活性等作用。KEGG通路富集分析结果发现,杜仲抗PD与多巴胺能突触这一通路有关。通过上述结果推测,多巴胺能神经系统与杜仲改善PD症状紧密相关。PPI显示,各靶点之间存在着紧密相关的联系,其中,DRD1、DRD2和DRD3是与多巴胺能神经系统密切相关的调节因子。DR主要与DA结合,激活DR能够调节轴突结构,保持大脑正常功能。DR广泛分布于中枢神经系统等众多多巴胺神经通路中,通过影响神经递质的释放以及释放频率等来调节神经元的兴奋性[17],与PD紧密相关。以往研究发现,DRD1和DRD2介导的多巴胺能信号对认知、运动和神经内分泌功能等具有重要影响,DRD3与思维、认知等功能相关[18]。本实验通过qRT-PCR对杜仲抗PD机制进一步检验,与造模组相比,杜仲处理组斑马鱼drd1和drd2水平明显上调,而drd3虽有上调趋势,但无统计学意义,提示杜仲改善PD症状可能主要通过调节drd1和drd2发挥作用。
综上所述,本研究通过网络药理学方法,分析了杜仲有效成分,预测了杜仲抗PD的作用靶点,绘制了杜仲抗PD靶点的生物过程富集分析,通过斑马鱼行为学和体内实验进行验证,揭示杜仲可以缓解斑马鱼PD样症状,并且与多巴胺能神经系统密切相关。这一发现为后续杜仲有效成分改善PD症状研究提供了新方向新思想。
| [1] |
Armstrong M J, Okun M S. Diagnosis and treatment of Parkinson disease: A review[J]. JAMA, 2020, 323(6): 548-60. doi:10.1001/jama.2019.22360 |
| [2] |
Stocchi F, Torti Ma, Fossati C. Advances in dopamine receptor agonists for the treatment of Parkinson's disease[J]. Expert Opin Pharmacother, 2016, 17(14): 1889-902. doi:10.1080/14656566.2016.1219337 |
| [3] |
Hunger L, Kumar A, Schmidt R. Abundance compensates kinetics: Similar effect of dopamine signals on D1 and D2 receptor populations[J]. Neurosci, 2020, 40(14): 2868-81. doi:10.1523/JNEUROSCI.1951-19.2019 |
| [4] |
Botticelli L, Micioni D I, Bonaventura E, et al. Underlying susceptibility to eating disorders and drug abuse: Genetic and pharmacological aspects of dopamine D4 receptors[J]. Nutrients, 2020, 12(8): 2288. doi:10.3390/nu12082288 |
| [5] |
Maitra S, Sarkar K, Sinha S, et al. The dopamine receptor D5 may influence age of onset: An exploratory study on indo-Caucasoid ADHD subjects[J]. Child Neurol, 2016, 31(10): 1250-6. doi:10.1177/0883073816652233 |
| [6] |
Wang S, Wu S, Liu S. Integration of (+)-catechin and β-sitosterol to achieve excellent radical-scavenging activity in emulsions[J]. Food Chem, 2019, 30(272): 596-603. |
| [7] |
李杰, 郭青, 马超, 等. 槲皮素对LRRK2突变转基因PD模型果蝇的治疗作用[J]. 西安交通大学学报(医学版), 2020, 41(5): 683-9. Li J, Guo Q, Ma C, et al. The therapeutic effect of quercetin on the transgenic PD drosophila model with LRRK2 mutation[J]. J of Xi 'an Jiaotong Univ, 2020, 41(5): 683-9. |
| [8] |
Kim J H, Hwang J, Shim E, et al. Association of serum carotenoid, retinol, and tocopherol concentrations with the progression of Parkinson's Disease[J]. Nutr Res Pract, 2017, 11(2): 114-20. doi:10.4162/nrp.2017.11.2.114 |
| [9] |
Zhang S S, Yu Z P, Jin M, et al. Anti-Parkinson's disease activity of phenolic acids from Eucommia ulmoides Oliver leaf extracts and their autophagy activation mechanism[J]. Food Funct, 2020, 11(2): 1425-40. doi:10.1039/C9FO02288K |
| [10] |
党姣, 张姗姗, 季秀娜, 等. 基于斑马鱼模型研究抗氧化活性十肽YSQLENEFDR的抗帕金森症活性[J]. 中国药理学通报, 2020, 36(12): 1710-6. Dang J, Zhang S S, Jin X N, et al. Study on anti-Parkinson's disease activity of antioxidant decapeptide YSQLENEFDR based on zebrafish model[J]. Chin Pharmacol Bull, 2020, 36(12): 1710-6. doi:10.3969/j.issn.1001-1978.2020.12.015 |
| [11] |
文婷, 付永莉, 罗婷, 等. α-苯基-N-叔丁基硝酮对MPP~+/MPTP诱发帕金森病模型的神经保护作用[J]. 中国药理学通报, 2018, 34(7): 940-6. Wen T, Fu Y L, Luo T, et al. Study on neuroprotection of α-phenyl-N-tert-butyl nitrone for anti-Parkinson's disease in vitro and in vivo[J]. Chin Pharmacol Bull, 2018, 34(7): 940-6. doi:10.3969/j.issn.1001-1978.2018.07.011 |
| [12] |
崔爽, 陈岩岩, 周淑娟, 等. 杜仲乙醇提取物联合左旋多巴6-OHDA诱导帕金森模型大鼠的抗氧化作用[J]. 中医学报, 2020, 35(12): 2636-41. Cui S, Chen Y Y, Zhou S J, et al. Antioxidant effect of eucommia ulmoides ethanol extract combined with levodopa on Parkinson's disease model rats induced by 6-OHDA[J]. Acta Chin Med, 2020, 35(12): 2636-41. |
| [13] |
Liu L, Wu F Y, Zhu C Y, et al. Involvement of dopamine signaling pathway in neurodevelopmental toxicity induced by isoniazid in zebrafish[J]. Chemosphere, 2021, 265: 129109. doi:10.1016/j.chemosphere.2020.129109 |
| [14] |
Laczko R, Chang A, Watanabe L, et al. Anti-inflammatory activities of Waltheria indica extracts by modulating expression of IL-1B, TNF-α, TNFRⅡ and NF-κB in human macrophages[J]. Inflammopharmacology, 2020, 28(2): 525-40. doi:10.1007/s10787-019-00658-6 |
| [15] |
Li J, Han B, Ma X, Qi S. The effects of propofol on hippocampal caspase-3 and Bcl-2 expression following forebrain ischemia-reperfusion in rats[J]. Brain Res, 2010, 14(1356): 11-23. |
| [16] |
Wu X, Liang Y, Jing X, et al. Rifampicin Prevents SH-SY5Y Cells from rotenone-induced apoptosis via the PI3K/Akt/GSK-3β/CREB signaling pathway[J]. Neurochem Res, 2018, 43(4): 886-93. doi:10.1007/s11064-018-2494-y |
| [17] |
吴俊霖. 多巴胺受体激动剂治疗帕金森病的临床疗效及安全性[J]. 临床合理用药杂志, 2018, 11(3): 75-6. Wu J L. Clinical efficacy and safety of dopamine receptor agonists in the treatment of Parkinson's disease[J]. Chin J Clin Rational Drug Use, 2018, 11(3): 75-6. |
| [18] |
Crocco P, Montesanto A, Passarino G, et al. Polymor-phisms falling within putative miRNA target sites inthe 3'UTR region of SIRT2 and DRD2 genes are cor-related with human longevity[J]. J Gerontol A BiolSci Med Sci, 2016, 71(5): 586-92. doi:10.1093/gerona/glv058 |

