


2. 重庆医科大学 病理学教研室,重庆 400016;
3. 重庆医科大学 组织胚胎学教研室,重庆 400016
王亚平(1956-),男,教授,博士生导师,研究方向:干细胞衰老生物学,通信作者,E-mail:ypwangcq@aliyun.com
 ,
WANG Shun-he1,2
,
WANG Shun-he1,2
 ,
WANG Lan1,2,
HU Ling1,3,
WANG Zi-ling1,3,
ZENG Di1,3,
HOU Ji-ying1,3,
HUANG Cai-hong1,3,
DU Kun-hang1,3,
WANG Lu1,3,
WANG Ya-ping1,3
,
WANG Lan1,2,
HU Ling1,3,
WANG Zi-ling1,3,
ZENG Di1,3,
HOU Ji-ying1,3,
HUANG Cai-hong1,3,
DU Kun-hang1,3,
WANG Lu1,3,
WANG Ya-ping1,3

2. Dept of Pathology, Chongqing Medical University, Chongqing 400016, China;
3. Dept of Histology and Embryology, Chongqing Medical University, Chongqing 400016, China
目前,人口老年化趋势日渐严峻,对于加快推动衰老生物学研究和寻找防治老年性疾病途径已迫在眉睫。随着年龄增加神经退行性疾病的发病率不断攀升,已经严重危及老年人群的健康,目前还没有延缓脑衰老的有效途径。人参是中医临床“补气”药,我们既往研究证明[1-2],人参皂苷Rg1是人参重要的抗衰老成分之一,它能有效延缓脑衰老,并证明可能与减轻神经干细胞(NSCs)的氧化损伤密切相关,但其具体机制尚不清楚。最新研究表明[3-4],自噬在调控细胞衰老过程发挥着极为重要的作用,而AMPK/mTOR信号通路在自噬相关的代谢中扮演着重要角色,因此,对于人参皂苷Rg1是否能通过调控该信号通路延缓脑衰老值得研究。本文采用D-半乳糖(D-gal)构建小鼠脑衰老模型,探讨了人参皂苷Rg1延缓脑衰老与其调控自噬相关信号通路的机制,旨在为Rg1延缓脑衰老的临床应用提供理论与实验依据。
1 材料与方法 1.1 实验动物6~8周龄♂ C57BL/6J小鼠,体质量(16~18)g,由重庆医科大学实验动物中心提供,合格证号:SYXK(渝)2018-0003。
1.2 主要药品与试剂人参皂苷Rg1(成都曼思特生物科技有限公司,纯度>99%);D-半乳糖(D-gal,上海麦克林生化科技有限公司,纯度>99%);BCA蛋白浓度测定试剂盒、RAPA裂解液(上海碧云天生物技术研究所);兔单克隆抗体LC3-Ⅱ、p62、Beclin1、AMPK、p-AMPK、mTOR、p-mTOR,鼠单克隆抗体p53(Affinity公司),鼠单克隆抗体β-actin(Signaling公司);乙酰胆碱酯酶试剂盒、雷帕霉素(Rapamycin)(索莱宝生物科技有限公司)。
1.3 方法 1.3.1 脑衰老模型建立与分组处理C57BL/6J雄性小鼠随机分为4组(10只/组)。脑衰老模型组:腹腔连续注射D-半乳糖(D-galactose,D-gal) (200 mg·kg-1·d-1×42 d);对照组:腹腔注射等量生理盐水×42 d;Rg1抗脑衰老模型组:腹腔注射等量D-gal×42 d,从d 16起,同时注射Rg1(40 mg·kg-1·d-1×27 d);自噬激活剂雷帕霉素抗衰老组:腹腔注射等量D-gal×42 d,从16 d起,同时注射Rap(2 mg·kg-1·d-1×27 d),建模完成后于次日进行各实验指标的检测。
1.3.2 小鼠衰老生物学表现观察在构建模型期间对各组小鼠进行衰老生物学动态观察,包括体质量、饮食、饮水情况、精神状态、活动状态、毛色与大小便等状况。
1.3.3 行为学测试让小鼠背对逃生平台,将其分别从水迷宫的4个象限轻轻放入水槽之中,记录小鼠在60 s内找到逃生平台的时间,并让小鼠在逃生平台上停留5 s,如果超过60 s仍未找到,则引导小鼠回到平台并使其停留20 s。d 7,撤去逃生平台,随机将小鼠在任一象限的同一位置放入水槽之中,并记录60 s内小鼠在目标象限游泳的时间百分比与穿越原逃生平台的次数。
1.3.4 海马组织形态学观察水迷宫测试完成后d 2,处死小鼠取脑组织,4%多聚甲醛固定2 d,选取脑海马区制作石蜡切片,进行HE染色、Nissl染色,观察各组海马区神经元损伤形态和神经元内尼氏小体的数量,并用ImageJ软件对海马区神经元进行计数分析。
1.3.5 脑组织乙酰胆碱酯酶(acetylcholinesterase,AchE)活性测定制备脑组织匀浆,8 000 r·min-1离心10 min,收集上清液。BCA蛋白测定试剂盒检测各组上清液的蛋白浓度,按照AChE检测试剂盒说明书相关检测AChE活性并分析数据。
1.3.6 脑组织自噬相关蛋白检测RAPA裂解液提取脑组织蛋白,BCA蛋白试剂盒进行蛋白浓度测定。SDS-PAGE凝胶电泳,PVDF膜进行蛋白转膜,5%脱脂奶粉封闭2 h。兔抗LC3-Ⅱ(1 ∶1 000)、p62(1 ∶1 000)、Beclin1(1 ∶1 000)、鼠抗β-actin(1 ∶10 000),4 ℃分别孵育过夜。次日,抗鼠二抗(1 ∶10 000)、抗兔二抗(1 ∶10 000)室温孵育2 h,TBST洗膜,ECL发光法显影。用ImageJ软件对各条带进行其灰度值分析,并计算各目的蛋白与内参蛋白β-actin的比值并作图。同时用石蜡切片进行免疫组化染色,检测海马区神经元内自噬蛋白p62、ATG5、ULK1的表达,并用ImageJ软件对各组切片进行免疫组化定量分析并作图。
1.3.7 自噬通路AMPK/mTOR信号通路的检测对AMPK/mTOR信号通路的两个主要蛋白进行Western blot蛋白检测,包括p-AMPK/AMPK与p-mTOR/mTOR的比值。同时检测脑组织中凋亡蛋白p53的表达,并用ImageJ软件对各条带进行灰度值分析并作图。
1.3.8 统计学分析所有实验数据均用GraphPad Prism8.0统计分析软件进行分析和作图,实验数据以x±s表示,多组比较宜先用方差分析,再作两两比较。
2 结果 2.1 衰老模型小鼠逐渐表现出自然衰老的生物学特点随着注射D-gal剂量累积和时间延长,D-gal组小鼠逐渐表现出衰老生物学特征,表现为体质量减轻,活动减少,精神倦怠,毛发灰暗,进食量减少,大便稀溏,符合自然衰老的生物学表现。而对照组和Rg1或Rap抗衰老组无明显衰老的生物学表现。
2.2 Rg1能显著改善脑衰老小鼠的空间探索与学习记忆能力水迷宫实验结果表明,D-gal组小鼠在探索期的游泳轨迹杂乱无章,逃避潜伏期较长,并且在目标象限停留时间的百分比与穿越逃生平台的次数均明显低于对照组(P<0.05),提示小鼠空间探索能力与学习记忆能力明显降低,而用Rg1或Rap干预致衰老过程,小鼠空间探索能力与学习记忆能力明显改善(Fig 1)。
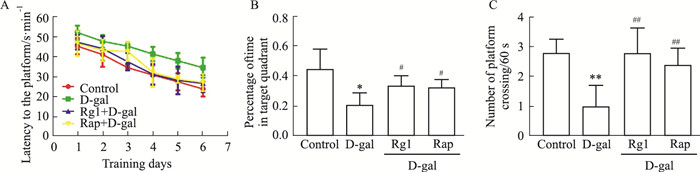
|
| Fig 1 Effect of ginsenoside Rg1 on learning and memory abilities of brain aging mice (x±s, n=5) A: The effect of Rg1 on the escape latency of brain aging mice; B: The effect of Rg1 on the percentage of time that brain aging mice stayed in the target quadrant. *P<0.05 vs control; #P<0.05 vs D-gal. C: The effect of Rg1 on the number of times that brain aging mice crossed the platform. **P<0.01 vs control; ##P<0.01 vs D-gal |
HE染色结果表明,对照组小鼠海马区神经元排列整齐,形态结构正常,而D-gal组小鼠海马区神经元数量明显减少,排列紊乱,分布稀疏,且退变与坏死细胞数增多,Nissl染色显示神经元内Nissl小体数量明显减少。采用Rg1或Rap干预致衰过程,海马区神经元数量无明显减少,没有明显的形态学损伤,且神经元内Nissl数量无明显减少(Fig 2,3)。
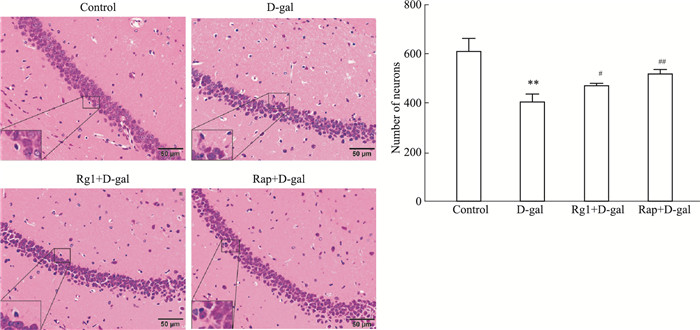
|
| Fig 2 Effect of ginsenoside Rg1 on morphology and number of neurons in hippocampus of brain aging mice (HE staining×400) (x±s, n=3) **P<0.01 vs control; #P<0.05, ##P<0.01 vs D-gal |
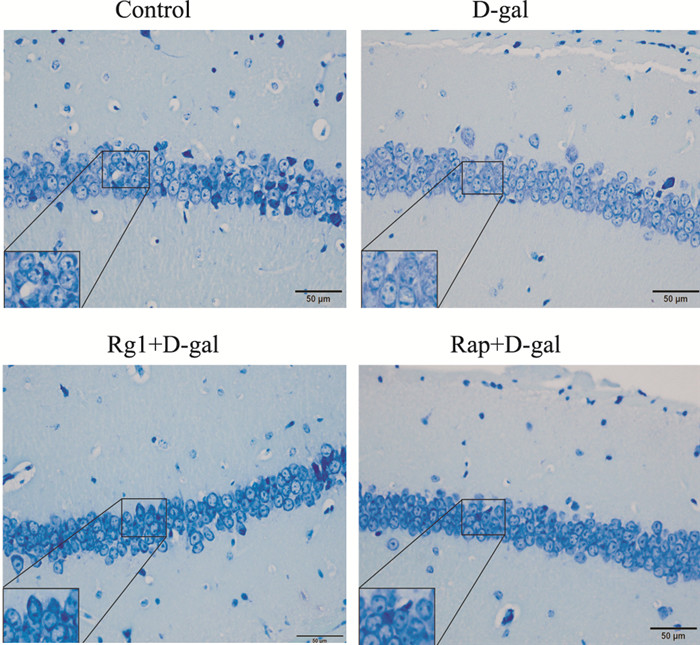
|
| Fig 3 Effect of ginsenoside Rg1 on number of Nissl bodies in hippocampus of brain aging mice (Nissl staining×400) (x±s, n=3) |
结果表明,D-gal组小鼠脑组织匀浆中乙酰胆碱酯酶的活性明显上升(P<0.05),采用Rg1或Rap干预致衰过程,脑组织匀浆中乙酰胆碱酯酶的活性明显降低(P<0.05)(Fig 4)。
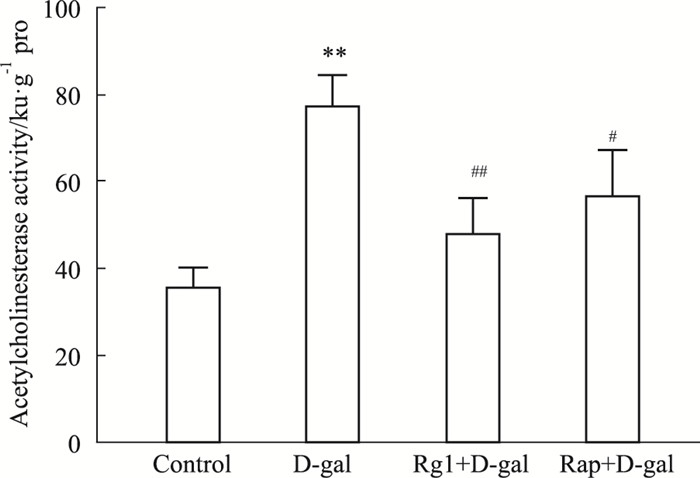
|
| Fig 4 Effect of ginsenoside Rg1 on acetylcholinesterase in brain tissues of brainaging mice (x±s, n=3) **P<0.01 vs control; #P<0.05, ##P<0.01 vs D-gal |
Western blot结果表明,与对照组相比,D-gal组小鼠脑组织中自噬相关蛋白LC3-Ⅱ、Beclin1表达下调,p62表达上调(P<0.05),提示小鼠脑自噬活动的下降。采用Rg1或Rap干预致衰过程,LC3-Ⅱ、Beclin1表达上调,p62表达下调(P<0.05),说明Rg1与Rap可以上调小鼠脑的自噬功能(Fig 5)。同时免疫组织化学染色结果表明,与对照组相比,D-gal组小鼠海马区神经元内自噬相关蛋白p62表达上升,ATG5、ULK1蛋白表达下降(P<0.05)。采用Rg1或Rap干预致衰过程,p62表达下降,ATG5、ULK1蛋白表达明显上升(P<0.05),提示了Rg1与Rap可以上调海马区神经元的自噬功能(Fig 6)。
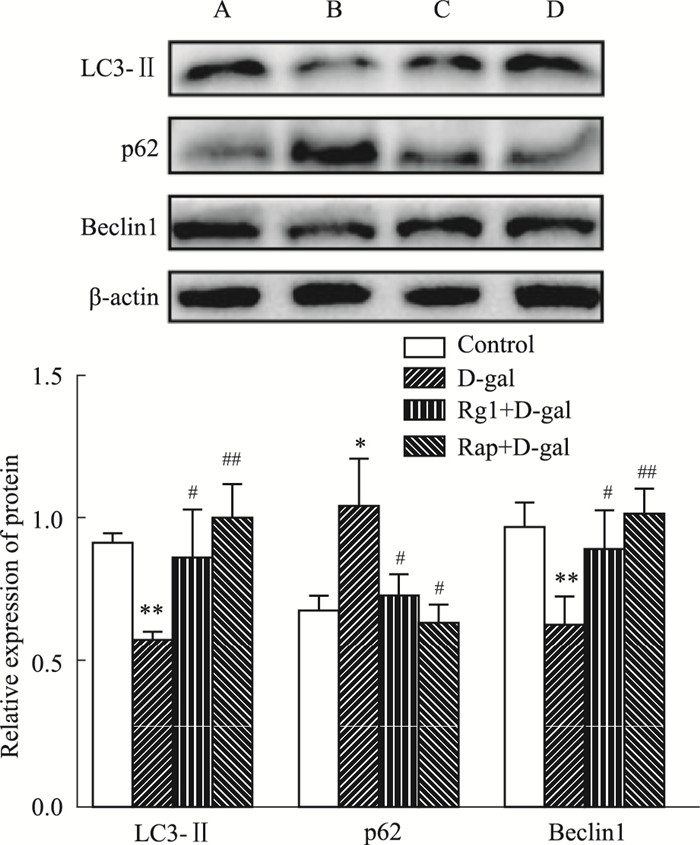
|
| Fig 5 Effect of ginsenoside Rg1 on expression of autophagy protein in brain tissues of brain aging mice (x±s, n=3) A: Control B: D-gal C: Rg1+D-gal D: Rap+D-gal.*P<0.05, **P<0.01 vs control; #P<0.05, ##P<0.01 vs D-gal |
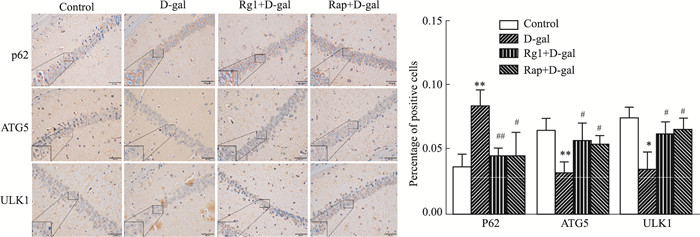
|
| Fig 6 Effect of ginsenoside Rg1 on expression of neuronal autophagy protein in hippocampus of brain aging mice (Immunohistochemistry×400) (x±s, n=3) *P<0.05 vs control, **P<0.01 vs D-gal; #P<0.05, ##P<0.01 vs D-gal |
Western blot结果表明,D-gal组小鼠脑组织蛋白的p-AMPK/AMPK比值下降,p-mTOR/mTOR的比值上升,提示脑内细胞自噬活动的下降。当采用Rg1或Rap干预致衰过程,脑组织蛋白的p-AMPK/AMPK比值上升,p-mTOR/mTOR的比值下降,说明Rg1可以通过上调p-AMPK或下调p-mTOR含量促进小鼠脑的自噬功能。同时,与对照组相比,D-gal组p53蛋白明显上调(P<0.05),提示小鼠脑中存在细胞凋亡现象,而采用Rg1或Rap干预致衰过程,p53表达明显下降(P<0.05),提示Rg1可以显著拮抗D-gal所致的脑衰老(Fig 7)。
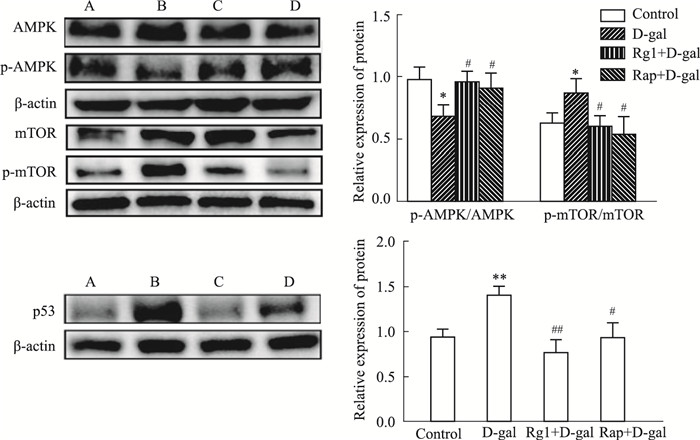
|
| Fig 7 Effect of ginsenoside Rg1 on AMPK/mTOR signaling pathway and p53 protein in brain tissues of brain aging mice (x±s, n=3) A: Control B: D-gal C: Rg1+D-gal D: Rap+D-gal. *P<0.05, **P<0.01 vs control; #P<0.05, ##P<0.01 vs D-gal |
随着年龄的增长,大脑逐渐出现器官与细胞水平上的退行性变,因此,阿尔茨海默病、帕金森病(PD)等神经退行性疾病的发病率逐渐上升[5]。人参是中医临床“补气”药,而人参皂苷Rg1是人参中最重要的抗氧化、抗衰老成分,它能够有效延缓机体脑器官的衰老[6],本文采用D-gal构建脑衰老模型,旨在探讨人参皂苷Rg1延缓D-gal所致的脑衰老与激活AMPK/mTOR信号通路调控自噬的初步机制。
D-gal是一种公认的致衰剂,所致衰老与自然衰老相似,它可以有效导致机体脑,心脏,脾等多个器官的氧化损伤与衰老,现被广泛用于机体抗衰老机制的相关研究[7-8]。课题组前期研究发现,D-gal对脑确有明显损伤,并与其下调自噬活动有关[9],而Rap是一种典型的自噬激活剂,它可以显著提升机体的自噬功能[10]。本实验结果证明,随着注射D-gal剂量的累积和时间的延长,小鼠逐渐出现精神萎靡,毛色灰暗等与自然衰老相似的生物学特征。经过水迷宫实验测试小鼠的学习与记忆能力,D-gal组小鼠的空间学习与记忆能力明显下降。在Rg1与Rap干预衰老模型之后,小鼠的学习与记忆能力显著提高,并明显提高了小鼠的认知功能,水迷宫实验证明了Rg1与Rap确实可以改善D-gal对小鼠大脑所致的学习记忆能力的损伤。
自噬是一种调节机体吞噬自身衰老细胞与细胞器的活动,在一定程度上,上调自噬功能可以对机体起着抗衰老的作用[11]。Beclin1是自噬过程启动的关键因子[12],当机体自噬启动时,胞质型LC3(LC3-Ⅰ)会酶解掉一小段多肽,转变为自噬体(膜型),即LC3-Ⅱ。p62蛋白是自噬过程的一种降解产物,具有底物特异性,在自噬的中晚期被降解,因此组织整体的p62水平与自噬活动存负相关[13]。因此,LC3-Ⅱ、p62、Beclin1均可作为自噬水平检测的主要标志物。本实验研究结果表明,D-gal所致脑衰老小鼠LC3-Ⅱ、Beclin1蛋白含量降低,p62蛋白含量升高。用Rg1与Rap干预其衰老进程之后,小鼠LC3-Ⅱ、Beclin1蛋白含量升高,p62蛋白含量显著降低,提示Rgl明显改善了小鼠脑的自噬功能。AMPK/mTOR信号通路是细胞自噬的重要调控通路。腺苷酸活化蛋白激酶(AMPK)和雷帕霉素靶蛋白(mTOR)是调控自噬的重要信号分子[14],自噬可在不同应激刺激下发生,如饥饿、缺氧和氧化应激[15]。在AMPK/mTOR信号通路中,AMPK通过磷酸化被激活,并降低了mTOR的磷酸化水平,最终激活自噬。Rg1与Rap通过促进AMPK或抑制mTOR的磷酸化和调节各自噬相关蛋白的表达来调控自噬功能。据报道,有许多信号通路都参与了自噬的调控,包括AMPK、mTOR、PI3K与MAPK等信号通路,人参皂苷Rg1被认为通过AMPK/mTOR信号通路诱导自噬,自噬功能的下降则会导致衰老的发生[16]。本研究结果表明,D-gal组p-AMPK/AMPK明显下降,p-mTOR/mTOR上升,通过Rg1与Rap干预之后,自噬活动明显提升,此研究证明了Rg1可以通过AMPK/mTOR信号通路提升小鼠脑的自噬功能。乙酰胆碱是一种神经递质,能特异性地作用于各类胆碱受体,在脑组织内迅速被乙酰胆碱酯酶所分解[17],因此, 同时通过测定脑组织内的乙酰胆碱酯酶活性可以反映神经递质乙酰胆碱的含量,以助于诊断小鼠大脑的神经功能状态。本研究结果表明,D-gal所致脑衰老小鼠的乙酰胆碱酯酶活性明显升高,而Rg1与Rap干预之后可以显著降低乙酰胆碱酯酶的活性,证明了Rg1可以改善D-gal所致小鼠脑衰老的神经功能障碍。
综上所述,本文通过腹腔注射D-gal成功构建小鼠脑衰老模型,同时用人参皂苷Rg1与自噬激活剂Rap干预其衰老机制,结果表明了Rg1确实可以延缓D-gal所致的脑衰老,与其自噬活动密切相关,并可能是因为上调了AMPK/mTOR信号通路,从而起着抗衰老的作用,这为今后进一步研究人参皂苷Rg1延缓机体衰老的具体机制提供了一定的理论基础。
| [1] |
Zhong S J, Wang L, Gu R Z, et al. Ginsenoside Rg1 ameliorates the cognitive deficits in D-galactose and AlCl-induced aging mice by restoring FGF2-Akt and BDNF-TrkB signaling axis to inhibit apoptosis[J]. Int J Med Sci, 2020, 17(8): 1048-55. doi:10.7150/ijms.43979 |
| [2] |
向玥, 陈粼波, 姚辉, 等. 人参皂苷Rg1对D-半乳糖所致衰老小鼠海马的保护机制[J]. 中草药, 2017, 48(18): 3789-95. Xiang Y, Chen L B, Yao H, et al. The protective mechanism of ginsenoside Rg1 on the hippocampus of aging mice induced by D-galactose[J]. Chin Tradit Herb Drugs, 2017, 48(18): 3789-95. doi:10.7501/j.issn.0253-2670.2017.18.019 |
| [3] |
Zheng J, Hu S S, Wang J X, et al. Icariin improves brain function decline in aging rats by enhancing neuronal autophagy through the AMPK/mTOR/ULK1 pathway[J]. Pharm Biol, 2021, 59(1): 183-91. |
| [4] |
Han X J, Tai H R, Wang X B, et al. AMPK activation protects cells from oxidative stress-induced senescence via autophagic flux restoration and intracellular NAD(+) elevation[J]. Aging Cell, 2016, 15(3): 416-27. doi:10.1111/acel.12446 |
| [5] |
Asefy Z, Hoseinnejhad S, Ceferov Z. Nanop articles approaches in neurodegenerative diseases diagnosis and treatment[J]. Neurol Sci, 2021, 42(7): 2653-60. doi:10.1007/s10072-021-05234-x |
| [6] |
Liang H Y, Zhang P P, Zhang X L, et al. Preclinical systematic review of ginsenoside Rg1 for cognitive impairment in Alzheimer's disease[J]. Aging (Albany NY), 2021, 13(5): 7549-69. |
| [7] |
Liu X H, Zhao Z H, Zhou Y, et al. Effect of ginsenoside Rg1 in delaying premature ovarian failure induced by D-gal in mice through PI3K/Akt/mTOR autophagy pathway[J]. Zhongguo Zhong Yao Za Zhi, 2020, 45(24): 6036-42. |
| [8] |
李赓, 汪子铃, 候吉颖, 等. 人参皂苷Rg1对D-半乳糖所致小鼠心肌损伤的保护作用[J]. 第三军医大学学报, 2021, 43(11): 1074-9. Li G, Wang Z L, Hou J Y, et al. Protective effect of ginsenoside Rg1 on myocardial injury induced by D-galactose in mice[J]. J Third Mil Med Univ Journal of the Third, 2021, 43(11): 1074-9. |
| [9] |
Chen L B, Yao H, Chen X B, et al. Ginsenoside Rg1 decreases oxidative stress and down-regulates Akt/mTOR signalling to attenuate cognitive impairment in mice and senescence of neural stem cells induced by D-Galactose[J]. Neurochem Res, 2018, 43(2): 430-40. doi:10.1007/s11064-017-2438-y |
| [10] |
Zhou W, Ye S D. Rapamycin improves insulin resistance and hepatic steatosis in type 2 diabetes rats through activation of autophagy[J]. Cell Biol Int, 2018, 42(10): 1282-91. doi:10.1002/cbin.11015 |
| [11] |
Benedetto A, Gems D. Autophagy promotes visceral aging in wild-type C. elegans[J]. Autophagy, 2019, 15(4): 731-2. doi:10.1080/15548627.2019.1569919 |
| [12] |
潘慧, 郑晓月, 王珊, 等. 褐藻胶寡糖对D-半乳糖诱导的小鼠肾脏衰老的保护作用及机制[J]. 中国药理学通报, 2021, 37(10): 1390-5. Pan H, Zhen X Y, Wang S, et al. Protective effect and mechanism of algin oligosaccharides on D-galactose-induced renal senescence in mice[J]. Chin Pharmacol Bull, 2021, 37(10): 1390-5. |
| [13] |
Jeong S J, Zhang X, Rodriguez-Velez A, et al. SQSTM1/p62 and selective autophagy in cardiometabolic diseases[J]. Antioxid Redox Signal, 2019, 31(6): 458-71. doi:10.1089/ars.2018.7649 |
| [14] |
Meng H Y, Shao D C, Li H, et al. Resveratrol improves neurological outcome and neuroinflammation following spinal cord injury through enhancing autophagy involving the AMPK/mTOR pathway[J]. Mol Med Rep, 2018, 18(2): 2237-44. |
| [15] |
Kulkarni A, Dong A, Kulkarni V V, et al. Differential regulation of autophagy during metabolic stress in astrocytes and neurons[J]. Autophagy, 2020, 16(9): 1651-67. doi:10.1080/15548627.2019.1703354 |
| [16] |
Yang P, Ling L, Sun W J, et al. Ginsenoside Rg1 inhibits apoptosis by increasing autophagy via the AMPK/mTOR signaling in serum deprivation macrophages[J]. Acta Biochim Biophys Sin (Shanghai), 2018, 50(2): 144-55. doi:10.1093/abbs/gmx136 |
| [17] |
Janeczek M, Gefen T, Samimi M, et al. Variations in acetylcholinesterase activity within human cortical pyramidal neurons across age and cognitive trajectories[J]. Cereb Cortex, 2018, 28(4): 1329-37. doi:10.1093/cercor/bhx047 |