

2. 航天中心医院、北京大学航天临床医学院 神经内科/航天医学中心, 北京 100049
李强(1980-),男,硕士,主任医师,研究方向:神经变性病发病机制临床与基础,E-mail:liqiang1980_1981@126.com;
王洪权(1979-),男,博士,教授、副主任医师,硕士生导师,研究方向:神经药理,E-mail:whongquan@alu.fudan.edu.cn。
2. Dept of Neurology & Aerospace Medical Center, Aerospace Center Hospital, Peking University Aerospace School of Clinical Medicine, Beijing 100049, China
阿尔茨海默病(Alzheimer′s disease,AD) 是最常见的一种神经变性病,以进行性脑功能失调为特征的疾病,表现为记忆、认知、语言和行为障碍以及人格改变等。AD的典型病理特征为由beta-淀粉样蛋白(β-amyloid,Aβ) 细胞外沉积形成的老年斑(senile plaques,SPs)和细胞内由tau蛋白过度磷酸化引起的神经原纤维缠结(neurofibrillary tangles,NFTs)[1]。AD目前没有确切有效的治疗方法。给社会和家庭带来了沉重的经济和精神负担。目前AD发病机制尚不清楚,主要的发病机制假说包括淀粉样蛋白学说、氧化应激学说、线粒体功能障碍学说和胆碱能学说等。针对不同的假说机制具有相应的治疗策略。近年来研究显示,天然化合物通过多种机制能、多靶点治疗特性抑制AD的发生,成为近年AD治疗有益的探索。本文就近年来以Tan IIA为代表的丹参酮在AD中的药理作用及其机制的研究进展综述。
1 丹参与丹参酮丹参为唇形科植物,以干燥根及根茎入药,具有活血化瘀、通经止痛、清心除烦、凉血消痈的作用。丹参的根(roots of Salvia miltiorrhiza Bunge,Lamiaceae)被广泛应用于临床治疗心脑血管疾病。根据其结构特点,丹参的主要成分可分为两类,第一类含有水溶性多酚化合物,如丹酚酸B (salvianolic acid B,Sal B)、丹酚酸A(salvianolic acid B,Sal A)和丹参素。第二类包含亲油性化学物质,如丹参酮I (tanshinone I,Tan I)、丹参酮IIA (tanshinone IIA,Tan IIA)、隐丹参酮(cryptotanshinone)和二氢丹参酮(dihydrotanshinone)[2]。其中Tan IIA是最主要的成分。丹参酮结构见Fig 1所示。
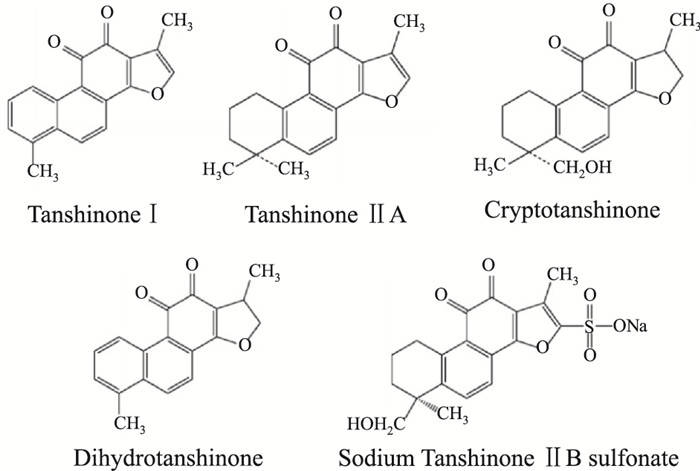
|
| Fig 1 Structure of neuroprotective tanshinones |
AD的胆碱能损伤学说(cholinergic hypothesis)认为AD病变过程中基底前脑区存在胆碱能神经元丢失,胆碱能受体密度下降,胆碱乙酰化酶(choline acetyltransferase,ChAT)和乙酰胆碱酯酶(acetylcholinesterase,AChE)活性及ACh的生成、释放、摄取等胆碱能神经系统功能降低,出现中枢胆碱能神经系统紊乱,进而导致认知和记忆功能障碍,被认为是AD的重要病因。早期研究显示,Tan I具有强效抑制AChE活性的药理学作用,表明丹参酮具有AChE抑制剂活性[3]。在链脲菌素(streptozotocin,STZ)诱导的小鼠认知功能障碍AD模型中,STZ升高AChE活性,而Tan IIA可以抑制STZ引起的AChE活性增加[4]。在东莨菪碱(Scopolamine,SCO)诱导的小鼠认知功能障碍AD模型中,Tan IIA降低SCO引起的AChE活性增加,并同时降低ChAT活性[5]。在Aβ25-35诱导的AD损伤模型中,侧脑室注射经Tan IIA孵育的间质干细胞(Tan IIA-MSCs),可降低AChE活性,并促进ACh的释放[6]。综上所述,表明丹参酮具有AChE抑制剂活性。
2.2 对Aβ的作用(1) 抑制Aβ产生、促进Aβ降解: Aβ是由淀粉样蛋白前体蛋白(amyloid-β precursor protein,APP)经不同的分泌酶相继切割生成。研究显示,Tan IIA能够在转染APPsw的SH-SY5Y细胞中,通过降低BACE1水平减少Aβ1-40和Aβ1-42的产生[7]。同时,Tan IIA上调ADAM10和sAPPα,这表明Tan IIA具有促进α-分泌酶的活性,从而减少APP经β-分泌酶途径产生Aβ[7]。同时,Tan IIA能够上调Aβ降解酶,即中性内肽酶(neprilysin,NEP)胰岛素降解酶(insulin-degrading enzyme,IDE)的蛋白表达,这表明Tan IIA具有促进Aβ降解的功能[7]。侧脑室注射经Tan IIA孵育的间质干细胞(Tan IIA-MSCs),可降低BACE1和PS1蛋白和mRNA表达水平,而对AMDM10无影响,从而降低Aβ1-40的产生[6]。总之, 体内外研究显示, Tan IIA具有抑制Aβ产生和促进其降解的功能,Tan IIA是β-分泌酶抑制剂,能够通过抑制β-分泌酶活性减少Aβ的产生。
(2) 抑制Aβ的聚集以及促进纤维状Aβ的降解: 早期原子力显微镜(atomic force microscopy,AFM)和硫磺素T (Thioflavin-T,Th-T)染色研究发现,Tan IIA和Tan I均具有抑制纤维状Aβ(amyloid fifibril,fAβ)形成和促进fAβ解聚的功能,而Tan I较Tan IIA具有更强的抑制作用[8]。在APP/PS1双转基因小鼠中,Tan IIA能够降低Aβ1-42的聚集,并减少CTFs的形成[9],验证了早期的体外研究。在APP/PS1双转基因小鼠中,Tan IIA能够降低老年斑的形成[10]。以上研表明,Tan IIA能够抑制Aβ的聚集、促进纤维状Aβ的降解和抑制老年斑的形成。
(3) 抑制Aβ诱导的氧化应激损伤和凋亡发生: Tan IIA在AD中的具有抗凋亡机制从而发挥神经保护作用研究最早源于西安交通大学医学院胡海涛教授组的研究,他们发现在原代培养大鼠皮层神经元中,Tan IIA上调Bcl-2/Bax比例、降低caspase-3激活和抑制细胞色素C释放,同时降低细胞上调谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、SOD活性,降低MDA和ROS产生,上调线粒体模电位[11],这表明,Tan IIA具有通过抑制氧化应激,从而抑制凋亡的发生。后期研究显示,Tan IIA在Aβ诱导的PC12细胞[3, 12]、原代皮层神经元[13]、SH-SY5Y细胞[14-15]中通过抗氧化和抗凋亡机制抑制Aβ诱导的损伤。隐丹参酮与多奈哌齐合用能够在SH-SY5Y细胞中抑制Aβ诱导的细胞凋亡[16]。
体内研究结果也证实, Tan IIA在AD中具有抗凋亡作用。在Aβ1-42诱导的大鼠AD模型中,Tan IIA通过抑制caspase-3激活抑制凋亡发生[17-19]。在APP/PS1双转基因小鼠中,Tan IIA亦能通过抑制凋亡发生发挥神经能保护作用[20]。在东莨菪碱(scopolamine,SCO)诱导的小鼠认知功能障碍AD模型中,Tan IIA通过降低MDA和ROS,升高SOD发挥抗氧化作用,通过降低Bax和cleaved-caspase-3以及上调Bcl-2水平发挥其抗凋亡作用[5]。而在链佐霉素(streptozotocin,STZ)诱导的小鼠认知功能障碍AD模型中,Tan IIA通过降低MDA、上调SOD和GSH-px活性来发挥其抗氧化作用[4]。最近研究显示,Tan IIA能改善侧脑室注射STZ诱导的小鼠认知障碍,其分子机制可能与抑制内质网应激及细胞凋亡有关[21]。
2.3 抑制tau蛋白过度磷酸化AD的Tau蛋白异常磷酸化假说认为,异常过度磷酸化的Tau蛋白以配对螺旋丝结构形成神经原纤维缠结(NFTs)并在神经元内聚积,Tau蛋白异常在AD患者神经变性和学习记忆障碍的发生发展中起重要作用。Aβ等可通过抑制PI3K和PKC途径而激活GSK-3β并使Tau蛋白发生过度磷酸化、聚积,从而导致神经元功能、结构改变、记忆障碍[22]。因此,抑制tau蛋白的过度磷酸化成为治疗AD的手段之一。在Aβ25-35诱导的原代培养皮层神经元AD损伤模型中,Tan IIA能够抑制Aβ25-35诱导tau蛋白过度磷酸化,进一步机制研究显示,Tan IIA通过抑制降低细胞浆p25表达,进而与抑制细胞周期依赖性蛋白激酶5(cyclin-dependent kinase 5,CDK-5)激活相关[23]。p25/Cdk5符合体参与对tau蛋白的过度磷酸化。在Aβ1-42诱导的AD大鼠损伤模型中,Aβ1-42诱导tau蛋白(Ser396,Ser404和Thr205)的过度磷酸化和GSK-3β的激活,而Tan IIA抑制GSK-3β激活和tau蛋白过度磷酸化,表明,Tan IIA具有通过抑制GSK-3β激活抑制tau过度磷酸化作用[17]。最近研究结果证实以上结论,研究显示Tan ⅡA降低了N2a细胞、Tau过表达细胞和3×Tg-AD小鼠原代神经元细胞Tau的表达,抑制Tau的磷酸化。此外,TanⅡA增加多泛素化Tau的积累,并诱导Tau蛋白经蛋白酶体降解。此外,TanⅡA与Tau蛋白结合并抑制肝素诱导的Tau纤维的形成。总之,Tan ⅡA可促进Tau的多泛素化,诱导Tau蛋白经蛋白酶体降解,TanⅡA与Tau蛋白的结合,抑制Tau原纤维的形成。Tan ⅡA可能作为AD治疗的一个潜在候选药物[24]。
2.4 抗神经炎症作用神经炎症(neuroinflammation)参与AD发病机制和病理进程。Aβ在中枢神经系统的过度聚集可激活小胶质细胞和浸润外周免疫细胞加速神经炎症。小胶质细胞的慢性激活导致神经炎症,导致AD发生。Aβ斑块与小胶质细胞和星形胶质细胞相互作用,增加促炎介质的产生,触发炎症级联反应。此外,全身炎症可作为触发免疫系统的外部因素,从而加速AD疾病进展。体内研究显示丹参酮具有抗神经炎症作用。在Aβ1-42诱导的小鼠AD模型中,神TanⅡA和隐丹参酮的神经保护作用与其抗神经炎症有关,表现为脑内GFAP、COX-2、iNOS、NF-κB的表达减少。此外,在Aβ1-42诱导的大鼠AD模型中,TanⅡA减少了促炎细胞因子IL-1β和IL-6的分泌,这可能是通过减少星形胶质细胞和小胶质细胞的活化介导的[25]。此外,在APP/PS1小鼠中,TanⅡA的神经保护作用与减轻小胶质细胞和星形细胞活化、促炎性细胞因子TNF-α、IL-6和IL-1β的产生有关,同时进一步机制研究显示,TanⅡA与其对RAGE和NF-κB信号转导活化有关[10]。侧脑室注射经Tan IIA孵育的间质干细胞(TIIA-MSCs)对Aβ25-35诱导的AD损伤模型中研究发现,Tan IIA的神经保护作用与其对促炎性因子(IL-1、IL-4、IL-6、IL-10和TNF-α)的释放有关[26]。而体外细胞研究同样证实了丹参酮在AD中具有抗神经炎症作用[7, 10, 14]。最近研究显示,Tan IIA可激活PI3K/AKT通路、降低脑内炎症反应、抑制小胶质细胞和星形胶质细胞过度激活,进而可保护AD小鼠神经受损,提高学习记忆能力[27]。
3 结语丹参酮作为丹参的粗提取物,多年来在中国和其他国家被广泛用于治疗各种人类疾病。最近,丹参酮不同剂型,如片剂、胶囊剂、颗粒剂、口服液、注射剂、喷雾剂和药丸,可作为多种人类疾病的治疗策略。复方丹参片滴丸被正式列入《中国药典》(2020)中,这表明丹参酮在人类患者中的药用价值。这些药物制剂的不良反应轻微,在人类临床试验中被认为是相对安全的。这些制剂在实验动物和人类患者中经口吸收,在人类中半衰期约为1~5 h。中国临床试验注册中心(https://www.chictr.org.cn/index.aspx) 目前关于丹参酮的临床注册研究包括治疗急性缺血性脑卒中、心血管疾病、肺动脉高压、急性冠脉综合征等,表明丹参酮可能是一种有吸引力的治疗策略。然而,与大多数植物化学物质一样,丹参酮的水溶性差,吸收能力差,可能限制了其作为理想候选药物的应用。另外,丹参酮的不良药代动力学特性是药物开发的另一个挑战。然而,已经开发了一些药理学策略来促进丹参酮IIA的吸收和生物利用度,其中之一是以盐形式制备该化合物,如丹参酮IIA磺酸钠。未来的研究应侧重于药物设计以及精心设计临床试验,将丹参酮作为治疗多种神经系统疾病的候选药物。
综上所述,Tan IIA及其相关化合物具有胆碱酯酶抑制剂活性,能够通过抑制Aβ产生和聚集、促进Aβ降解,抑制Aβ诱导的氧化应激损伤和凋亡发生,以及抗炎和抑制tau蛋白过度磷酸化机制对AD具有治疗作用(Fig 2)。而其在PD中可通过抗氧化、抗凋亡、抗炎和调控Nrf2/ARE通路发挥其对PD的治疗作用。表明丹参酮在以PD和AD为代表的神经变性病中具有广阔的应用前景。尽管丹参酮针对部分疾病的药物临床试验研究,但是目前针对AD和PD的药物临床试验研究尚缺乏,值得期待。
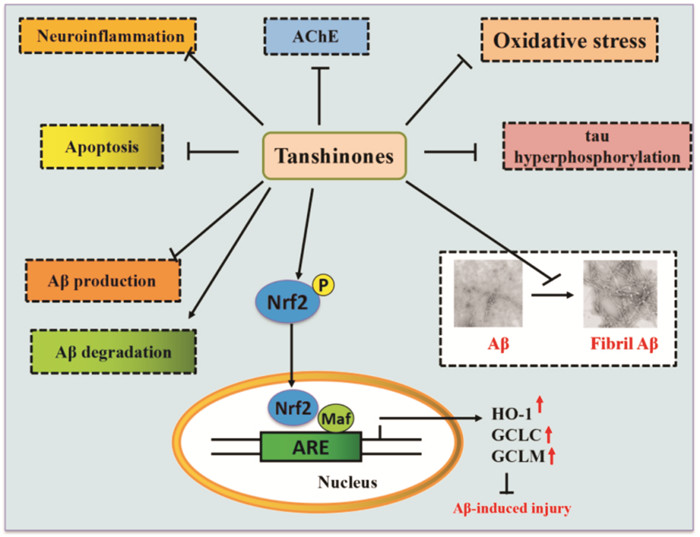
|
| Fig 2 Schematic representation of tanshinones-mediated neuroprotection in AD |
| [1] |
郝丹丹, 张垒, 张凤宁, 等. 麦角甾苷的神经保护作用研究进展[J]. 中国药理学通报, 2021, 37(7): 906-10. Hao D D, Zhang L, Zhang F N, et al. Current advances in understanding the mechanism of neuroprotective effect of acteoside in neurodegenerative disease[J]. Chin Pharmacol Bull, 2021, 37(7): 906-10. doi:10.3969/j.issn.1001-1978.2021.07.005 |
| [2] |
Zhang X Z, Qian S S, Zhang Y J, et al. Salvia miltiorrhiza: A source for anti-Alzheimer's disease drugs[J]. Pharm Biol, 2016, 54(1): 18-24. doi:10.3109/13880209.2015.1027408 |
| [3] |
Zhou Y, Li W, Xu L, et al. In Salvia miltiorrhiza, phenolic acids possess protective properties against amyloid β-induced cytotoxicity, and tanshinones act as acetylcholinesterase inhibitors[J]. Environ Toxicol Pharmacol, 2011, 31(3): 443-52. doi:10.1016/j.etap.2011.02.006 |
| [4] |
Liu C, Wu Y, Zha S, et al. Treatment effects of tanshinone ⅡA against intracerebroventricular streptozotocin induced memory deficits in mice[J]. Brain Res, 2016, 1631: 137-46. doi:10.1016/j.brainres.2015.11.040 |
| [5] |
Xu Q Q, Xu Y J, Yang C, et al. Sodium Tanshinone ⅡA sulfonate attenuates scopolamine-induced cognitive dysfunctions via improving cholinergic system[J]. Biomed Res Int, 2016, 2016: 9852536. |
| [6] |
Huang N, Li Y, Zhou Y, et al. Neuroprotective effect of tanshinone ⅡA-incubated mesenchymal stem cells on Aβ25-35-induced neuroinflammation[J]. Behav Brain Res, 2019, 365: 48-55. doi:10.1016/j.bbr.2019.03.001 |
| [7] |
Zhang D P, Lu X Y, He S C, et al. Sodium tanshinone ⅡA sulfonate protects against Aβ-induced cell toxicity through regulating Aβ process[J]. J Cell Mol Med, 2020, 24(6): 3328-35. doi:10.1111/jcmm.15006 |
| [8] |
Wang Q, Yu X, Patal K, et al. Tanshinones inhibit amyloid aggregation by amyloid-β peptide, disaggregate amyloid fibrils, and protect cultured cells[J]. ACS Chem Neurosci, 2013, 4(6): 1004-15. doi:10.1021/cn400051e |
| [9] |
Li F, Han G, Wu K. Tanshinone ⅡA alleviates the AD phenotypes in APP and PS1 transgenic mice[J]. Biomed Res Int, 2016, 2016: 7631801. |
| [10] |
Ding B, Lin C, Liu Q, et al. Tanshinone ⅡA attenuates neuroinflammation via inhibiting RAGE/NF-κB signaling pathway in vivo and in vitro[J]. J Neuroinflammat, 2020, 17(1): 302. doi:10.1186/s12974-020-01981-4 |
| [11] |
Liu T, Jin H, Sun Q R, et al. The neuroprotective effects of tanshinone ⅡA on β-amyloid-induced toxicity in rat cortical neurons[J]. Neuropharmacology, 2010, 59(7-8): 595-604. doi:10.1016/j.neuropharm.2010.08.013 |
| [12] |
Dong H, Mao S, Wei J, et al. Tanshinone ⅡA protects PC12 cells from β-amyloid(25-35)-induced apoptosis via PI3K/Akt signaling pathway[J]. Mol Biol Rep, 2012, 39(6): 6495-503. doi:10.1007/s11033-012-1477-3 |
| [13] |
Qian Y H, Xiao Q, Xu J. The protective effects of tanshinone ⅡA on β-amyloid protein (1-42)-induced cytotoxicity via activation of the Bcl-xL pathway in neuron[J]. Brain Res Bull, 2012, 88(4): 354-8. doi:10.1016/j.brainresbull.2012.03.007 |
| [14] |
Geng L, Liu W, Chen Y. Tanshinone ⅡA attenuates Aβ-induced neurotoxicity by down-regulating COX-2 expression and PGE2 synthesis via inactivation of NF-κB pathway in SH-SY5Y cells[J]. J Biol Res (Thessalon), 2019, 26: 15. doi:10.1186/s40709-019-0102-1 |
| [15] |
Yang W, Zhang J, Shi L, et al. Protective effects of tanshinone ⅡA on SH-SY5Y cells against oAβ1-42-induced apoptosis due to prevention of endoplasmic reticulum stress[J]. Int J Biochem Cell Biol, 2019, 107: 82-91. doi:10.1016/j.biocel.2018.12.011 |
| [16] |
梅峥嵘, 张芳艳, 吴仲洪, 等. 隐丹参酮与多奈哌齐合用对β-淀粉样蛋白诱导SH-SY5Y细胞凋亡的保护作用[J]. 重庆医学, 2014, 43(10): 1211-3. Mei Z R, Zhang F Y, Wu Z H, et al. Protective effect of combination of cryptotanshinone and donepezil on amyloid-β protein induced apoptosis in SH-SY5Y cells[J]. Chongqing med, 2014, 43(10): 1211-3. doi:10.3969/j.issn.1671-8348.2014.10.021 |
| [17] |
Lin L, Jadoon S S, Liu S Z, et al. Tanshinone ⅡA ameliorates spatial learning and memory deficits by inhibiting the activity of ERK and GSK-3β[J]. J Geriatr Psychiatry Neurol, 2019, 32(3): 152-63. doi:10.1177/0891988719837373 |
| [18] |
Li J, Wang F, Zhou J, et al. Effects of tanshinone ⅡA on the expressions of p53, pp53 and apoptosis in the rats with Alzheimer's disease[J]. Zhong Nan Da Xue Xue Bao Yi Xue Ban, 2015, 40(11): 1210-6. |
| [19] |
Wen P, Luo H, Zhou L, et al. Effects of tanshinone ⅡA on the expressions of caspase-3, Akt and NF-κB in the brains of rat models of Alzheimer's disease[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi, 2014, 30(2): 155-9. |
| [20] |
He Y, Ruganzu J B, Lin C, et al. Tanshinone ⅡA ameliorates cognitive deficits by inhibiting endoplasmic reticulum stress-induced apoptosis in APP/PS1 transgenic mice[J]. Neurochem Int, 2020, 133: 104610. doi:10.1016/j.neuint.2019.104610 |
| [21] |
何莹莹, 靳辉, 计胜峰, 等. 丹参酮ⅡA抑制内质网应激及细胞凋亡改善AD小鼠的认知障碍[J]. 西安交通大学学报(医学版), 2020, 41(2): 287-93. He Y Y, Jin H, Ji S F, et al. Tanshinone ll A improves memory deficits by inhibiting the endoplasmic reticulum stress and apoptosis in Alzheimer's disease mice[J]. J Xi'an Jiaotong Uni(Medical Edition), 2020, 41(2): 287-93. |
| [22] |
Gallardo G, Holtzman D M. Amyloid-β and tau at the crossroads of Alzheimer's Disease[J]. Adv Exp Med Biol, 2019, 1184: 187-203. |
| [23] |
Shi L L, Yang W N, Chen X L, et al. The protective effects of tanshinone ⅡA on neurotoxicity induced by β-amyloid protein through calpain and the p35/Cdk5 pathway in primary cortical neurons[J]. Neurochem Int, 2012, 61(2): 227-35. doi:10.1016/j.neuint.2012.04.019 |
| [24] |
Cai N, Chen J, Bi D, et al. Specific degradation of endogenous tau protein and inhibition of tau fibrillation by Tanshinone ⅡA through the ubiquitin-proteasome pathway[J]. J Agric Food Chem, 2020, 68(7): 2054-62. doi:10.1021/acs.jafc.9b07022 |
| [25] |
Lu B L, Li J, Zhou J, et al. Tanshinone ⅡA decreases the levels of inflammation induced by Aβ1-42 in brain tissues of Alzheimer's disease model rats[J]. Neuroreport, 2016, 27(12): 883-93. doi:10.1097/WNR.0000000000000618 |
| [26] |
Huang N, Li Y, Zhou Y, et al. Neuroprotective effect of tanshinone ⅡA-incubated mesenchymal stem cells on Aβ(25-35)-induced neuroinflammation[J]. Behav Brain Res, 2019, 365: 48-55. doi:10.1016/j.bbr.2019.03.001 |
| [27] |
方毅, 宋光捷, 陈黎, 等. 丹参酮ⅡA对阿尔茨海默症模型小鼠神经保护作用及对PI3K/AKT通路的影响[J]. 中国实验动物学报, 2021, 29(4): 499-505. Fang Y, Song G J, Chen L, et al. Neuroprotective effect of tanshinone ⅡA and its effects on the PI3K/AKT pathway in a mouse model of Alzheimer's disease[J]. Acta Lab Anim Sci Sin, 2021, 29(4): 499-505. doi:10.3969/j.issn.1005-4847.2021.04.011 |
