


2. 贵州医科大学附属医院风湿免疫科,贵州 贵阳 550004;
3. 贵州中医药大学附属第二医院,贵州 贵阳 550003
 ,
HU Huan2,
LIU Jun2,
ZENG Jia-shun2,
HUANG Ying3,
LING Yi3,
LI Pei-ting2,
QIN Long-yan2,
LI Long1,2
,
HU Huan2,
LIU Jun2,
ZENG Jia-shun2,
HUANG Ying3,
LING Yi3,
LI Pei-ting2,
QIN Long-yan2,
LI Long1,2

2. Affiliated Hospital of Guizhou Medical University, Guiyang 550004, China;
3. The Second Affiliated Hospital of Guizhou University of Traditional Chinese Medicine, Guiyang 550003, China
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性、自身免疫性炎症性疾病,病理改变以滑膜增生和软骨破坏为主[1];其中增生的滑膜组织包含着两种类型的细胞,分别为成纤维样滑膜细胞(fibroblast-like synoviocytes,FLS)及滑膜巨噬细胞,两种细胞呈肿瘤样生长,通过释放炎症因子及其他相关介质导致骨和软骨进行性破坏[2-3]。因此,抑制滑膜成纤维细胞的活力,是治疗RA的关键。
瑞香素(daphnetin,DAP)为香豆素的衍生物,具有抗炎、抗肿瘤、抗凝、抗氧化等作用[4-5]。部分研究表明,DAP可降低胶原诱导性关节炎(collagen-induced arthritis,CIA)大鼠血清中的辅助性T细胞1(helper T cell,Th1)、辅助性T细胞2(helper T cell,Th2)、辅助性T细胞17(helper T cell,Th17)的应答,抑制基质金属蛋白酶(matrix metalloproteinase,MMPs)、炎症介质白细胞介素1β(interleukin 1β,IL-1β)、白细胞介素6(interleukin 6,IL-6)及白细胞介素12(interleukin 12,IL-12)的表达,促进促凋亡基因死亡受体3(death receptor 3,DR3)、细胞程序性死亡受体5(programmed cell death 5,PDCD5)及人凋亡相关因子配体(human factor-related apoptosis ligand,FasL)的活化,从而抑制类肿瘤增殖[6]。但相关研究仍然较少,且只停留在动物模型及模型提取的细胞上,并未从RA患者细胞着手。
本研究基于内质网应激(endoplasmic reticulum stress,ERS)中PERK/ATF4/CHOP信号通路,探讨DAP对RA-FLS增殖、抗炎、凋亡、迁移及侵袭能力的影响,旨在进一步明确DAP作用机制,为应用于临床提供一定的数据及理论支撑。
1 材料与方法 1.1 材料 1.1.1 细胞人类风湿关节炎成纤维样滑膜细胞(RA-FLS),由贵州中医药大学附属第二医院黄颖、凌益老师赠送;滑膜组织取自贵州中医药大学附属第二医院关节置换术的患者,实验经贵州中医药大学第二附属医院医学伦理委员会批准(PY2019104),所有患者均签署知情同意书;根据2010ACR/EULAR类风湿性关节炎分类标准和28个关节的疾病活动评分以及包括C反应蛋白(DAS28-CRP)≥3.2在内的4个变量,所有患者均被诊断为活动性RA;排除骨关节炎,系统性红斑狼疮、干燥综合征等自身免疫性疾病;滑膜组织用含2%青霉素/链霉素的磷酸盐缓冲盐水清洗5次,去除其他不相关组织,剪碎后在37 ℃和5%CO2的培养箱中,用含有20%胎牛血清和1%青霉素/链霉素培养,于第3~8代间开展实验。
1.1.2 药物与试剂瑞香素(上海源叶,纯度≥98%)、4-苯基丁酸钠盐(4-PBA)(上海麦克林)、CCK-8试剂盒(大连美伦),胎牛血清、青霉素/链霉素(美国BI),二甲基亚砜(中国索莱宝),DMEM高糖培养基、胰酶(美国Gibco),Transwell小室(美国NEST),Matrigel胶(美国Corning),PERK、p-PERK、ATF4、GRP78、CHOP、Caspase-12(中国武汉三鹰),C-caspase12(美国CST),BCL-2(中国华安生物),IL-6和TNF-α ELISA试剂盒(中国欣博盛生物),凋亡试剂盒(美国BD)。
1.1.3 实验仪器倒置显微镜(日本,Nikon),酶标仪(美国,Thermo),曝光机(美国,BIO-RAD),培养箱(美国,BIOBASE),流式细胞仪(美国,BECKMAN COULTER)。
1.2 方法 1.2.1 细胞培养与鉴定细胞在含20%胎牛血清和1%青霉素/链霉素的DMEM培养基中培养;培养箱条件为37 ℃,5% CO2。细胞培养至第3代时,加入细胞爬片,待细胞长到70%时,PBS清洗,4%多聚甲醛固定30 min,PBS再次清洗,加入0.5% Triton X-100室温透化20 min,胎牛血清封闭,分别加入兔抗Vimentin(1 ∶ 100)和CD68(1 ∶ 100),4 ℃孵育过夜;FITC-山羊抗兔IgG(1 ∶ 100)室温避光孵育2 h,PBS缓冲液再次冲洗后,加入DAPI染核10 min,封片干燥,使用荧光显微镜进行观察。
1.2.2 CCK-8检测细胞增殖活性及实验分组细胞培养至第3代开始开展实验。利用CCK-8试剂盒检测细胞存活率。设置不含细胞,只含培养基组、只含细胞不加药物、药物DAP(5、10、20、40、50、60、70 mg·L-1)组[7-8]。处理24 h后加入CCK-8增强剂10 μL在37 ℃细胞培养箱孵育2 h后于酶标仪检测吸光度(OD)值,根据CCK-8试剂盒说明书上的指示算出细胞增殖率,统计分析后确定实验分组;实验分为空白(Blank)、低剂量(L-DAP)、中剂量(M-DAP)、高剂量组(H-DAP)以及高剂量+4-PBA(H-DAP+4-PBA),4-PBA在高剂量药物加入细胞培养箱孵育2 h后,根据5 mol·L-1 [9]的浓度再加入相应剂量同其他组别一同孵育至24 h。
1.2.3 ELISA检测细胞因子根据“1.2.2”中实验分组处理,收取24 h后的细胞上清,离心后取上清液用ELISA试剂盒按照实验说明书检测IL-6、TNF-α,之后于酶标仪上检查吸光度值。进行3个独立实验,研究结果具有重复性,并进行统计分析。
1.2.4 细胞凋亡检测将细胞接种在6孔板中,实验分组同“1.2.2”,进行不同浓度DAP处理24 h后用冷PBS洗涤细胞两次,用PE AnnexinV和7-AAD溶液避光染色15~30 min。用流式细胞仪于30 min内对样本进行检测。数据用FlowJo V10软件进行分析。
1.2.5 细胞侵袭能力检测用无血清培养基、Matrigel胶按8 ∶ 1比例包被小室,放入37 ℃培养箱过夜,实验分组同“1.2.2”,次日除去多余培养基,加入200 μL含1×108L-1细胞悬液于上室,下室加600 μL含不同浓度药物的完全培养箱,放入培养箱继续孵育24 h;取出小室,PBS清洗2次,固定、染色后于正置显微镜观察且采图。
1.2.6 划痕实验调整细胞浓度并接种于6孔板,生长数量达到75%时,于超净台上用枪尖对6孔板划痕,去除培养液后用PBS清洗,实验分组同“1.2.2”,培养箱培养24 h后倒置显微镜下观察细胞愈合情况。
1.2.7 Western blot分析根据“1.2.2”中实验分组处理,将处理后的细胞用含蛋白酶抑制剂和磷酸酶抑制剂的冰冷RIPA裂解缓冲液裂解。SDS-PAGE分离,转移至PVDF膜。膜在5%脱脂牛奶中室温封闭2 h,用PERK、p-PERK、ATF4、GRP78、CHOP、Caspase-12、C-caspase12、Bcl-2、GAPADH一抗4 ℃孵育过夜,清洗后再用辣根过氧化物酶(HRP)偶联的二抗处理2 h,TBST清洗3次后通过ECL试剂盒将信号可视化,使用ImageJ进行灰度值定量分析。
1.2.8 统计学分析采用SPSS 18.0统计软件进行统计学分析,计量资料采用x±s进行统计学描述;多组间比较采用单因素方差分析。
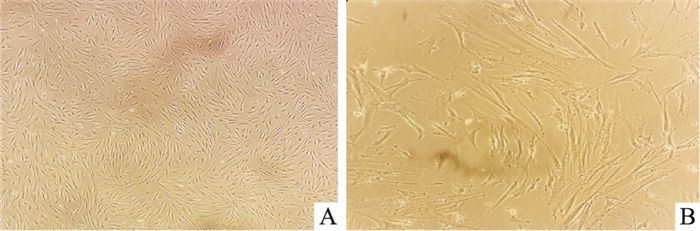
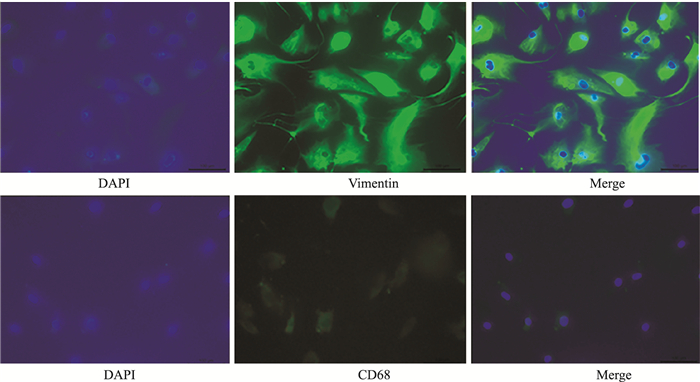
2 结果 2.1 RA-FLSs形态表现及鉴定常规显微镜下观察细胞呈梭形状态,利用免疫荧光检查细胞表达情况,结果显示,波形蛋白(Vimentin)表达强阳性,而CD68表达阴性,结合取材部位为关节滑膜组织,则确定分离出的细胞为人类风湿关节炎滑膜成纤维细胞(RA-FLS)。见Fig 1、2。
|
| Fig 1 Primary synovial fibroblasts from rheumatoid arthritis A: Second generation of RA-FLS primary cells (100×); B: Second generation of RA-FLS primary cells (200×) |
|
| Fig 2 Immunofluorescence identification of synovial fibroblasts from primary rheumatoid arthritis (200×) |
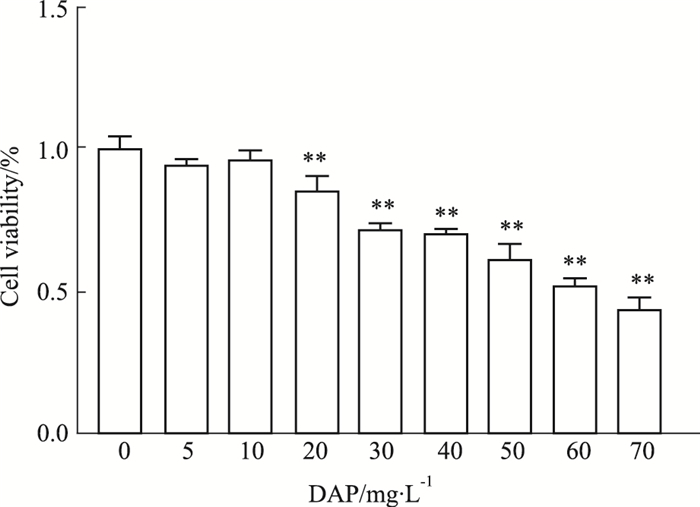
通过CCK-8法检测被处理24 h后的细胞增殖活性结果显示,与空白组(0 mg·L-1 DAP)比较,5 mg·L-1 DAP增殖率(95.67±1.10%)、10 mg·L-1 DAP增殖率(97.33±2.52%)差异不具有显著性(P>0.05),其余各种增殖率分别为(86.88±4.16%)、(72.67±1.53%)、(71.00±1.00%)、(62.33±4.62%)、(53.00±1.73%)、(44.67±3.35%),与空白组比较差异均具有显著性(P < 0.05);组间比较后0、20、40、60 mg·L-1 DAP对应的细胞增殖率差异具有显著性(P < 0.05),因此,实验分组为空白组(Blank,0 mg·L-1 DAP)、低剂量组(L-DAP,20 mg·L-1 DAP)、中剂量组(M-DAP,40 mg·L-1 DAP)、高剂量组(H-DAP,60 mg·L-1 DAP)及高剂量+抑制剂4-PBA组(H-DAP+4-PBA,60 mg·L-1 DAP+5 mol·L-1),以此作为后续实验分组。见Fig 3。
|
| Fig 3 Effects of different concentrations of DAP on proliferation of RA-FLS cells **P < 0.01 vs 0 mg·L-1. |
不同分组处理之后,与Blank组比较,IL-6浓度呈剂量依赖性下降,H-DAP+4-PBA组中,IL-6浓度表达增高,接近M-DAP组浓度;同样TNF-α也受DAP影响表达下降,加入4-PBA抑制剂后表达上调。见Tab 1。
| Group | IL-6/ng·L-1 | TNF-α/ng·L-1 |
| Blank | 191.65±1.91 | 20.31±0.87 |
| L-DAP | 156.31±0.24* | 17.48±0.53* |
| M-DAP | 129.52±3.24* | 14.34±0.32* |
| H-DAP | 90.13±0.27* | 10.52±0.41* |
| H-DAP+4-PBA | 133.78±3.04# | 15.57±3.41# |
| F | 838.61 | 132.77 |
| P | < 0.01 | < 0.01 |
| *P < 0.05 vs blank;#P < 0.05 vs H-DAP. | ||
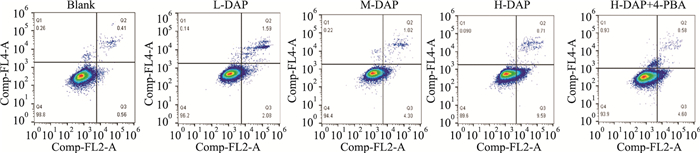
结果显示,与Blank组比较,在药物处理培养24 h后,L-DAP组、M-DAP组和H-DAP组凋亡率明显增高,差异具有统计学意义(P < 0.05);与H-DAP组相比,H-DAP+4-PBA组凋亡率下降,差异具有显著性(P < 0.05)。见Fig 4、Tab 2。
|
| Fig 4 Comparison of apoptosis in each group detected by flow cytometry |
| Group | Apoptotic rate/% |
| Blank | 1.11±0.12 |
| L-DAP | 3.52±0.14* |
| M-DAP | 5.01±0.52* |
| H-DAP | 9.21±0.94* |
| H-DAP+4-PBA | 4.92±0.59# |
| F | 112.82 |
| P | 0.01 |
| *P < 0.05 vs blank;#P < 0.05 vs H-DAP. | |
与Blank组比较,细胞侵袭数量随药物浓度增加而减少,差异具有显著性(P < 0.05)。与H-DAP组比较,H-DAP+4-PBA组细胞侵袭数量增加,差异具有显著性(P < 0.05)。见Fig 5、Tab 3。
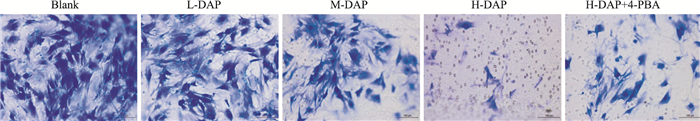
|
| Fig 5 Cell invasion ability detected by Transwell method (200×) |
| Group | Number of invaded cells |
| Blank | 81.00±2.00 |
| L-DAP | 65.67±2.81* |
| M-DAP | 45.00±2.00*# |
| H-DAP | 11.33±2.51* |
| H-DAP+4-PBA | 27.33±2.31# |
| F | 494.21 |
| P | < 0.01 |
| *P < 0.05 vs blank;#P < 0.05 vs H-DAP. | |
药物处理细胞24 h后,DAP各浓度组细胞未愈合面积均明显大于Blank组,且随DAP浓度增大而增大,差异具有统计学意义(P < 0.05)。与H-DAP组相比,H-DAP+4PBA组细胞迁移能力增加,且差异具有统计学意义(P < 0.05)。见Fig 6、Tab 4。
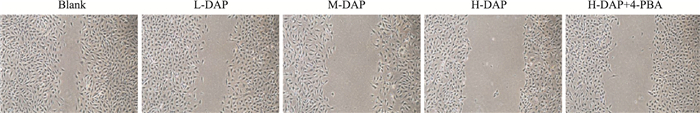
|
| Fig 6 Cell migration detected by scratch method (100×) |
| Group | Healing area (pixels) |
| Blank | 293 368.33±12 487.06 |
| L-DAP | 321 747.66±5 591.98*# |
| M-DAP | 379 511.65±20 049.03* |
| H-DAP | 496 988.48±1 613.43*# |
| H-DAP+4-PBA | 398 572.66±2 685.51 |
| F | 155.95 |
| P | < 0.01 |
| *P < 0.05 vs blank;#P < 0.05 vs H-DAP. | |
与Blank比较,ERS相关蛋白PERK、p-PERK、ATF-4、GRP78、CHOP、Caspase-12、C-caspase-12表达随药物浓度增加而增加,进行定量统计时,差异具有统计学意义(P < 0.05);而抑制凋亡蛋白Bcl-2在药物处理后,表达量随药物浓度增加而减少,差异具有统计学意义(P < 0.05)。与H-DAP组比较,H-DAP+4-PBA组各蛋白表达量均出现改变,差异具有统计学意义(P < 0.05),进一步说明4-PBA可改变DAP诱导的ERS反应。见Fig 7。
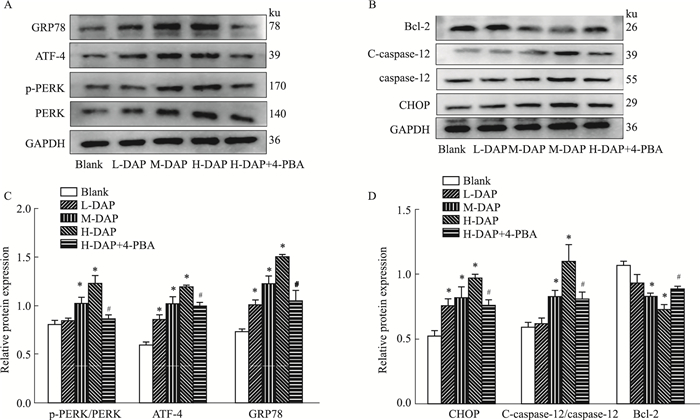
|
| Fig 7 Expression of endoplasmic reticulum stress-related proteins detected by Western blot A: Protein expression of p-PERK, PERK, ATF4 and GRP78;B: Protein expression of CHOP, C-caspase-12, Caspase-12 and Bcl-2;C: Quantitative analysis of p-PERK, PERK, ATF4 and GRP78 protein expression; D: Quantitative analysis of CHOP, C-caspase-12, Caspase-12 and Bcl-2 protein expression. *P < 0.05 vs Blank; #P < 0.05 vs H-DAP. |
非甾体类抗炎药、改善病情的抗风湿药、糖皮质激素等为RA临床主要用药[10];不断研发的RA药物使得一些患者病情得到较好的控制,但仍有部分患者出现不同程度副作用,且因个体差异对药物的敏感性及耐受性均呈现不同状态,使得患者3年内致残率达到80%左右[11];因此,找到一种合适的、更有效的治疗方式至关重要。近年来,中草药类药物研发和应用不断发展,与化学类药剂相比,具有毒性小、副作用小的优势,因此,发掘中草药类抗炎制剂将更加造福于人类[12]。
ERS是细胞内外环境改变时,内质网所发生的适应性改变,通过自我调节,提高细胞存活率,但过度的应激反应超过自身调节能力时,可诱发凋亡信号,促进细胞凋亡[13];相关研究发现,ERS可参与抗氧化、抗炎、抗癌等作用[14-15]。
RA发病机制中炎症介质的表达起着重要作用,RA-FLS自身可产生趋化因子和基质金属蛋白酶促进炎症反应和骨破坏[16]。本研究结果显示,DAP可抑制RA-FLS细胞中IL-6、TNF-α水平,抑制RA-FLS细胞侵袭及迁移能力,在高剂量DAP处理细胞后加入ERS抑制剂4-PBA,可促使炎症因子表达,恢复细胞侵袭及迁移能力;此外,DAP还可抑制RA-FLS增殖,促进凋亡,高剂量DAP中加入ERS抑制剂4-PBA后,可减弱细胞的凋亡水平。
PERK/ATF4/CHOP是ERS中的一条通路,可介导下游凋亡基因的表达,当启动ERS时,PERK与GRP78解离,以磷酸化活性状态激活下游CHOP途径,CHOP表达上调促进细胞凋亡[17];此外,ERS还可以促进Caspase-12,该凋亡蛋白是ERS凋亡的关键分子,为ERS介导凋亡的特异性蛋白[18]。而本研究在DAP处理细胞24 h后PERK、p-PERK、ATF-4、GRP78、CHOP、Caspase-12及C-caspase-12表达增加,减少抑制凋亡蛋白Bcl-2表达,在高剂量DAP处理细胞后加入ERS抑制剂4-PBA,与未加4-PBA的高剂量组比较,ERS相关蛋白表达下降,Bcl-2表达上升,与前期研究中免疫荧光初步检测结果一致,由此说明,DAP对RA-FLS的作用可能与ERS中该条通路激活相关。
综上所述,DAP对RA-FLS抗炎、促凋亡作用呈剂量依赖性,通过抑制剂的加入,可初步得知DAP的作用机制可能和内质网PERK/ATF4/CHOP信号通路相关。此外,还需进一步在动物体内加以研究,深入验证分子机制,为DAP治疗RA提供更具说服力的理论支撑。
( 致谢: 李龙老师负责指导实验开展,监督实验进程;胡欢负责实验技术上的指导,感谢贵州中医药大学附属第二医院黄颖、凌益老师在实验上的支持与指导。)
| [1] |
Shelef M A. New relationships for old autoantibodies in rheumatoid arthritis[J]. Arthritis Rheumatol, 2019, 71(9): 1396-9. doi:10.1002/art.40879 |
| [2] |
Kim E K, Kwon J E, Lee S Y, et al. IL-17-mediated mitochondrial dysfunction impairs apoptosis in rheumatoid arthritis synovial fibroblasts through activation of autophagy[J]. Cell Death Dis, 2017, 8(1): e2565. |
| [3] |
Korb-Pap A, Bertrand J, Sherwood J, et al. Stable activation of fibroblasts in rheumatic arthritis-causes and consequences[J]. Rheumatology (Oxford), 2016, 55(S2): 64-7. |
| [4] |
Zhang X, Yao J, Wu Z, et al. Chondroprotective and antiarthritic effects of Daphnetin used in vitro and in vivo osteoarthritis models[J]. Life Sci, 2020, 240: 116857. doi:10.1016/j.lfs.2019.116857 |
| [5] |
Fan X Y, Gu W J, Gao Y, et al. Daphnetin ameliorated GM-induced renal injury through the suppression of oxidative stress and apoptosis in mice-science direct[J]. Int Immunopharmacol, 2021, 96(4): 107601. |
| [6] |
Yao R, Fu Y, Li S, et al. Regulatory effect of daphnetin, a coumarin extracted from Daphne odora, on the balance of Treg and Th17 in collagen-induced arthritis[J]. Eur J Pharmacol, 2011, 670(1): 286-94. doi:10.1016/j.ejphar.2011.08.019 |
| [7] |
Deng H, Zheng M, Hu Z, et al. Effects of daphnetin on the autophagy signaling pathway of fibroblast-like synoviocytes in rats with collagen-induced arthritis (CIA) induced by TNF-α[J]. Cytokine, 2020, 127: 154952. doi:10.1016/j.cyto.2019.154952 |
| [8] |
申宁, 席晓云, 李飞, 等. 瑞香素联合IGF-1对大鼠脂肪间充质干细胞成软骨分化的影响[J]. 中国修复重建外科杂志, 2019, 33(6): 743-9. Shen N, Xi X, Li F, et al. Effect of daphresin combined with IGF-1 on chondrogenic differentiation of rat adipose mesenchymal stem cells[J]. Chin J Repar Reconstr Surg, 2019, 33(6): 743-9. |
| [9] |
周琳, 罗娟, 戢艳琼, 等. 淫羊藿苷通过抑制内质网应激减轻异丙肾上腺素诱导的H9c2细胞肥大损伤[J]. 中国病理生理杂志, 2021, 37(4): 619-25. Zhou L, Luo J, Ji Y Q, et al. Icariin reduces isoproterenol-induced H9c2 cell hypertrophy injury by inhibiting endoplasmic reticulum stress[J]. Chin J Pathophysiol, 2021, 37(4): 619-25. doi:10.3969/j.issn.1000-4718.2021.04.005 |
| [10] |
Hazlewood G S, Barnabe C, Tomlinson G, et al. Methotrexate monotherapy and methotrexate combination therapy with traditional and biologic disease modifying antirheumatic drugs for rheumatoid arthritis: Abridged Cochrane systematic review and network meta-analysis[J]. BMJ, 2016, 353(2): i1777. |
| [11] |
Alam J, Jantan I, Bukhari SNA. Rheumatoid arthritis: Recent advances on its etiology, role of cytokines and pharmacotherapy[J]. Biomed Pharmacother, 2017, 92: 615-33. doi:10.1016/j.biopha.2017.05.055 |
| [12] |
Zhou X, Xiang K, Lu M, et al. A comparative study of the efficacy of Chinese herbal medicine Duhuo Jisheng decoction combined with DMARDs vs isolated DMARDs for rheumatoid arthritis: A protocol for systematic review and meta analysis[J]. Medicine (Baltimore), 2020, 99(50): e23479. doi:10.1097/MD.0000000000023479 |
| [13] |
Wang J, Cheng Q, Wang X, et al. Deficiency of IRE1 and PERK signal pathways in systemic lupus erythematosus[J]. Am J Med Sci, 2014, 348(6): 465-73. doi:10.1097/MAJ.0000000000000328 |
| [14] |
Rezghi B S, Movahedian A A, Aghaei M. MicroRNA-30c-2-3p regulates ER stress and induces apoptosis in ovarian cancer cells underlying ER stress[J]. EXCLI J, 2021, 20: 922-34. |
| [15] |
刘丹, 潘连红, 金良友, 等. 柚皮苷预处理通过抑制内质网应激凋亡途径减轻心肌细胞缺氧/复氧损伤[J]. 中国药理学通报, 2019, 35(2): 214-8. Liu D, Pan L H, Jin L Y, et al. Naringin preconditioning alleviates hypoxia/reoxygenation injury of cardiomyocytes by inhibiting endoplasmic reticulum stress apoptosis pathway[J]. Chin Pharmacol Bull, 2019, 35(2): 214-8. doi:10.3969/j.issn.1001-1978.2019.02.014 |
| [16] |
Bottini N, Firestein G S. Duality of fibroblast-like synoviocytes in RA: Passive responders and imprinted aggressors[J]. Nat Rev Rheumatol, 2013, 9(1): 24-33. doi:10.1038/nrrheum.2012.190 |
| [17] |
刘涛, 李晶, 鲍翠玉. 基于PERK/ATF4/CHOP通路探讨普伐他汀对棕榈酸诱导心肌细胞损伤的影响[J]. 中国药理学通报, 2021, 37(8): 1183-4. Liu T, Li J, Bao C Y. Effect of pravastatin on injury of cardiomyocyte in-duced by palmitic acid based on PERK/ATF4/CHOP signaling pathway[J]. Chin Pharmacol Bull, 2021, 37(8): 1183-4. doi:10.3969/j.issn.1001-1978.2021.08.026 |
| [18] |
Liu K, Chen Y, Ai F, et al. PHLDA3 inhibition attenuates endoplasmic reticulum stress-induced apoptosis in myocardial hypoxia/reoxygenation injury by activating the PI3K/AKT signaling pathway[J]. Exp Ther Med, 2021, 21(6): 613. doi:10.3892/etm.2021.10045 |