

2. 成都中医药大学药学院,四川 成都 610075
2. School of Pharmacy, Chengdu University of TCM, Chengdu 610075, China
四氢姜黄素(tetrahydrocurcuminoids,THC)由姜黄素氢化而来,是姜黄的主要代谢产物之一。研究表明四氢姜黄素具有抗氧化、抗炎、抗肿瘤、增强胰岛细胞功能、抗动脉粥样硬化等药理活性[1-2]。氧化应激源于英国学者Harmna提出的自由基衰老学说,认为衰老是由于体内自由基的攻击致使组织细胞损伤[3]。近年来研究表明,自由基所致氧化损伤与许多疾病具有密切的关系,如心脑血管疾病、代谢性疾病、炎症性疾病、神经系统疾病等[4]。自由基(free radical,FR)是一类具有高化学活性的非偶电子的基团或原子,人体细胞代谢过程中有2%的氧转化为自由基。过量的自由基会造成细胞氧化损伤,从而引发各类型疾病。在自由基堆积的老化过程中,血液中的抗氧化酶系:谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-px)、超氧化物歧化酶(superoxide dismutase,SOD)、乳酸盐脱氢酶(lactate dehydrogenase,LDH)含量随之变化,进而导致器官功能衰退。近年来,抗氧化药物的研发也因之兴起。研究表明,中药或天然药物中的黄酮类、多酚类、多糖、生物碱等有效成分均表现出良好的抗氧化活性[5]。抗氧化也是皮肤美白的主要机制之一[6]。B16F10黑色素瘤细胞与人体黑色素细胞的生理差异小,能够多次传代,且培养条件低、生长速度快[7],另外,B16F10黑色素瘤细胞的基本结构,特别是黑色素合成功能与人正常的黑色素细胞基本一致,在人体原代皮肤黑色素细胞培养非常困难的情况下,常被作为筛选美白剂功效的首选受试细胞[8]。本文开展THC抗氧化作用评价、抑制黑色素生成及其机制研究,为THC在抗氧化及皮肤美白抗衰领域的应用提供参考依据。
1 材料与方法 1.1 材料 1.1.1 细胞小鼠黑色素瘤细胞B16F10(广州赛库生物有限公司,货号:CC9016);人类永生化表皮细胞HaCaT(广州赛库生物有限公司,货号:CC4013)。
1.1.2 药物与试剂四氢姜黄素(四川省中医药科学院药学研究所,批号:20190610,纯度>98%),DMEM培养基(赛默飞,批号:8119074),胎牛血清(呼和浩特市草原绿野生物工程材料有限公司,批号:181108),胰蛋白酶(济南科赛特科技有限公司,批号:25200-056),熊果苷(天津阿尔塔试剂有限公司,批号:FS1602275),L-多巴(美国Sigma,批号:SLBP0312V),TritonX-100(美国Sigma,批号:WXBC3534V),CCK-8试剂盒(上海皓元生物医药科技有限公司,批号:HY-K0301),Anti-MITF(abcam生物公司,货号:ab140606),β-actin抗体(abclonal公司,货号:AC026),生物素化山羊抗兔IgG(H+L)(英国abcam,货号:ab6721),人超氧化物歧化酶SOD酶联免疫分析试剂盒(上海bioswamp公司,批号:20190327),人乳酸脱氢酶LDH酶联免疫分析试剂盒(上海bioswamp公司,批号:20190421),人谷胱甘肽-过氧化物酶GSH-PX酶联免疫分析试剂盒(上海bioswamp公司,批号:20190315),维生素C标准品(天津阿尔塔科技有限公司,批号:FS1602275),T-AOC总抗氧化能力检测试剂盒(索莱宝生化试剂盒事业部,批号:20190327),DPPH(上海麦克林生化科技有限公司,批号:C10272194),无水乙醇(成都长联化工试剂有限公司,批号:20171218)。
1.1.3 仪器Varioskan Flash全波长多功能酶标仪(美国Thermo),二氧化碳培养箱(美国Thermo),ALLEGRA X-15R超速离心机(Beckman CoμLter),SW-CJ-2F双人双面净化工作台(苏州净化设备有限公司),DMIL倒置显微镜(德国徕卡),FA1204B电子天平(上海精科),Image-Pro Plus 6.0图像分析软件(美国Media Cybernetics公司),MV-2401PC紫外分光光度计(岛津实验器材有限公司)。
1.2 方法 1.2.1 抗氧化作用 1.2.1.1 对HaCaT细胞增殖活性的影响收集对数生长期细胞,调整细胞密度为6×108 L-1,将细胞接种于96孔板中,每孔100 μL,设置空白对照组及不同浓度给药组。置于37 ℃、5% CO2饱和湿度培养箱中培养,使细胞贴壁。24 h后,弃去培养液,用PBS洗涤,给药组分别加入浓度为12、25、50、100、200 μmol·L-1含THC培养基100 μL,对照组加入空白培养基,每组设置5个复孔,于37 ℃、5% CO2饱和湿度环境下孵育24 h,CCK-8试剂检测细胞增殖率/%=(药物处理组A450-空白孔A450)/(对照组A450-空白孔A450)×100%。
1.2.1.2 SOD、LDH、GSH-PX活性测定按照“1.2.1.1”项下操作方法将细胞种于96孔板,实验组分别加入浓度为25、50、100、200 μmol·L-1的THC培养基,对照组加入100 μmol·L-1的维生素C培养基。24 h后收集细胞上清,按照试剂盒说明检测SOD、LDH、GSH-PX含量。
1.2.1.3 DPPH自由基清除率测定配制0.1 mmol·L-1 DPPH无水乙醇溶液,避光保存,现配现用。将THC溶液依次稀释10、50、80、100、200、400、800、1 600倍,使其将样品液与DPPH溶液以1 ∶ 5的比例充分混合均匀,室温下反应30 min后,于517 nm处测定吸光度值。
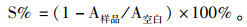
|
分别配制浓度为5、10、15、20、25 μmol·L-1的THC乙醇溶液及维生素C溶液作为供试品。按照T-AOC试剂盒说明书操作,测定593 nm处吸光度值。
总抗氧化能力(kU·L-1)=X×V反总÷V样=34×X,其中V反总为反应总体积,V样为反应中样品体积,X为测得的吸光度值。
1.2.2 对黑色素生成的影响 1.2.2.1 对B16F10细胞增殖的影响将B16F10细胞接种于含有10%胎牛血清的DMEM培养基中,置于37 ℃、5% CO2饱和湿度环境下培养。收集对数生长期细胞,调整细胞密度为6×108 L-1,将细胞接种于96孔板中,每孔100 μL。置于相同条件下培养24 h后,弃去培养液,用PBS洗涤,每组分别加入浓度为10、20、40、80、160 μmol·L-1的THC培养基100 μL,对照组加入空白培养基,每组设置5个复孔,于37 ℃、5% CO2饱和湿度环境下继续培养24 h。计算细胞增殖抑制率。
细胞增殖抑制率/%=1-[(药物处理组A450-空白孔A450)/(对照组A450-空白孔A450)]×100%。
1.2.2.2 黑色素含量测定消化并收集对数生长期细胞,调整细胞密度为1×109 L-1接种于6孔板中,每孔2 mL,置于37 ℃、5% CO2饱和湿度培养箱中培养。24 h后弃去上清,用PBS冲洗1次,每孔分别加入2 mL浓度为0、25、50、100、200 μmol·L-1的THC培养基和200 μmol·L-1熊果苷培养基(阳性对照),每个浓度设置5个复孔,在相同条件下继续培养。24 h后弃上清液,用PBS洗涤,胰蛋白酶消化后收集细胞于离心管中,1 200 r·min-1离心3 min,弃上清加入1 mL含10% DMSO的1 mol·L-1 NaOH溶液,于80 ℃水浴中孵育1 h,分别移入96孔板,用酶标仪于405 nm处测定吸光度值并计算黑色素含量/%=(试验孔A405-空白孔A405)/(对照孔A405-空白孔A405)×100%
1.2.2.3 酪氨酸酶活性测定按照“1.2.2.1”方法将对数生长期的B16F10细胞接种于96孔板,24 h后弃去培养基,分别加入浓度为0、25、50、100、200 μmol·L-1的THC培养基和200 μmol·L-1熊果苷培养基(阳性对照),每组设置5个复孔。24 h后取出,PBS洗涤2次,每孔加1% TritonX-100溶液100 μL,迅速放入-80 ℃冰箱冻存1 h后室温裂解细胞,37 ℃预温后每孔加入浓度为0.1%的L-DOPA 100 μL,置于37 ℃水浴2 h,酶标仪检测490 nm处的吸光度值,计算细胞内酪氨酸酶活性/%=[(药物处理组A490-空白孔A490)/(正常组A490-空白孔A490)]×100%。
1.2.3 抑制黑色素生成机制研究 1.2.3.1 细胞划痕实验消化并收集对数生长期的细胞,调整细胞密度为1×109L-1接种于6孔板中,每孔2 mL,置于培养箱中培养过夜。待细胞汇合度接近100%时,用10 μL枪头在每孔中央划痕,加入含不同浓度含药培养基(THC:0、25、50、100、200 μmol·L-1)处理细胞,分别于0、24、48 h在倒置显微镜下观察并拍照。
1.2.3.2 蛋白质印迹检测将B16F10细胞接种于培养皿,细胞贴壁后分别给予浓度为0、25、50、100 μmol·L-1的含THC培养基。48 h后收集细胞于15 mL离心管中,加入RIPA裂解液置碎冰上裂解10 min;收集裂解液,4 ℃、12 000 r·min-1离心10 min后取上清液;加足量电泳缓冲液上样、电泳,转膜后封闭1 h,孵育抗体。一抗(mitf 1 ∶ 1 000、β-actin 1 ∶ 100 000)4 ℃孵育过夜,用TBST将PVDF膜洗3次,每次5 min;二抗(稀释1 ∶ 5 000)室温孵育2 h,用TBST将PVDF膜洗3次,每次15 min;将PVDF膜平铺到曝光板上,加发光液曝光显影并成像。
1.2.4 统计学分析采用SPSS 21.0软件进行数据分析。所有数据用x±s表示,如符合正态分布,进行单因素方差分析,否则进行K-W非参数检验;单因素方差分析时,如方差齐性,采用LSD检验,如方差不齐,采用Tamhane′s T2检验。
2 结果 2.1 抗氧化作用评价 2.1.1 对HaCaT细胞增殖活性的影响由Tab 1可见,12 μmol·L-1 THC能促进HaCaT细胞增殖,与空白对照组比较,差异有统计学意义(P < 0.05);200 μmol·L-1 THC能抑制HaCaT细胞的增殖,与空白对照组比较差异有统计学意义(P < 0.05)。提示后续试验选择对细胞增殖无影响的药物浓度25、50、100 μmol·L-1进行实验。
| Concentration of THC/μmol·L-1 | 0 | 12 | 25 | 50 | 100 | 200 |
| Proliferation rate/% | 99.94±0.35 | 118.90±1.33* | 100.51±3.01 | 97.85±6.10 | 98.49±5.40 | 81.94±1.12* |
| *P < 0.05 vs control | ||||||
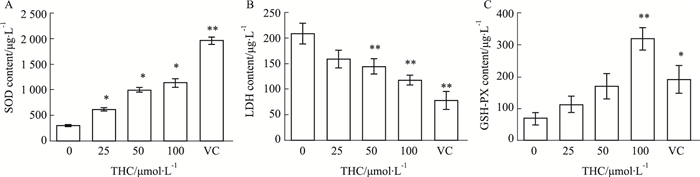
由Fig 1可见,不同浓度的THC(25、50、100 μmol·L-1)处理HaCaT细胞后,细胞中的SOD水平分别由298.33 μg·L-1增加至615.00、988.33、1 130.00 μg·L-1;LDH水平由207.83 μg·L-1降低至157.83、144.50、117.83 μg·L-1;GSH-PX水平由19.25 mU·L-1增至25.46、41.94、34.70 mU·L-1,且浓度为100 μmol·L-1时,活性增加优于同浓度维生素C。由此,在所试剂量范围内THC可增加HaCaT细胞SOD水平、降低LDH水平、增加GSH-PX水平,与空白对照组比较差异有统计学意义(P < 0.05或P < 0.01)。
|
| Fig 1 Effect of THC on SOD, LDH, GSH-PX activity of HaCaT cells *P < 0.05, **P < 0.01 vs control |
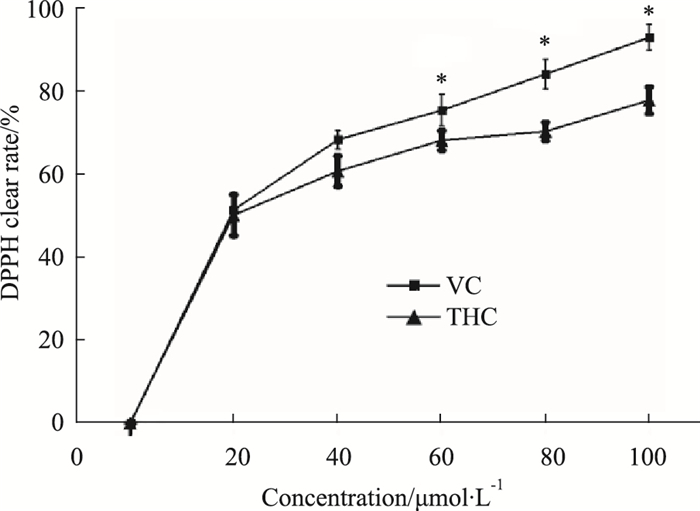
由Fig 2可见,THC对DPPH自由基具有一定的清除能力,表现出抗氧化能力。在所试浓度范围内,清除率随THC浓度的增加而增强。
|
| Fig 2 DPPH radical scavenging capacity of THC (x±s, n=3) *P < 0.05 vs control |
如Tab 2所示,THC对Fe3+的还原能力随浓度增加而增强,当浓度达到10 μmol·L-1时,对Fe3+还原能力THC大于同浓度的维生素C,差异有统计学意义(P < 0.05)。
| Concentration/μmol·L-1 | 5 | 10 | 15 | 20 | 25 |
| THC | 0.12±0.01 | 0.23±0.01* | 0.30±0.03* | 0.37±0.05* | 0.52±0.06* |
| VC | 0.10±0.02 | 0.17±0.02 | 0.20±0.02 | 0.26±0.05 | 0.29±0.05 |
| *P < 0.05 vs control | |||||
如Tab 3可见,在所试剂量范围内THC可有效抑制小鼠B16F10细胞增殖,与空白对照组比较差异有统计学意义(P < 0.01)。
| Concentration of THC/μmol·L-1 | 0 | 10 | 20 | 40 | 80 | 160 |
| Inhibitory rate/% | 0.08±4.27 | 20.93±0.39** | 18.27±2.08** | 22.53±2.98** | 27.99±4.95** | 50.48±2.47** |
| *P < 0.05 vs control | ||||||
由Fig 3可见,在所试剂量范围内THC可降低B16F10细胞内黑色素含量,当给予细胞相应浓度(25、50、100、200 μmol·L-1)的THC后,黑色素含量由100%分别降至74.34%、80.14%、34.37%、21.40%,与空白对照组比较差异有统计学意义(P < 0.05或P < 0.01)。

|
| Fig 3 Effects of THC on content of melanin in B16F10 cells *P < 0.05, **P < 0.01 vs control |
由Fig 4可见,THC 100、200 μmol·L-1剂量组可降低B16F10细胞内酪氨酸酶活性,当给予细胞相应浓度(100、200 μmol·L-1)的THC后,细胞内酪氨酸酶活性分别降至84.51%、83.38%,与空白对照组比较差异有统计学意义(P < 0.05)。

|
| Fig 4 Effects of THC on tyrosinase activity in B16F10 cells *P < 0.05 vs control |
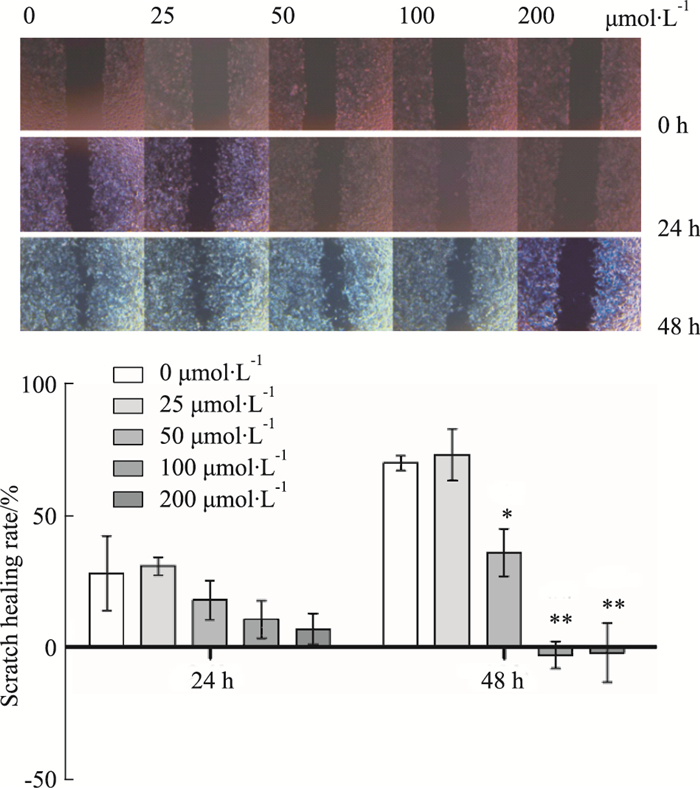
由Fig 5可知,给药48 h后,THC 50、100、200 μmol·L-1剂量组B16F10细胞迁移受到抑制,划痕愈合率显著降低(P < 0.05或P < 0.01)。
|
| Fig 5 Cell migration changes in scratch test (x±s, n=3) *P < 0.05, **P < 0.01 vs control |
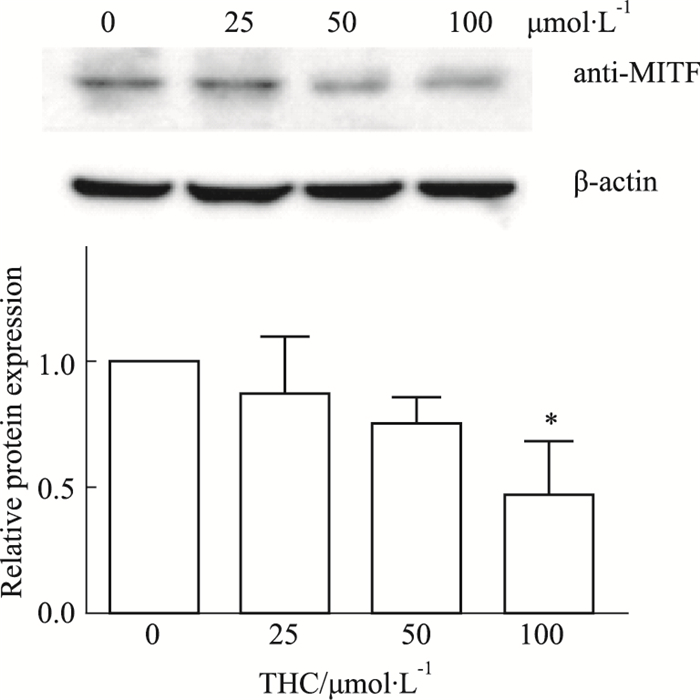
由Fig 6可知,在予以THC处理后,细胞内的MITF蛋白表达整体有下调趋势。可见,四氢姜黄素的抑制黑色素生成的作用可能与抑制MITF蛋白的表达有关。
|
| Fig 6 Expression of MITF protein in cells (x±s, n=3) *P < 0.05 vs control |
影响人体皮肤颜色的因素除皮肤生理学特点之外,主要取决于黑色素的含量及分布。黑色素合成主要涉及酪氨酸酶基因家族中的3种酶,即酪氨酸酶(tyrosinase,TYR)、酪氨酸酶相关蛋白1(tyrosinase-related protein-1,TRP-1)、酪氨酸酶相关蛋白2(tyrosinase-related protein-2,TRP-2),这3种酶都是与膜结合的糖蛋白,其中酪氨酸酶是该反应的关键酶[9]。皮肤黑化、雀斑、褐斑和老年斑的出现,都与体内酪氨酸酶的活性增高密切相关[10]。酪氨酸酶(EC 1.14.18.1)广泛存在于动植物、微生物体内,酪氨酸酶活性的过度增强,是导致黑色素异常积累的主要原因[6]。黑色素合成主要包括两个阶段,第一阶段:酪氨酸在酪氨酸酶的催化作用下生成L-二羟基苯丙氨酸多巴,并在酪氨酸酶作用下进一步生成多巴醌(dopamine quinone,DQ),或者酪氨酸酶催化酪氨酸直接氧化生成DQ。该阶段的反应是黑色素合成的关键步骤。多巴醌作为黑色素合成底物进入第二阶段反应。第二阶段又分为3部分,当半胱氨酸或谷胱甘肽存在时,多巴醌与其反应生成半胱氨酰多巴或谷胱甘肽多巴,之后进一步氧化聚合生成褐黑素;当二者不存在时,多巴醌自身环化形成多巴色素,若多巴色素自发脱羧,形成5,6-二羟基吲哚,在酪氨酸酶作用下进一步氧化聚合生成黑色素[9, 11]。
同时,抗氧化物质的参与也能在一定程度上减缓黑色素产生的进程。黑色素的生成是一个氧依赖的过程,包括一系列氧化反应,并伴随着O2-和H2O2的生成。在真黑素形成的最后阶段,H2O2的生成与真黑素前体5,6-二羟基吲哚和5,6-二羟基吲哚-2-羧酸的氧化有关。同时,在黑色素生成过程中检测到活性氧(reactive oxygen species,ROS)水平升高和细胞内谷胱甘肽浓度降低,这使黑色素生成成为色素细胞中ROS的潜在来源,进而使黑色素细胞遭受高水平的氧化应激。另一方面,ROS刺激/调节黑色素生成,低水平的H2O2(≤0.3 mmol·L-1)会激活酪氨酸酶,增加人黑素细胞中黑色素的合成。抗氧化防御系统通过抑制ROS、防止氧化应激、过度黑色素生成在维持黑色素细胞最佳氧化还原平衡中发挥重要作用[11]。1,1-二苯基苦基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)是一种很稳定的以氮为中心的自由基,通过检测生物试剂对DPPH自由基的清除能力可以表示其抗氧化能力的强弱[12]。若受试物能清除它,则说明它具有降低羟基等自由基和打断脂质过氧化链反应的作用。生物体内存在着有效的抗氧化防御系统,可清除环境胁迫下机体内产生的ROS及其代谢产物。总抗氧化能力(T-AOC)代表体内酶类和非酶类抗氧化物的总体水平,是反映机体抗氧化作用的重要指标。机体防御体系中T-AOC的作用主要是维持内环境活性氧的动态平衡,清除过高的ROS,使机体处于氧化还原相对稳定的状态[13]。T-AOC能够克服分析机体某种抗氧化成分,从而难以准确反映生物体实际抗氧化应激能力的局限性。
本实验以THC为研究对象,采用人类永生化表皮细胞(HaCaT细胞)和小鼠黑色素瘤细胞B16F10,评价其抗氧化、抑制黑色素生成及其机制研究。结果表明,THC可清除DPPH自由基和增加对Fe3+的还原能力,在25、50、100 μmol·L-1浓度作用下,可增加HaCaT细胞内的SOD、GSH-PX水平,降低LDH含量,结果提示THC具有抗氧化活性。同时,THC可抑制B16F10细胞的增殖和迁移,减少B16F10细胞内的黑色素含量、降低酪氨酸酶活性,具有抑制黑色素生成的作用。有研究报道,MITF基因表达产物是黑色素细胞最重要的转录因子,在黑色素细胞的色素产生、分化和存活中发挥着重要的作用,在黑色素生成过程中,MITF可调控TRPs家族的表达,参与黑色素的生成[14-15]。由此,在作用机制研究中,开展THC对MITF蛋白表达的影响,结果表明THC可降低B16F10细胞内MITF基因表达,提示THC抑制黑色素生成可能通过降低MITF基因表达实现的。综上,THC作为一种天然功能性化合物,已有研究表明其具有美白、抗氧化、抗炎、抗肿瘤等多种药理活性,本研究结果为THC在美白、抗氧化产品中的应用提供了有力的实验依据。
| [1] |
Zhu J, Sanidad K Z, Sukamtoh E, et al. Potential roles of chemical degradation in the biological activities of curcumin[J]. Food Funct, 2017, 8(3): 907-14. doi:10.1039/C6FO01770C |
| [2] |
孙林林, 乔利, 田振华, 等. 姜黄化学成分及药理作用研究进展[J]. 山东中医药大学学报, 2019, 43(2): 207-12. Sun L, Qiao L, Tian Z H, et al. Research progress on chemical constituents and pharmacological effects of turmeric[J]. J Shandong Univ Tradit Chin Med, 2019, 43(2): 207-12. |
| [3] |
沈云辉, 陈长勋. 抗氧化应激研究进展[J]. 中成药, 2019, 41(11): 2715-19. Shen Y H, Chen C X. Research progress in the study of anti-oxidative stress[J]. Chin Ttradit Pat Med, 2019, 41(11): 2715-19. doi:10.3969/j.issn.1001-1528.2019.11.031 |
| [4] |
Ahmed E, Imran M, Malik A, et al. Antioxidant activity with flavonoidal constituents from Aerva persica[J]. Arch Pharm Res, 2009(26): 343-7. |
| [5] |
梁璐, 蔡晓彤, 岑慧裕, 等. 甘木通活性化合物的抗氧化活性及对H2O2诱导的H9C2心肌细胞损伤的保护作用[J]. 中国药理学通报, 2021, 37(11): 1530-5. Liang L, Cai X T, Cen H Y, et al. Antioxidant activities of 10 active compounds from Clematis filamentosa Dunn.and their protective effects on H2O2 induced oxidative stressinjury in H9C2 cardiomyocytes[J]. Chin Pharmacol Bull, 2021, 37(11): 1530-5. doi:10.3969/j.issn.1001-1978.2021.11.010 |
| [6] |
冯法晴, 刘有停, 董银卯. 化妆品美白剂作用机制研究进展[J]. 香料香精化妆品, 2019(6): 71-7. Feng F Q, Liu Y T, Dong Y M. Research progress on the mechanism of cosmetic whitening agent[J]. Flavour Fragrance Cosmet, 2019(06): 71-7. |
| [7] |
郭立群, 王敏. 化妆品功效评价(Ⅵ)——细胞生物学在化妆品功效评价中的应用[J]. 日用化学工业, 2018, 48(7): 371-7. Guo L Q, Wang M. Evaluation of cosmetic efficacy (ⅵ)--Application of cell biology in cosmetic efficacy evaluation[J]. China Surfactant Deterg Cosmet, 2018, 48(7): 371-7. |
| [8] |
陶丽莉, 刘洋, 吴金昊, 等. 化妆品美白功效评价方法研究进展[J]. 日用化学品科学, 2015, 38(3): 15-21. Tao L L, Liu Y, Wu J H, et al. Research progress of cosmetic whitening efficacy evaluation method[J]. Deterg Cosmet, 2015, 38(3): 15-21. |
| [9] |
赵美娟, 户晶晶, 倪辉, 等. 黑色素生成信号通路研究进展[J]. 生物工程学报, 2019, 35(9): 1633-42. Zhao M J, Hu J J, Ni H, et al. Research progress of melanin production signaling pathway[J]. Chin J Biotechnol, 2019, 35(9): 1633-42. |
| [10] |
刘玉荣, 曹雅菲, 雒洋洋, 等. 丁香精油对黑色素细胞抗氧化特性及黑色素生成的影响[J]. 黑龙江医药科学, 2021, 44(1): 48-9, 52. Liu Y R, Cao Y F, Luo Y Y, et al. Effects of clove essential oil on antioxidant properties and melanin production of melanocytes[J]. Heilongjiang Med Pharm, 2021, 44(1): 48-9, 52. doi:10.3969/j.issn.1008-0104.2021.01.020 |
| [11] |
Lu Y, Tonissen K F, Trapani G D. Modulating skin colour: role of the thioredoxin and glutathione systems in regulating melanogenesis[J]. Biosci Rep, 2021, 41(5): BSR20210427. doi:10.1042/BSR20210427 |
| [12] |
陈两绵, 邹芳艳, 刘晓谦, 等. 3种检测方法比较忍冬药用和非药用部位的抗氧化活性[J]. 世界中医药, 2021, 16(17): 2513-9, 26. Chen L M, Zou F Y, Liu X Q, et al. Comparison of antioxidant activities of medicinal and non-medicinal parts of Lonicera japonica by three detection methods[J]. World Chin Med, 2021, 16(17): 2513-9, 26. doi:10.3969/j.issn.1673-7202.2021.17.001 |
| [13] |
宋怀恩, 闻韧. 抗氧化剂筛选方法的研究进展[J]. 中国药物化学杂志, 2003, 13(2): 63-8. Song H E, Wen R. Research progress of screening methods for antioxidant[J]. Chin J Med Chem, 2003, 13(2): 63-8. |
| [14] |
邓云云, 王笑月, 李才广, 等. 珍珠水解液的美白作用机理研究[J]. 中国现代中药, 2017, 19(7): 992-4, 1006. Deng Y Y, Wang X Y, Li C G, et al. Study on whitening mechanism of pearl hydrolysate[J]. Mod Chin Med, 2017, 19(7): 992-4, 1006. |
| [15] |
Yun C Y, Roh E, Kim S H, et al. Stem cell factor-inducible MITF-M expression in therapeutics for acquired skin hyperpigmentation[J]. Theranostics, 2020, 10(1): 340-52. doi:10.7150/thno.39066 |

