


2. 蚌埠医学院药学院/安徽省生化药物工程技术研究中心,安徽 蚌埠 233030;
3. 广州欢网科技有限责任公司,北京 100021
何旨意(1996-),女,硕士生,研究方向:消化系统肿瘤与炎症性肠病,E-mail:397869148@qq.com。
2. School of Pharmacy, Bengbu Medical College/Anhui Biochemical Drug Engineering Technology Research Center, Bengbu Anhui 233030, China;
3. Guangzhou Huanwang Science and Technology Co., Ltd, Beijing 100021, China
结直肠癌(colorectal cancer,CRC)是一种发病率高、死亡率高的常见恶性肿瘤,是全球最紧迫的健康问题之一。根据GLOBOCAN 2020年全球发病率和死亡率估计报告,大肠癌是全球第三大确诊癌症和第二大癌症相关死亡原因[1]。目前治疗结直肠癌的方法包括手术、放疗、化疗、免疫治疗和生物靶向治疗[2]。然而,大多数癌症患者最终还是会复发并产生抗药性[3]。因此,迫切需要寻找既能提高抗癌药物的药效,又能克服多药耐药和毒副作用的有效化疗增敏剂。
紫草素(shikonin, Shi)是从紫草根中提取的一种化合物[4]。研究表明,Shi已在多种人类癌症中显示出抗肿瘤活性,例如神经胶质瘤[5]、黑色素瘤[6]、乳腺癌[7]、肝细胞癌[8]等。研究发现[9],Erastin(Era)对结直肠癌细胞具有明显的细胞毒作用,进一步研究发现,Era减轻了结直肠癌细胞对化疗药物的耐药性。最近,联合化疗被发现是一种更好的治疗策略[10],既能提高抗癌药物的疗效,又能克服多药耐药并减轻毒副作用。Shi单独或与其他药物联合使用导致细胞死亡的机制,需要进一步研究。本研究主要探讨铁死亡诱导剂Era与Shi联合应用对结直肠癌细胞SW480和SW620抗肿瘤活性的影响并分析其可能作用机制,以期为结直肠癌的治疗提供一种很有前途的策略。
1 材料与方法 1.1 材料人结直肠癌细胞株SW480(CL-0223)、SW620(CL-0225)购于武汉普诺赛生命科技有限公司。DMEM高糖培养基(C11995500BT)购于Gibco,胎牛血清(fetal bovine serum, FBS)(FSP500)购于ExCell Bio。紫草素(HY-N0822)和Erastin(HY-15763)均购自MCE公司。胰酶细胞消化液(BL501A)购于biosharp,CCK-8(K1018)、Annexin-V /PI双染试剂盒(BB-4103-100T)购于贝博公司;乳酸检测试剂盒(A019-2-1)购自南京建成;Bax(50599-2-Ig)、Bcl-2(12789-1-AP)、PARP1(13371-1-AP)、caspase 3(19677-1-AP)、caspase 8(13423-1-AP)、AKT(10176-2-AP)、山羊抗兔IgG(SA00001-2)和β-actin(66009-1-Ig)均购自Proteintech,p-AKT(4060S)购自CST公司。
1.2 方法 1.2.1 细胞培养人结直肠癌细胞SW480,SW620培养于含10%热灭活胎牛血清、1%青霉素-链霉素高糖DMEM培养基中,在37 ℃、含5% CO2的加湿、恒温培养箱中常规培养。
1.2.2 CCK-8检测细胞存活率将对数生长期的SW480、SW620细胞接种于96孔板,8×103/孔,放置于37 ℃、5%的CO2培养箱中培养,2 h后弃去孔中培养液,加入含有不同浓度(0、10、20、40、80、100 μmol·L-1)Era和(SW480:0、1、2、4、8、16 μmol·L-1;SW620:0、0.2、0.4、0.8、1.6、3.2 μmol·L-1)Shi的DMEM培养液,并设置空白组,每组3个复孔。之后置于培养箱,分别培养24 h和48 h,每孔加入10 μL CCK-8试剂,继续孵育2 h,用酶标仪于450 nm处检测吸光度,实验重复3次。根据药物剂量效应曲线分别计算出Era和Shi的半数抑制浓度(IC50)。再选用浓度低于IC50的Era与不同浓度(SW480:0、1、2、4、8、16 μmol·L-1;SW620:0, 0.2、0.4、0.8、1.6、3.2 μmol·L-1)的Shi联合作用于SW480和SW620细胞24 h,观察单用Shi以及Shi与Era联合应用对SW480、SW620细胞活力的影响。
1.2.3 Erastin与紫草素的结合指数CI根据CCK-8检测结果使用CompuSyn软件计算结合指数CI。CI=1表示两药起到相加作用;CI < 1表示协同作用;CI>1表示拮抗作用。Era浓度为10 μmol·L-1,Shi浓度梯度分别为1、2、4和0.5、1、2 μmol·L-1作用于SW480和SW620。
1.2.4 倒置显微镜观察细胞形态变化将人结直肠癌细胞SW480和SW620接种于6孔板,2×105/孔,置于37 ℃,5% CO2培养箱中常规培养,24 h后弃去孔中培养液,细胞分为4组,含DMEM培养液的对照组,10 μmol·L-1 Era组,2 μmol·L-1 Shi(SW480)组(SW620:1 μmol·L-1 Shi)以及两者联合用药组,继续培养24 h后使用倒置显微镜拍照。
1.2.5 活性氧(reactive oxygen species,ROS)生成量的测定收集对数生长期的SW480、SW620细胞,按3×105/孔种于6孔板中,SW480细胞组加入浓度分别为0、10 μmol·L-1 Era、2 μmol·L-1 Shi以及两者合用组;SW620细胞组加入浓度分别为0、10 μmol·L-1 Era、1 μmol·L-1 Shi以及两者合用组。置于培养箱中24 h,弃去培养基,PBS清洗,将10 μmol·L-1的DCFH-DA以500 μL/孔加入6孔板中,放37 ℃培养箱中染色30 min,弃去染液,收集细胞,用流式细胞仪检测活细胞内ROS的生成量。
1.2.6 培养液中乳酸含量的测定对数生长期的SW480、SW620细胞,3×105/孔种于6孔板中,SW480细胞组分别加入浓度为0、10 μmol·L-1 Era、2 μmol·L-1 Shi以及两者合用组;SW620细胞组分别加入浓度为0、10 μmol·L-1 Era、1 μmol·L-1 shi以及两者合用组。置于培养箱中24 h,收集培养液,按照乳酸检测试剂盒说明书进行乳酸含量的测定。实验重复3次。
1.2.7 AnnexinV-Alexa Fluor 488/PI双染检测细胞凋亡将对数生长期的SW480、SW620细胞,按3×105/孔种于6孔板中,SW480细胞组分别加入浓度为0、10 μmol·L-1 Era、2 μmol·L-1 Shi以及两者合用组;SW620细胞组分别加入浓度为0、10 μmol·L-1 Era、1 μmol·L-1 Shi以及两者合用组。置于培养箱中24 h,收集培养液,PBS清洗,收集细胞。于冰上避光加入5 μL AnnexinV/PI染色15 min;然后加入10 μL PI染液,染色5 min。上机,用流式细胞仪检测药物对细胞凋亡的影响。实验重复3次。
1.2.8 Western blot检测Bax、Bcl-2、PARP1、caspase3、caspase8、AKT和p-AKT的表达结直肠癌细胞SW620接种于60 mm平皿而后置于培养箱培养48 h后,弃去培养液,更换为含有0、10 μmol·L-1 Era、1 μmol·L-1 shi以及两者合用组的DMEM培养液,置于培养箱中24 h,加入100 μL含有PMSF的裂解液,冰上裂解30 min,12 000 r·min-1 4 ℃离心30 min。取上清,BCA蛋白定量法计算出每组所需上样量。每组取60 μg蛋白进行电泳,之后蛋白转移至PVDF膜,洗膜1次,5 min。封闭30 min,洗膜3次,每次5 min。4 ℃敷一抗过夜。洗膜3次,每次5 min。室温摇床敷二抗1 h,洗膜3次,每次5 min。ECL试剂盒显影,凝胶成像系统采集图像。
1.2.9 统计学分析采用SPSS 21.0统计软件进行统计分析,实验数据均以x±s表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验。
2 结果 2.1 Erastin与Shikonin单用及联合应用对结直肠癌细胞增殖的影响人结直肠癌细胞SW480、SW620经药物作用并计算出IC50(24 h):SW480-Shi为1.98 μmol·L-1,SW480-Era为35.83 μmol·L-1,SW620-Shi为1.204 μmol·L-1,SW620-Era为22.24 μmol·L-1。Era和Shi联合应用对结直肠癌细胞的增殖抑制作用明显高于单用药组(Fig 1)。使用10 μmol·L-1 Era分别与不同浓度Shi(SW480:1、2、4 μmol·L-1;SW620:0.5、1、2 μmol·L-1)联合应用24 h,经CompuSyn软件计算出CI值(Tab 1),结果表明联合用药具有协同作用。
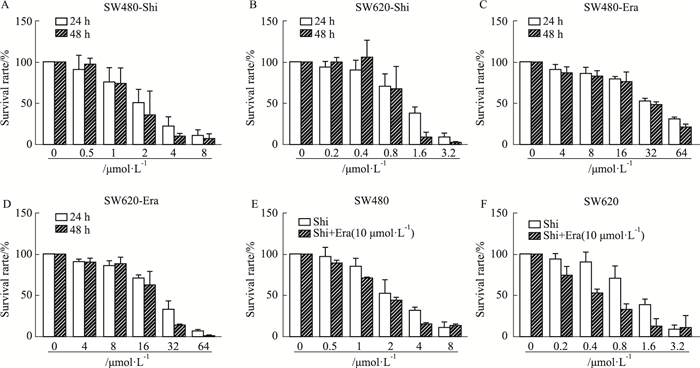
|
| Fig 1 Combination of Erastin and Shikonin exhibits synergistic anticancer effects A-D: Cells were treated with Erastin and Shikonin respectively for 24 h, 48 h. E and F: Erastin enhances shikonin-induced growth inhibition in colon cancer cells. |
| Combination therapy | SW480 | SW620 | |||
| E | S | CI | CI | ||
| 10 | 1(0.5) | 0.945 | 0.618 | ||
| 10 | 2(1) | 0.779 | 0.565 | ||
| 10 | 4(2) | 0.676 | 0.492 | ||
如Fig 2所示,10 μmol·L-1 Era处理组细胞形态和密度与对照组相比无明显差别,2 μmol·L-1和1 μmol·L-1 Shi处理组细胞密度减少,而联合用药组细胞形态与密度则有明显的改变。
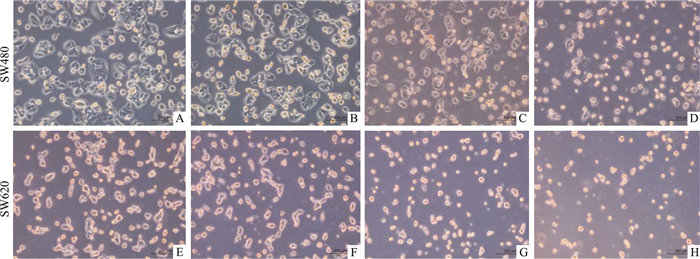
|
| Fig 2 The morphological changes of colorectal cancer cells A E: control. B F: Era. C G: Shi. D H: Era+Shi. |
如Fig 3所示,联合用药组中糖酵解的最终产物乳酸的产生比单用Shi组抑制作用更明显,差异具有统计学意义(P < 0.05)。
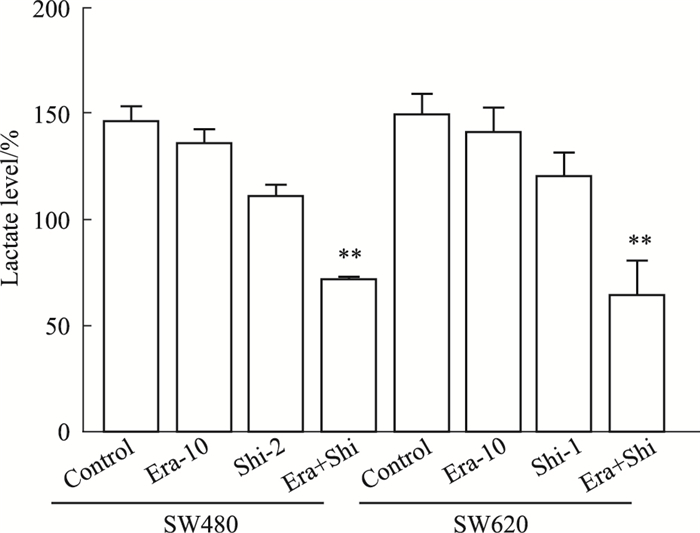
|
| Fig 3 Changes of lactate level **P < 0.01 vs Shi-2(Shi-1). |
如Fig 4所示,ROS检测结果表明,单独处理组ROS产生不明显,联合用药组ROS水平比Shi组明显升高(Fig 4A,B)。
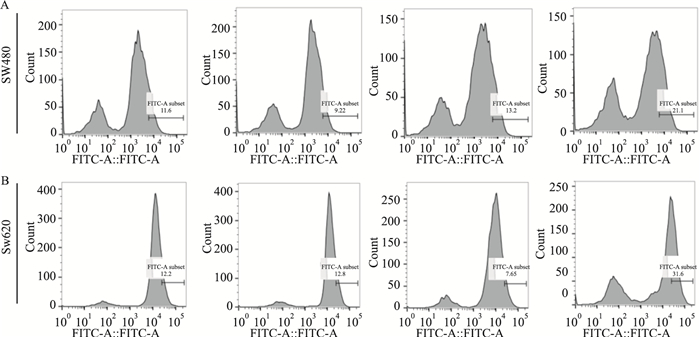
|
| Fig 4 Changes of ROS level A and B: Intracellular ROS generation were measured (E: Erastin, S: Shikonin). |
如Fig 5所示,为了进一步阐明联合作用抑制细胞生长的机制,我们用Annexin V/PI染色法检测了Shi和/或Era对结直肠癌细胞的促凋亡作用。如Fig 5A,B所示,与单独使用Era或Shi相比,联合治疗导致凋亡细胞比例明显增加。凋亡检测结果表明,联合用药组与Shi组相比差异有统计学意义(Fig 5C,D)。
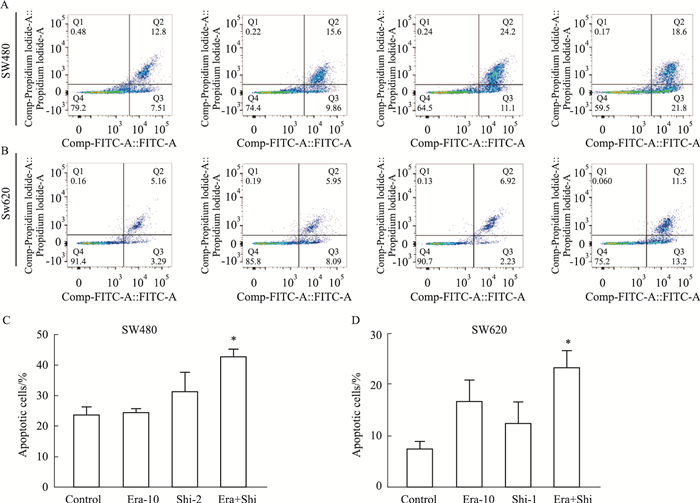
|
| Fig 5 Erastin enhances shikonin-induced cell apoptosis A and B: Erastin enhances Shikonin-induced apoptosis in SW480 and SW620 cells. C and D: The percentage of apoptotic cells. *P < 0.05 vs Shi-2(Shi-1). |
Fig 6A显示,10 μmol·L-1 Era和1 μmol·L-1 Shi两者合用组p-Akt明显低于单用Shi组。如Fig 6B显示,单用药组Bcl-2和Bax的表达没有明显变化,联合用药组可显著抑制Bcl-2的表达,上调Bax的表达。与流式细胞仪结果一致,Era处理明显增强Shi诱导的caspase 3和caspase 8的激活,进而Cleaved-caspase 3,Cleaved-caspase 8和Cleaved-parp1表达增加。PARP是caspase的底物,裂解的PARP被认为是细胞凋亡的重要标志。此研究结果表明铁死亡诱导剂Era与Shi联合应用可以促进凋亡相关蛋白的激活。

|
| Fig 6 The expression levels of related proteins in SW620 cells |
Shi是从中国草本植物紫草中分离出来的一种天然化合物,几千年来一直被用来治疗各种疾病[11]。Shi通过诱导细胞内氧化应激抑制恶性肿瘤细胞生长和诱导癌细胞凋亡[12]。研究表明[13],紫草提取物具有多种药理活性,包括抗炎、抗氧化应激、抗病毒、抗菌和抗癌。研究发现[14],Erastin和顺铂的联合应用具有协同作用,表明在结直肠癌中铁死亡增加了经典治疗药物和抗肿瘤机制所触发的另一种细胞死亡途径。在本研究中,Erastin和Shi联合用药的结果显示,Erastin能有效地增强Shi诱导的细胞凋亡,并显示出协同抑制结直肠癌细胞增殖的作用。也有研究表明[15],Erastin可能通过诱导氧化应激对结直肠癌细胞产生细胞毒性和促凋亡作用。
在肿瘤细胞中,Shi治疗通过抑制丙酮酸激酶M2(PKM2)的活性来抑制糖酵解,通过增加ROS的产生来诱导细胞凋亡[16]。我们的研究结果表明,联合用药组ROS含量明显高于Shi组。癌细胞中ROS的增加在癌症的发生和发展中起着至关重要的作用。本实验乳酸含量检测结果显示,合用组能显著抑制乳酸的产生。肿瘤细胞以高速率产生乳酸,乳酸是一种经常被忽视的碳源,但可以促进三羧酸循环(TCA)回补;循环乳酸也是调节氧化还原平衡的重要手段[17]。Akt信号通路在细胞中发挥重要作用,介导多种细胞机制,如增殖、存活、血管生成、自噬和凋亡。据报道,Akt级联信号通路有助于肿瘤细胞的发生、增殖、侵袭和发展。因此,Akt级联抑制可以避免肿瘤的发生。在本研究中,Erastin和Shi联合治疗可显著降低Bcl-2的表达,而增加Bax的表达。Bcl-2家族最终表达失衡导致结直肠癌细胞凋亡。
综上所述,Erastin作为Shi的增效剂,可能通过诱导细胞内氧化应激、抑制乳酸产生、抑制Akt通路,进而使促凋亡蛋白高表达,抗凋亡蛋白低表达来实现协同抗癌作用的一种高效途径。此研究结果证明ROS的产生可能是开发新的抗癌药物的一个很好的策略,因此,Erastin可能是一种很有前途的化疗增敏剂,可以作为以Shi为基础的癌症治疗药物,也可作为一种新型的抗结直肠癌药物,应在肠道疾病领域内进一步研究。
| [1] |
Sung H, Ferlay J, Siegel R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-49. doi:10.3322/caac.21660 |
| [2] |
Benson A B, Venook A P, Al-Hawary M M, et al. NCCN guidelines insights: Colon cancer, version 2.2018[J]. J Natl Compr Canc Netw, 2018, 16(4): 359-69. doi:10.6004/jnccn.2018.0021 |
| [3] |
Galluzzi L, Vitale I, Michels J, et al. Systems biology of cisplatin resistance: Past, present and future[J]. Cell Death Dis, 2014, 5: e1257. doi:10.1038/cddis.2013.428 |
| [4] |
廖媛, 李健春, 谭睿陟, 等. 紫草素通过Smad3/Erbb4-IR轴对肾脏纤维化的抑制作用研究[J]. 中国药理学通报, 2019, 35(12): 1699-704. Liao Y, Li J C, Tan R Z, et al. Protective effect of shikonin on renal fibrosis via Smad3/long-chain non-coding Erbb4-IR axis[J]. Chin Pharmacol Bull, 2019, 35(12): 1699-704. doi:10.3969/j.issn.1001-1978.2019.12.015 |
| [5] |
Guo N, Miao R, Gao X C, et al. Shikonin inhibits proliferation and induces apoptosis in glioma cells via downregulation of CD147[J]. Mol Med Rep, 2019, 19(5): 4335-43. |
| [6] |
Liu Y K, Kang X, Niu G, et al. Shikonin induces apoptosis and prosurvival autophagy in human melanoma A375 cells via ROS-mediated ER stress and p38 pathways[J]. Artif Cells Nanomed Biotechnol, 2019, 47(1): 626-35. doi:10.1080/21691401.2019.1575229 |
| [7] |
Xu J X, Koizumi K, Liu M X, et al. Shikonin induces an anti tumor effect on murine mammary cancer via p38 dependent apoptosis[J]. Oncol Rep, 2019, 41(3): 2020-6. |
| [8] |
Liu B, Jin J B, Zhang Z Y, et al. Shikonin exerts antitumor activity by causing mitochondrial dysfunction in hepatocellular carcinoma through PKM2-AMPK-PGC1α signaling pathway[J]. Biochem Cell Biol, 2019, 97(4): 397-405. doi:10.1139/bcb-2018-0310 |
| [9] |
Xu X T, Zhang X Y, Wei C Q, et al. Targeting SLC7A11 specifically suppresses the progression of colorectal cancer stem cells via inducing ferroptosis[J]. Eur J Pharm Sci, 2020, 152: 105450. doi:10.1016/j.ejps.2020.105450 |
| [10] |
Larkin J, Chiarion-Sileni V, Gonzalez R, et al. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma[J]. N Engl J Med, 2015, 373(1): 23-34. doi:10.1056/NEJMoa1504030 |
| [11] |
Chen X, Yang L, Oppenheim J J, et al. Cellular pharmacology studies of shikonin derivatives[J]. Phytother Res, 2002, 16(3): 199-209. doi:10.1002/ptr.1100 |
| [12] |
Mao X, Yu C R, Li W H, et al. Induction of apoptosis by shikonin through a ROS/JNK-mediated process in Bcr/Abl-positive chronic myelogenous leukemia (CML) cells[J]. Cell Res, 2008, 18(8): 879-88. doi:10.1038/cr.2008.86 |
| [13] |
Wang F F, Yao X S, Zhang Y W, et al. Synthesis, biological function and evaluation of Shikonin in cancer therapy[J]. Fitoterapia, 2019, 134: 329-39. doi:10.1016/j.fitote.2019.03.005 |
| [14] |
Guo J P, Xu B F, Han Q, et al. Ferroptosis: A novel anti-tumor action for cisplatin[J]. Cancer Res Treat, 2018, 50(2): 445-60. doi:10.4143/crt.2016.572 |
| [15] |
Huo H Z, Zhou Z Y, Qin J, et al. Erastin disrupts mitochondrial permeability transition pore (mPTP) and induces apoptotic death of colorectal cancer cells[J]. PLoS One, 2016, 11(5): e0154605. doi:10.1371/journal.pone.0154605 |
| [16] |
Yang W, Liu J H, Hou L, et al. Shikonin differentially regulates glucose metabolism via PKM2 and HIF1α to overcome apoptosis in a refractory HCC cell line[J]. Life Sci, 2021, 265: 118796. doi:10.1016/j.lfs.2020.118796 |
| [17] |
Tu V Y, Ayari A, O'Connor R S. Beyond the lactate paradox: How lactate and acidity impact T cell therapies against cancer[J]. Antibodies (Basel), 2021, 10(3): 25. doi:10.3390/antib10030025 |

