

2. 河南中医药大学第一附属医院脑病一区,河南 郑州 450000;
3. 河南中医药大学药学院,河南 郑州 450046
 ,
QIAO Zhan-ke1,
LIU Xiang-zhe2
,
QIAO Zhan-ke1,
LIU Xiang-zhe2
 ,
SUN Yong-kang1,
RAN Chun-long1,
BAI Chen1,
FANG Xiao-yan3
,
SUN Yong-kang1,
RAN Chun-long1,
BAI Chen1,
FANG Xiao-yan3
2. Neurology First Ward of The Fist Affiliated, The First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450000, China;
3. School of Pharmacy, Henan University of Chinese Medicine, Zhengzhou 450046, China
缺血性卒中(ischemic stroke,IS)是由高血压、糖尿病、高脂血症及体内高凝状态等多种危险因素导致脑血流量降低、脑部缺血缺氧引发神经功能缺损的一种疾病[1, 2]。根据中国2019年流行病学调查显示,缺血性卒中的发病率、患病率、复发率、死亡率逐年攀升,总体发病风险仍位居世界首位[3],这种持续上升的形势依然严峻。健脾补肾活血方(Jianpi Bushen Huoxue Prescription,JPBSHXP)由河南中医药大学第一附属医院脑病专家团队拟定,已在临床应用十余年。该方针对缺血性卒中本虚标实的基本病机,以健脾补肾,活血通络为治疗原则。方中黄芪、党参、白术健脾益气;牛膝、杜仲、桑寄生、肉苁蓉补肾固本;丹参,川芎活血通络;石菖蒲化痰开窍;炙甘草调和诸药。前期研究表明,JPBSHXP可提高缺血性卒中患者脑缺血区灌注水平,减轻神经功能缺损,改善中医证候、临床症状和体征,提高日常生活能力[4],但其作用机制尚不明确。网络药理学是从分子层次阐释中药方剂作用原理的有效方法,本文旨在应用网络药理学的分析方法,通过靶点的筛选、通路分析以及分子对接技术,为验证该方治疗IS的有效性提供合理依据,同时为此方进一步研究提供新的方向。
1 材料与方法 1.1 材料本文所需数据库及相关应用程序,如Tab 1。
| No. | Database | Website | No. | Software |
| 1 | TCMSP | http://lsp.nwu.edu.cn/tcmsp.php | 1 | Cytoscape3.8.0 |
| 2 | genecards | https://www.genecards.org | 2 | Chem 3D |
| 3 | OMIM | https://www.omim.org/ | 3 | AutoDock Tools 1.5.6 |
| 4 | DrugBank | https://www.ncbi.nlm.nih.gov/gene | 4 | Autodock vina 1.1.2 |
| 5 | TTD | http://db.idrblab.net/ttd/ | 5 | Discovery Studio 2020 |
| 6 | PharmGkb | https://www.pharmgkb.org/ | 6 | R x64 4.0.2 |
| 7 | uniprot | http://www.Unitprot.org/ | 7 | perl |
| 8 | String | https://string-db.org/ | 8 | Pymol |
| 9 | DAVID | https://david.ncifcrf.gov/ | ||
| 10 | pubchem | https://pubchem.ncbi.nlm.nih.gov/ | ||
| 11 | RCSB | http://www1.rcsb.org/ |
利用TCMSP中药系统药理数据库及分析平台检索健脾补肾活血方11味中药的有效活性成分及对应靶点信息,根据药代动力学参数吸收、分布、代谢和排泄(ADME)的原则,以口服生物利用度(oral bioavailability,OB)≥30%,类药性(Drug-like,DL)≥0.18为条件筛选潜在化合物,OB、DL越高,说明药物在体内发挥效能的作用越强[5]。使用Perl语言将11味中药整理合并,得到健脾补肾活血方的中药-活性成分-靶点的总体信息表。
1.2.2 收集疾病靶点及预测药物作用靶点通过Genecards、OMIM、DrugBank、TTD、PharmGkb五种疾病数据库,以“Ischemic stroke”为关键词,查找IS的疾病基因靶点,用R语言程序将其合并;Genecards数据库获取基因分值越高与疾病相关性越强,选择分值大于1与IS相关性高的靶点进行研究;在Uniprot平台将所有关于人的及被证实的基因下载,并通过perl语言将药物靶点转换为基因ID编码的形式;取药物和疾病的共同靶点并绘制venn图,预测药物靶点。
1.2.3 中药复方网络的构建设计perl语言程序对健脾补肾活血方与缺血性卒中相同靶点进行整理,应用Cytoscape 3.8.0软件构建JPBSHXP-活性成分-靶点和IS相互作用的调控信息网络图,应用拓扑插件计算介数中心性(betweenness centrality,BC),紧密中心性(closeness centrality,CC),度值(degree centrality,DC),特征向量中心性(eigenvector centrality,EC),局部平均连通度中心性(local average connectivity centrality,LAC),通过DC、BC筛选该方核心活性成分。
1.2.4 蛋白互作(PPI)网络的构建通过String平台构建PPI蛋白互作网络,将药物与疾病交集所得到的190个基因导入List Of Names,设置highest confidence为0.9,去除游离靶点后得到170个靶点,应用Cytoscape3.8.0进行PPI网络分析,拓扑参数取大于BC、CC、DC、EC、LAC的中位值得到核心靶点。
1.2.5 GO功能分析和KEGG信号通路富集分析应用David数据库进行GO分析及KEGG信号通路富集分析,根据P值提取前20名的生物学过程(biological process,BP)、细胞组成(cellular components,CC)、分子功能(molecular function,MF)及信号通路的数据,运用微生信在线制图进行气泡图的绘制。
1.2.6 分子对接使用分子对接技术研究JPBSHXP的活性成分与治疗IS的相关靶点。首先,从pubchem数据库下载化合物结构,保存为SDF格式,并通过Chem 3D软件将SDF格式转化为mol2格式,从RCSB数据库下载相关蛋白,使用Pymol软件去除溶剂分子与配体,使用AutoDock Tools 1.5.6软件计算电荷、加氢等。最后运行Autodock vina 1.1.2进行分子对接, 采用Discovery Studio 2020可视化分析对接构象。
2 结果 2.1 成分及靶点的筛选根据TCMSP得到JPBSHXP中药-活性成分-靶点(单位:个),其中黄芪-17个-462个、党参-17个-214个、白术-4个-23个、杜仲-26个-519个、桑寄生-2个-157个、怀牛膝-17个-444个、肉苁蓉-6个-223个、丹参-59个-932个、川芎-6个-42个、石菖蒲-4个-103个、甘草87个-1 761个。共有活性成分245个,靶点4 880个,剔重后取得该方有效成分201个,靶点263个。
2.2 疾病靶点及预测药物作用靶点通过R语言设计程序将疾病基因合并、剔除重复项并取唯一值,得到2 808个疾病靶点。药物靶点与疾病靶点相交集得到共同基因190个。(详见Fig 1)。
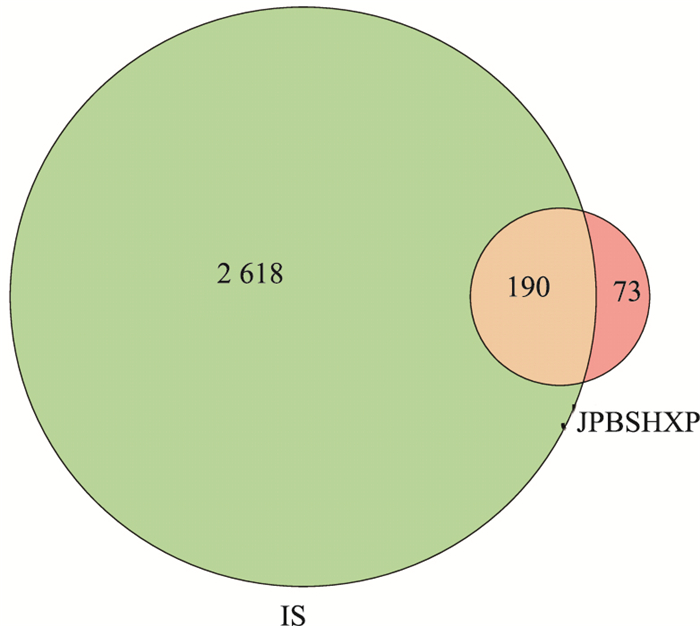
|
| 图 1 Venn diagram of drug-disease target intersection |
通过Sytoscape 3.8.0构建中药-活性成分-靶点-疾病网络图。Network Analyzer计算分析得到398个节点,2 118条边。拓扑研究显示健脾类药物主要化学成分槲皮素(quercetin)、山柰酚(kaempferol)、木犀草素(luteolin)等。其中槲皮素、山柰酚、豆甾醇为健脾类、补肾类共有活性成分,其余补肾类药物显著化学成分有汉黄芩素(wogonin)、β-谷甾醇(beta-sitosterol)等。活血类药物为丹参、川芎,研究显示发挥活血作用的药物为丹参,主要有丹参酮IIA(tanshinone iia)、隐丹参酮(cryptotanshinone)等化合物(Tab 2)。
| MolID | Source | Active ingredient | DC | BC | OB(%) | DL |
| MOL000098 | Mulberry Mistletoe、Radix Astragali、Eucommia Bark、Radix Achyranthis、Herba Cistanches、Liquorice Root | quercetin | 100 | 0.268 5 | 46.43 | 0.28 |
| MOL000006 | Radix Salviae Miltiorrhizae、Radix Codonopsis | luteolin | 43 | 0.067 0 | 36.16 | 0.25 |
| MOL000422 | Radix Astragali、Eucommia Bark、Rhizoma Acori Tatarinowii、Radix Achyranthis、Liquorice Root | kaempferol | 37 | 0.055 2 | 41.88 | 0.24 |
| MOL007154 | Radix Salviae Miltiorrhizae | tanshinone iia | 30 | 0.031 3 | 49.89 | 0.4 |
| MOL009031 | Eucommia Bark | Cinchonan-9-al, 6′-methoxy-, (9R)- | 29 | 0.016 6 | 68.22 | 0.4 |
| MOL004328 | Liquorice Root | naringenin | 29 | 0.089 1 | 59.29 | 0.21 |
| MOL000173 | Radix Achyranthis | wogonin | 29 | 0.030 1 | 30.68 | 0.23 |
| MOL000378 | Radix Astragali | 7-O-methylisomucronulatol | 28 | 0.007 4 | 74.69 | 0.3 |
| MOL009015 | Eucommia Bark | (-)-Tabernemontanine | 27 | 0.013 2 | 58.67 | 0.61 |
| MOL003896 | Radix Codonopsis、GanCao | 7-Methoxy-2-methyl isoflavone | 25 | 0.007 4 | 42.56 | 0.2 |
| MOL007049 | Radix Salviae Miltiorrhizae | 4-methylenemiltirone | 25 | 0.006 9 | 34.35 | 0.23 |
| MOL007088 | Radix Salviae Miltiorrhizae | cryptotanshinone | 25 | 0.017 4 | 52.34 | 0.4 |
| MOL000358 | Eucommia Bark、Radix Achyranthis、Herba Cistanches | beta-sitosterol | 25 | 0.021 9 | 36.91 | 0.75 |
| MOL007100 | Radix Salviae Miltiorrhizae | dihydrotanshinlactone | 23 | 0.003 6 | 38.68 | 0.32 |
| MOL007145 | Radix Salviae Miltiorrhizae | salviolone | 23 | 0.006 7 | 31.72 | 0.24 |
| MOL002565 | Liquorice Root | Medicarpin | 23 | 0.007 6 | 49.22 | 0.34 |
| MOL000449 | Radix Achyranthis、Radix Codonopsis | Stigmasterol | 22 | 0.024 9 | 43.83 | 0.76 |
| MOL007122 | Radix Salviae Miltiorrhizae | Miltirone | 22 | 0.005 1 | 38.76 | 0.25 |
| MOL007041 | Radix Salviae Miltiorrhizae | 2-isopropyl-8-methylphenanrene-3, 4-dione | 21 | 0.002 9 | 40.86 | 0.23 |
| MOL007108 | Radix Salviae Miltiorrhizae | isocryptotanshi-none | 21 | 0.003 4 | 54.98 | 0.39 |
| MOL007124 | Radix Salviae Miltiorrhizae | neocryptotanshinone ii | 21 | 0.002 6 | 39.46 | 0.23 |
| MOL002773 | Eucommia Bark | beta-carotene | 21 | 0.019 4 | 37.18 | 0.58 |
| MOL000497 | Liquorice Root | licochalcone a | 21 | 0.008 6 | 40.79 | 0.29 |
| MOL002714 | Radix Achyranthis | baicalein | 21 | 0.035 2 | 33.52 | 0.21 |
| MOL007098 | Radix Salviae Miltiorrhizae | deoxyneocryptotanshinone | 20 | 0.002 4 | 49.40 | 0.29 |
| MOL000392 | Liquorice Root | formononetin | 20 | 0.010 9 | 69.27 | 0.21 |
| MOL004891 | Liquorice Root | shinpterocarpin | 20 | 0.002 5 | 80.30 | 0.73 |
| MOL007094 | Radix Salviae Miltiorrhizae | danshenspiroketallactone | 19 | 0.002 0 | 50.43 | 0.31 |
| MOL000354 | Radix Astragali | isorhamnetin | 19 | 0.017 1 | 49.60 | 0.31 |
| MOL004835 | Liquorice Root | Glypallichalcone | 19 | 0.003 7 | 61.60 | 0.19 |
| MOL000500 | Liquorice Root | Vestitol | 19 | 0.001 9 | 74.66 | 0.21 |
| MOL007105 | Radix Salviae Miltiorrhizae | epidanshenspiroketallactone | 18 | 0.001 7 | 68.27 | 0.31 |
| MOL007111 | Radix Salviae Miltiorrhizae | Isotanshinone II | 18 | 0.002 0 | 49.92 | 0.40 |
| MOL007119 | Radix Salviae Miltiorrhizae | miltionone Ⅰ | 17 | 0.004 6 | 49.68 | 0.32 |
| MOL004957 | Liquorice Root | HMO | 17 | 0.001 8 | 38.37 | 0.21 |
将190个交集基因导入String数据库,置信度设置为0.9,并剔除游离靶点,共得到170个基因,将170个基因通过sytoscape 3.8.0进行网络可视化分析和拓扑分析。根据拓扑分析结果,取BC>58.4、DC>7、CC>0.11、EC>0.03、LAC>3(中位值)的靶点作为该方的核心基因。STAT3、Tp53、MAPK1、MAPK3、JUN、APP、MAPK14、MAPK8、AKT1、EGFR、VEGFA等基因可能是该方防治缺血性卒中的潜在靶点(Fig 2)。
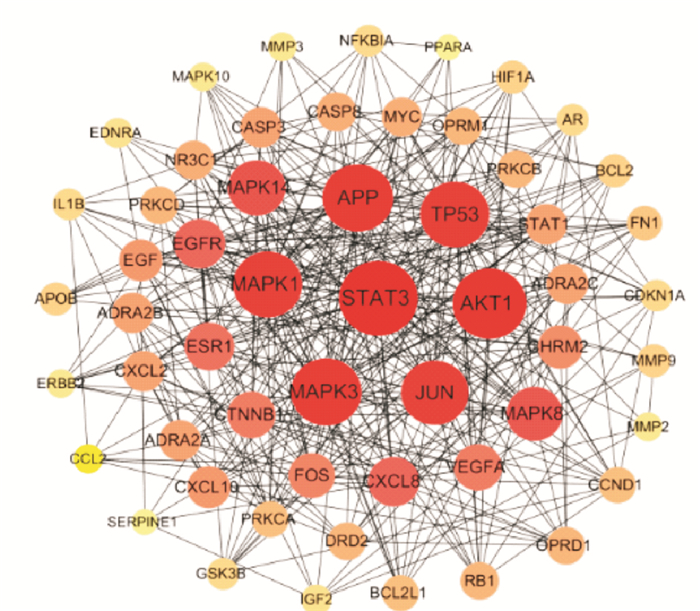
|
| 图 2 Network diagram of potential targets Note: a red circle indicates a larger value |
GO分析共得到880个分析条目,其中生物学过程有662条,最多对应交集基因有40个,最少2个;细胞组成有82条,最多对应交集基因有87个,最少2个;分子功能有136条;最多对应交集基因有150个,最少2个。根据排名前20的GO条目分析显示,健脾补肾活血方治疗缺血性卒中可能与对药物的反应、对缺氧的反应、对乙醇的反应、对脂多糖的反应、对雌二醇的反应、老化等生物学过程密切相关,分子生物学功能集中在酶结合、蛋白质均二聚活性、血红素结合、类固醇结合、转录因子结合、多巴胺结合、蛋白激酶结合、多巴胺神经递质受体活性等方面,细胞组分主要有细胞外空间、膜筏、质膜等。
KEGG富集分析共得到125条通路,主要与癌症通路、乙型肝炎、弓形虫病、大肠癌、TNF信号通路、膀胱癌、胰腺癌、蛋白聚糖在癌症中、HIF-1信号通路、前列腺癌、局灶性粘连、丙型肝炎、PI3K-Akt信号通路、细胞凋亡、Toll样受体信号通路等密切相关(Fig 3)。
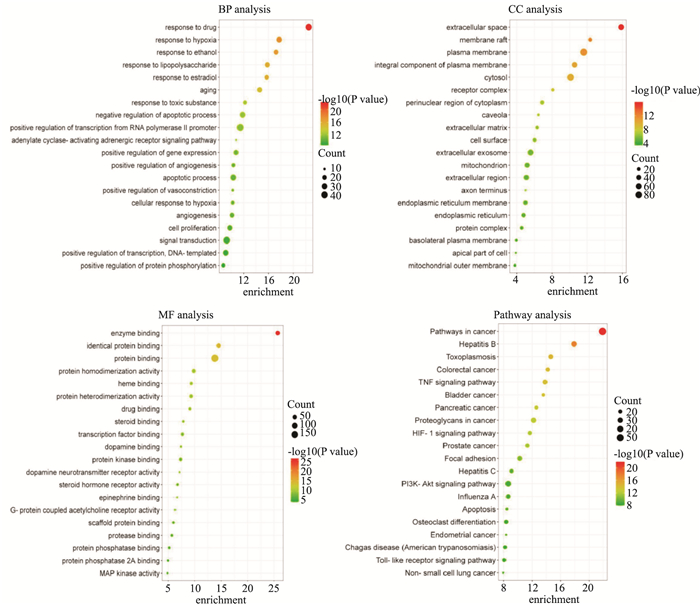
|
| 图 3 Visual analysis diagram of biological process, cell composition, molecular function and KEGG |
Quercetin、Tanshinone IIa、Luteolin、Kaempferol与STAT3、Tp53、MAPK3、MAPK1、JUN、APP、AKT1关键靶蛋白进行28次对接,结果显示靶点与化合物均有较强的结合能(Tab 3)。Quercetin主要是健脾补肾药物共有活性成分,β淀粉样前体蛋白(APP)与Quercetin结合较强,Tanshinone IIa为活血药物主要成分,主要与转录因子AP-1(JUN)、丝裂原活化蛋白激酶3(MAPK3)、丝裂原活化蛋白激酶1(MAPK1)等化合物结合具有较好的稳定性(Fig 4)。另外,氢键使结构更具稳定性。例如,APP与Quercetin的a环Arg381、Pro385形成氢键作用;b环与Arg500、Tyr369形成氢键作用;c环与Ala334、Glu362、Tyr501形成氢键作用。
| Compound | Affinity(kcal·mol-1) | |||||
| Gene | PDB ID | Quercetin | Tanshinone IIa | Luteolin | Kaempferol | |
| STAT3 | 5AX3 | -8.4 | -8.8 | -8.6 | -8.1 | |
| TP53 | 2J21 | -6.8 | -6.6 | -6.6 | -6.6 | |
| MAPK3 | 5AX3 | -7.8 | -9.2 | -8 | -7.8 | |
| MAPK1 | 1PME | -8.8 | -9 | -8.8 | -8.5 | |
| JUN | 2G01 | -8.4 | -10.2 | -8.9 | -8.6 | |
| APP | 5AMB | -9.1 | -8.5 | -8.9 | -8.8 | |
| AKT1 | 4GV1 | -8.3 | -8.6 | -8.2 | -7.8 | |
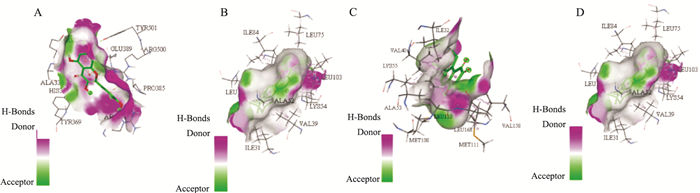
|
| 图 4 Molecular docking diagram Note: A.quercetin and APP; B.tanshinone iia and MAPK3; C. tanshinone IIa and JUN; D.tanshinone IIa and MAPK1 |
课题组成员前期多角度、多层次阐释健脾补肾活血方治疗缺血性卒中的药理机制。实验研究表明, 该方通过抑制CD3+、CD8+和调节CD4+淋巴细胞在缺血/再灌注损伤后脑组织内的浸润,减少免疫应答所介导的神经细胞凋亡,增加大鼠外周血中内皮组细胞(EPCs)的含量,增强脑组织CD31抗原的表达,促进大鼠脑组织新生血管的形成、有效建立侧支循环,从而减轻脑损伤。临床试验也显示,该方明显增加患者外周血EPCs含量,提高缺血区血液灌注水平、改善细胞免疫、拮抗炎症反应,减少卒中后氧化应激反应,增强机体抗氧化应激能力,同时修复受损的血管内皮细胞[4, 6-8]。
拓扑分析得出槲皮素、木犀草素、山柰酚、丹参酮IIA可能是JPBSHXP治疗IS的关键化学成分。Oh等[9]将槲皮素应用于缺血/再灌注诱导小鼠模型中发现,抑制在细胞活化期间由糖蛋白VI介导的血小板信号转导,明显破坏胶原相关肽诱导的血小板聚集,减少颗粒分泌及活性氧生成,降低细胞内钙动员水平,抑制动脉血栓形成。木犀草素通过抑制基质金属蛋白酶(MMP)9和激活PI3K/Akt信号通路增强细胞活力,并下调细胞凋亡,减少了脑梗塞体积[10]。山柰酚促进血管内皮生长因子(VEGF)诱导血管内皮生长因子受体2(VEGFR2)磷酸化、内皮一氧化氮合酶(eNOS)和细胞外信号调节激酶(Erk)表达,从而促使内皮细胞增殖、迁移和血管新生[11]。徐璇实验得出丹参酮IIA可使脑缺血大鼠的PTEN表达增强,降低自噬通路PI3K/AKT/mTOR的表达水平,减轻脑缺血后炎症反应,保护大鼠的脑组织[12]。该方治疗IS的核心靶点有STAT3、TP53、MAPK1、MAPK3、APP、JUN、AKT1等。转录激活因子3(STAT3)广泛存在于中枢神经系统中,参与细胞生长、代谢、凋亡,血管生成和氧化应激等多种生物学途径,同时介导机体免疫失调、炎症反应等过程[13]。余录等[14]研究发现山柰酚糖苷可能通过STAT3信号通路减少卒中后TNF-α、IL-1β炎性因子,降低白质区胼胝体和纹状体的β淀粉样前体蛋白(APP)阳性表达,改善大鼠神经行为障碍,缩小脑梗死范围,减轻神经元损伤。
健脾补肾活血方作用于缺血性卒中的炎症通路有肿瘤坏死因子(tumor necrosis factor,TNF)信号通路、Toll样受体(Toll-like receptors,TLRs)信号通路;促血管新生通路主要是低氧诱导因子-1(hypoxia inducible factor-1,HIF-1α)信号通路、磷脂酰肌醇-3-激酶/丝苏氨酸蛋白激酶(phosphatei-dylinositol-3-kinase/serine-threonine kinase,PI3K /Akt)通路(Tab 4,Fig 5)。脑梗死急性期常出现大量的炎症因子,TNF信号通路富集基因显示可能调节IL-1β及CCL2、CXCL10、NFKBIA等致炎因子来对抗脑缺血。Toll样受体信号通路参与神经炎症的反应过程[15],可能是通过MAPK信号通路,调控转录因子AP-1,调节下游基因IL-8、IL-1β、NFKBIA、IKBKB、CXCL10、CXCL11等炎性因子参与中风后炎性反应。这也为未来临床及实验研究炎症信号通路方向提供新的研究指标。PI3K/Akt通路,参与多种通路的调节,与炎症免疫反应、细胞凋亡、HIF-1α等通路均有相关性[16-17]。PI3K-Akt通路得出该方可能是调控GF、RTK、ECM等上游蛋白,使PI3K激活,AKT磷酸化启动下游PKCs、eNOS、ERK、GSK3、p21、Bcl-2、Bax、caspase-9等靶蛋白来作用于缺血性卒中。以上得知健脾补肾活血方可能通过免疫、炎症反应、氧化应激、血管新生、细胞凋亡等途径作用于缺血性卒中。
| ID | Pathway | P-Value | Gene |
| hsa04668 | TNF signaling pathway | 1.51335E-14 | JUN, VCAM1, MMP3, FOS, PTGS2, MAPK14, SELE, CXCL2, MMP9, ICAM1, MAPK10, NFKBIA, IKBKB, CXCL10, CASP7, MAPK8, CASP8, IL1B, CASP3, CCL2, AKT1, MAPK1, MAPK3 |
| hsa04066 | HIF-1 signaling pathway | 2.1727E-12 | EGLN1, CDKN1A, NOS2, PRKCB, NOS3, EGF, INSR, STAT3, SERPINE1, PRKCA, HIF1A, EGFR, VEGFA, IFNG, ERBB2, BCL2, AKT1, HMOX1, MAPK1, MAPK3 |
| hsa04151 | PI3K-Akt signaling pathway | 2.3449E-09 | CHRM2, GSK3B, CDKN1A, CHRM1, ITGB3, EGFR, CASP9, IKBKB, CCND1, MYC, KDR, SPP1, AKT1, MAPK1, MAPK3, IL4R, EGF, NOS3, BAD, INSR, FN1, PRKCA, VEGFA, COL1A1, COL3A1, IL2RB, BCL2, MDM2, MET, TP53, BCL2L1 |
| hsa04210 | Apoptosis | 3.60205E-09 | BAD, XIAP, CASP9, NFKBIA, IKBKB, CASP7, CASP8, CASP3, BCL2, BAX, AKT1, CYCS, Tp53, BCL2L1 |
| hsa04620 | Toll-like receptor signaling pathway | 8.46533E-09 | JUN, CXCL8, STAT1, FOS, MAPK14, MAPK10, NFKBIA, IKBKB, CXCL10, CXCL11, MAPK8, CASP8, IL-1β, SPP1, AKT1, MAPK1, MAPK3 |
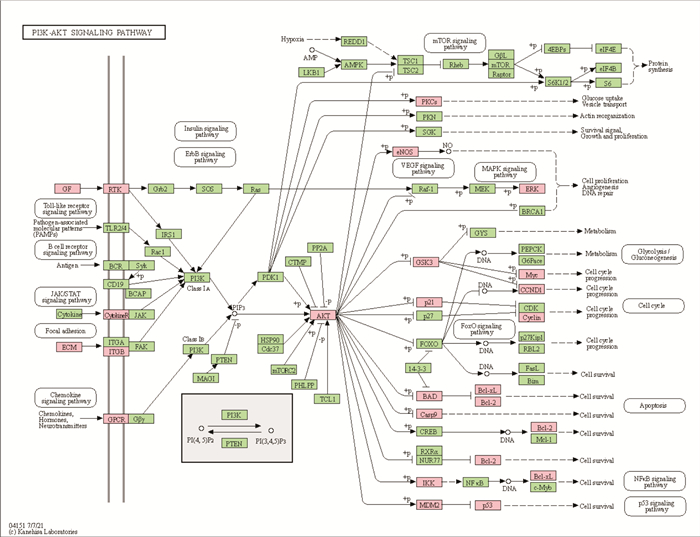
|
| 图 5 The key pathway of JPBSHXP possible to promote neovascularization |
网络药理学通过生物信息学、计算机技术、药理学等对方剂进行现代化阐释,为新药创制研发提供思路,也给予关键的技术支撑,对后续实验研究指明有希望的验证方向。本研究通过该方法得出缺血性卒中的潜在化学成分、小分子蛋白以及信号通路,在分子生物学层面为该方进一步实验研究及临床应用提供了理论基础。中医药在传承中发展,在发展中创新,中药新药以证候为干预对象,以辨证论治为理论基础,具有异病同治的特征。临床研究中本方对脾肾两虚型脑梗死、卒中后认知障碍和脑白质病变具有明显疗效,是否通过调控这些通路、靶蛋白发挥作用,有待于课题组下一步实验和临床验证。
| [1] |
高长玉, 吴成翰, 赵建国, 等. 中国脑梗死中西医结合诊治指南(2017)[J]. 中国中西医结合杂志, 2018, 38(2): 136-44. Gao C Y, Wu C H, Zhao J G, et al. Guidelines for the diagnosis and treatment of cerebral infarction in integrative chinese and western medicine in China (2017)[J]. Chin J Integr Tradit West Med, 2018, 38(2): 136-44. |
| [2] |
Cipolla M J, Liebeskind D S, Chan S L. The importance of comorbidities in ischemic stroke: Impact of hypertension on the cerebral circulation[J]. J Cereb Blood Flow Metab, 2018, 38(12): 2129-49. doi:10.1177/0271678X18800589 |
| [3] |
《中国脑卒中防治报告》编写组. 《中国脑卒中防治报告2019》概要[J]. 中国脑血管病杂志, 2020, 17(5): 272-81. Report on Stroke Prevention and Treatment in China Writing Group. Brief report on stroke prevention and treatment in China 2019[J]. Chin J Cerebrovasc Dis, 2020, 17(5): 272-81. doi:10.3969/j.issn.1672-5921.2020.05.008 |
| [4] |
路永坤, 刘向哲, 王新志, 等. 健脾补肾活血方对急性脑梗死患者氧化应激及血管内皮功能的影响[J]. 中药药理与临床, 2019, 35(3): 156-60. Lu Y K, Liu X Z, Wang X Z, et al. Effect of Jianpi Bushen Huoxue Prescription on oxidative stress and vascular endothelial function in patients with acute cerebral infarction[J]. Pharmacol Clin Chin Mater Med, 2019, 35(3): 156-60. |
| [5] |
Huang J, Cheung F, Tan H Y, et al. Identification of the active compounds and significant pathways of yinchenhao decoction based on network pharmacology[J]. Mol Med Rep, 2017, 16(4): 4583-92. doi:10.3892/mmr.2017.7149 |
| [6] |
郭朋飞. 健脾补肾活血方动员脑缺血大鼠内源性内皮祖细胞脑保护机制研究[D]. 郑州: 河南中医药大学, 2016. Guo P F. Study on brain protection mechanism of endogenous endothelial progenitor cells mobilized by Jianpi Bushen Huoxue Prescription in rats with cerebral ischemia[D]. Zhengzhou: Henan Univ of Chin Med, 2016. |
| [7] |
冯珍珍. 健脾补肾活血方对脑缺血大鼠T淋巴细胞亚群的影响[D]. 郑州: 河南中医药大学, 2017. Feng Z Z. Effect of Jianpi Bushen Huoxue Prescription on T lymphocyte subsets in rats with cerebral ischemia[D]. Zhengzhou: Henan Univ of Chin Med, 2017. |
| [8] |
刘向哲, 王新志, 王聪. 健脾补肾活血方对脑梗死患者神经功能缺损和T细胞亚群的影响[J]. 中国实验方剂学杂志, 2013, 19(3): 279-82. Liu X Z, Wang X Z, Wang C. Effect of Jianpi Bushen Huoxue Prescription on neurological deficit and T cell subsets in patients with cerebral infarction[J]. Chin J Exp Tradit Med Form, 2013, 19(3): 279-82. |
| [9] |
Oh T W, Do H J, Jeon J H, et al. Quercitrin inhibits platelet activation in arterial thrombosis[J]. Phytomedicine, 2021, 80: 153363. doi:10.1016/j.phymed.2020.153363 |
| [10] |
Luo S, Li H, Mo Z, et al. Connectivity map identifies luteolin as a treatment option of ischemic stroke by inhibiting MMP9 and activation of the PI3K/Akt signaling pathway[J]. Exp Mol Med, 2019, 51(3): 1-11. |
| [11] |
Hu W H, Wang H Y, Xia Y T, et al. Kaempferol, a major flavonoid in ginkgo folium, potentiates angiogenic functions in cultured endothelial cells by binding to vascular endothelial growth factor[J]. Front Pharmacol, 2020, 11: 526. doi:10.3389/fphar.2020.00526 |
| [12] |
徐璇, 汤其强. 丹参酮ⅡA对大鼠脑缺血后PTEN-PI3K/AKT/mTOR信号通路的影响[J]. 安徽医科大学学报, 2020, 55(11): 1706-9. Xu X, Tang Q Q. Effects of tanshinone iia on PTEN-PI3K/AKT/mTOR signaling pathway after cerebral ischemia in rats[J]. Acta Univ Med Anhui, 2020, 55(11): 1706-9. |
| [13] |
曹慧, 徐立, 宋文婷. 脑缺血后神经元自噬与凋亡机制及中药干预作用的研究进展[J]. 中药新药与临床药理, 2021, 32(3): 441-8. Cao H, Xu L, Song W T. Research progress on the mechanisms of autophagy and apoptosis of neurons after cerebral ischemia and the intervention effect of Chinese medicine[J]. Tradit Chin Drug Res Clin Pharmacol, 2021, 32(3): 441-8. |
| [14] |
余录, 陈雏, 和丽芬, 等. NF-κB和STAT3信号通路在山柰酚糖苷治疗缺血性脑损伤中的作用[J]. 中国药理学与毒理学杂志, 2012, 26(3): 422-3. Yu L, Chen C, He L F, et al. The role of NF-κB and STAT3 signaling pathways in the treatment of kaempferol glucoside on ischemic brain injury[J]. Chin J Pharmacol Toxicol, 2012, 26(3): 422-3. |
| [15] |
张建文, 王萍, 任超, 等. 缺血性卒中中后期炎症反应机制研究进展与新药研发的契机[J]. 中国药理学通报, 2019, 35(4): 468-73. Zhang J W, Wang P, Ren C, et al. Research progress of inflammatory response mechanisms in the middle and late stage of ischemic stroke and opportunities for new drug development[J]. Chin Pharmacol Bull, 2019, 35(4): 468-73. |
| [16] |
顾霞, 赵敏, 王平义, 等. 低氧诱导因子1α与低氧相关疾病信号通路的关系[J]. 中国组织工程研究, 2021, 25(8): 1284-9. Gu X, Zhao M, Wang P Y, et al. The relationship between hypoxia-inducible factor 1α and signaling pathways of hypoxia-related diseases[J]. J Clin Rehabil Tissue Eng Res, 2021, 25(8): 1284-9. |
| [17] |
Liu N X, Li Q H. LncRNA BC200 regulates neuron apoptosis and neuroinflammation via PI3K/AKT pathway in Alzheimer's disease[J]. J Biol Regul Homeost Agents, 2020, 34(6): 2255-61. |