

张可锋(1982-),男,博士,教授,硕士生导师,主要从事中药肝病药理学,通信作者,E-mail:xueshengcailiao@163.com
肝纤维化(hepatic fibrosis,HF)是由各种病因诱导的慢性肝病所引起的共同病理过程,包括脂肪性肝炎、病毒性肝炎和药物性肝炎等,是肝脏损伤后在修复过程中的一种代偿反应[1],其主要特点是肝脏受损后,细胞自身修复能力不足,从而导致细胞外基质(extracellular matrix,ECM)沉积及分化为肌成纤维细胞,ECM则主要在活化的肝星状细胞(hepatic stellate cell,HSC)中产生,它在HF的致病过程中起关键性作用[2]。HF是一种可逆的创伤愈合过程,但随病症的不断加重,形成难逆性肝硬化,最终导致肝癌,因此寻找有效防治或者缓解HF的治疗靶点及药物,已经成为亟待解决的问题[3]。
MAPK信号转导通路主要包括c-Jun氨基末端激酶(JNK)、p38丝裂原活化蛋白激酶(P38 MAPK)、细胞外信号调节蛋白激酶(ERK)以及大丝裂原激活蛋白激酶(ERK5/BMK1)4个亚族,其中关于JNK、p38和ERK的研究较多[4]。JNK是参与生物体内各种应激反应的关键分子,p38主要介导炎症和凋亡相关通路,ERK则广泛存在于机体内,参与细胞的增殖和分化[5]。研究显示,在HF发展过程中,JNK、p38、ERK磷酸化水平升高,治疗后则逐渐下降,抑制MAPK信号通路可明显改善HF[6]。
狗肝菜多糖(dicliptera chinensis polysaccharide,DCP)是爵床科植物狗肝菜Dicliptera chinensis(L.)Nees的主要活性成分。本课题组前期研究发现, DCP具有抗炎、抗氧化实现保肝作用[7-8];且发现DCP能够通过减少炎症因子的释放发挥抗HF的作用,对DMN诱导的HF具有显著的缓解作用[9]。综上所述,MAPK通路与HF的发生发展及炎症反应密切相关,DCP又可通过减轻炎症来抑制HF,因此推测DCP抗HF与抑制MAPK通路的激活有关。故本实验在前期研究明确DCP抗HF的基础上,通过观察DCP对MAPK通路及相关炎症因子的影响,探究DCP抗HF的作用机制。
1 材料 1.1 实验动物SPF级SD大鼠60只,6~8周龄,体质量(170~210) g,由湖南斯莱克景达实验动物有限公司提供,实验动物生产许可证号: SCXK(湘)2015-0010。饲养于湿度40%~55%、温度(22~26)℃、12 h光暗循环条件下,自由饮食饮水。
1.2 药物与试剂2, 4-二甲基亚硝胺(2, 4-dimethylnitrosamine,DMN)溶液购自天津市化学试剂研究所(批号:010110);秋水仙碱购自昆明制药集团股份有限公司(批号:1909A);丙氨酸氨基转移酶(ALT)试剂盒、门冬氨酸氨基转移酶(AST)试剂盒、血清碱性磷酸酶(ALP)试剂盒、总胆红素(TBIL)试剂盒、透明质酸酶(HA)试剂盒、层粘连蛋白(LN)试剂盒、Ⅳ型胶原(Ⅳ-C)试剂盒、Ⅲ型前胶原(PCⅢ)试剂盒购自南京建成生物工程研究所(批号分别为:20190516、20190503、20190428、20190513、20190603、20190610、20190515、20190521);苏木精-伊红(HE)染色试剂盒、Masson染色试剂盒购自大连美仑生物技术有限公司(批号依次为:MB9898-JUL-13D、MA0123-1-DEC-20D);RIPA裂解液、BCA蛋白定量试剂盒、SDS-PAGE蛋白上样缓冲液购自南通市碧云天生物科技研究所(批号依次为:P0013B、P0010S、P0015B);PVDF膜购自美国Millipor公司(批号:ISEQ00010);TGF-β1、α-SMA、p-JNK、JNK、p-p38、p38、p-ERK、ERK蛋白一抗购自英国Abcam公司(批号依次为:GR121504-3、GR105729-1、ab207477、ab176645、ab278674、ab31828、ab192591、ab32537);β-actin蛋白一抗购自无锡傲锐东源生物科技有限公司(批号:17AV0305);山羊抗鼠、山羊抗兔二抗购自北京中杉金桥生物技术有限公司(批号依次为:112438、133599)。
1.3 仪器ELx800Epoch酶标仪(美国Bio-Tek公司)、CFX96荧光定量PCR(美国Bio-Rad公司)、H2050R台式高速大容量冷冻离心机(湖南湘仪离心机仪器有限公司)、电泳仪、转膜仪(美国Bio-Rad公司)、OLYMPUS BX51显微镜(日本Olmpus公司)、Tanon-4100全自动化学发光图像分析检测系统(上海Tanon公司)。
2 方法 2.1 DCP的制备爵床科狗肝菜Dicliptera chinensis (L.) Ness.的全草购自广西桂林市中药材市场,经广西中医药大学药用植物学教研室韦松基教授鉴定为正品。干燥的狗肝菜全草切碎后于石油醚中回流脱脂2 h,接着沸水提取并浓缩,在4 ℃下用95%酒精醇沉12 h。用Sevag法除去蛋白。抽滤,滤渣依次用乙醚、无水乙醇、丙酮进行洗涤,得狗肝菜粗多糖。将所得物溶于水,于DE52型树脂层析柱中进行洗脱,真空干燥得浅黄色粉末状DCP[10]。
2.2 造模及给药60只大鼠被随机均分成6组,分别为对照组,模型组,秋水仙碱组(0.2 mg·kg-1)和DCP低、中、高剂量组(DCP100、200、300 mg·kg-1)。除对照组外,其他组均腹腔注射(1.6 mL·kg-1) 0.5% DMN溶液。每周3次,8周末完成造模,对照组被灌胃等体积的生理盐水。DCP和秋水仙碱用生理盐水溶解,灌胃给药,每天(8 mL·kg-1)处理1次,共6周[9]。
2.3 血清、组织样本收集末次给药后,用3%的戊巴比妥钠麻醉大鼠,然后收集腹主动脉血液及肝脏。血液经离心机离心后得到血清,贮存在-20 ℃冰箱备用。肝组织500 mg按1∶9加入枸橼酸缓冲液,制成10%的肝匀浆液。肝匀浆液离心后得到的上清液放置在-80 ℃冰箱保存。所有大鼠的左叶肝组织被均分为2份,其中1份在同一位置被剪成约1 cm×1 cm大小的肝组织,放置于4%多聚甲醛中固定,肝组织分别用于HE,Masson染色和免疫组化实验。另1份肝组织放置在-80 ℃被用于RT-PCR和Western blot实验。
2.4 血清样本分析根据ALT、AST、ALP、TBIL试剂盒说明生化法检测血清中ALT、AST、ALP的活性和TBIL的含量;同时,严格按照HA、LN、Ⅳ-C和PCⅢ试剂盒说明书加入血清样品与相关工作液,经气浴后,置于酶标仪上,按试剂盒说明书检测吸光度并计算血清中HA、LN、Ⅳ-C和PCⅢ的含量。
2.5 肝脏样本分析肝脏组织剪碎后,加入相当于肝脏9倍体积的磷酸缓冲液(0.01 mol·L-1,pH7.4),充分研磨成10%(W/V)匀浆。按照各炎症因子ELISA试剂盒说明书测量肝组织中TNF-α、IL-6、IL-1β的水平。
2.6 肝脏病理切片检查 2.6.1 HE染色和Masson染色大鼠的肝组织固定48 h后,在不同浓度的乙醇和二甲苯进行脱水。脱水后的肝组织用石蜡包埋机包埋成肝组织蜡块。然后将肝组织蜡块切成4 μm的切片。按照HE和Masson染色方法对肝组织切片进行染色。置于光学显微镜下,观察肝组织病理变化并拍摄收集图片。
2.6.2 免疫组化将制备好的组织切片于70 ℃中放置30 min,再置二甲苯中10 min脱蜡。首先将切片置于乙醇中脱水,接着用枸橼酸钠抗原修复液进行抗原修复,冷却至室温,再依次使用过氧化氢和牛血清白蛋白。分别孵育一抗a-SMA(1∶200)和TGF-β1(1∶500)12 h,和山羊抗兔IgG二抗(1∶100)30 min。最后,用二氨基联苯胺(DAB)浸泡5 min着色,用苏木精复染,观察表达结果并拍摄收集图片。
2.7 实时荧光定量PCR在各实验组肝脏中加入TRIzol试剂,裂解后得到总RNA。按说明书操作,总RNA被反转录成cDNA。以cDNA为模板在CFX96荧光定量PCR仪上根据检测试剂盒反应条件进行扩增。扩增条件为95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,循环40次。依据Ct值计算2-ΔΔCt,以β-actin为参照,计算相对表达量(Tab 1)。
| Genes | Primer | Sequence (5′-3′) |
| TNF-α | Forward | CGTCAGCCGATTTGCTATCT |
| Reverse | CGGACTCCGCAAAGTCTAAG | |
| IL-1β | Forward | TCTGTCTGTCTGTCTGTCTGTCTGTC |
| Reverse | CAGGCGTGTGCTACCATGCTAG | |
| IL-6 | Forward | CCGGAGAGGAGACTTCACAG |
| Reverse | TCCACGATTTCCCAGAGAAC | |
| β-actin | Forward | GGAGATTACTGCCCTGGCTCCTA |
| Reverse | GACTCATCGTACTCCTGCTTGCTG |
在各实验组肝脏中加入1%的PMSF的RIPA缓冲液,裂解后得到总蛋白。按照BCA担保测定试剂盒说明书检测总蛋白浓度。总蛋白中加入蛋白上样缓冲液,于95 ℃水浴5 min变性蛋白质。用10%SDS-PAGE分离变性蛋白质,冰浴条件下以恒转电流转移到PVDF膜上。将PVDF膜放入5%脱脂奶粉中,于室温下摇床封闭封闭2 h,TBST洗膜后分别于以下抗体4 ℃摇床孵育过夜:JNK(1∶1 000),p38(1∶1 000),ERK(1∶1 000),p-JNK(1∶1 000),p-p38(1∶1 000),p-ERK (1∶1 000),β-actin(1∶1 000)。次日,TBST洗膜后加入山羊抗小鼠IgG和山羊抗兔IgG二抗(1∶2 000)室温孵育2 h。将PVDF膜置于全自动化学发光图像分析系统中,使用Image软件分析条带蛋白灰度,以β-actin为参照,计算蛋白相对表达量。
2.9 数据统计分析所有数据均使用Graphpad Prism 5.0软件进行统计分析, x±s表示,多组间比较采用单因素方差分析,两组间比较采用独立样本t检验。
3 结果 3.1 DCP对HF大鼠肝组织病理形态学的影响对照组大鼠肝脏呈鲜红色,表面光滑,质地柔软且有弹性;模型组肝脏呈暗红色和灰白色相间,表面粗糙,质地较硬且边缘变厚;给药组肝脏病变程度较模型组均有改善,其中DCP高剂量组对组织形态改善程度最大。
进一步HE染色和Masson染色结果显示,对照组大鼠的肝小叶结构清晰,肝细胞结构正常,排列整齐, 且以中央静脉为中心呈现放射状、无明显炎症细胞浸润;模型组大鼠肝小叶结构被破坏,肝细胞排列分布紊乱,出现大量蓝色胶原纤维沉积,被沉积的胶原纤维分割成大小不等的假小叶,出现大量炎性细胞浸润和肝细胞坏死;与模型组相比,各给药组受损的肝小叶结构减轻,亦有不同程度的胶原纤维沉积,炎性细胞浸润减少,其中DCP高剂量组改善程度最大(Fig 1)。

|
| Fig 1 Effect of DCP on liver appearance and pathological changes of rats (×200) A: Control group; B: Model group; C: Colchicine group; D: DCP low dose group; E: DCP medium dose group; F: DCP high dose group(similarly hereinafter) |
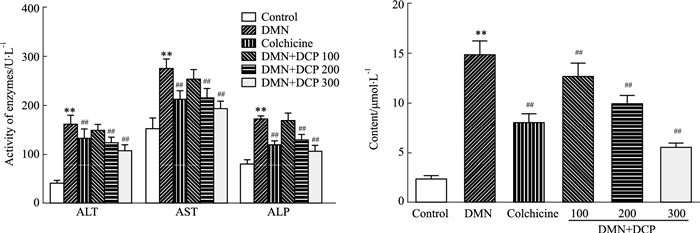
观察血清生化指标,模型组大鼠肝细胞产生大量ALT、AST、ALP,显示肝细胞严重受损,TBIL的显著升高说明大鼠肝脏摄取和排泄功能出现障碍,以上各指标与对照组相比具有明显差异(P<0.01);各给药组与模型组相比,ALT、AST、ALP、TBIL均有不同程度的下降(P<0.01),其中DCP高剂量组改善程度最明显(Fig 2)。
|
| Fig 2 Effect of DCP on liver function of rats (x±s, n=10) **P < 0.01 vs control group; ##P < 0.01 vs model group(similarly hereinafter) |
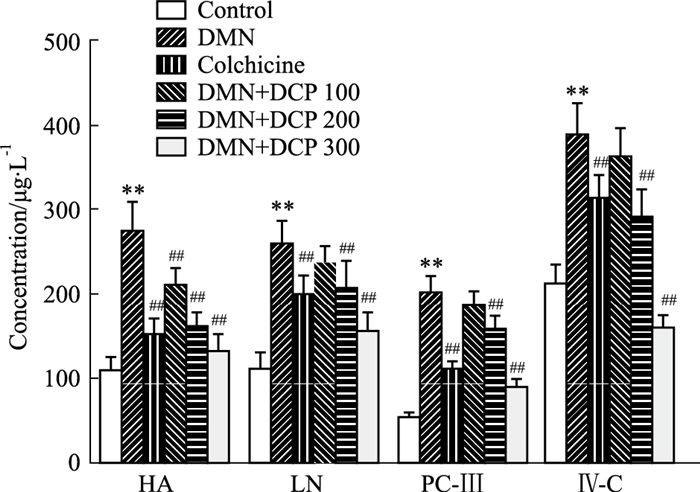
肝纤维化4项(HA、LN、Ⅳ-C和PCⅢ)指标常用来作为判断HF病情发展情况和治疗效果,与对照组相比,模型组大鼠肝纤维化四项指标均上升(P<0.01);与模型组相比,各给药组肝纤维化四项指标均有不同程度的下降(P<0.01), 其中DCP高剂量组改善程度最为明显(Fig 3)。
|
| Fig 3 Effect of DCP on four indexes of liver fibrosis in rats (x±s, n=10) **P < 0.01 vs control group; ##P < 0.01 vs model group |
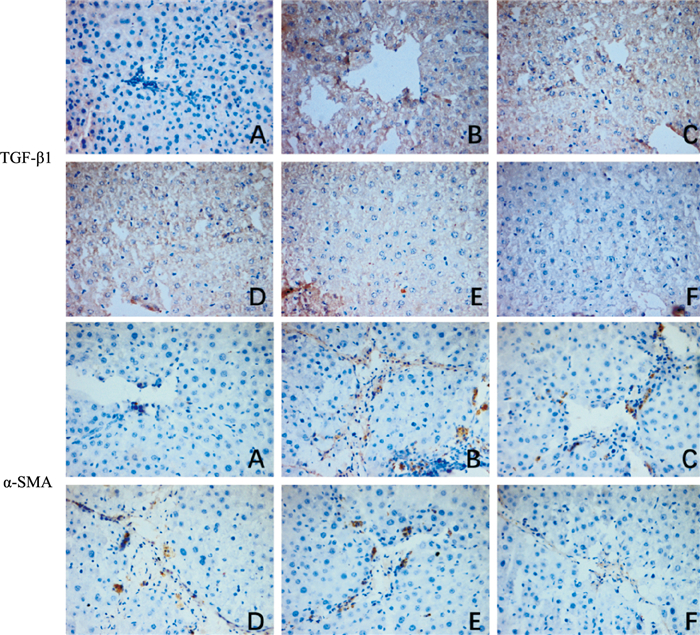
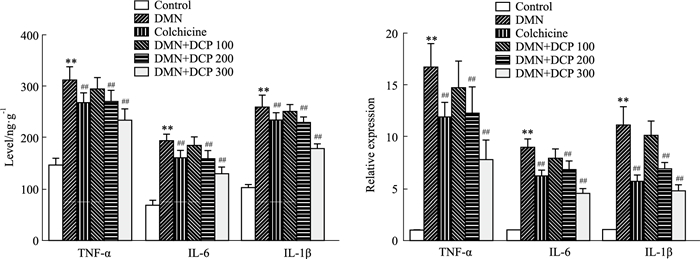
免疫组化结果显示,与对照组相比,模型组大鼠肝组织中TGF-β1、α-SMA、表达明显增加,与模型组相比,各给药组肝组织中TGF-β1、α-SMA表达明显降低,其中DCP高剂量组降低程度最为明显;ELISA及RT-PCR结果显示,与对照组相比,模型组大鼠肝组织中TNF-α、IL-6、IL-1β表达明显增加(P<0.01);与模型组相比,各给药组肝组织中TNF-α、IL-6、IL-1β表达明显降低(P<0.01),其中DCP高剂量组降低程度最为明显(Fig 4, 5)。
|
| Fig 4 Effect of DCP on TGF-β1 and α-SMA of liver in rats (×200) A: control; B: DMNC; C: colchicine; D: DMN+DPC 100; E: DMN+DCP 200;F: DMN+DCP 300 |
|
| Fig 5 Effect of DCP on inflammatory cytokines of liver in rats (x±s, n=10) **P < 0.01 vs control group; ##P < 0.01 vs model group |
Western blot实验结果显示,模型组大鼠p-JNK、p-p38、p-ERK蛋白表达水平明显高于对照组(P<0.01)。与模型组相比,DCP干预后,肝组织中MAPK通路相关蛋白的表达具有不同程度的降低(P<0.01),其中DCP高剂量组改善程度最为明显(Fig 6)。
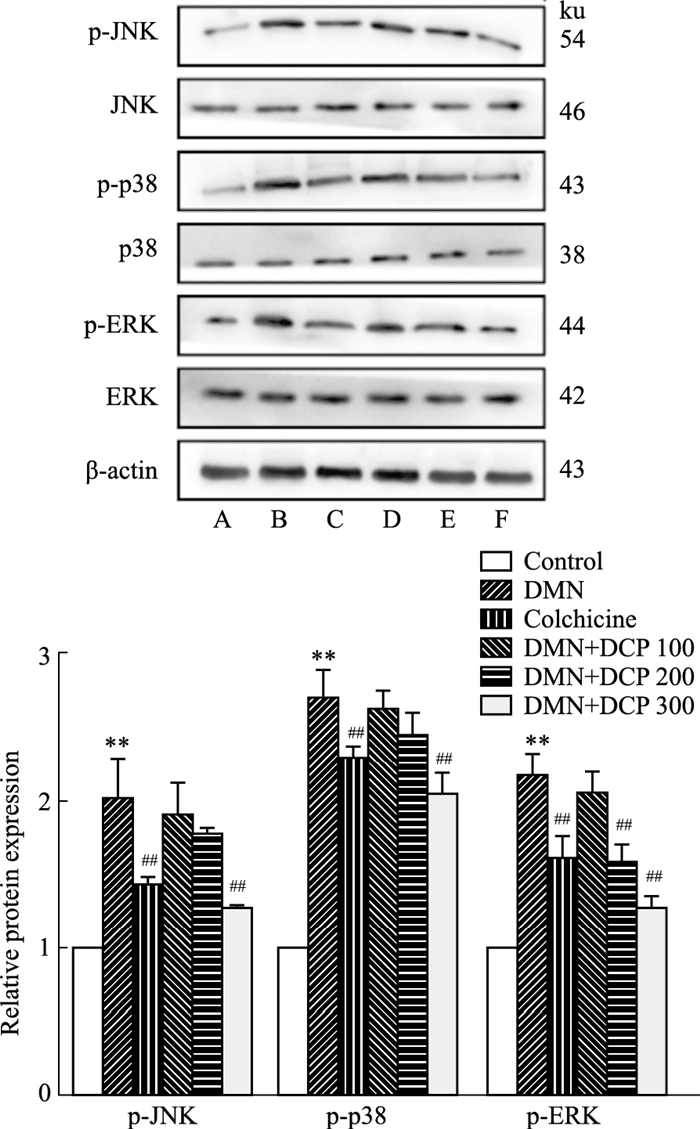
|
| Fig 6 Effect of DCP on MAPK pathway proteins in rats (x±s, n=3) A: control; B: DMNC; C: colchicine; D: DMN+DPC 100; E: DMN+DCP 200;F: DMN+DCP 300. **P < 0.01 vs control group; ##P < 0.01 vs model group |
本实验采用的DMN诱导大鼠HF模型,其造模原理是DMN进入肝细胞代谢成乙醛,乙醛引起肝细胞损伤,同时生成的甲基使核酸、蛋白质甲基化导致肝坏死,因其造模时间短、重复性高等特点被作为研究抗HF的首选模型[11]。因此本研究选该造模方法。
当肝脏受损时,由于细胞膜的通透性改变,使位于肝细胞内的ALT、AST、ALP、TBIL溢出进入血液,因此ALT、AST、ALP、TBIL被认为是临床判断肝损伤的重要指标[12]。当肝脏出现纤维化样病变时,HA、LN、PC-Ⅲ、Ⅳ-C随HF的加重不断升高,因此HA、LN、PC-Ⅲ、Ⅳ-C可作为临床判断HF病情发展情况和治疗效果的重要指标[13]。在本次实验中,用DMN处理后的大鼠,肝组织结构被严重破坏,胶原纤维过度积累,并引起血清中ALT、AST、ALP、TBIL、HA、LN、PC-Ⅲ和Ⅳ-C活性或含量的显著增加,以上指标表明HF动物模型的成功建立。经DCP干预,发现不同剂量DCP可以减轻DMN对肝脏造成的肝损伤,减少胶原沉积,表明DCP可减缓DMN诱导的HF进程。
α-SMA在HF过程中起重要作用,能反映HSC细胞的活化水平[14]。TGF-β1则贯穿HF始终,其可通过不断刺激HSC的激活加重HF病症[15]。研究表明,TNF-α是调节HF的重要因素之一,IL-6和IL-1β是具有炎症介质作用的多功能细胞因子,这3个炎症因子的表达对于HF的发展进程具有重要影响[16];在机体各种纤维化的发展过程中,MAPK信号通路蛋白的表达情况和变化趋势与HF和炎症反应的变化趋势一致[17]。JNK是细胞内调节周期、凋亡、应激的关键分子,参与细胞内的各种应激反应,能够活化HSC细胞的增殖;p38主要调节抗炎和致炎方面的平衡,影响炎症反应的过程,对HSC的增殖具有影响作用;ERK则属于MAPK的经典信号转导途径,机体内许多因子的受体都是由ERK的活化来达到信号转导的目的,在HSC的增殖中起到调节作用[18]。因此,抑制MAPK相关通路的激活可作为缓解HF的有效作用靶点。本研究显示,DCP可明显下调α-SMA、TGF-β1、TNF-α、IL-6和IL-1β,抑制MAPK通路被激活,从而有效改善HF病变。
综上所述,本研究结果表明,DCP具有减轻DMN所诱导的大鼠肝纤维化作用,其机制可能与抑制TGF-β1的表达、抑制MAPK通路及降低炎症因子的释放有关。由于肝纤维化疾病的病因复杂、致病因素多、涉及的细胞信号通路广泛,因此,DCP抗HF的详尽分子作用机制接下来将继续深入。本文研究结果进一步为证实DCP抗HF疗效确切,为将其开发为临床保肝药物提供实验基础。
| [1] |
Parola M, Pinzani M. Liver fibrosis: Pathophysiology, pathogenetic targets and clinical issues[J]. Mol Aspects Med, 2019, 65: 37-55. doi:10.1016/j.mam.2018.09.002 |
| [2] |
阚悦, 杨雁. 基于Cleaved caspase-9研究丹酚酸B对肝纤维化细胞凋亡的影响[J]. 中国药理学通报, 2019, 35(6): 827-32. Kan Y, Yang Y. Effect of salvianolic acid B on apoptosis of liver fibrotic cells based on cleaved caspase-9 protein[J]. Chin Pharmacol Bull, 2019, 35(6): 827-32. doi:10.3969/j.issn.1001-1978.2019.06.018 |
| [3] |
Damiris K, Tafesh Z H, Pyrsopoulos N. Efficacy and safety of anti-hepatic fibrosis drugs[J]. World J Gastroenterol, 2020, 26(41): 6304-21. doi:10.3748/wjg.v26.i41.6304 |
| [4] |
Lu M, Wang Y, Zhan X. The MAPK pathway-based drug therapeutic targets in pituitary adenomas[J]. Front Endocrinol (Lausanne), 2019, 10: 330-41. doi:10.3389/fendo.2019.00330 |
| [5] |
Yue S J, Zhang P X, Zhu Y, et al. A ferulic acid derivative FXS-3 inhibits proliferation and metastasis of human lung cancer A549 cells via positive JNK signaling pathway and negative ERK/p38, AKT/mTOR and MEK/ERK signaling pathways[J]. Molecules, 2019, 24(11): 2165-77. doi:10.3390/molecules24112165 |
| [6] |
Pan L X, Li L Y, Zhou H, et al. TMEM100 mediates inflammatory cytokines secretion in hepatic stellate cells and its mechanism research[J]. Toxicol Lett, 2019, 317: 82-91. doi:10.1016/j.toxlet.2018.12.010 |
| [7] |
Xu Q, Xu J, Zhang K, et al. Study on the protective effect and mechanism of Dicliptera chinensis (L.) Juss (Acanthaceae) polysaccharide on immune liver injury induced by LPS[J]. Biomed Pharmacother, 2021, 134: 111159-68. doi:10.1016/j.biopha.2020.111159 |
| [8] |
Zhang K, Xu Q, Gao Y, et al. Polysaccharides from Dicliptera chinensis ameliorate liver disturbance by regulating TLR-4/NF-κB and AMPK/Nrf2 signalling pathways[J]. J Cell Mol Med, 2020, 24(11): 6397-409. doi:10.1111/jcmm.15286 |
| [9] |
Zhang K, Gao Y, Zhong M, et al. Hepatoprotective effects of Dicliptera chinensis polysaccharides on dimethylnitrosamine-induced hepatic fibrosis rats and its underlying mechanism[J]. J Ethnopharmacol, 2016, 179: 38-44. doi:10.1016/j.jep.2015.12.053 |
| [10] |
韦日明, 高雅, 钟明利, 等. 狗肝菜多糖对大鼠酒精性肝损伤的影响[J]. 中药药理与临床, 2015, 31(4): 97-100. Wei R M, Gao Y, Zhong M L, et al. Study on the protective effect of Dicliptera chinensis polysaccharide on rats liver induced by alcohol[J]. Pharm Clin Chin Mater Med, 2015, 31(4): 97-100. |
| [11] |
华晓萍, 赵科, 唐大轩, 等. 肝宝胶囊调控巨噬细胞亚型构成逆转肝纤维化作用机理研究[J]. 中药药理与临床, 2021, 37(1): 153-60. Hua X P, Zhao K, Tang D X, et al. Study the mechanism of Ganbao capsule on regulating the formation of macrophage subtypes to reverse liver fibrosis[J]. Pharm Clin Chin Mater Medica, 2021, 37(1): 153-60. |
| [12] |
Gao Y, Xi B T, Li J N, et al. Scoparone alleviates hepatic fibrosis by inhibiting the TLR-4/NF-κB pathway[J]. J Cell Physiol, 2020, 236(4): 3044-58. |
| [13] |
廖智红, 陈燕燕, 黄修影, 等. 裂果薯总皂苷抗大鼠肝纤维化作用及其机制[J]. 中国药理学通报, 2019, 35(5): 624-9. Liao Z H, Chen Y Y, Huang X Y, et al. Effects of total saponins of schizocapsa plantaginea hance on hepatic fibrosis in rats and its mechanism[J]. Chin Pharmacol Bull, 2019, 35(5): 624-9. doi:10.3969/j.issn.1001-1978.2019.05.008 |
| [14] |
Wu Y, Li Z, Xiu A Y, et al. Carvedilol attenuates carbon tetrachloride-induced liver fibrosis and hepatic sinusoidal capillarization in mice[J]. Drug Des Devel Ther, 2019, 13: 2667-76. doi:10.2147/DDDT.S210797 |
| [15] |
Dewidar B, Meyer C, Dooley S, et al. TGF-β in hepatic stellate cell activation and liver fibrogenesis-updated 2019[J]. Cells, 2019, 8(11): 1419-33. doi:10.3390/cells8111419 |
| [16] |
Beringer A, Miossec P. IL-17 and TNF-α co-operation contributes to the proinflammatory response of hepatic stellate cells[J]. Clin Exp Immunol, 2019, 198(1): 111-20. doi:10.1111/cei.13316 |
| [17] |
Wu W, Piao H, Wu F, et al. Yu Jin Pulvis inhibits carbon tetrachloride-induced liver fibrosis by blocking the MAPK and PI3K/Akt signaling pathways[J]. Am J Transl Res, 2019, 11(9): 5998-6006. |
| [18] |
Li R, Guo Y, Zhang Y, et al. Salidroside ameliorates renal interstitial fibrosis by inhibiting the TLR4/NF-κB and MAPK signaling pathways[J]. Int J Mol Sci, 2019, 20(5): 1103-16. doi:10.3390/ijms20051103 |

