

2. 上海中医药大学中医外科研究所,上海 200032
刘萍(1966-),女,教授,博士生导师,研究方向:中医药防治动脉粥样硬化,通信作者,E-mail:liuping0207@126.com
2. Institute of Traditional Chinese Medicine Surgery, Shanghai University of Traditional Chinese Medicine, Shanghai 200032, China
动脉粥样硬化(atherosclerosis,AS)作为心血管疾病的共同病理基础,是脂质在大、中型动脉内膜沉积并导致动脉粥样硬化斑块形成的过程[1]。研究[2]发现,AS是由脂质驱动炎症反应的病理过程。因此,改善脂质代谢、缓解炎症反应仍然是治疗AS的有效方法。而肝脏在脂质代谢及炎症反应中发挥重要作用[3]。因此,本实验拟观察AS模型小鼠的肝脏炎症变化。
丹酚酸B(salvianolic acid B,Sal B)是丹参的主要有效水溶性成分,具有抗炎、抗氧化、抗肿瘤等药理作用,对心血管、肝脏、脑、肺、肾均有保护作用[4]。已有研究发现,Sal B可有效改善肝损伤、抑制肝脏炎症[5]。但是,Sal B在AS模型小鼠肝脏炎症反应中的具体机制尚不完善。因此,本研究以高脂饮食诱导低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)敲除小鼠作为AS模型,观察Sal B对AS模型小鼠肝脏组织炎症因子及其蛋白表达的影响,并探讨其对丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)/核因子κB(nuclear factor-κB,NF-κB)等炎症相关信号通路蛋白的调控,明确Sal B对炎症反应的作用及其机制,为其抗动脉粥样硬化临床应用提供依据。
1 材料与方法 1.1 材料 1.1.1 动物♂ LDLR基因敲除小鼠,6周龄,体质量为(18~23) g,购于江苏集萃药康生物科技有限公司,动物合格证号:202000150,许可证号:SCXK(苏)2018-0008;饲养于上海中医药大学附属龙华医院SPF级动物实验室。
1.1.2 实验药物与试剂Sal B购于成都普菲德生物技术有限公司,批号19031101,纯度98%。阿托伐他汀钙片(atorvastatin calcium tablets,ATO),购自上海中医药大学附属龙华医院西药房,批号CK2270。蛋白质抽提试剂盒(批号P0013B)、BCA蛋白定量试剂盒(批号P0010)、SDS-PAGE电泳试剂(批号103019200702)、苏木精-伊红染液(批号052020200176)购自碧云天科技有限公司; 油红O染液(批号SLBH0251V)购于美国SIGMA公司; ERK1/2(批号28)、p-ERK1/2(批号28)、p38(批号9)、p-p38(批号13)、GAPDH(批号7)抗体购于CST公司; JNK(批号A1221)、P-JNK(批号A2621)、p-NF-κB(批号C0221)、NF-κB(批号K2320)、p-IκB(批号C1021)、IκB(批号B1621)抗体购于Santa Cruz公司; VCAM(批号GR257919-8)、iNOS(批号GR3205303-1)抗体购于Abcam公司; mRNA提取试剂盒购于中国上海海方生物技术有限公司,批号B4DP210121;PCR反转录试剂盒和PCR反应试剂盒购于日本TaKaRa公司,批号AJ10935A、AIF1686A;引物由上海闪晶分子生物科技有限公司合成,批号111359735;ELISA试剂盒购于上海西唐生物科技有限公司,批号2009101、2008251、2008261。
1.1.3 仪器垂直电泳仪、置胶架、电泳槽、转膜槽、凝胶成像仪,美国BIO-RAD公司; 高速冷冻离心机,德国Eppendorf公司; StepOne Plus实时荧光定量PCR仪,美国ABI公司; SynergyH4型酶标仪,美国BioTek公司。
1.2 实验方法 1.2.1 小鼠干预与造模LDLR-/-小鼠32只随机分为对照组(CON)、模型组(MOD)、丹酚酸B组(Sal B)、阿托伐他汀组(ATO),每组8只。CON给予普通饲料喂养,MOD、Sal B、ATO组给予高脂饲料(含脂肪21%,胆固醇0.15%)。12周后,分别给予CON、MOD组生理盐水200 μL腹腔注射,Sal B组给予25 mg·kg-1 Sal B溶液腹腔注射,ATO组给予阿托伐他汀1.3 mg·kg-1灌胃,疗程12周。
1.2.2 血清生化检测小鼠腹腔麻醉后,取腹主动脉血,静置0.5 h后,离心,3 000 r·min-1,4 ℃,取上清。血清送上海中医药大学附属龙华医院检验科,应用全自动生化仪检测总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(alanine aminotransferase,AST)。
1.2.3 小鼠主动脉、肝组织病理染色小鼠主动脉、肝组织在4%中性甲醛溶液中固定48 h。主动脉移至蔗糖溶液中脱水,OCT胶包埋,切片厚度约10 μm,按照油红O标准流程进行染色封片晾干后在显微镜下观察并拍照。采用Image Pro Plus图像分析软件测量斑块及官腔面积,比例(%)=斑块面积/管腔面积×100%。肝组织脱水浸蜡后,进行石蜡包埋切片,厚度约10 μm,按照HE标准流程进行染色封片晾干后在显微镜下观察并拍照。肝组织常规评分标准见Tab 1。
| Term | Score | |||
| 0 | 1 | 2 | 3 | |
| Hepatocyte steatosis | < 5% | 5%~33% | 33%~66% | >66% |
| Intralobular inflammation (Number of necrotic foci under 20 magnification) | None | < 2 | 2~4 | >4 |
| Hepatocyte ballooning | None | Rare | More common | - |
取小鼠血清。配制标准品液、洗涤液。每孔加入标准品或待测样本100 μL,37 ℃反应45 min。洗板,加入第一抗体工作液,37 ℃反应20 min。洗板,加入酶标抗体工作液,37 ℃反应10 min。洗板,加入底物工作液,37 ℃避光反应15 min,加入终止液。在酶标仪450 nm处读取吸光度值。
1.2.5 实时定量RT-PCR测定肝组织炎症因子mRNA表达取小鼠肝组织,按照RNA提取试剂盒按说明书提取RNA。逆转录合成cDNA。以β-actin为内参进行荧光定量PCR扩增以检测各组小鼠肝组织中白介素-1β(interleukin-1β,IL-1β)、白介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)mRNA的表达水平。以2-ΔΔ Ct法表示各目的基因的相对表达量。扩增引物由上海闪晶分子生物科技有限公司合成,引物序列见Tab 2。
| Gene | Oligonucleotide sequence |
| β-actin | Forward: 5′-GAGACCTTCAACACCCCAGC- 3′ |
| Reverse:5′-ATGTCACGCACGATTTCCC-3′ | |
| IL-1β | Forward:5′-GCTTCAGGCAGGCAGTATCA-3′ |
| Reverse:5′-TGCAGTTGCTAATGGGAACG-3′ | |
| IL-6 | Forward:5′-AAAGCAGCAAAGAGGCACTG-3′ |
| Reverse:5′-TACCTCAAACTCCAAAAGACCAG-3′ | |
| TNF-α | Forward:5′-CCCTCCAGAAAAGACACCATG-3′ |
| Reverse:5′-CACCCCGAAGTTCAGTAGACAG-3′ |
取肝组织加入细胞裂解液,进行组织匀浆,离心收集上清提取细胞蛋白。采用BCA法进行蛋白定量。将蛋白样品加入上样缓冲液,95 ℃孵育5 min进行蛋白变性,上样至聚丙烯酰胺凝胶进行电泳分离,电转至PVDF膜。封闭1 h后,分别以一抗(1:1 000)4 ℃孵育过夜,二抗(1:5 000)室温孵育1 h。电化学法显影后,采集条带并进行灰度分析。
1.3 统计学方法选用统计软件SPSS 21.0进行数据统计分析,GraphPad Prism 6.0软件作图,实验数据以x±s表示。多组比较采用单因素方差分析(One-Way ANOVA),两组间比较采用LSD检验。
2 结果 2.1 各组小鼠血清血脂、转氨酶水平AS模型组小鼠血清TC、TG、ALT、AST较正常对照明显升高(P < 0.05)。与MOD比较,Sal B、ATO明显降低TC、TG、ALT、AST(P < 0.05)(Tab 3)。
| Group | TC/mmol·L-1 | TG/mmol·L-1 | ALT/U·L-1 | AST/U·L-1 |
| CON | 2.72±0.71 | 1.20±0.08 | 25.84±6.26 | 123.79±22.39 |
| MOD | 55.20±1.94* | 7.62±0.87* | 96.14±28.50* | 367.24±124.74* |
| Sal B | 34.46±2.93# | 3.84±0.72# | 47.01±14.20# | 209.81±66.60# |
| ATO | 26.37±3.46# | 3.15±0.71# | 29.40±3.40# | 139.35±25.09# |
| *P<0.05 vs CON; #P<0.05 vs MOD | ||||
AS模型组小鼠主动脉粥样斑块面积较正常对照组明显增大。与MOD比较,Sal B、ATO干预后明显减小斑块面积(P < 0.05)。CON小鼠肝组织结构正常且清晰,MOD小鼠肝组织结构紊乱,出现炎性细胞浸润灶、气泡性脂肪变。与MOD对比,Sal B、ATO组小鼠肝组织病理变化得到明显改善(Fig 1)。
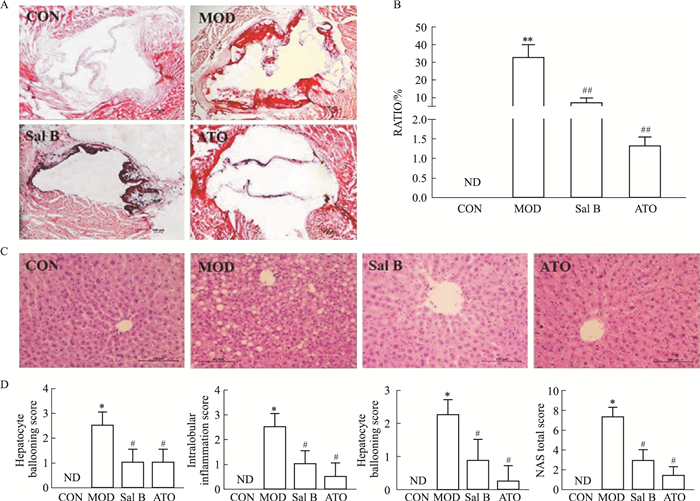
|
| Fig 1 Histopathological figure of each group of mice(x±s, n=8) A: Oil red O staining of aortic atherosclerotic plaque, (×40); B: The areas of lesion were calculated respectively by ImageJ analysis software; C: HE staining of liver tissues, (×200); D: NAS scores in liver tissues. ND: not detected. *P < 0.05, **P < 0.01 vs CON; #P < 0.05, ##P < 0.01 vs MOD. |
ELISA法检测各组小鼠血清IL-1β、IL-6、TNF-α含量,结果显示,MOD小鼠血清IL-1β、IL-6、TNF-α含量明显升高(P < 0.05);Sal B、ATO明显降低血清IL-1β、IL-6、TNF-α的含量(P < 0.05)。RT-PCR法检测各组小鼠肝组织IL-1β、IL-6、TNF-α mRNA表达,结果显示,MOD小鼠肝组织IL-1β、IL-6、TNF-α mRNA表达明显升高(P < 0.05);Sal B、ATO明显降低上述炎症因子mRNA表达(P < 0.05)(Tab 4)。
| Group | IL-1β/ng·L-1 | IL-6/ng·L-1 | TNF-α/ng·L-1 | IL-1β mRNA | IL-6 mRNA | TNF-α mRNA |
| CON | 58.41±9.84 | 9.57±3.17 | 12.47±3.52 | 1.13±0.07 | 0.94±0.06 | 0.92±0.16 |
| MOD | 189.33±24.58* | 79.32±8.72* | 229.70±64.46* | 2.44±0.26* | 11.21±2.38* | 1.48±0.26* |
| Sal B | 117.64±15.03# | 44.73±9.46# | 64.24±15.88# | 0.92±0.38# | 3.87±1.67# | 0.58±0.15# |
| ATO | 91.3688±12.02# | 27.07±6.62# | 41.75±4.11# | 0.45±0.11# | 2.02±0.56# | 0.32±0.04# |
| *P<0.05 vs CON; #P<0.05 vs MOD | ||||||
Western blot检测肝组织炎症蛋白血管细胞黏附分子(vascular cell adhesion molecule,VCAM)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的表达水平。结果显示,模型组小鼠肝组织VCAM、iNOS蛋白表达明显升高(P < 0.01),Sal B干预后,VCAM、iNOS蛋白表达明显降低(P < 0.05)(Fig 2)。
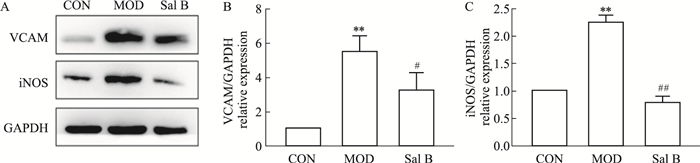
|
| Fig 2 Expression of inflammatory protein in liver tissues of mice in each group(x±s, n=3) A: Western blot assay; B: The quantitative result of VCAM was depicted; C: The quantitative result of iNOS was depicted.**P < 0.01 vs CON; #P < 0.05, ##P < 0.05 vs MOD. |
MAPKs/NF-κB信号通路在炎症反应中起到重要作用。Western blot检测小鼠肝组织MAPKs/NF-κB信号通路相关蛋白。结果显示,MOD组JNK、p38、ERK1/2、IκB、NF-κB蛋白的磷酸化水平均明显升高(P < 0.01),Sal B明显下调上述蛋白磷酸化水平(P < 0.05)(Fig 3)。
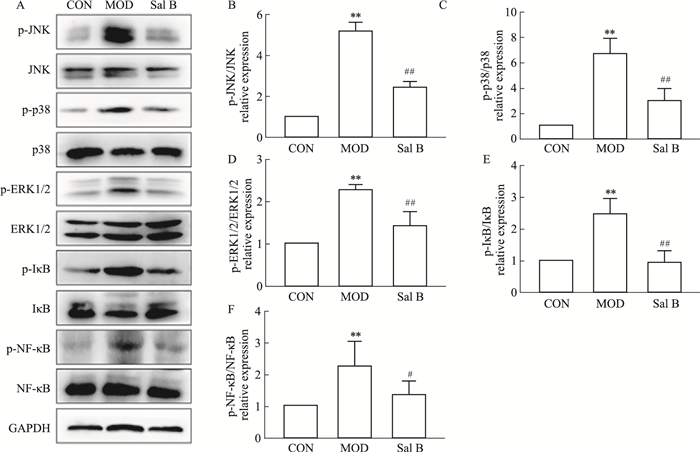
|
| Fig 3 MAPKs/NF-kB signaling pathway related protein expression in liver tissues of mice in each group(x±s, n=3) A: Western blot assay; B: The quantitative result of p-JNK was depicted; C: The quantitative result of p-p38 was depicted; D: The quantitative result of p-ERK1/2 was depicted; E: The quantitative result of p-IκB was depicted; F: The quantitative result of p-NF-κB was depicted.**P < 0.01 vs CON; #P < 0.05, ##P < 0.05 vs MOD. |
AS的发病机制与脂质代谢异常、炎症、氧化应激等有关[1]。血脂异常是AS发生发展的独立危险因素。肝脏在脂质代谢中发挥重要作用,是脂肪酸合成和脂质循环的枢纽[3]。临床研究发现,非酒精性脂肪肝病是心血管疾病死亡率的独立预测因素,并与颈动脉内膜-中膜增厚和斑块早发有关[6]。既往有研究发现,“瓜蒌-薤白”明显减少AS小鼠主动脉斑块,减轻肝脏脂滴积累[7]; 甘草酸调节肝脏胆固醇代谢,有效阻抑Apo E-/-小鼠AS的发展[8]。本课题组前期研究发现,复方冠心康通过调控肝脏ATP结合盒转运子等分子的表达,改善脂质代谢紊乱,从而改善ApoE-/-小鼠AS[9]。本实验结果显示,Sal B降低高脂饮食诱导AS的LDLR-/-小鼠血清中的TC、TG水平,病理学观察显示,Sal B减少LDLR-/-小鼠主动脉斑块、肝脏脂滴积累,改善肝组织病理改变。这提示Sal B通过改善血脂异常从而控制斑块的形成。
研究发现[10],肝脏炎症在AS过程中发挥重要作用,导致AS的炎症因子部分来源于肝脏。研究表明[11],肝脏炎症的发生早于主动脉早期病变形成。过量的脂质摄入会导致氧化应激,诱导肝脏发生炎症反应,激活干扰素γ、IL-1、TNF-α等炎症信号通路,释放炎症因子C-反应蛋白、IL-6等,促进动脉粥样硬化。非酒精性脂肪性肝炎患者比单纯脂肪变性患者更容易发生AS[12]。本实验结果显示,Sal B降低高脂饮食诱导AS的LDLR-/-小鼠血清中ALT、AST及炎症因子IL-1β、IL-6、TNF-α水平,以及肝组织IL-1β、IL-6、TNF-α mRNA表达水平和VCAM、iNOS蛋白表达水平,这提示Sal B通过减轻肝组织炎症缓解动脉粥样硬化。
MAPKs信号通路参与炎症和AS的发展过程[13]。NF-κB是介导炎症反应的关键转录因子[14]。当Toll样受体4受到内毒素、脂肽的刺激,触发骨髓分化因子88依赖途径,快速激活MAPKs/ NF-κB信号通路,上调炎性因子的转录翻译,增加VCAM、iNOS的表达,促进肝脏炎症,从而加重AS[15-16]。研究发现[17],MAPKs/NF-κB信号通路的过度激活,会促进巨噬细胞向M1型转化,增加活性氧自由基、内质网应激,进一步驱动肝脏炎症。因此抑制MAPKs/NF-κB信号通路是减轻肝脏炎症的有效途径。龚勇珍等[18]研究发现乙酰水杨酸姜黄素酯抑制肝脏NF-κB p65表达,从而下调肝脏炎症因子,改善AS。本研究结果显示,相比于模型组,给予Sal B干预后的小鼠肝组织ERK1/2、JNK、p38、IκB、NF-κB蛋白磷酸化水平有不同程度的下调。说明Sal B可能通过抑制MAPKs/NF-κB信号通路,减轻肝脏炎症。
综上所述,本研究阐明Sal B通过抑制肝脏MAPKs/NF-κB信号通路,减轻肝脏炎症反应,从而缓解动脉粥样硬化,为抗炎性药物、抗动脉粥样硬化药物筛选提供了实验依据。
| [1] |
Schaftenaar F, Frodermann V, Kuiper J, et al. Atherosclerosis: The interplay between lipids and immune cells[J]. Curr Opin Lipidol, 2016, 27(3): 209-15. doi:10.1097/MOL.0000000000000302 |
| [2] |
Viola J, Soehnlein O. Atherosclerosis-A matter of unresolved inflammation[J]. Semin Immunol, 2015, 27(3): 184-93. doi:10.1016/j.smim.2015.03.013 |
| [3] |
Nguyen P, Leray V, Diez M, et al. Liver lipid metabolism[J]. J Anim Physiol Anim Nutr (Berl), 2008, 92(3): 272-83. doi:10.1111/j.1439-0396.2007.00752.x |
| [4] |
Xiao Z, Liu W, Mu Y P, et al. Pharmacological effects of salvianolic acid B against oxidative damage[J]. Front Pharmacol, 2020, 11: 572373. doi:10.3389/fphar.2020.572373 |
| [5] |
卢万鹏, 温振帆, 刘家园, 等. 丹酚酸B对Apo E敲除小鼠非酒精性脂肪肝的改善运用及其机制研究[J]. 中国药理学通报, 2020, 36(1): 31-7. Lu W P, Wen Z F, Liu J Y, et al. Improvement and mechanism of salvianolic acid B on non-alcoholic fatty liver in Apo E knockout mice[J]. Chin Pharmacol Bull, 2020, 36(1): 31-7. doi:10.3969/j.issn.1001-1978.2020.01.008 |
| [6] |
Dunn W, Xu R, Wingard D L, et al. Suspected nonalcoholic fatty liver disease and mortality risk in a population-based cohort study[J]. Am J Gastroenterol, 2008, 103(9): 2263-71. doi:10.1111/j.1572-0241.2008.02034.x |
| [7] |
徐鹏博, 丁立丹, 仇静文, 等. 基于肝脏代谢组学研究"瓜蒌-薤白"对ApoE~(-/-)小鼠动脉粥样硬化的影响[J]. 中国中药杂志, 2021, 46(20): 5320-9. Xu P B, Ding L D, Qiu J W, et al. Study on effect of "Trichosanthis Fructus-Allii Macrostemonis Bulbus" on atherosclerosis in ApoE~(-/-) mice based on liver metabonomics[J]. Chin J Chin Mater Med, 2021, 46(20): 5320-9. |
| [8] |
格桑曲珍, 马俐, 谢光辉, 等. 甘草酸对载脂蛋白E基因敲除小鼠脂质代谢及动脉粥样硬化斑块的影响[J]. 中国动脉硬化杂志, 2015, 23(2): 116-20. Ge S Q Z, Ma L, Xie G H, et al. Effects of Glycyrrhiza Acid on lipid metabolism and atherosclerotic lesions in Apo-lipoprotein E gene knockout mice[J]. Chin J Arterioscler, 2015, 23(2): 116-20. |
| [9] |
毛美娇, 胡俊萍, 王从, 等. 冠心康对ApoE-/-动脉粥样硬化小鼠PPARγ-LXRα-ABCA1信号通路的影响[J]. 中西医结合学报, 2012, 10(7): 814-20. Mao M J, Hu J P, Wang C, et al. Effects of Chines herbal medicine Guanxinkang on expression of PPARγ-LXRα-ABCA1 pathway in ApooE-knockout mice with atherosclerosis[J]. Integr Med, 2012, 10(7): 814-20. |
| [10] |
Purnak T, Efe C, Beyazit Y, et al. Recent insights into the relationship between inflammatory liver diseases and atherosclerosis[J]. J Investig Med, 2011, 59(6): 904-11. doi:10.2310/JIM.0b013e318217f3a0 |
| [11] |
Kleemann R, Verschuren L, van Erk M J, et al. Atherosclerosis and liver inflammation induced by increased dietary cholesterol intake: A combined transcriptomics and metabolomics analysis[J]. Genome Biol, 2007, 8(9): R200. doi:10.1186/gb-2007-8-9-r200 |
| [12] |
Targher G, Day C P, Bonora E. Risk of cardiovascular disease in patients with nonalcoholic fatty liver disease[J]. N Engl J Med, 2010, 363(14): 1341-50. doi:10.1056/NEJMra0912063 |
| [13] |
Lu S, Luo Y, Sun G, et al. Ginsenoside Compound K attenuates ox-LDL-mediated macrophage inflammation and foam cell formation via autophagy induction and modulating NF-κB, p38, and JNK MAPK signaling[J]. Front Pharmacol, 2020, 11: 567238. doi:10.3389/fphar.2020.567238 |
| [14] |
Jawień J, Gajda M, Mateuszuk Ł, et al. Inhibition of nuclear factor-kappaB attenuates artherosclerosis in ApoE/LDLR - double knockout mice[J]. J Physiol Pharmacol, 2005, 56(3): 483-9. |
| [15] |
Wang S, Zhou H, Feng T, et al. β-Glucan attenuates inflammatory responses in oxidized LDL-induced THP-1 cells via the p38 MAPK pathway[J]. Nutr Metab Cardiovasc Dis, 2014, 24(3): 248-55. doi:10.1016/j.numecd.2013.09.019 |
| [16] |
Wu Y, Wang F, Fan L, et al. Baicalin alleviates atherosclerosis by relieving oxidative stress and inflammatory responses via inactivating the NF-κB and p38 MAPK signaling pathways[J]. Biomed Pharmacother, 2018, 97: 1673-9. doi:10.1016/j.biopha.2017.12.024 |
| [17] |
Li J, Deng X, Bai T, et al. Resolvin D1 mitigates non-alcoholic steatohepatitis by suppressing the TLR4-MyD88-mediated NF-κB and MAPK pathways and activating the Nrf2 pathway in mice[J]. Int Immunopharmacol, 2020, 88: 106961. doi:10.1016/j.intimp.2020.106961 |
| [18] |
龚勇珍, 孙少卫, 杨慧仙, 等. 小凹蛋白1-NFκB通路介导乙酰水杨酸姜黄素酯的抗动脉粥样硬化作用[J]. 中国现代医学杂志, 2015, 25(9): 21-6. Gong Y Z, Sun S W, Yang H X, et al. Caveolin-1/nuclear factor kappa B pathway mediates antiatherosclerotic effect of curcumin acetylsalicylate in apolipoprotein E-deficient mice[J]. Chin J Mod Med, 2015, 25(9): 21-6. |

