

孙妩弋(1981-),女,博士,教授,博士生导师,研究方向:肝脏药理学,通信作者,E-mail:sunwuyi51@aliyun.com
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是指除酒精和其他明确损肝因素外,脂肪在肝脏堆积产生的以弥漫性肝细胞大泡性脂肪变性为主要病变的临床病理综合征[1]。NAFLD的发病率在全球范围内均逐年升高,预计将成为未来10年内我国第一大慢性肝病和肝脏移植手术的首要病因,但由于其发病机制复杂,目前尚无获批的针对NAFLD的治疗药物[2]。动物模型是研究疾病的发病机制、疾病的治疗靶点以及制定防治策略的重要手段,对探究其发病机制与药理作用等均有重要意义。目前针对NAFLD模型研究不断取得新进展,但因其机制复杂,建立与人类NAFLD疾病进程相类似的动物模型,仍是亟待解决的难题。高脂饲料喂养是较为常用的造模方法[3],但该方法诱导成模周期长,而单纯的化学诱导被认为不能较好地拟合人类NAFLD的发病机制。高脂饮食喂养联合化学药物诱导可能成为诱导建立NAFLD的新思路方法,因此本文选用两种方法建立NAFLD模型,观察在高脂饲料喂养的基础上,联合注射低剂量四氯化碳(carbon tetrachloride,CCl4)相较于单纯的WD饲料喂养建立的NAFLD病理特征和发病特点,旨在为不同因素诱发的NAFLD的潜在发病机制及相关分子基础研究提供理想可靠的动物模型。
1 材料与方法 1.1 实验动物C57BL/6J小鼠6-8周龄,♂,体质量18-20 g,由北京斯贝福生物技术有限公司提供,动物生产许可证号:SCXK(京)2019-0010。饲养于安徽医科大学临床药理研究所SPF屏障环境,实验动物使用许可证号:SYXK(皖)2020-001。恒温(20±2) ℃及湿度(50±5)%。12 h昼夜交替光照,自由摄食和饮水,适应性饲养1周后随机分组。所有操作经安徽医科大学实验动物伦理委员会批准(批准号:LLSC202000794)。
1.2 主要试剂及仪器西方饮食(western diet,WD)饲料(Research diets,D12079B,批号: 21060103)购自上海博奥派克生物科技有限公司,普通维持饲料由北京科奥协力饲料有限公司提供(批号: 21013113);CCl4溶液(上海凌峰化工有限公司); 血糖仪及血糖检测试纸(上海罗氏诊断产品有限公司); 油红O粉末(北京索莱宝科技有限公司); 小鼠白细胞介素1β(interleukin 1β,IL-1β)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素6(interleukin 6,IL-6)ELISA试剂盒,购自上海酶联生物科技有限公司; 谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,T-CHO)生化试剂盒,购自日本和光纯药株式会社; 脂肪酸合成酶(fatty acid synthase,FAS)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体,均购自Affinity公司; α平滑肌肌动蛋白(α smooth muscle actin,α-SMA)抗体购自美国Cell Signaling Technology公司,全自动生化分析仪3100(日本日立有限公司); 正置光学显微镜DM4B(德国LEICA公司); Infinite M1000 PRO多功能酶标仪(瑞士TECAN公司); BIO-RAD powerpack164-5070电泳仪(美国BIO-RAD公司); Image Quant化学发光成像系统(美国GE公司)。
1.3 实验方法 1.3.1 模型建立及处理小鼠适应性饲养1周体征状态恢复稳定后,随机分为三组:正常饲料(normal diet,ND)对照组、WD组、WD+CCl4组。ND组小鼠喂食普通维持饲料,WD组喂食WD饲料,WD+CCl4组在喂食WD饲料的基础上,每周一次注射50 μL的CCl4油溶液。在造模后第6、11、16周,眼眶后静脉丛取血并处死小鼠,2 500 r·min-1离心20 min收集血清,冻存于-80 ℃冰箱。取出肝脏称重后,留取部分肝组织制作病理石蜡切片及冰冻切片,剩余肝组织冻存于-80 ℃冰箱备用。
1.3.2 血糖检测及肝指数造模期间每周称量一次小鼠体质量,并记录。每两周检测一次血糖。眼眶后静脉丛取血并处死小鼠后,迅速取出完整肝脏并称量,计算肝指数:肝指数/mg·g-1=肝脏重量(mg)/体质量(g)。
1.3.3 血清生化检测全自动生化分析仪检测造模第6、11、16周,小鼠血清中的ALT、AST、TG、T-CHO水平。
1.3.4 肝组织HE染色肝组织包埋、切片,石蜡切片于二甲苯溶液中脱蜡,依次用100%、95%、85%、70%的乙醇进行水化,苏木精染色5 min,流水洗去染料,0.1%的盐酸乙醇进行分化,流水冲洗约2 min,入伊红染液中2 s,流水冲洗多余染料,依次经70%、85%、95%、100%乙醇进行脱水,二甲苯透明,中性树脂封片。于普通光学显微镜下观察肝脏脂肪变性、细胞形态改变以及炎性细胞浸润情况。
1.3.5 肝组织油红O染色肝组织行冰冻切片后,复温干燥10 min,蒸馏水或60%乙醇稍洗,后在油红O工作液中避光孵育10-15 min,60%乙醇分化数秒,水洗1 min,苏木精复染1-2 min,自来水冲洗返蓝,甘油明胶封片保存。显微镜下可观察到脂滴呈橘红色至鲜红色,细胞核呈蓝色。
1.3.6 ELISA检测肝组织IL-1β、IL-6、TNF-α水平称取一定量肝组织,无菌生理盐水研磨成10%的组织匀浆。在酶标包被板上分别设置空白对照孔、标准孔和待测样本孔。待测样品孔每孔加样品稀释液40 μL和10 μL待测样品。加入酶标试剂100 μL,37 ℃孵育1 h,洗涤液洗涤5次,加入显色剂A、显色剂B各50 μL,震荡混匀,37 ℃避光显色15 min; 每孔加终止液50 μL终止反应; 450 nm波长处测量各孔吸光度(OD)值。
1.3.7 Western blot检测FAS、α-SMA蛋白表达肝组织剪碎研磨后,加入RIPA裂解液,冰上裂解30 min,收集裂解液,12 000 r·min-1离心20 min,吸取上清,加入上样缓冲液,配制10% SDS-PAGE凝胶,上样电泳,转移至PVDF膜,TBST-脱脂牛奶37 ℃封闭2 h,加入相应一抗4 ℃孵育过夜,TPBS洗3次,每次7 min。根据一抗来源种属选择辣根过氧化物酶标记的抗兔或抗小鼠IgG二抗,37 ℃孵育2 h,TPBS洗3次,每次7 min,化学成像发光系统显影蛋白条带,采用ImageJ软件定量分析蛋白灰度值,计算各组目的蛋白与内参GAPDH的比值以反映各组目的蛋白表达水平,并进行统计分析。
1.3.8 统计学分析采用SPSS 26.0软件进行数据分析。实验数据以x±s表示,多组间差异比较采用单因素方差分析。GraphPad Prism 7.0软件绘制统计图。
2 结果 2.1 小鼠体征状况造模过程中ND组小鼠状态均良好、食欲良好,活动正常。喂食WD饲料组小鼠粪便颜色均偏浅黄。ND组小鼠活动频繁且反应灵敏,毛发光泽。WD组和WD+CCl4组小鼠随造模时间延长,毛色灰暗且杂乱粗糙,皮毛日渐疏松且油腻。WD+CCl4组小鼠精神萎靡(Fig 1)。
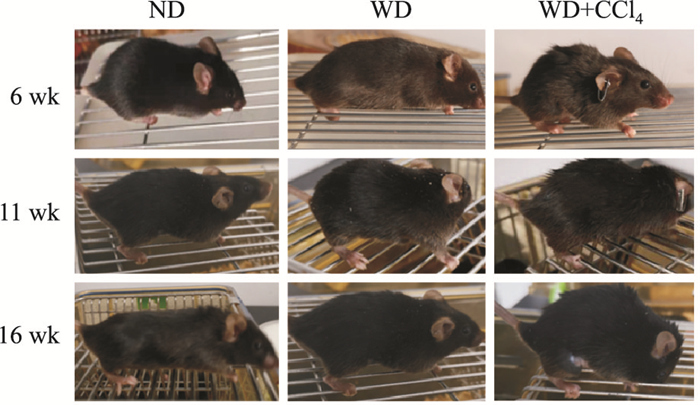
|
| Fig 1 Comparison of NAFLD mouse appearance induced by different methods |
造模过程中,WD组小鼠体重在第13周开始明显快速增长,与对照组相比,差异有统计学意义。WD组小鼠表现出体重增加和肥胖,CCl4处理减轻了WD喂养引起的体重增加,造模第13周,WD+CCl4组小鼠体重较ND组略微升高,差异无统计学意义(Fig 2A)。WD喂养的小鼠血糖在造模后第6周开始升高,与对照组相比差异有统计学意义(P<0.05)。WD+CCl4组小鼠血糖从造模第6周开始即较对照组明显升高,略高于WD组,差异无显著性(Fig 2B)。
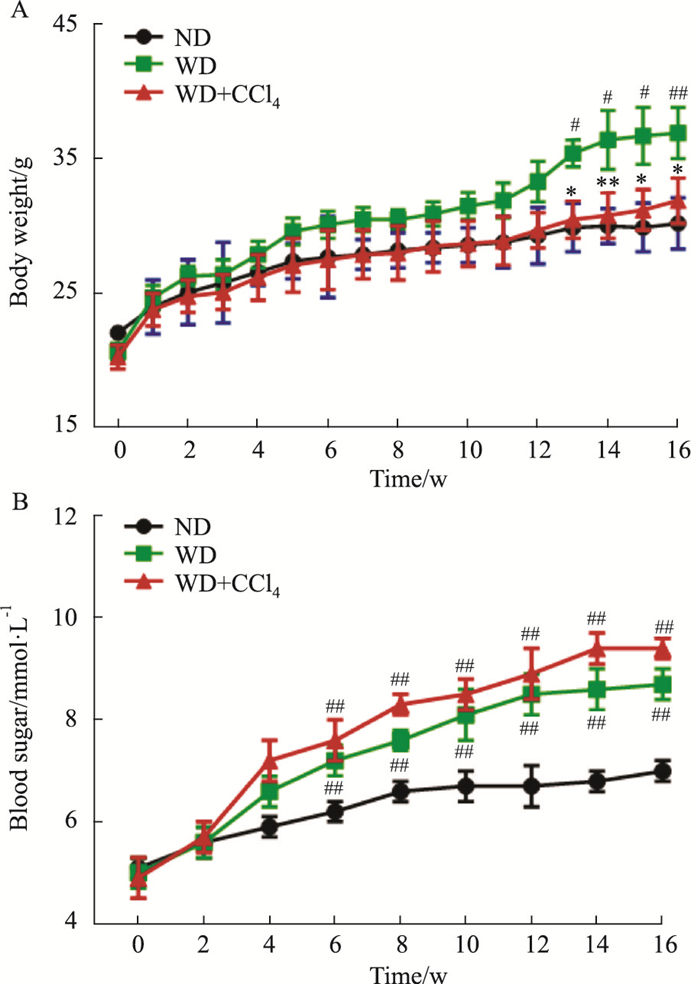
|
| Fig 2 Body weight and blood sugar of NAFLD mice induced by different methods (x±s, n=5) A: Body weight changes of mice induced by different methods at different time points; B: Changes of the blood sugar levels of mice induced by different methods at different time points. #P < 0.05, ##P < 0.01 vs ND group; *P < 0.05, **P < 0.01 vs WD group. |
Tab 1结果显示,造模第6周时,WD+CCl4组小鼠肝指数较ND组和WD组明显升高,差异有统计学意义; 造模第11周时,WD组、WD+CCl4组小鼠肝指数较ND组略微升高,差异无统计学意义; 第16周,WD组、WD+CCl4组小鼠肝指数较ND组明显升高(P<0.05)。
| Group | ND | WD | WD+CCl4 |
| 6 w | 44.20±2.80 | 44.55±0.07 | 60.31±1.80##** |
| 11 w | 43.47±0.75 | 43.83±1.15 | 47.53±5.15 |
| 16 w | 43.95±1.14 | 51.73±1.10# | 53.90±5.68# |
| #P<0.05, ##P<0.01 vs ND group; **P<0.01 vs WD group | |||
Tab 2结果表明,从造模第6周开始,WD组和WD+CCl4组小鼠ALT含量即开始升高,与ND组比较差异有统计学意义(P<0.01),且WD+CCl4组小鼠ALT高于WD组。Tab 3结果表明,造模第11周开始,WD组AST活性较ND组明显升高,且WD+CCl4组的AST升高更为明显,与WD组比较差异有统计学意义。
| Group | ND | WD | WD+CCl4 |
| 6 w | 26.5±0.7 | 41.2±2.8## | 52.2±5.6##** |
| 11 w | 26.5±0.7 | 65.0±5.6## | 185.5±14.8##** |
| 16 w | 25.3±2.6 | 133.6±11.0## | 213.2±45.7##** |
| ##P<0.01 vs ND group; **P<0.01 vs WD group | |||
| Group | ND | WD | WD+CCl4 |
| 6 w | 118.0±21.9 | 124.6±11.1 | 167.5±10.6#* |
| 11 w | 118.3±22.3 | 145.5±12.0# | 197.7±19.8##** |
| 16 w | 116.5±16.8 | 229.3±7.7## | 259.0±18.1##** |
| #P<0.05, ##P<0.01 vs ND group; *P<0.05, **P<0.01 vs WD group | |||
全自动生化分析仪检测小鼠血清TG、T-CHO含量。Tab 4结果表明,从造模后第11周开始,WD组和WD+CCl4组小鼠血清TG水平明显升高,与ND组比较差异有统计学意义,且WD+CCl4组小鼠TG水平高于WD组,差异有统计学意义。Tab 5结果表明,从造模后第6周开始,WD和WD+CCl4组小鼠血清T-CHO水平明显上升,与ND组比较差异有统计学意义; 在第16周时,WD组T-CHO水平明显高于WD+CCl4组(P<0.05)。
| Group | ND | WD | WD+CCl4 |
| 6 w | 0.21±0.03 | 0.26±0.12 | 0.29±0.02 |
| 11 w | 0.23±0.01 | 0.33±0.01## | 0.63±0.02##** |
| 16 w | 0.23±0.02 | 0.46±0.13# | 0.65±0.07##* |
| #P<0.05, ##P<0.01 vs ND group; *P<0.05, **P<0.01 vs WD group | |||
| Group | ND | WD | WD+CCl4 |
| 6 w | 3.23±0.04 | 3.36±0.09# | 3.41±0.01## |
| 11 w | 3.21±0.01 | 3.51±0.03# | 3.65±0.08## |
| 16 w | 3.27±0.06 | 5.17±0.02## | 4.16±0.07#* |
| #P<0.05, ##P<0.01 vs ND group; *P<0.05 vs WD group | |||
HE染色结果显示,对照组小鼠肝组织结构完整清晰,肝索呈放射状排列,肝小叶和汇管区形态结构均完整,细胞质均匀且无脂肪变性。WD组小鼠第6周时出现少量脂肪空泡; 至第11周时脂肪空泡增多,且肝细胞结构紊乱,符合非酒精性单纯性脂肪肝(non-alcoholic fatty liver,NAFL)特征,第16周时出现大泡性、小泡性混合脂肪变性,伴有部分炎性细胞浸润。WD+CCl4组小鼠第6周时开始出现脂肪变性,肝细胞结构紊乱等NAFL特征; 造模后第11周,除混合脂肪变性外,开始出现炎性细胞浸润,并出现气球样变性等病理表现; 第16周时,出现大量大泡性脂肪空泡、气球样变性等非酒精性脂肪性肝炎(non-alcoholic steatosis,NASH)典型表现,炎性细胞浸润进一步加重,并出现纤维间隔增厚(Fig 3A)。油红O染色结果表明(Fig 3B),WD组在造模后第6周开始出现脂滴,至造模第11、16周进一步加重,小鼠肝脏所含脂滴在第16周达到峰值。WD+CCl4组小鼠在造模后第6周,肝细胞内即开始出现大量脂滴,明显高于ND组和WD组; 造模后第16周脂滴相较于WD组有所减少,明显高于ND组(Fig 3C)。

|
| Fig 3 Histological features of liver in NAFLD mice induced by different methods (x±s, n=5) A: HE staining of the liver tissues in NAFLD mice at different time points (×100); B: Oil red O staining of the liver tissues in NAFLD mice at different time points (×100); C: The positive level of oil red O staining. ##P < 0.01 vs ND group; **P < 0.01 vs WD group. |
多项研究表明,TNF-α等炎性细胞因子在NAFLD患者中呈高水平,并在疾病进程中发挥重要作用,促进疾病的进一步发展[4]。为进一步了解NAFLD不同阶段炎症因子水平的变化,ELISA法检测了小鼠肝组织IL-1β、TNF-α、IL-6的水平。结果表明(Fig 4),WD组小鼠肝脏IL-1β水平自造模第6周即开始明显升高,IL-6、TNF-α水平在造模后第11周开始明显升高,与ND组相比差异有统计学意义。WD+CCl4组小鼠肝组织IL-1β、IL-6、TNF-α水平自造模后第6周开始持续升高,与ND组相比差异有统计学意义; 从造模后第6周开始,WD+CCl4组IL-6和TNF-α水平较WD组明显升高; 造模后第11周开始,WD+CCl4组IL-1β水平明显高于WD组,差异有统计学意义。
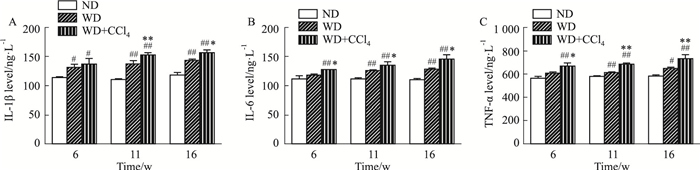
|
| Fig 4 Levels of IL-1β (A), IL-6 (B) and TNF-α (C) in liver homogenates of NAFLD mice induced by different methods (x±s, n=5) #P < 0.05, ##P < 0.01 vs ND group; *P < 0.05, **P < 0.01 vs WD group |
综合分析两种造模方法在不同时间点的病理、生化、炎性细胞因子等各项指标,结果表明在第16周时,WD+CCl4组小鼠可进展至NASH阶段,出现纤维化; WD组进展至NAFL阶段,脂质蓄积发挥主要作用。因此我们进一步检测第16周时脂肪合成关键酶FAS和纤维化相关蛋白α-SMA表达水平。Western blot结果显示(Fig 5),与ND组比较,WD和WD+CCl4组FAS水平均明显升高,与油红O染色结果一致; WD组FAS的表达明显高于WD+CCl4组。WD组α-SMA的表达与ND组比较,差异无显著性; 而WD+CCl4组α-SMA水平较ND组、WD组明显升高(P<0.01)。
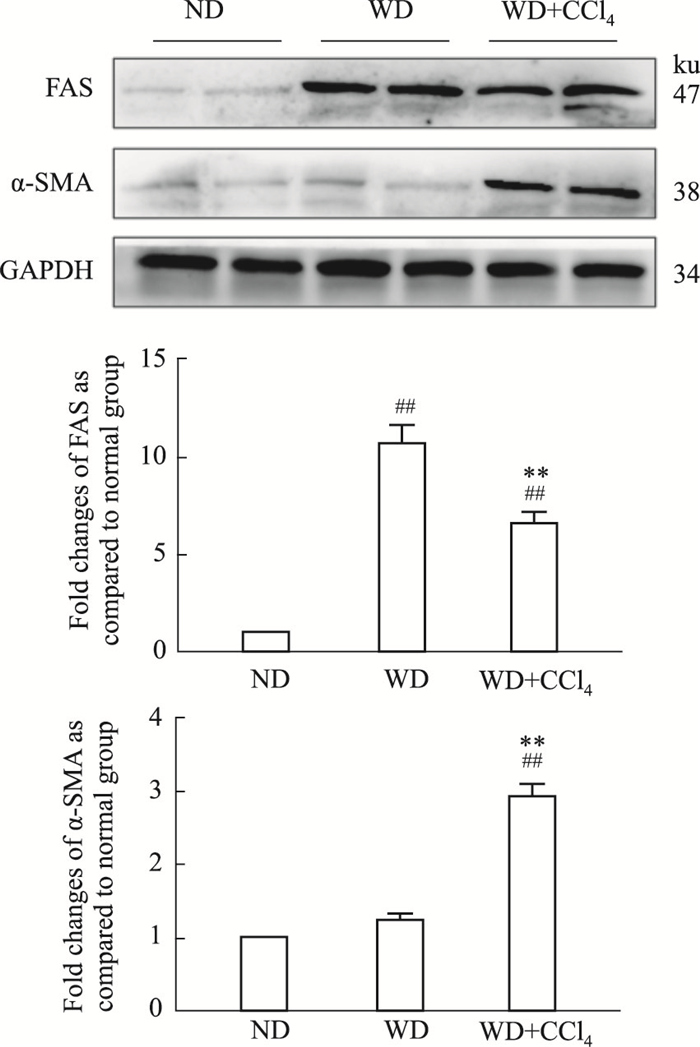
|
| Fig 5 Changes of FAS and α-SMA protein expression in NAFLD mice on 16th week (x±s, n=5) ##P < 0.01 vs ND group; **P < 0.01 vs WD group |
NAFLD是以肝细胞内脂肪过度沉积为主要特征的临床病理综合征,初级阶段为NAFL,如未进行有效的控制和治疗,可进一步发展为NASH、肝纤维化和肝硬化,甚至有部分患者会进展至肝癌。已有研究表明,在NAFLD病程的初期NAFL阶段,只要积极给予干预治疗,NAFLD可以被逆转; NASH是单纯性脂肪肝向肝纤维化和肝硬化发展的重要阶段,因此构建能够体现NAFLD全病程的动物模型至关重要。动物模型的成功建立是研究NAFLD发病机制,寻找潜在药物作用靶点,研发抗NAFLD药物的实验基础。当前NAFLD动物模型的建立方法仍在进一步摸索完善中,国内外常用的NAFLD动物模型有:营养失调性模型,包括高糖、高脂、胆碱缺乏等诱发模型[5]; 化学药物诱导模型,包括CCl4、四环素、乙硫氨酸等[6]。常用的经典方法是高脂饮食诱导[7],但该方法耗时过长,且较难进展到NASH、肝纤维化等病理阶段。甲硫氨酸胆碱缺乏饮食(MCD)造模时间短,在第8周即可进展至NASH。但由于缺乏胆碱和蛋氨酸成分,不符合人类实际的饮食情况,且会导致模型动物体重的严重下降,与人类的NAFLD发病机制差别较大[8],基于该方法建立的模型被认为不能较好拟合NAFLD患者的发病特点,且不能体现出NASH向肝纤维化和肝硬化的演变过程[9-10]。因此,建立一种符合人类NAFLD疾病进程,且能缩短造模时间的标准动物模型至关重要。含有高脂肪、高果糖和高胆固醇的WD饲料被广泛应用于当前的小鼠NAFLD模型的建立,WD饲料模拟了当前人们的快餐饮食习惯。研究表明,单纯的WD饲料喂养不能诱导小鼠进展至严重的NASH和纤维化阶段[11]。CCl4是一种特征明确的肝脏毒素,可直接导致肝细胞损伤和肝纤维化,一直以来被用以诱导建立肝损伤和肝纤维化模型[12-13]。也有研究表明,CCl4可以诱导小鼠肝细胞出现NASH的典型病变气球样变性[14],可在WD喂养诱导肝脂肪变性的基础上进一步促进NAFLD疾病的发展。因此本实验考虑在高脂饮食的基础上,联合小剂量的CCl4诱导建立NAFLD模型,并与单纯的WD喂养模型进行比较。
本实验研究结果表明,单纯WD喂养和WD联合小剂量CCl4的方法均能成功建立NAFLD模型,在造模后不同时间点先后出现NAFLD不同疾病进程标志性病理特征。NAFLD疾病主要表现为肝脏的代谢紊乱,包括血糖、血清TG和T-CHO水平升高等。两组模型组小鼠血糖在造模后第6周开始出现升高,WD+CCl4组血糖升高更明显,同时小鼠血清中TG和T-CHO含量明显升高,提示小鼠肝脏出现代谢紊乱,同时油红O染色结果也表明肝脏出现脂质蓄积。肝损伤标志物ALT、AST水平明显升高,WD+CCl4组小鼠升高更为明显。病理结果显示,WD组小鼠在造模后第11周出现NAFL阶段的脂肪空泡,16周时炎症和脂肪变性进一步加重,FAS蛋白水平明显高于ND组和WD+CCl4组,T-CHO水平也明显升高。WD+CCl4组小鼠在造模后第6周开始出现NAFL阶段明显的脂肪变性空泡; 至第11周时,除脂肪变性空泡外,开始出现炎性细胞浸润和气球样变性,提示NAFLD疾病在发生进展; 造模后第16周时,肝脏脂质蓄积作用减弱,FAS蛋白水平低于WD组,而细胞气球样变性和炎症进一步加重,表现出典型的NASH病理特征。因此,与单纯的WD喂养比较,WD+CCl4能够在第16周诱导小鼠出现NASH,而单纯喂养WD组小鼠表现出NAFL病理特征。
炎症被认为是导致NAFLD疾病发生发展的重要因素之一。研究报道,在NAFLD患者血清中IL-1β、IL-6和TNF-α水平显著上调[15],在动物模型中,3种炎性细胞因子的水平也呈现高水平[16]。本实验结果显示,与单纯的WD喂养比较,WD+CCl4在引起脂肪变性的基础上, 可导致更为严重的肝脏炎症,肝组织中炎性细胞因子IL-1β、IL-6和TNF-α水平显著升高,并明显高于WD组。与病理结果一致,炎性细胞浸润和气球样变性更为严重。α-SMA是活化的肝星状细胞的标志性蛋白,活化的星状细胞能够促进胶原和细胞外基质的生成,导致纤维化的发生[17]。Western blot检测发现,WD+CCl4组小鼠在造模后第16周α-SMA蛋白的表达水平明显上升,高于ND组和WD组,结合HE染色结果该组小鼠肝脏出现明显的胶原纤维增粗,提示该模型组小鼠出现纤维化。当前学界较为认可的NAFLD发病机制是“多重打击学说”,该学说认为脂肪变性、氧化应激、内质网应激、炎症等多重打击平行作用于机体[18],因此高脂饮食联合化学诱导符合该学说的理念。本研究中WD喂养联合小剂量的CCl4可诱导肝脏发生炎症,并出现纤维化,导致疾病进展至NASH阶段。
综上所述,高脂饮食喂养联合化学诱导有望成为新的高效的NAFLD造模方法,能够弥补单纯高脂饮食喂养耗时长的不足。本研究中,WD饲料喂养联合每周一次小剂量CCl4腹腔注射能够成功诱导建立小鼠NAFLD模型,符合人类NAFLD病理演变过程,可进展至NASH甚至纤维化,是一种较为理想的小鼠NAFLD模型建立方法,为今后研究NAFLD提供更接近临床发病机制的动物造模方法。
| [1] |
卢万鹏, 温振帆, 刘家园, 等. 丹酚酸B对ApoE敲除小鼠非酒精性脂肪肝的改善运用及其机制研究[J]. 中国药理学通报, 2020, 36(1): 31-7. Lu W P, Wen Z F, Liu J Y, et al. Salvianolic acid B improves non-alcoholic fatty liver in ApoE knockout mice and its mechanism[J]. Chin Pharm Bull, 2020, 36(1): 31-7. doi:10.3969/j.issn.1001-1978.2020.01.008 |
| [2] |
Zhou Z, Deng L, Hu L. Hepatoprotective effects of ZLY16, a dual peroxisome proliferator-activated receptor α/δ agonist, in rodent model of nonalcoholic steatohepatitis[J]. Eur J Pharmacol, 2020, 882: 173301-11. |
| [3] |
Pinterić M, Podgorski Ⅱ, Popovi Had ija M, et al. Chronic high fat diet intake impairs hepatic metabolic parameters in ovariectomized sirt3 KO mice[J]. Int J Mol Sci, 2021, 22(8): 4277. doi:10.3390/ijms22084277 |
| [4] |
AlNafea H M, Korish A A. Activation of the peroxisome proliferator-activated receptors (PPAR-α/γ) and the fatty acid metabolizing enzyme protein CPT1A by camel milk treatment counteracts the high-fat diet-induced nonalcoholic fatty liver disease[J]. PPAR Res, 2021, 2021: 5558731-42. |
| [5] |
Kanuri G, Bergheim I. In vitro and in vivo models of non-alcoholic fatty liver disease (NAFLD)[J]. Int J Mol Sci, 2013, 14(6): 11963-80. doi:10.3390/ijms140611963 |
| [6] |
Haas J T, Francque S, Staels B. Pathophysiology and mechanisms of nonalcoholic fatty liver disease[J]. Annu Rev Physiol, 2016, 78: 181-205. doi:10.1146/annurev-physiol-021115-105331 |
| [7] |
Wei G, An P, Vaid KA, et al. Comparison of murine steatohepatitis models identifies a dietary intervention with robust fibrosis, ductular reaction, and rapid progression to cirrhosis and cancer[J]. Am J Physiol Gastrointest Liver Physiol, 2020, 318(1): G174-88. doi:10.1152/ajpgi.00041.2019 |
| [8] |
Teufel A, Itzel T, Erhart W, et al. Comparison of gene expression patterns between mouse models of nonalcoholic fatty liver disease and liver tissues from patients[J]. Gastroenterology, 2016, 151(3): 513-25. doi:10.1053/j.gastro.2016.05.051 |
| [9] |
Nakagawa H. Recent advances in mouse models of obesity-and nonalcoholic steatohepatitis-associated hepatocarcinogenesis[J]. World J Hepatol, 2015, 7(17): 2110-8. doi:10.4254/wjh.v7.i17.2110 |
| [10] |
Santhekadur P K, Kumar D P, Sanyal A J. Preclinical models of non-alcoholic fatty liver disease[J]. J Hepatol, 2018, 68(2): 230-7. doi:10.1016/j.jhep.2017.10.031 |
| [11] |
Asgharpour A, Cazanave S C, Pacana T, et al. A diet-induced animal model of non-alcoholic fatty liver disease and hepatocellular cancer[J]. J Hepatol, 2016, 65(3): 579-88. doi:10.1016/j.jhep.2016.05.005 |
| [12] |
孙家昌, 孙妩弋, 厉歆然, 等. 不同浓度四氯化碳诱导小鼠肝纤维化模型的比较[J]. 实验动物与比较医学, 2018, 38(4): 255-60. Sun J C, Sun W Y, Li X R, et al. Comparison of different concentrations of carbon tetrachloride-induced liver fibrosis in mice[J]. Lab Anim Comp Med, 2018, 38(4): 255-60. doi:10.3969/j.issn.1674-5817.2018.04.003 |
| [13] |
Sun J C, Du J J, Li X Q, et al. Depletion of β-arrestin 2 protects against CCl4-induced liver injury in mice[J]. Biochem Biophys Res Commun, 2020, 522(2): 485-91. doi:10.1016/j.bbrc.2019.11.093 |
| [14] |
Urtasun R, Lopategi A, George J, et al. Osteopontin, an oxidant stress sensitive cytokine, up-regulates collagen-I via integrin α(V)β (3) engagement and PI3K/pAkt/NFκB signaling[J]. Hepatology, 2012, 55(2): 594-608. doi:10.1002/hep.24701 |
| [15] |
Zhang Q, Yu K, Cao Y, et al. miR-125b promotes the NF-κB-mediated inflammatory response in NAFLD via directly targeting TNFAIP3[J]. Life Sci, 2021, 270: 119071-107. doi:10.1016/j.lfs.2021.119071 |
| [16] |
Bian Y, Lei J, Zhong J, et al. Kaempferol reduces obesity, prevents intestinal inflammation, and modulates gut microbiota in high-fat diet mice: Kaempferol reduce inflammation and dysbacteria[J]. J Nutr Biochem, 2021, 99: 108840-1. |
| [17] |
Liu G, Cui Z, Gao X, et al. Corosolic acid ameliorates non-alcoholic steatohepatitis induced by high-fat diet and carbon tetrachloride by regulating TGF-β1/Smad2, NF-κB, and AMPK signaling pathways[J]. Phytother Res, 2021, 35(9): 5214-26. doi:10.1002/ptr.7195 |
| [18] |
Fang Y L, Chen H, Wang C L, et al. Pathogenesis of non-alcoholic fatty liver disease in children and adolescence: From "two hit theory" to "multiple hit model"[J]. World J Gastroenterol, 2018, 21;24(27): 2974-83. |

