


郑晓珂(1961-),女,教授,博士生导师,研究方向:中药活性成分及其作用机制,通信作者,E-mail: zhengxk.2006@163.com
 ,
ZENG Meng-nan,
JIA Ju-fang,
GUO Peng-li,
LIU Meng,
ZHANG Qin-qin,
FENG Wei-sheng
,
ZENG Meng-nan,
JIA Ju-fang,
GUO Peng-li,
LIU Meng,
ZHANG Qin-qin,
FENG Wei-sheng
 ,
ZHENG Xiao-ke
,
ZHENG Xiao-ke

脓毒症是一种系统性炎症反应综合征,严重可导致器官功能障碍,肾脏往往是脓毒症最易受累靶器官之一[1]。急性肾损伤(acute kidney injury,AKI) 是常见的肾功能快速下降的临床综合征,是脓毒症常见的致死性并发症,而且脓毒症引起的AKI超过50%[2]。脂多糖(lipopolysaccharide,LPS) 诱导的AKI是研究脓毒症急性肾损伤的常见模型[3]。到目前为止,还没有明确阐明LPS诱导毒性的机理,但其本质上是多因素的,涉及活性氧(reactive oxygen species,ROS)、细胞凋亡和炎症因子等[4]。此外,肾小管上皮细胞损伤是脓毒症急性肾损伤发生发展较为重要的机制之一,常出现肾单位中肾小管上皮细胞凋亡[5]。
山药的记载最早出现在《山海经》,在《神农本草经》中被列为上品,其味甘、性平,归脾、肺、肾经,具有补脾养胃、生津益肺、补肾涩精等功效[6],且有疗五劳七伤,治诸百病之说。本课题组前期对山药进行了系统的化学成分研究,并发现从山药中分离得到的熊果苷(arbutin, Ar)通过雌激素受体β (estrogen receptor β,ERβ) 和G蛋白偶联受体30 (G protein coupled receptor 30,GPR30) 发挥雌激素样活性[7],且对急性肾损伤也具有较好的保护作用[8]。Ar常用于美白化妆品中,具有抗炎、抗氧化等药理活性[9],但是Ar对急性肾损伤的作用与雌激素样活性之间的关系仍未明确,因此本研究通过LPS诱导大鼠肾小管上皮细胞NRK-52e细胞损伤构建脓毒症急性肾损伤体外模型,探究Ar干预急性肾损伤与雌激素样活性之间的关系。
1 材料与方法 1.1 药品与试剂NRK-52e大鼠肾小管上皮细胞购自中国科学院上海细胞库;LPS(批号: L2880)购自Sigma公司;THC(批号: HYB0151)购自MCE公司;DMEM高糖培养基(批号: 2082064)购自Gibco Invitrogen公司;胎牛血清(批号: 1011-881) 购自杭州四季青公司;PBS(批号: SH30256107)购自Hyclone公司;Ar(批号: A7380),胰蛋白酶(批号: T1350),MTT(批号: M8180),DMSO(批号: D8370),氨苄青霉素(批号: A6920),链霉素(批号: S8290),Fluo-4 AM(批号: F8500),ROS试剂盒(批号: CA1410),4%组织细胞固定液(批号: P1110),TritonX-100 (批号: T8200),PBST(批号: G4207-500),DPBS(批号: G4200)购自北京索莱宝科技有限公司;BSA(批号: 9423010160)北京鼎国昌盛生物技术责任有限公司;细胞凋亡试剂盒(批号: 559763) 购自BD Biosciences公司;caspase-3一抗(ab13847)、caspase-9一抗(ab32539)、Bax一抗(ab32503)、Bcl-2一抗(ab59348)、ERβ一抗(ab3576)、β-actin一抗(ab8227) 购自Abcam公司;兔源荧光二抗(925-68071)、鼠源荧光二抗(925-32210)购自LI-COR Biosciences公司。
1.2 仪器与设备BioTek全功能酶标仪(美国伯腾仪器有限公司),流式细胞仪(美国BD Biosciences),Amnis FlowSight成像流式细胞仪(美国Luminex有限公司),双色近红外成像系统(美国LI-COR Biosciences),90-3型双向定时恒温磁力搅拌器(上海楚定分析仪器有限公司)。
1.3 细胞培养与实验分组NRK-52e细胞培养在高糖DMEM+0.1 FBS的培养液中(含青、链霉素为100 kU·L-1)。培养箱条件为37 ℃,5% CO2,饱和湿度。取对数生长期NRK-52e细胞,以2 000个细胞/孔接种于96孔板,24 h后分为正常组(CON)、不同浓度的模型组(LPS, 0.1、0.5、1、5、10 mg·L-1),培养24 h后,MTT检测细胞活力。同样NRK-52e细胞接种于96孔板24 h后,分为正常组(CON)、模型组(LPS, 1 mg·L-1)、不同浓度的Ar组(Ar, 0.1、1、5、10、20、50 μmol·L-1+LPS, 1 mg·L-1),MTT检测细胞活力。
1.4 Amnis FlowSight成像流式细胞仪检测ROS水平取对数生长期NRK-52e细胞以20 000个细胞/孔接种于6孔板,通过处理分为正常组(CON)、模型组(LPS, 1 mg·L-1)、低剂量Ar组(LAr, 5 μmol·L-1+LPS, 1 mg·L-1)、高剂量Ar组(HAr, 10 μmol·L-1+LPS, 1 mg·L-1)、正常+THC组(CON+THC, 1 μmol·L-1)、模型+THC组(LPS, 1 mg·L-1+ THC, 1 μmol·L-1)、低剂量Ar+THC组(LAr, 5 μmol·L-1+LPS, 1 mg·L-1+THC, 1 μmol·L-1)、高剂量Ar+THC组(HAr, 10 μmol·L-1+LPS, 1 mg·L-1+THC, 1 μmol·L-1),使用活性氧检测试剂盒(CA1410; Beijing Solarbio Science & Technology Co., Ltd.),按照说明书进行染色处理,通过Amnis FlowSight成像流式细胞仪检测NRK-52e细胞中ROS水平。
1.5 流式细胞仪检测Ca2+水平经上述实验得到细胞样本之后,使用Fluo-4 AM(F8500;Beijing Solarbio Science & Technology Co.,Ltd.) 检测NRK-52e细胞中Ca2+浓度。操作如下:收集细胞,PBS洗涤,离心并弃上清;加入500 μL工作液(Fluo-4 AM 1 mg+Pluronic 1.65 mg+HBSS 200 μL)于37 ℃避光孵育20 min;加入5倍体积的含有1% FBS的HBSS培养40 min;用HEPEs buffer saline洗涤细胞1次,离心并弃上清,HEPEs buffer saline重悬细胞并制成1×108个细胞·L-1的细胞悬液;37 ℃培养10 min用于流式细胞仪检测NRK-52e细胞内Ca2+的浓度。
1.6 流式细胞仪检测细胞凋亡水平同样经上述实验得到细胞样本之后,使用PE Annexin V/7-AAD凋亡检测试剂盒(559763;BD PharmingenTM)检测细胞凋亡水平,根据试剂盒说明书进行染色,用于流式细胞仪检测细胞凋亡水平。
1.7 流式细胞仪检测线粒体膜电位(MMP) 水平同样经上述实验得到细胞样本之后,使用具有5, 5′, 6, 6′-四氯-1, 1, 3, 3′-四乙基苯并咪唑-碳氰化物碘的染料(JC-1;GK3610;Genview; 北京)进行染色,并使用流式细胞仪检测线粒体膜电位水平。各组NRK-52e细胞用JC-1在37 ℃下染色20 min并使用流式细胞仪进行分析。JC-1(红色)代表正常细胞,线粒体膜电位降低后,JC-1解离,单体JC-1(蓝色)代表其中线粒体膜电位降低的细胞。
1.8 In cell western检测细胞凋亡标志蛋白及ERβ表达水平取对数生长期NRK-52e细胞,以2 000个细胞/孔接种于96孔黑板中(165305; Thermo fisher scientific,USA),通过处理分组如“1.4”,小心吸净培养液,加入细胞组织固定液150 μL后室温孵育20 min,弃去细胞组织固定液,加入0.1% Triton-X-100 200 μL,在室温慢摇5 min后弃去,重新加入0.1% Triton-X-100 200 μL后室温慢摇5 min后弃去,连续重复5次;加入150 μL封阻液(含5% BSA的PBST),在室温进行封闭60 min后加入50 μL一抗Bcl-2 (1 ∶200)、Bax (1 ∶250)、caspase-3 (1 ∶200)、caspase-9 (1 ∶200),ERβ (1 ∶200),室温孵育30 min后于4 ℃冰箱过夜;PBST 200μL洗涤5遍,加入荧光二抗50 μL,室温避光孵育1 h后,PBST洗涤4遍后,PBS洗涤1遍,采用近红外双色成像系统(ODSSEY)成像,Image studio软件进行数据分析。
1.9 分子对接技术模拟Ar与ERβ的亲和作用通过Chem Office制作化合物Ar的3D结构,基于PDB数据库(https://www.rcsb.org/) 下载ERβ的3D结构,采用PyMOL软件对蛋白质进行去水,提取配体等处理,Auto Dock 1.5.6软件将关键蛋白及化合物pdb格式转为pdbqt格式并寻找活性口袋,最后通过Vina进行对接。
1.10 统计学处理实验数据以x±s表示,SPSS 20.0进行单因素方差分析(One-way ANOVA)统计处理。
2 结果 2.1 不同浓度的LPS对NRK-52e细胞损伤的影响如Tab 1所示,与正常对照组相比,LPS(0.1、0.5、1、5、10 mg·L-1)可明显降低NRK-52e细胞活力(P < 0.01),并且1 mg·L-1效果较为明显。因此,选择LPS(1 mg·L-1)用于后续实验。
| Group | Dose/mg·L-1 | Cell viability |
| CON | - | 1.00 ± 0.039 |
| LPS | 0.1 | 0.87 ± 0.039** |
| 0.5 | 0.86 ± 0.036** | |
| 1 | 0.80 ± 0.039** | |
| 5 | 0.83 ± 0.025** | |
| 10 | 0.85 ± 0.020** | |
| **P < 0.01 vs CON. | ||
如Tab 2所示,与LPS诱导NRK-52e细胞组相比,Ar(5、10、20、50 μmol·L-1)可明显增强NRK-52e细胞活力(P < 0.01或P < 0.05),并且5 μmol·L-1和10 μmol·L-1效果较好。因此,选择Ar(5、10 μmol·L-1)用于进一步机制探讨。
| Group | Dose | Cell viability |
| CON | - | 1.00 ± 0.074** |
| LPS/mg·L-1 | 1 | 0.77 ± 0.070 |
| Arbutin/μmol·L-1 | 0.1 | 0.72 ± 0.114 |
| 1 | 0.76 ± 0.076 | |
| 5 | 0.93 ± 0.032** | |
| 10 | 0.94 ± 0.044** | |
| 20 | 0.89 ± 0.125* | |
| 50 | 0.91 ± 0.047* | |
| *P < 0.05, **P < 0.01 vs LPS. | ||
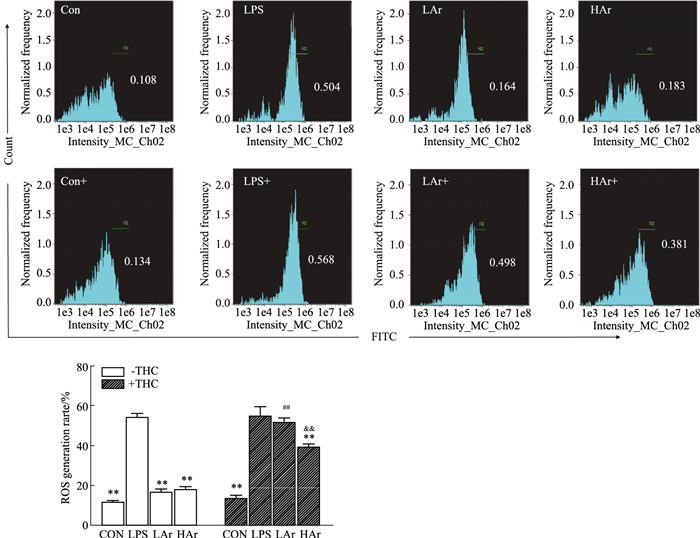
运用FlowSight成像流式细胞术检测Ar对LPS诱导NRK-52e细胞中ROS水平的影响,结果如Fig 1所示,LPS诱导NRK-52e细胞中ROS水平明显升高,Ar可有效降低模型组NRK-52e细胞中ROS水平。但是,在加入ERβ阻断剂THC后,Ar作用明显降低。
|
| Fig 1 Effect of arbutin on level of ROS in LPS-induced NRK-52e cells (x±s, n=3) **P < 0.01 vs LPS group; ##P < 0.01 vs LAr-THC group; &&P < 0.01 vs HAr-THC group. |
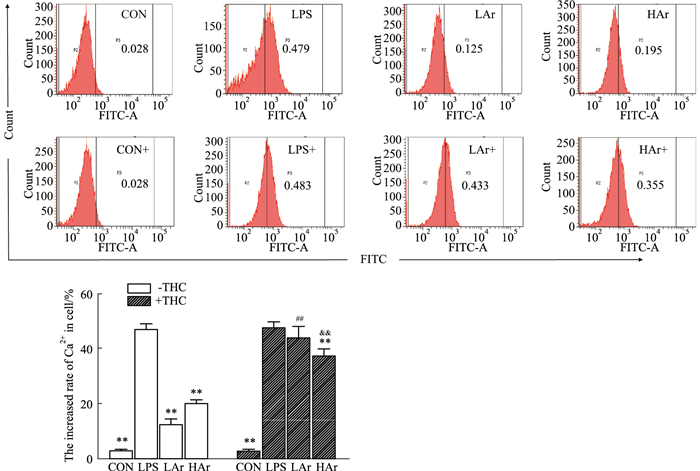
采用Fluo-4 AM探针检测Ar对LPS诱导NRK-52e细胞Ca2+浓度的影响,结果如Fig 2所示,LPS诱导NRK-52e细胞Ca2+浓度明显升高,Ar可有效降低LPS诱导的NRK-52e细胞中Ca2+浓度,但是THC可有效减弱Ar的作用。
|
| Fig 2 Effect of arbutin on levels of Ca2+ in LPS-induced NRK-52e cells (x±s, n=3) **P < 0.01 vs LPS group; ##P < 0.01 vs LAr-THC group; &&P < 0.01 vs HAr-THC group. |
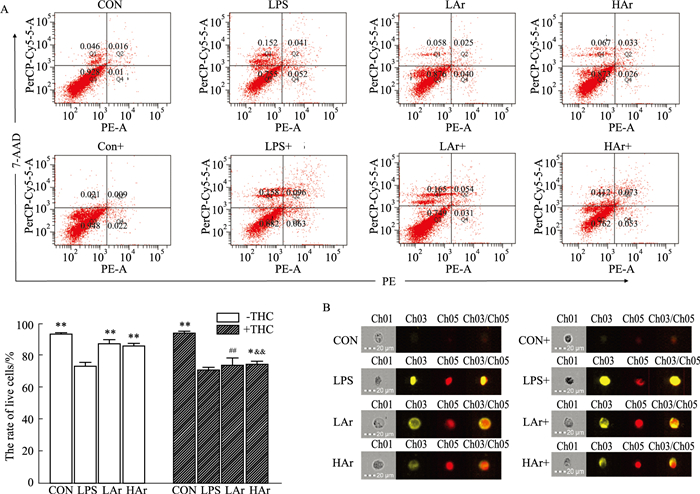
采用Annexin V-PE/7-AAD进行染色,并通过流式细胞术检测Ar对LPS诱导NRK-52e细胞凋亡水平的影响,结果如Fig 3A所示,LPS诱导NRK-52e细胞凋亡水平明显升高,Ar可有效抑制LPS诱导的NRK-52e细胞凋亡,但是THC可减弱Ar的作用;此外,通过成像流式细胞仪检测Ar对LPS诱导NRK-52e细胞凋亡形态的影响,结果如图 3B所示,LPS组NRK-52e细胞出现细胞固缩,且Annexin V-PE/7-AAD荧光表达增强,Ar可有效改善细胞形态,并降低Annexin V-PE/7-AAD荧光表达,同样,Ar的作用被THC减弱。
|
| Fig 3 Effect of arbutin on apoptosis in LPS-induced NRK-52e cells (x±s, n=3) A: Representative plots showing the effects of arbutin on the levels of cell apoptosis in LPS-induced NRK-52e cells detected by Flow cytometry; B: Representative plots showing the effects of arbutin on apoptotic morphology in LPS-induced NRK-52e cells detected by Amnis FlowSight. *P < 0.05, **P < 0.01 vs LPS group; ##P < 0.01 vs LAr-THC group; &&P < 0.01 vs HAr-THC group. |
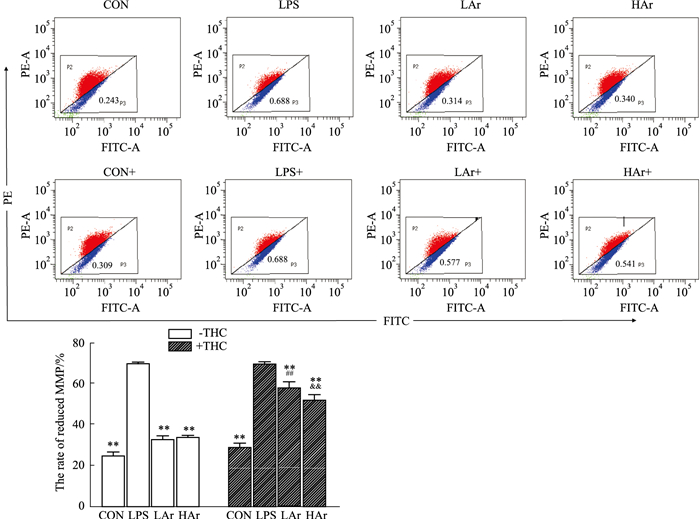
采用JC-1染色并通过流式细胞术检测细胞中线粒体膜电位水平,检测原理为:细胞在正常状态下,JC-1在线粒体中聚集并发出红色荧光;一旦线粒体的膜电位发生改变,JC-1将会在线粒体中解离,产生绿色荧光,FCM可以很容易地监测到荧光强弱的变化。结果如Fig 4所示,用LPS (1 mg·L-1)处理NRK-52e细胞24 h会导致线粒体膜电位降低,Ar可明显提高NRK-52e细胞线粒体膜电位的水平。此外,THC可以阻断Ar的作用。
|
| Fig 4 Effect of arbutin on level of MMP in LPS-induced NRK-52e cells (x±s, n=3) **P < 0.01 vs LPS group; ##P < 0.01 vs LAr-THC group; &&P < 0.01 vs HAr-THC group. |
通过In cell western技术检测Ar对LPS诱导NRK-52e细胞凋亡标志蛋白caspase-3、caspase-9、Bax、Bcl-2表达水平,结果如Fig 5所示,LPS可诱导NRK-52e细胞中caspase-3、caspase-9、Bax表达水平明显升高,Bcl-2表达水平明显降低,Ar可明显降低促凋亡蛋白caspase-3、caspase-9、Bax表达水平,提高抗凋亡蛋白Bcl-2表达水平,但是在加入THC后Ar作用被阻断。
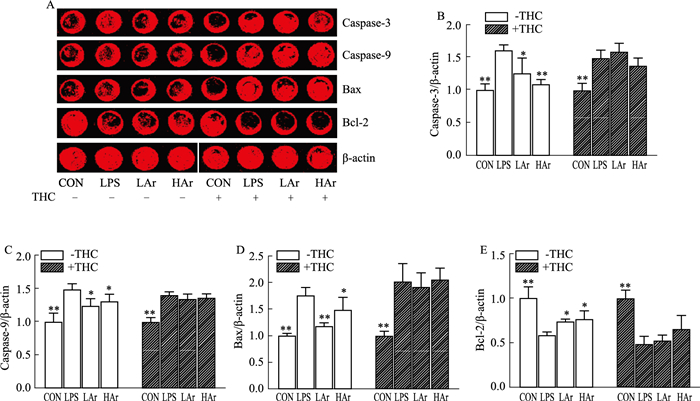
|
| Fig 5 Effects of arbutin on level of apoptosis markers in LPS-induced NRK-52e cells (x±s, n=3) A: Representative plots showing the effects of arbutin on the levels of apoptosis markers in LPS-induced NRK-52e cells; B: Caspase-3 protein expression; C: Caspase-9 protein expression; D: Bax protein expression; E: Bcl-2 protein expression. *P < 0.05, **P < 0.01 vs LPS group. |
分子对接结果如Fig 6所示,Ar与ERβ的亲和力为-7.4 kJ·mol-1,其中Ar 1-OH、2′-OH、6′-OH分别与ERβ的305-GLU、298-LEU、472-GLY形成氢键相互作用。以结合能≤ -5.0 kJ·mol-1为标准[10],该结果表明Ar和ERβ具有较好的结合活性。
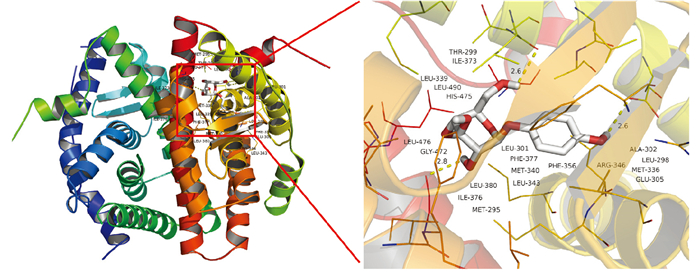
|
| Fig 6 The molecular docking mode for arbutin and ERβ |
结果如Fig 7所示,LPS可抑制NRK-52e细胞中ERβ表达,Ar可明显诱导LPS引起的NRK-52e细胞中ERβ表达增加,但是在加入THC后Ar作用被阻断。进一步表明,Ar可能通过ERβ抑制LPS诱导的NRK-52e细胞凋亡。
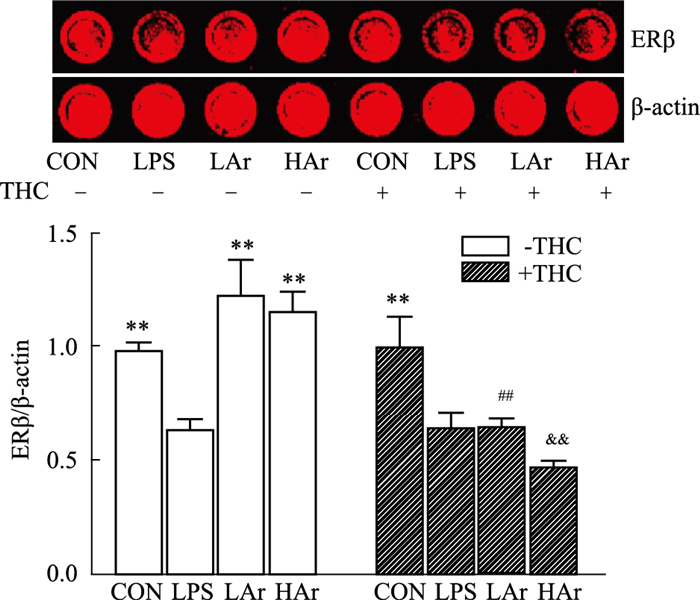
|
| Fig 7 Effect of arbutin on level of ERβ in LPS-induced NRK-52e cells (x±s, n=3) **P < 0.01 vs LPS group; ##P < 0.01 vs LAr-THC group; &&P < 0.01 vs HAr-THC group. |
肾小管上皮细胞损伤是脓毒症急性肾损伤发生发展较为重要的机制之一,常出现肾单位中肾小管上皮细胞凋亡[5]。LPS可诱导肾小管上皮细胞凋亡而造成细胞损伤,细胞凋亡包括死亡受体途径和线粒体途径,线粒体凋亡途径是主要的内源性途径,其起始于氧化应激反应[11],脓毒症急性肾损伤发生时,ROS在短时间内大量产生,且抗氧化酶活性降低,诱导线粒体内膜脂质过氧化,促使Bax/Bcl-2进入线粒体并诱导线粒体内膜通透性增加[12],开放线粒体转换孔并释放AIF后激活caspase-3,从而直接或间接地诱导细胞凋亡;此外线粒体受损导致线粒体膜电位下降,同样会进一步激活caspase级联反应,诱导细胞凋亡。本研究基于流式细胞术和In cell western技术检测Ar对LPS诱导的NRK-52e细胞中ROS水平、线粒体膜电位和细胞凋亡水平的影响,结果发现,Ar可有效增强LPS诱导的NRK-52e细胞活力,降低模型组NRK-52e细胞中ROS水平,抑制cspase-3、caspase-9和Bax表达,促进Bcl-2表达增加并提高线粒体膜电位,从而表明Ar可抑制LPS诱导的NRK-52e细胞线粒体途径凋亡。细胞中ROS大量增加会导致Ca2+内流[13],且细胞内Ca2+超载会导致DNA链断裂降解,并诱发肾组织功能损伤,参与急性肾损伤过程中的细胞凋亡反应[14]。通过检测Ca2+浓度结果表明,Ar可有效降低LPS诱导的NRK-52e细胞中Ca2+浓度。提示,Ar通过线粒体途径并降低Ca2+浓度抑制LPS诱导的NRK-52e细胞凋亡。
前期研究结果表明,Ar通过ERβ发挥植物雌激素样活性,是山药发挥雌激素样活性的物质基础之一[7]。雌激素是人体内重要的甾体激素,具有保护中枢神经系统[15]、心血管系统[16],且可以改善LPS诱导的脓毒症损伤[17]。本次实验结果发现,雌激素受体β特异性拮抗剂THC可减弱Ar对LPS诱导NRK-52e细胞损伤的干预作用,且Ar与ERβ具有较好的结合活性,由此可以推出,Ar可能通过ERβ抑制LPS诱导NRK-52e细胞凋亡。本研究为Ar用于急性肾损伤的治疗提供实验依据,为临床治疗急性肾损伤提供理论基础。
| [1] |
曾小娜, 尹连红, 许丽娜. 脓毒症性急性肾损伤发病机制[J]. 生理科学进展, 2020, 51(2): 122-6. Zeng X N, Yin L H, Xu L N. Pathogenesis of sepsis induced acute renal injury[J]. Prog Physiol Sci, 2020, 51(2): 122-6. doi:10.3969/j.issn.0559-7765.2020.02.011 |
| [2] |
涂曦文, 肖勇健, 黄治家. IGFBP7在早期预测脓毒症急性肾损伤中作用的研究[J]. 中南医学科学杂志, 2020, 48(5): 536-9. Tu X W, Xiao Y J, Huang Z J. The role of IGFBP7 in early prediction of sepsis-induced acute kidney injury[J]. Med Sci J Cent South Chin, 2020, 48(5): 536-9. |
| [3] |
Zhao H Y, Liu Z N, Shen H T, et al. Glycyrrhizic acid pretreatment prevents sepsis-induced acute kidney injury via suppressing inflammation, apoptosis and oxidative stress[J]. Eur J Pharmacol, 2016, 781(2016): 92-9. |
| [4] |
Yeh C H, Yang J J, Yang M L, et al. Rutin decreases lipopolysaccharide-induced acute lung injury via inhibition of oxidative stress and the MAPK-NF-κB pathway[J]. Free Radic Biol Med, 2014, 69(14): 249-57. |
| [5] |
杨莉. 急性肾损伤发病与修复的机制[J]. 中华肾病研究电子杂志, 2013, 2(3): 120-4. Yang L. Mechanism of injury and repair of acute kidney injury[J]. Chin J Kidney Dis Invest(Electronic Edition), 2013, 2(3): 120-4. doi:10.3877/cma.j.issn.2095-3216.2013.03.003 |
| [6] |
国家药典委员会. 中华人民共和国药典[M]. 一部. 北京: 中国医药出版社, 2015: 28. Chinese Pharmacopoeia Commission. Pharmacopoeia of People's Republic of China[M]. vol 1. Beijing: China Med Sci Press, 2015: 28. |
| [7] |
Zeng M N, Zhang B B, Li B K, et al. Estrogenic effects of the extracts from the Chinese Yam (Dioscorea opposite Thunb.) and its effective compounds in vitro and in vivo[J]. Molecules, 2018, 23(2): 11. doi:10.3390/molecules23020011 |
| [8] |
Zhang B B, Zeng M N, Li B K, et al. Arbutin attenuates LPS-induced acute kidney injury by inhibiting inflammation and apoptosis via the PI3K/Akt/Nrf2 pathway[J]. Phytomedicine, 2021, 82: 153466. doi:10.1016/j.phymed.2021.153466 |
| [9] |
Safari H, Zabihi E, Pouramir M, et al. Decrease of intracellular ROS by arbutin is associated with apoptosis induction and downregulation of IL-1beta and TNF-α in LNCaP; prostate cancer[J]. J Food Biochem, 2020, 44(9): e13360. |
| [10] |
曲一帆, 徐凤英, 王玉珍, 等. 基于网络药理学和分子对接技术探索黄酮类化合物治疗新型冠状病毒肺炎(COVID-19)的作用机制[J]. 包头医学院学报, 2020, 36(3): 74-86. Qu Y F, Xu F Y, Wang Y Z, et al. Mechanism of flavonoids in the treatment of coronavirus disease-19 (COVID-19) based on network pharmacology and molecular docking[J]. J Baotou Med Col, 2020, 36(3): 74-86. |
| [11] |
Yang C C, Yao C A, Yang J C, et al. Sialic acid rescues repurified lipopolysaccharide-induced acute renal failure via inhibiting TLR4/PKC/gp91-mediated endoplasmic reticulum stress, apoptosis, autophagy, and pyroptosis signaling[J]. Toxicol Sci, 2014, 141(1): 155-65. doi:10.1093/toxsci/kfu121 |
| [12] |
张伟, 孙仁华, 呼邦传. 脓毒症急性肾损伤肾脏细胞凋亡通路的研究进展[J]. 中国现代医生, 2017, 55(2): 165-8. Zhang W, Sun R H, Hu B Z. Research progress of renal cell apoptosis pathway in sepsis acute kidney injury[J]. Chin Mod Doc, 2017, 55(2): 165-8. |
| [13] |
张一伟, 刘宏岩. 中医方药抑制心肌细胞凋亡调控通路的研究进展[J]. 吉林中医药, 2019, 39(2): 278-80. Zhang Y W, Liu H Y. Research progress of traditional chinese medicine inhibiting myocardial apoptosis pathway[J]. Jilin J Tradit Chin Med, 2019, 39(2): 278-80. |
| [14] |
伊连红, 齐蒙, 彭金咏. 急性肾损伤的分子机制及中药干预研究进展[J]. 中国药理学通报, 2016, 32(11): 1494-500. Yi L H, Qi M, Peng J Y. Molecular mechanism of acute kidney injury and intervention by Chinese medicine[J]. Chin Pharmacol Bull, 2016, 32(11): 1494-500. doi:10.3969/j.issn.1001-1978.2016.11.004 |
| [15] |
Li K X, Sun Q, Wei L L, et al. ERα gene promoter methylation in cognitive function and quality of life of patients with Alzheimer disease[J]. J Geriatr Psychiatry Neurol, 2019, 32(4): 221-8. doi:10.1177/0891988719835325 |
| [16] |
蔡心银, 张紫佳. 植物雌激素药理作用及相关中药的研究进展[J]. 现代中药研究与实践, 2020, 34(2): 75-8. Cai X Y, Zhang Z J. Pharmacological effects of phytoestrogens and research progress of related traditional Chinese medicine[J]. Res Pract Chin Med, 2020, 34(2): 75-8. |
| [17] |
娄云鹏, 张晟, 林兆奋. 雌激素对脓毒症小鼠心肌半胱氨酸富集分泌蛋白CRISPLD2表达的影响[J]. 中华危重病急救医学, 2018, 30(7): 625-8. Lou Y P, Zhang S, Lin Z F. Effect of estrogen on the expression of myocardial cysteine-enriched secretory protein CRISPLD2 in septic mice[J]. Chin Crit Care Med, 2018, 30(7): 625-8. doi:10.3760/cma.j.issn.2095-4352.2018.07.002 |