


2. 广西中医药大学基础医学院生理学教研室,广西 南宁 530200;
3. 广西医科大学公共卫生学院毒理教研室,广西 南宁 530021
 ,
WANG Hong-lei1,
WANG Zi-xuan3,
LI Xin-yu1,
LI Mei-xiu1,
WU Yong3,
LIU Yu-jia1,
LU Guo-dong3,
ZHOU Jing1
,
WANG Hong-lei1,
WANG Zi-xuan3,
LI Xin-yu1,
LI Mei-xiu1,
WU Yong3,
LIU Yu-jia1,
LU Guo-dong3,
ZHOU Jing1

2. Dept of Physiology, School of Preclinical Medicine, Guangxi University of Chinese Medicine, Nanning 530200, China;
3. Dept of Toxicology, School of Public Health, Guangxi Medical University, Nanning 530021, China
原发性肝癌是常见的恶性肿瘤之一,在全球肿瘤致死率统计中肝细胞肝癌(hepatocellular carcinoma,HCC)居世界第四位[1]。早期诊断是提高肝癌病人存活率,延长生存期的关键。然而,由于原发性肝癌起病隐匿,出现症状时大部分已为中晚期。目前外科手术是治疗肝癌的有效策略之一,但是由于术后仍有较高的转移复发风险,所以药物治疗仍是治疗肝癌不可或缺的手段。临床一线靶向化疗药物如阿霉素、卡培他滨、索拉菲尼、乐伐替尼等对肝癌患者的生存和治疗都有明显的效果[2],但化疗药物的毒副作用和耐药性也已成为肿瘤治疗效果和良好预后的一大难题[3]。我国传统中草药具有毒副作用小、多靶点和整体性的特点,可通过抑制肿瘤的生长、促进肿瘤细胞死亡和降低肿瘤细胞耐药性等方式,达到中草药的抗肿瘤作用[4]。雷公藤红素(celastrol),是卫矛科雷公藤根茎的提取物,是一种五环三萜类化合物,有研究表明雷公藤红素在抗炎、减肥、治疗神经系统疾病、糖尿病、心血管、抗肿瘤等方面都有很好的治疗作用[5-6],其中雷公藤红素的抗肿瘤作用主要通过抑制肿瘤细胞增殖、阻滞细胞周期、增强肿瘤细胞的侵袭、转移和血管生成等达到抗肿瘤效果[7]。本研究主要探讨雷公藤红素作用后引起肝癌细胞内ROS水平的不断升高,造成细胞DNA损伤,从而诱导癌细胞凋亡,达到抗癌作用的基础研究。
1 材料与方法 1.1 实验材料及试剂细胞株:人肝癌HepG2细胞和Huh7细胞(购自中国科学院上海细胞生物学研究所细胞库)。主要试剂:雷公藤红素,纯度:>99%(货号:219465,美国Sigma公司);噻唑蓝(MTT,碧云天生物技术有限公司);DMEM培养基(货号:C11995500BT),胎牛血清(货号:10099141),(美国Life Sciences公司);二甲亚砜(DMSO,货号:0219605580,美国MP Biomedicals公司);GAPDH(货号:SC-32233),(美国Santa Cruz公司);α-tubulin抗体(货号:T-5168),碘化丙啶(propidium iodide,PI,货号:P4170),NAC (N-Acetyl-L-cysteine,NAC,货号: A7250),Hoechst 33258(货号:94403),(美国Sigma公司);caspase-3抗体(货号:9668S), PARP抗体(货号:9532), γ-H2AX(货号:9718)(美国Cell Signaling Technology公司)。
1.2 细胞培养选取两种肝癌细胞HepG2和Huh7细胞,使用时加10%胎牛血清的DMEM高糖培养基进行培养。培养箱培养条件:温度37 ℃,CO2通气量5%,湿度饱和。隔天传代,然后取对数生长期的细胞进行相关实验。
1.3 光学显微镜下观察细胞形态以2×105·L-1细胞数接种肝癌细胞,分别设置细胞对照组(DMSO)和雷公藤红素组(2 μmol·L-1),作用时间24 h,然后用倒置光学显微镜观察肝癌细胞形态改变情况。
1.4 MTT法检测细胞存活取对数生长期的细胞,每孔细胞数约为6×103(每孔液体体积100 μL),接种于96孔板中,设空白对照组、溶剂对照组(DMSO)和雷公藤红素组(雷公藤红素浓度分别为:0.5、1、2 μmol·L-1),培养24 h以后,按照MTT检测步骤进行培养:每孔再加入10 μL MTT,孵育2 h后吸去96孔内液体,再加入DMSO(100 μL),放置到37 ℃培养箱中孵育10 min,然后使用酶标仪检测吸光度值(490 nm)。根据公式计算存活率:细胞存活率/%=(实验组OD490 nm-空白组OD490 nm)/(细胞对照组OD490 nm-空白组OD490 nm)×100%(以上实验各重复3次)。
1.5 CM-H2DCFDA探针检测细胞内ROSCM-H2DCFDA为活性氧(reactive oxygen species,ROS)的细胞渗透性指示剂,加入反应后可将其醋酸基团去除掉,指示剂发出红色荧光,红色荧光的强弱可以反映细胞内ROS水平的高低。实验设置为:溶剂对照组(DMSO),雷公藤红素组(雷公藤红素浓度分别为:0.5、1、2 μmol·L-1),抗氧化剂组(NAC 5 mmol·L-1),雷公藤红素联合抗氧化剂NAC组(Celastrol 2 μmol·L-1+NAC 5 mmol·L-1),雷公藤红素联合抗氧化剂组先给予5 mmol·L-1的NAC预处理1 h,后再与雷公藤红素共培养24 h,然后收取各组细胞,加入500 μL CM-H2DCFDA探针稀释液重悬细胞,避光孵育时间20~30 min,然后流式细胞仪检测肝癌细胞的荧光强度。
1.6 免疫荧光检测DNA损伤的标志产物γ-H2AX制备细胞悬液,6孔板内种板细胞数为2×108·L-1,每孔体积为2 mL。实验设置为:细胞对照组(DMSO),雷公藤红素组(celastrol 2 μmol·L-1),抗氧化剂组(NAC 5 mmol·L-1),雷公藤红素联合抗氧化剂组(celastrol 2 μmol·L-1+NAC 5 mmol·L-1),药物联合组先给予NAC (5 mmol·L-1)预处理1 h,再与雷公藤红素组共培养24 h后终止培养。去上清,冰乙醇(70%)固定30 min,TBS漂洗,0.3%的Triton X-100破膜15 min,羊血清封闭约1 h,然后加入一抗,放4 ℃冰箱孵育12~18 h;荧光标记二抗避光孵育1 h,接着用DAPI进行细胞核染色,然后采用激光共聚焦显微镜观察拍照并用ImageJ对γ-H2AX荧光进行定量分析。
1.7 Hoechst 33258染色检测细胞凋亡制备细胞悬浊液,种植6孔板内,每孔体积为2 mL。分别设置为:细胞对照组(DMSO)、雷公藤红素组(celastrol 2 μmol·L-1)、抗氧化剂组(NAC 5 mmol·L-1)、雷公藤红素联合抗氧化剂NAC组(celastrol 2 μmol·L-1+NAC 5 mmol·L-1),24 h后终止培养,PBS清洗,加入培养液和Hoechst 33258工作液(终浓度100 μmol·L-1),室温染色30 min,荧光显微镜下观察。
1.8 流式细胞术检测细胞死亡制备细胞悬液,种植细胞于6孔板。分别设置为:溶剂对照组(DMSO)、雷公藤红素组(celastrol 2 μmol·L-1)、抗氧化剂组(NAC 5 mmol·L-1)、雷公藤红素联合抗氧化剂组(celastrol 2 μmol·L-1+NAC 5 mmol·L-1),各组均处理24 h,收取各组细胞,加入2 mL(浓度为5 mg·L-1)的PI染液混匀,用流式细胞仪进行检测。
1.9 Western blot检测蛋白表达水平制备细胞悬液,种板细胞到60 mm培养皿进行培养。按预设的药物浓度和时间进行细胞处理,加入SDS裂解缓冲液,放置到冰上裂解,裂解时间大约20 min。然后用BCA法测定蛋白浓度,上样电泳后转膜。牛奶封闭液封闭时间大约1 h,孵一抗,然后放4 ℃冰箱(时间:12~18 h),一抗抗体分别为胱天蛋白酶3(caspase-3)、PARP、γ-H2AX、GAPDH、α-tubulin。孵育二抗,室温摇床孵育1 h,然后使用i-Bright FL1000凝胶成像系统进行显影定影。
1.10 统计学分析数据分析:应用SPSS 20.0软件;作图软件:采用GraphPad Prism8。计量分析用x±s表示;组间差异分析采用单因素方差分析;两两比较采用LSD t检验。
2 结果 2.1 雷公藤红素对肝癌HepG2和Huh7细胞形态的作用显微镜下观察,肝癌细胞对照组贴壁生长情况良好,表现为细胞大小均一,形态比较规则,生长速度旺盛。而雷公藤红素组(2 μmol·L-1)处理24 h后,发现HepG2和Huh7细胞均出现细胞形态的皱缩,细胞间连接逐渐消失,细胞变圆、空泡化、脱落等现象出现(Fig 1)。

|
| Fig 1 Effect of celastrol on liver cancer cell morphology |
经不同浓度雷公藤红素作用24 h后,检测两种肝癌细胞存活率(Fig 2)。实验结果观察到,低浓度雷公藤红素对两种肝癌细胞的存活率没有明显的抑制作用,但随着雷公藤红素浓度的增加,雷公藤红素对两种肝癌细胞的抑制作用明显加强,并且呈浓度依赖性关系(P < 0.05,P < 0.01)(Fig 2)。
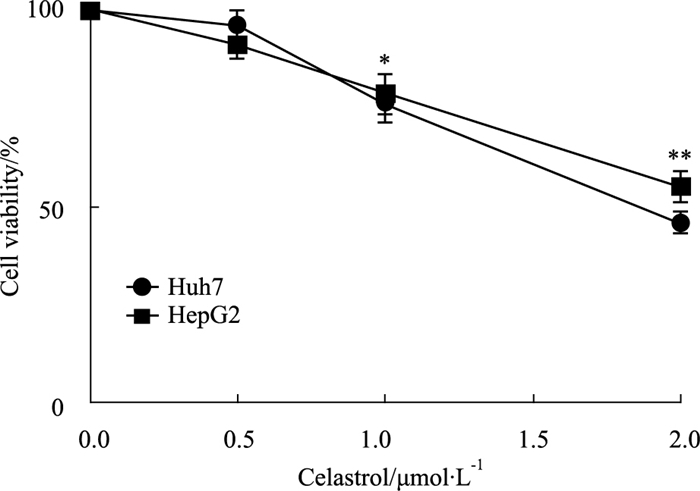
|
| Fig 2 Effect of celastrol on cell viability of liver cancer cells *P < 0.05 vs Control group, **P < 0.01 vs Control group |
HepG2细胞经不同浓度雷公藤红素处理24 h后,实验结果显示,随着雷公藤红素浓度增加,肝癌细胞HepG2细胞内ROS水平明显升高(Fig 3 A, B)(P < 0.05);而联合抗氧化剂NAC作用后,与单独药物组相比,雷公藤红素联合抗氧化剂NAC组细胞内ROS含量明显降低(Fig 3C, D)(P < 0.05, P < 0.01)。
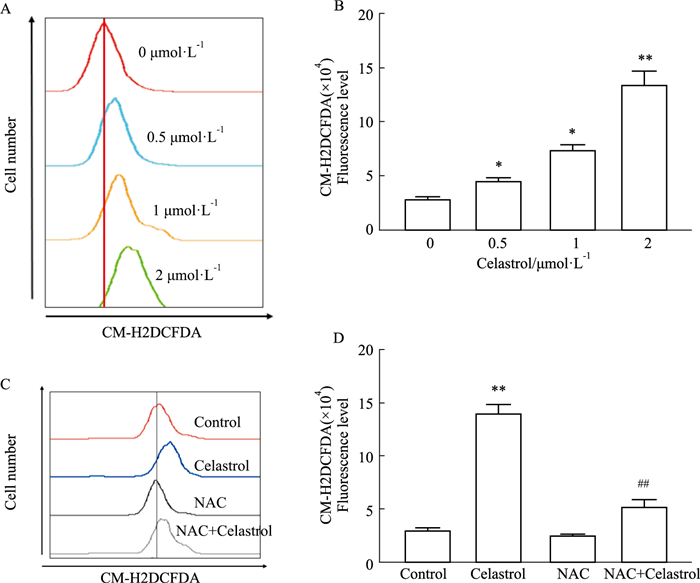
|
| Fig 3 Effect of celastrol on intracellular ROS level in HCC *P < 0.05 vs Control group, **P < 0.01 vs Control group, ##P < 0.01 vs Celastrol group |
免疫荧光实验结果观察到(Fig 4A),HepG2细胞在雷公藤红素作用12 h后,与对照组比较,雷公藤红素组细胞核内γ-H2AX的积累增加(P < 0.05),表明雷公藤红素作用可诱导细胞内DNA的损伤;而雷公藤红素联合抗氧化剂NAC作用后,与单独药物组相比γ-H2AX的荧光强度则明显降低(P < 0.05)。Western blot实验结果一致表明,随着雷公藤红素药物作用时间的增加,雷公藤红素组细胞内DNA损伤标志蛋白γ-H2AX的表达相比对照组明显增多(P < 0.05)(Fig 4B);而抗氧化剂NAC可明显抑制雷公藤红素诱导的细胞内γ-H2AX的高表达(P < 0.01)(Fig 4C)。
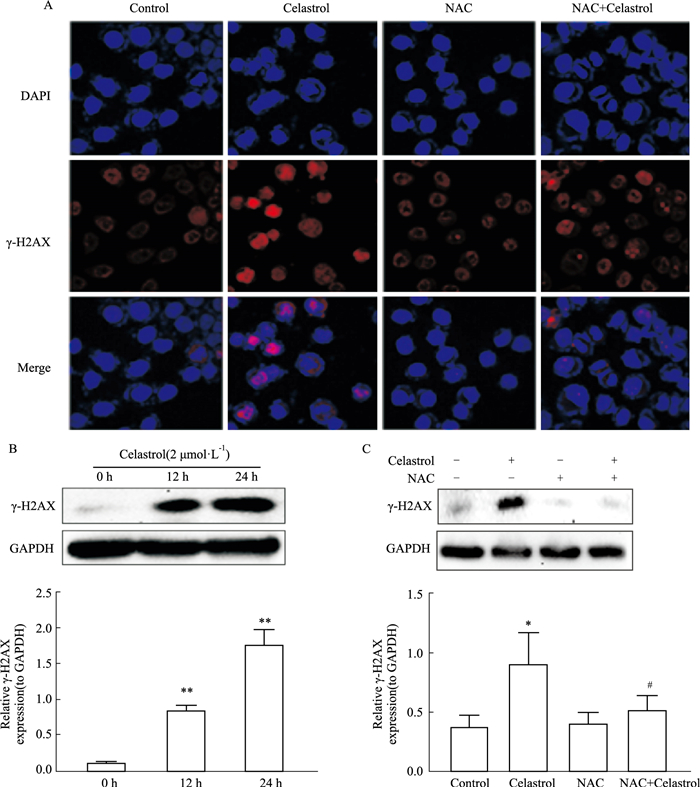
|
| Fig 4 Celastrol induced ROS-dependent DNA damage *P < 0.05 vs Control group, **P < 0.01 vs Control group, #P < 0.05 vs Celastrol group |
Hoechst 33258染色观察到(Fig 5A),肝癌细胞HepG2对照组中发现染色均质、淡蓝色的荧光,细胞核染色质并没有发现明显改变;肝癌细胞经雷公藤红素处理24 h后,肝癌细胞出现细胞核染色质的固缩、细胞核的碎裂和溶解等典型的凋亡现象,在联合抗氧化剂NAC后,逆转了核染色质的改变。PI活染测定细胞死亡实验结果表明,抗氧化剂NAC明显保护了雷公藤红素诱导的肝癌细胞HepG2的死亡(P < 0.01)(Fig 5B);Western blot检测的结果表明(Fig 5C),与对照组比较,随着雷公藤红素浓度升高,HepG2细胞内初始状态的caspase-3明显减少(P < 0.01);cleaved-PARP明显增多(P < 0.01),提示PARP被激活的caspase-3切割;与同浓度雷公藤红素单独作用比较,联合抗氧化剂NAC可明显抑制雷公藤红素诱导的细胞凋亡,并逆转了caspase-3、和cleaved-PARP蛋白的改变(P < 0.01,P < 0.01)(Fig 5D)。

|
| Fig 5 Celastrol induced apoptosis by ROS accumulation 1:Control; 2:Celastrol; 3:NAC; 4:NAC+Celastrol. *P < 0.05 vs Control group, **P < 0.01 vs Control group, ##P < 0.01 vs Celastrol group |
国际癌症研究机构(IARC)编制并发布了2018年的GLOBOCAN数据库,发现HCC发病率占原发性肝癌的75%~85%,也是全球最常见的发病肿瘤之一[8]。在正常生理条件下,细胞内氧自由基的产生与清除处于一个相对动态平衡的状态[9]。低水平的ROS有利于细胞的生存,但高水平的ROS可通过氧化损伤反应杀伤细胞,从而触发细胞程序性死亡[10],其他相关研究也表明, ROS的水平与各种形式的细胞死亡方式均存在一定关系[11]。
雷公藤红素是中药雷公藤提取物中的单体,属于醌甲基三萜类化合物。研究文献发现雷公藤红素在减肥、抗炎、调节免疫、治疗神经退行性疾病、抗肿瘤等方面都有很好的药理活性[12]。本实验发现,肝癌细胞经雷公藤红素作用24 h后,肝癌细胞有形态变圆,细胞膜皱缩等显著变化,进一步检测发现肝癌细胞存活率明显下降;提示雷公藤红素对肿瘤细胞具有明显杀伤作用。
在检测细胞内ROS水平时发现,经雷公藤红素作用后,肝癌细胞内的ROS水平呈剂量依赖性增加。ROS是公认的DNA损伤的介质,它可以诱导DNA损伤并影响DNA损伤反应[13],可通过氧自由基诱导DNA双链断裂;或者诱导线粒体DNA的损伤,引起线粒体DNA的断裂和降解[14]。DNA双链断裂后会在DNA双链断裂点处形成DNA损伤标志蛋白γ-H2AX的聚集[15],γ-H2AX蛋白主要识别损伤后的DNA,它在保持基因组的完整性和稳定性中具有重要作用,因此γ-H2AX成为DNA双链断裂的标志[16]。免疫荧光实验结果观察到雷公藤红素组γ-H2AX的荧光强度相比对照组明显增强,表明雷公藤红素作用后引起细胞内DNA双链的断裂,细胞内γ-H2AX聚集到DNA断裂处;更为重要的是,本课题的Western blot实验结果进一步验证了上述实验结论,雷公藤红素组与对照组相比,γ-H2AX的表达明显增强,并随着时间的延长,磷酸化的H2AX蛋白表达水平越高,表明DNA损伤程度加重;而在加入抗氧化剂NAC后,反转了以上的实验结果,由此说明,肝癌细胞的DNA损伤是由于雷公藤红素诱导肝癌细胞内ROS水平的不断增加引起的。
Hoechst染色实验观察到雷公藤红素组细胞出现核染色质固缩、细胞核碎裂和溶解等典型的细胞凋亡现象;细胞凋亡通路的关键酶caspase-3可激活下游级联反应从而诱导细胞凋亡[17],细胞凋亡核心成员半胱天冬酶(caspase)的切割底物PARP[18],底物PARP的被剪切认为是细胞凋亡的另一个重要指标。Western blot实验结果表明,随雷公藤红素浓度的增加,初始状态的caspase-3表达水平显著降低,提示caspase-3被激活,PARP被切割部分明显增加;联合抗氧化剂NAC作用后,反转了caspase-3和PARP蛋白表达水平的改变。故肝癌细胞内ROS积聚所导致的细胞凋亡为雷公藤红素杀伤肝癌细胞的主要作用机制。
为了检测雷公藤红素对肝癌细胞是否具有一定的特异性,本研究也检测了雷公藤红素对正常的肝细胞株HL-7702细胞的影响,结果发现仅在使用高浓度雷公藤红素时,HL-7702的存活率有所降低;更重要的是,雷公藤红素作用HL-7702细胞后,细胞内ROS水平无明显增加。基于以上实验结果提示ROS升高是雷公藤红素诱导肝癌细胞死亡的主要原因,由此推测雷公藤红素可作为靶向杀伤癌细胞的有效候选单体。上述实验结论共同证明了雷公藤红素可通过肝癌细胞内ROS的水平不断升高导致DNA损伤,从而引起癌细胞凋亡,本研究发现为今后进一步研究雷公藤红素诱导肝癌细胞死亡的分子机制打下基础。
| [1] |
Yang J D, Hainaut P, Gores G J, et al. A global view of hepatocellular carcinoma: Trends, risk, prevention and management[J]. Nat Rev Gastroenterol Hepatol, 2019, 16(10): 589-604. doi:10.1038/s41575-019-0186-y |
| [2] |
Kim D W, Talati C, Kim R. Hepatocellular carcinoma (HCC): Beyond sorafenib—chemotherapy[J]. J Gastrointest Oncol, 2017, 8(2): 256-65. doi:10.21037/jgo.2016.09.07 |
| [3] |
Zhu Z X, Huang J W, Liao M H, et al. Treatment strategy for hepatocellular carcinoma in China: Radiofrequency ablation versus liver resection[J]. Jpn J Clin Oncol, 2016, 46(12): 1075-80. |
| [4] |
Wang S, Wang Q, Wang H, et al. Induction of ROS and DNA damage-dependent senescence by icaritin contributes to its antitumor activity in hepatocellular carcinoma cells[J]. Pharm Biol, 2019, 57(1): 424-31. doi:10.1080/13880209.2019.1628073 |
| [5] |
Liu J, Lee J, Salazar Hernandez M A, et al. Treatment of obesity with celastrol[J]. Cell, 2015, 161(5): 999-1011. doi:10.1016/j.cell.2015.05.011 |
| [6] |
Guo D, Zhang W, Yang H, et al. Celastrol induces necroptosis and ameliorates inflammation via targeting biglycan in human gastric carcinoma[J]. Int J Mol Sci, 2019, 20(22): 5716. doi:10.3390/ijms20225716 |
| [7] |
Hou W, Liu B, Xu H T. Celastrol: Progresses in structure-modifications, structure-activity relationships, pharmacology and toxicology[J]. Eur J Med Chem, 2020, 189: 112081. doi:10.1016/j.ejmech.2020.112081 |
| [8] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. doi:10.3322/caac.21492 |
| [9] |
Li R, Jia Z, Trush M A. Defining ROS in biology and medicine[J]. React Oxyg Species (Apex), 2016, 1(1): 9-21. |
| [10] |
Mittler R. ROS are good[J]. Trends Plant Sci, 2017, 22(1): 11-9. doi:10.1016/j.tplants.2016.08.002 |
| [11] |
Dupré-Crochet S, Erard M, Nüβe O. ROS production in phagocytes: Why, when, and where?[J]. J Leukoc Biol, 2013, 94(4): 657-70. doi:10.1189/jlb.1012544 |
| [12] |
王秀, 张竞竞, 张配, 等. 雷公藤甲素诱导鼻咽癌细胞凋亡作用[J]. 中国药理学通报, 2014, 30(8): 1147-50. Wang X, Zhang J J, Zhang P, et al. Effect of triptolide on apoptosis of nasopharynx cancer[J]. Chin Pharmacol Bull, 2014, 30(8): 1147-50. doi:10.3969/j.issn.1001-1978.2014.08.022 |
| [13] |
Kutuk O, Aytan N, Karakas B, et al. Biphasic ROS production, p53 and BIK dictate the mode of cell death in response to DNA damage in colon cancer cells[J]. PLoS One, 2017, 12(8): e0182809. doi:10.1371/journal.pone.0182809 |
| [14] |
Srinivas U S, Tan B W Q, Vellayappan B A, et al. ROS and the DNA damage response in cancer[J]. Redox Biol, 2019, 25: 101084. doi:10.1016/j.redox.2018.101084 |
| [15] |
余艳柯, 陆源, 余应年, 等. γH2AX: DNA双链断裂的标志[J]. 中国药理学与毒理学杂志, 2005, 3: 237-40. Yu Y K, Lu Y, Yu Y N, et al. γH2AX: A biomarker for DNA double-stranded breaks[J]. Chin J Pharmacol Toxicol, 2005, 3: 237-40. doi:10.3321/j.issn:1000-3002.2005.03.014 |
| [16] |
Chen Y L, Chung S Y, Chai H T, et al. Early administration of carvedilol protected against doxorubicin-induced cardiomyopathy[J]. J Pharmacol Exp Ther, 2015, 355(3): 516-27. doi:10.1124/jpet.115.225375 |
| [17] |
Zamaraev A V, Kopeina G S, Prokhorova E A, et al. Post-translational modification of caspases: The other side of apoptosis regulation[J]. Trends Cell Biol, 2017, 27(5): 322-39. doi:10.1016/j.tcb.2017.01.003 |
| [18] |
Deben C, Lardon F, Wouters A, et al. APR-246 (PRIMA-1(MET)) strongly synergizes with AZD2281 (olaparib) induced PARP inhibition to induce apoptosis in non-small cell lung cancer cell lines[J]. Cancer Lett, 2016, 375(2): 313-22. doi:10.1016/j.canlet.2016.03.017 |