

2. 郑州大学 临床药理研究所,河南 郑州 450001
2. Institute of Clinical Pharmacology, Zhengzhou University, Zhengzhou 450001, China
肺癌(lung cancer)目前是世界上最为常见的恶性肿瘤之一,大约有四分之一的癌症相关死亡都归因于肺癌[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)约占所有肺癌的80%,是世界范围内发病率和死亡率最高的恶性肿瘤。尽管手术方案的改进和靶向药物的开发极大改善了NSCLC的治疗现状,但是约75%的患者发现时已处于中晚期,其5年生存率很低。
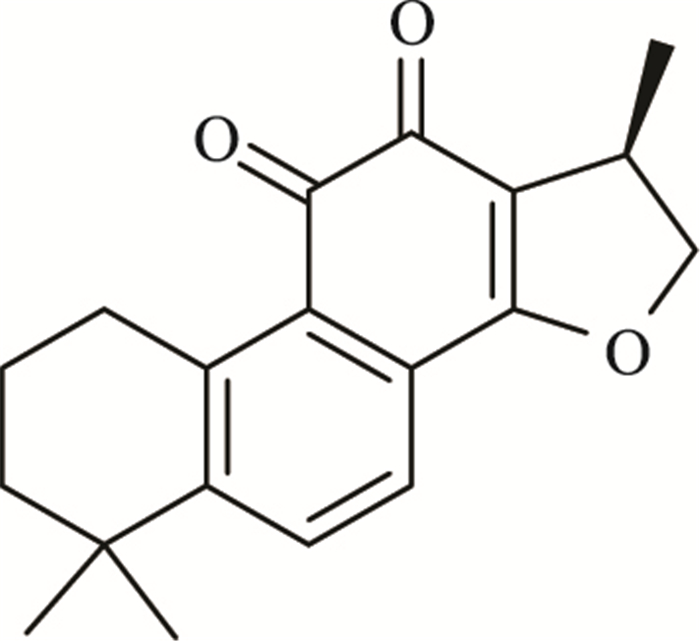
隐丹参酮(cryptotanshinone,CTS)为二萜类单体,是从传统唇形科中草药丹参(Salvia miltiorrhiza)干燥根和根茎中提取出的一种脂溶性成分。CTS已被证实具有抗氧化、抗肿瘤、抗菌和抗炎多种生物活性。近年来[2],其在抗肿瘤方面的药理活性得到许多研究者的关注。CTS可以通过抑制肿瘤细胞迁移与侵袭、诱导肿瘤细胞凋亡、抑制新血管的生成、抑制肿瘤细胞增殖、调控雌雄激素受体信号和抑制淋巴管生成等机制来发挥其抗肿瘤活性[3]。CTS的化学结构如Fig 1所示。
|
| Fig 1 The chemical structure of cryptotanshinone |
已有研究证明CTS可以通过促进NSCLC癌干细胞中河马信号通路调节因子TAZ的核质转位而降低其表达[4]。许冠华等[5]的研究表明, CTS抑制PC9细胞生长的作用机制可能是通过抑制STAT3的Tyr705和Ser727的磷酸化表达水平。马蒙恩等[6]的研究表明,CTS可以下调p-ERK1/2、MMP-2和MMP-9的表达从而降低PC9细胞的迁移侵袭能力。目前关于CTS抗NSCLC相关机制的研究仍比较少,也并不全面。
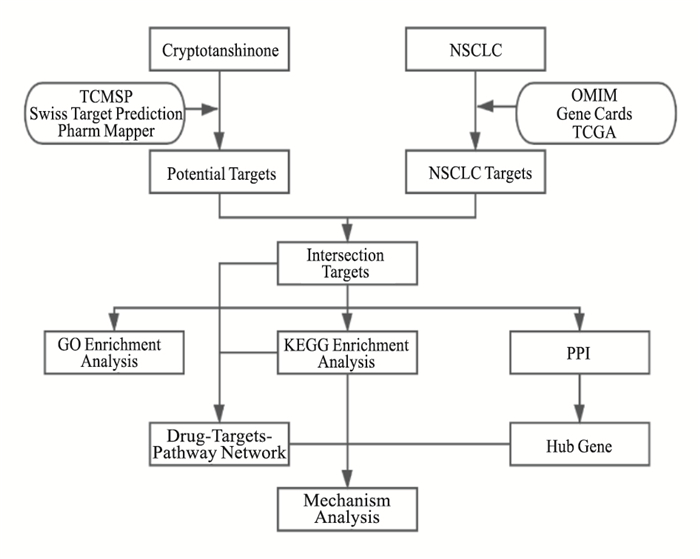
本研究欲利用网络药理学以及生物信息学方法来构建“CTS-交集靶点-KEGG通路”网络图,进一步探讨CTS抗NSCLC的机制,并为其进一步的深入研究奠定理论基础。本研究的流程图如Fig 2所示。
|
| Fig 2 Flow chart |
使用TCMSP数据库(https://old.tcmsp-e.com/)检索cryptotanshinone,获CTS相关作用靶点。为了更全面的收集CTS相关的可靠靶点,通过PharmMapper数据库(http://www.lilab-ecust.cn/pharmmapper/)进行靶点预测,根据Normalized Fit Score>0.8进行靶点的筛选。然后通过SwissTargetPrediction靶点预测平台(http://www.swisstargetprediction.ch/)对CTS的作用靶点进行预测,并根据Probability>0进行靶点筛选。通过Uniprot数据库(https://www.uniprot.org/)将靶点名字转换为统一的基因名,并限定物种为人类。
1.2 NSCLC相关靶点的获得通过GeneCards数据库(https://www.genecards.org/)和OMIM数据库(https://omim.org/)检索non-small cell lung cancer和其同义词non-small cell lung carcinoma,并通过TCGA数据库(https://portal.gdc.cancer.gov/)下载LUAD(Lung adenocarcinoma)以及LUSC(Lung squamous cell carcinoma)转录组数据中的Htseq-Counts。并用R语言的limma包进行差异表达基因分析,设置P < 0.05以及|log2FoldChange|>2。将结果进行整合后删除重复基因。
1.3 CTS和NSCLC交集靶点将CTS相关靶点和NSCLC相关靶点取交集后得到75个交集靶点。
1.4 蛋白相互作用网络图构建(PPI)上述所得到的交集靶点导入到String数据库(https://string-db.org/),限定物种为人。本研究采取高可信度,即minimum required interaction score选择high confidence(0.700)来构建PPI网络图。结果保存为TSV文件导入到Cytoscape_3.8.2,根据Degree和Combined-score值重新绘制PPI网络图。并对PPI网络图进行网络拓扑学分析,以筛选核心靶点(hub targets)。
1.5 分子对接用AutoDockVina 1.1.2软件将核心靶点与CTS进行分子对接实验,并用NSCLC临床常用药物吉西他滨(Gemcitabine)作为对照组[7]。PDB(Protein Data Bank)数据库(http://www1.rcsb.org/)下载核心靶点的蛋白质的pdb文件,用Pymol 2.4去除蛋白质分子的配体。从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载CTS和吉西他滨的sdf文件,并转换为pdb格式文件。使用AutoDockTools 1.5.6对蛋白质分子和配体的pdb文件进行除水、加氢、加电荷等操作。使用AutoDock Vina 1.1.2对蛋白质和配体进行分子对接,并对对接结果进行进一步的分析。
1.6 GO和KEGG通路富集分析使用R语言的clusterProfiler包对交集靶点进行GO富集分析和KEGG通路富集分析。GO富集分析分为生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞组分(cellular component,CC)三部分。R语言代码设置pvalueCutoff=0.01和qvalueCutoff=0.01,GO分别取P值最小的前十项、KEGG取前二十项进行数据可视化分析。
1.7 “CTS-交集靶点-KEGG通路”网络图构建通过Excel构建CTS、交集靶点和前二十条KEGG通路的对应关系,后导入到Cytoscape_3.8.2软件,构建“CTS-交集靶点-KEGG通路”网络图。
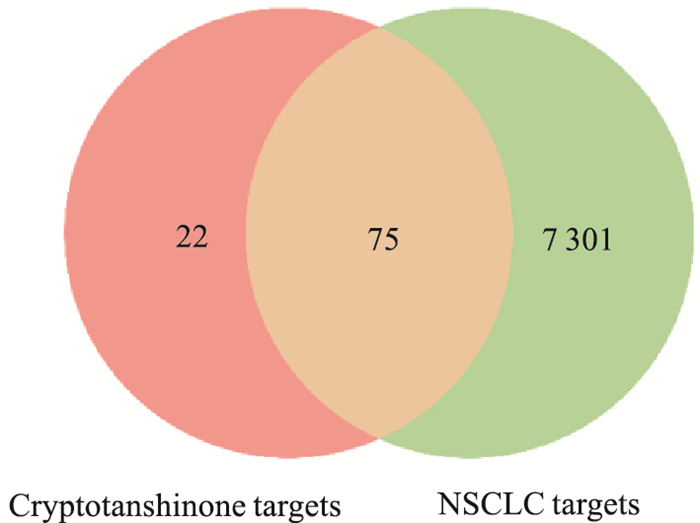
2 结果 2.1 交集靶点的获得TCMSP数据库共检索出30个CTS相关靶点,少数未经DrugBank数据库验证。PharmMapper数据库经过筛选后共得到22个靶点,SwissTargetPrediction数据库筛选后共得到56个靶点。3个数据库得到的靶点整合并删除重复值后共得到97个靶点。通过对OMIM、GeneCards以及TCGA数据库分析共得到NSCLC相关靶点7 376个。对CTS和NSCLC相关靶点取交集,得到75个交集靶点,见Fig 3。
|
| Fig 3 Intersection targets |
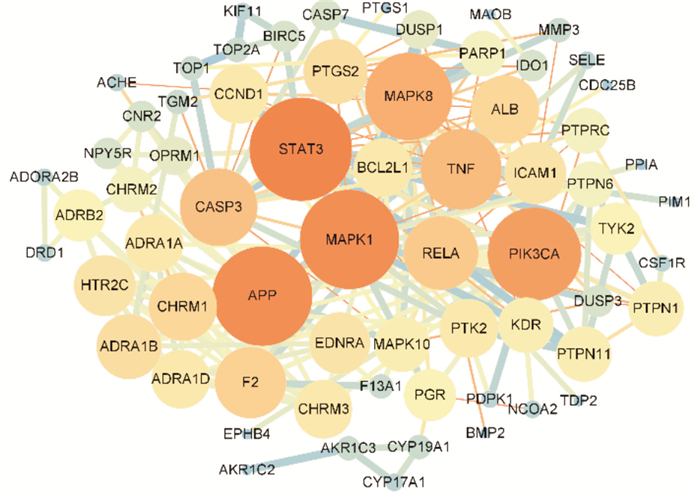
交集靶点通过String数据库以及Cytoscape软件得到的PPI网络图结果如Fig 4所示。如PPI网络图所示,节点(nodes)为交集靶点,边(edges)表示的是靶点与靶点之间的关联关系,其中共有66个节点,226条边。节点越大则度值(degree)越大,边越粗则连接评分(combined-score)越高。对PPI网络图相关数据进行分析,平均度值为6.84,平均节点紧密度(closeness centrality)为0.39,平均节点介度(betweenness centrality)为0.03。经过筛选,靶点相对应的度值、节点紧密度、节点介度均大于平均度值、平均节点紧密度、平均节点介度的共有12个。此12个靶点有较大可能为CTS抗NSCLC作用的核心靶点。通过DisGeNET数据库检索12个靶点,初步得到靶点相对应的蛋白类别,按照度值大小排序得到Tab 1。
|
| Fig 4 PPI network |
| Target | Class | Degree |
| STAT3 | Nucleic acid binding | 23 |
| APP | Enzyme modulator | 22 |
| MAPK1 | Kinase | 22 |
| PIK3CA | Kinase | 20 |
| MAPK8 | Kinase | 18 |
| TNF | Signaling | 16 |
| CASP3 | Enzyme | 15 |
| RELA | Transcription factor | 14 |
| F2 | Enzyme | 13 |
| ALB | Transporter | 12 |
| PTGS2 | Enzyme | 11 |
| PGR | Nuclear receptor | 7 |
根据Tab 1选取度值大于或等于20的靶点,即STAT3、APP、MAPK1和PIK3CA,与CTS和吉西他滨(Gemcitabine)分别进行分子对接,结果如Tab 2所示。通常情况下认为结合能小于0,则蛋白质与受体可以自发的结合,同时结合能越低则发生结合的可能性越大。分子对接验证结果显示选取的核心靶点均可与CTS自发的结合,且与吉西他滨相比,CTS与靶点的结合能均更小,表明CTS与靶点的结合力更大。CTS与四个靶点的理论上最佳结合位置图结果如Fig 5。
| Ligand | Targets | Affinity (kcal/mol) |
| CTS | STAT3(6NJS) | -9.0 |
| APP(4PQD) | -8.0 | |
| MAPK1(6SLG) | -9.5 | |
| PIK3CA(7K6O) | -9.0 | |
| Gemcitabine | STAT3(6NJS) | -5.9 |
| APP(4PQD) | -5.4 | |
| MAPK1(6SLG) | -7.0 | |
| PIK3CA(7K6O) | -7.6 |

|
| Fig 5 Molecule docking of CTS and targets A: STAT3. B: APP. C: MAPK1. D: PIK3CA. |
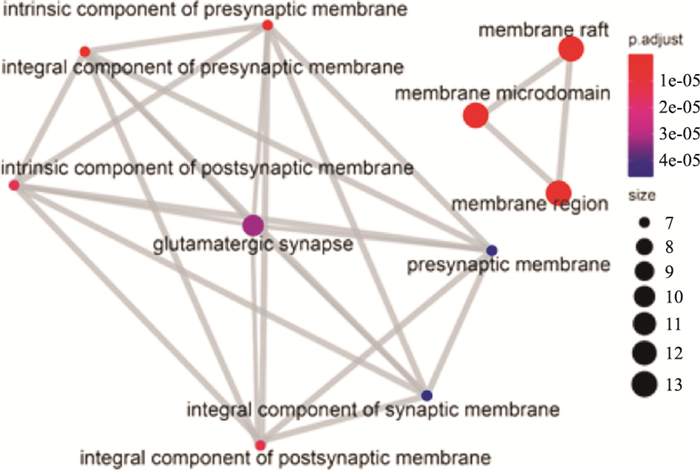
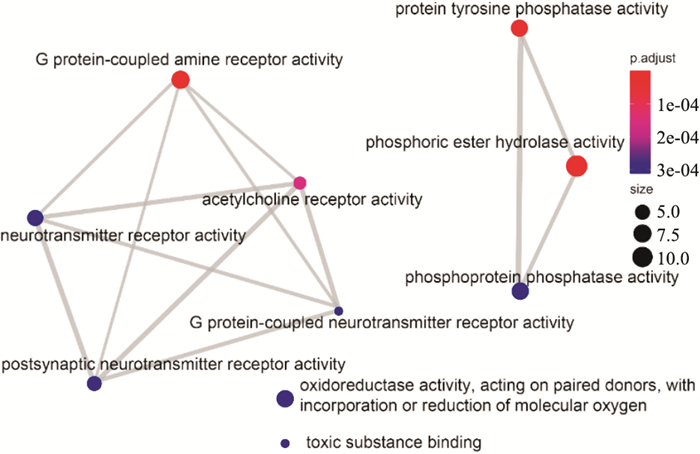
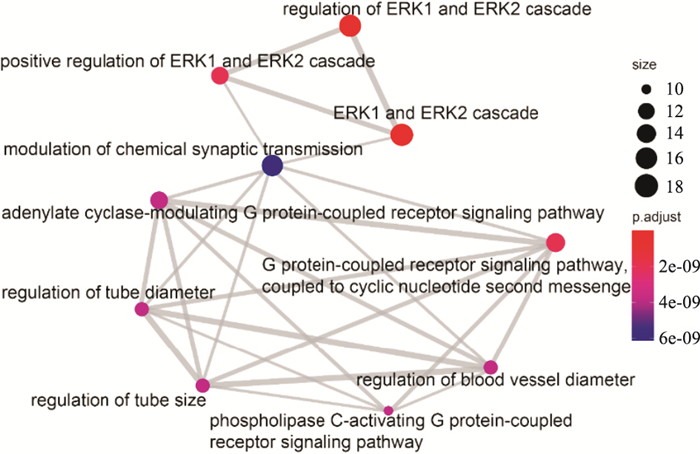
R语言clusterProfiler包对交集靶点进行GO富集分析,得到BP条目564个、CC条目22个和MF条目34个。分别只显示P值由小到大排列的前十项,可视化分析结果如Figure 6-8所示。颜色越红表示该条目富集越显著,圆形越大表示该条目富集的基因越多,连线越粗则表示条目与条目之间的关系越密切。由图形可知,CC主要涉及膜微区、膜筏以及突触前后膜等。MF主要涉及G蛋白偶联的胺受体活性、磷酸酯水解酶活性、蛋白质酪氨酸磷酸酶活性、乙酰胆碱受体活性等方面。BP主要涉及ERK1和ERK2级联反应以及反应的调节、与环状核苷酸第二信使偶联的G蛋白偶联受体信号转导途径、血管直径的调节、磷脂酶C激活的G蛋白偶联受体信号通路、腺苷酸环化酶调节性G蛋白偶联受体信号通路和化学突触传递的调节等方面。由Figure 8可见,ERK1和ERK2级联反应的相关通路通过化学突触传递的调节与其他通路相联系。
|
| Fig 6 CC enrichment analysis |
|
| Fig 7 MF enrichment analysis |
|
| Fig 8 BP enrichment analysis |
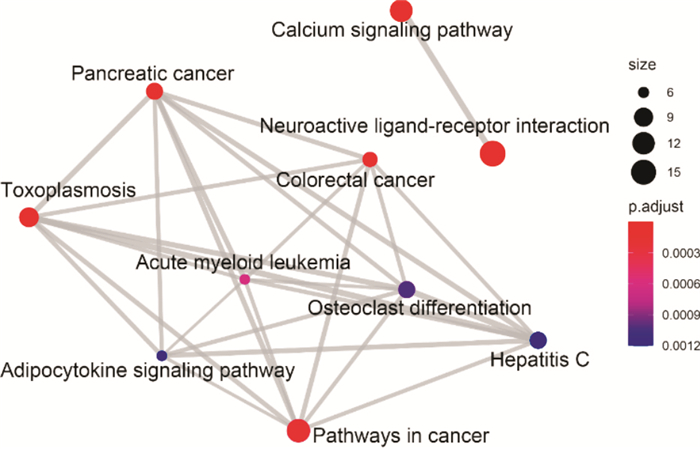
KEGG通路富集分析共得到35条通路,选取P值最小的前20条进行高级气泡图的绘制,得到结果如Fig 9所示。表明CTS抗NSCLC主要涉及信号转导、免疫系统、疾病通路和细胞凋亡等多个复杂的生物学过程。信号转导通路有神经活性配体-受体相互作用、钙离子信号通路、Jak-STAT信号通路等,免疫系统包括NOD样受体信号通路和自然杀伤细胞介导的细胞毒性等通路,疾病通路包括胰腺癌、大肠癌途径、急性粒细胞白血病、慢性粒细胞白血病等通路,以及细胞凋亡通路。前10条通路之间的相互关系图如Fig 10,可见神经活性配体-受体相互作用和钙离子信号通路相对独立于其他通路之外。

|
| Fig 9 KEGG enrichment bubble chart |
|
| Fig 10 KEGG enrichment emapplot |
通过Cytoscape_3.8.2软件构建“CTS-交集靶点-KEGG通路”网络图如Fig 11所示。该网络包括96个节点(其中1个化合物、75个靶点以及20条KEGG通路)以及232条边。网络拓扑学分析得靶点的度值、节点紧密度和节点介度均高于其对应平均值的靶点有12个。KEGG通路的度值、节点紧密度和节点介度均高于其对应平均值的通路有2条。按照度值排序结果见Tab 3。靶点PIK3CA、MAPK1和STAT3很好的和PPI网络图形成了对应关系,但是APP靶点并未有较高的度值,初步推测酶调节剂APP可能是通过调节其他蛋白的活性来间接发挥其抗NSCLC的作用。

|
| Fig 11 "CTS-Intersection targets-KEGG pathways" network diagram |
| Name | Degree | Class |
| PIK3CA | 15 | Target |
| MAPK1 | 14 | Target |
| RELA | 12 | Target |
| MAPK8 | 11 | Target |
| MAPK10 | 11 | Target |
| TNF | 10 | Target |
| BCL2L1 | 8 | Target |
| CCND1 | 8 | Target |
| STAT3 | 8 | Target |
| CASP3 | 6 | Target |
| TYK2 | 5 | Target |
| PTPN11 | 5 | Target |
| Pathways in cancer | 14 | Pathway |
| Toxoplasmosis | 10 | Pathway |
本研究运用网络药理学和生物信息学相结合的方法对CTS抗NSCLC的分子机制进行了较为全面的探讨。
“CTS-交集靶点-KEGG通路”网络图表明了CTS抗NSCLC是多靶点、多通路机制。STAT3、APP、MAPK1和PIK3CA极大可能是CTS抗NSCLC的核心靶点。STAT3为一种信号转录蛋白,其组成性异常激活与细胞的增殖、分化、癌变密切相关,并在肺癌等肿瘤干细胞中存在异常的表达[8]。
APP是淀粉样β前体蛋白,研究表明淀粉样β前体蛋白结合家族成员1(APBB1)可以通过激活IGF1R信号通路,促进NSCLC上皮间质转化[9]。本课题组之前的研究发现CTS可以减少β-AP(APP水解而来)的合成以及β-AP的沉积速率[10]。关于APP和NSCLC之间的研究很少,值得我们进一步的研究。
MAPK1(ERK2)是细胞内的丝/苏氨酸蛋白激酶,其在肺癌患者中高表达。李耀杰等[11]则通过实验验证了miR-105-5p靶向下调MAPK1的表达抑制A549细胞的生长、运动和上皮间质转化。MAPK1有望成为治疗NSCLC的潜在性靶点。
PIK3CA为NSCLC相关驱动基因,严晓娣等[12]运用高通量测序技术检测了NSCLC患者相关基因的突变情况,PIK3CA突变的检出率为4.67%。宋忠花等[13]发现PIK3CA基因沉默48 h后,A549细胞的转移和侵袭能力显著降低。NSCLC组织中miR-363-3p可以通过靶向下调PIK3CA抑制A549细胞的增殖、侵袭和迁移[14]。PIK3CA亦有望成为治疗NSCLC的潜在性靶点。
分子对接结果表明了CTS相较于临床药物吉西他滨与核心靶点有更好的亲和力。CTS为脂溶性成分,结果提示我们可以对CTS的结构进行进一步的改造,以提高其水溶性,CTS或许可以成为抗NSCLC联合用药的一种选择。
GO富集分析结果表明CTS抗NSCLC机制的复杂性,广泛涉及信号传导、磷酸化与去磷酸化、细胞凋亡与血管调节等多种生物过程。
KEGG富集分析结果表明CTS抗NSCLC主要涉及信号传导、免疫系统等相关通路。CTS作为STAT3抑制剂,可以作用于STAT3相关信号通路来发挥其抗肿瘤的作用。根据相关靶点在通路中的位置分析,其机制与TYK2/STAT3通路相关的Bcl-XL、PIM1介导的抗细胞凋亡以及CyclinD1相关的细胞增殖有关。并且和SHP1/SHP2、PI3K/AKT、NF-κB、TNF-α(肿瘤坏死因子α)、MAPK级联反应和TGF-β(转化生长因子β)信号通路有关。
已有研究证明CTS可以通过JAK2/STAT3、SHP1/SHP2通路来发挥其抗慢性粒细胞白血病的作用,可以增强TNF-α诱导的KBM-5细胞凋亡[15-16]。提示我们CTS可能通过SHP1/SHP2和TNF-α通路发挥其抗NSCLC的作用。NF-κB途径可以介导CyclinD1、Bcl-XL以及COX-2(PTGS2)的表达,Cao等[17]研究发现,CTS剂量依赖性地抑制人肠道细胞中mRNA和蛋白水平COX-2的表达,从而降低PGE2表达量。COX-2在免疫系统以及肿瘤血管生成等方面发挥着重要作用,我们初步推测CTS可能是COX-2的抑制剂从而抑制肿瘤血管的生成。张倩钰等[18]验证了CTS能抑制TGF-β诱导的A549细胞由铺路石向梭状的形态转变,并降低了诱导之后的α-SMA表达量。CTS可能是通过竞争性结合SMAD4,从而减少了SMAD2/3与SMAD4的结合量来降低α-SMA的表达量。CTS能否通过TYK2/STAT3、SHP1/SHP2通路以及其他待验证通路发挥其抗NSCLC作用,仍需要进一步的实验验证。
综上所述,本研究以CTS为对象,运用网络药理学以及生物信息学方法,对CTS抗NSCLC的潜在相关性靶点以及机制进行了较为全面的探讨。为抗NSCLC的药物治疗提供了一定的参考价值,也为将CTS进一步开发为生物活性更高的抗NSCLC药物提供了理论上的支持。
| [1] |
Passiglia F, Pilotto S, Facchinetti F, et al. Treatment of advanced non-small-cell lung cancer: The 2019 AIOM (Italian Association of Medical Oncology) clinical practice guidelines[J]. Crit Rev Oncol Hematol, 2020, 146: 102858. doi:10.1016/j.critrevonc.2019.102858 |
| [2] |
郝文慧, 赵文文, 陈修平. 丹参酮类抗肿瘤作用与机制研究进展[J]. 中国药理学通报, 2014, 30(8): 1041-4. Hao W H, Zhao W W, Chen X P. Research progress of antitumor effect and mechanism of tanshinone[J]. Chin Pharmacol Bull, 2014, 30(8): 1041-4. doi:10.3969/j.issn.1001-1978.2014.08.002 |
| [3] |
张佳, 李明花, 袁星, 等. 隐丹参酮抗肿瘤作用机制的研究进展[J]. 中医研究, 2020, 33(7): 76-80. Zhang J, Li M H, Yuan X, et al. Research progress on anti-tumor mechanism of cryptotanshinone[J]. TCM Res, 2020, 33(7): 76-80. doi:10.3969/j.issn.1001-6910.2020.07.26 |
| [4] |
Jin L, Wu Z, Wang Y, et al. Cryptotanshinone attenuates the stemness of non-small cell lung cancer cells via promoting TAZ translocation from nuclear to cytoplasm[J]. Chin Med, 2020, 15: 66. doi:10.1186/s13020-020-00348-4 |
| [5] |
许冠华, 雷俊华, 金丽莎, 等. 隐丹参酮联合顺铂作用于非小细胞肺癌PC9细胞的体外研究[J]. 浙江中西医结合杂志, 2014, 24(12): 1043-5, 1048, 1034. Xu G H, Lei J H, Jin L S, et al. In vitro study of cryptotanshinone combined with cisplatin on non-small cell lung cancer PC9 cells[J]. Zhejiang JITCWM, 2014, 24(12): 1043-5, 1048, 1034. doi:10.3969/j.issn.1005-4561.2014.12.003 |
| [6] |
马蒙恩, 雷俊华, 许冠华. 隐丹参酮联合顺铂对非小细胞肺癌PC9细胞MMP-9、MMP-2、p-ERK1/2表达和迁移侵袭的影响[J]. 全科医学临床与教育, 2020, 18(8): 682-5, 668. Ma M E, Lei J H, Xu G H. Effects of cryptotanshinone combined with cisplatin on the expression, migration and invasion of MMP-9, MMP-2, p-ERK1/2 in non-small cell lung cancer PC9 cells[J]. Clinical Education of General Practice, 2020, 18(8): 682-5, 668. |
| [7] |
李向欣, 穆新林, 李璐. 吉西他滨注射剂联合顺铂注射剂治疗非小细胞肺癌患者的临床研究[J]. 中国临床药理学杂志, 2020, 36(11): 1446-9. Li X R, Mu X L, Li L. Clinical study of gemcitabine injection combined with cisplatin injection in the treatment of patients with non-small cell lung cancer[J]. Chin. J. Clin. Pharmacol, 2020, 36(11): 1446-9. |
| [8] |
刘航, 赵庆杰, 徐伟. 信号转导及转录激活因子3抑制剂研究进展[J]. 药学实践杂志, 2021, 39(1): 4-8. Liu H, Zhao Q J, Xu W. Research progress of signal transducer and activator of transcription 3 inhibitors[J]. J. Pharm. Pract, 2021, 39(1): 4-8. |
| [9] |
Lee J H, Kim J Y, Kim S Y, et al. APBB1 reinforces cancer stem cell and epithelial-to-mesenchymal transition by regulating the IGF1R signaling pathway in non-small-cell lung cancer cells[J]. Biochem Biophys Res Commun, 2017, 482(1): 35-42. doi:10.1016/j.bbrc.2016.11.030 |
| [10] |
Mei Z, Zhang F, Tao L, et al. Cryptotanshinone, a compound from Salvia miltiorrhiza modulates amyloid precursor protein metabolism and attenuates beta-amyloid deposition through upregulating alpha-secretase in vivo and in vitro[J]. Neurosci Lett, 2009, 452(2): 90-5. doi:10.1016/j.neulet.2009.01.013 |
| [11] |
李耀杰, 汤素娜, 王保收, 等. miR-105-5p靶向MAPK1抑制非小细胞肺癌细胞A549的生长、运动和上皮间质转化[J]. 中国免疫学杂志, 2020, 36(20): 2485-90. Li Y J, Tang S N, Wang B S, et al. miR-105-5p targets MAPK1 to inhibit the growth, movement and epithelial-mesenchymal transition of non-small cell lung cancer cell A549[J]. Chin. J. Immunol, 2020, 36(20): 2485-90. doi:10.3969/j.issn.1000-484X.2020.20.011 |
| [12] |
严晓娣, 史国振, 毛旭华. 高通量测序技术检测非小细胞肺癌相关驱动基因的突变[J]. 南京医科大学学报(自然科学版), 2021, 41(2): 193-7. Yan X D, Shi G Z, Mao X H. High-throughput sequencing technology to detect mutations in non-small cell lung cancer-related driver genes[J]. J. Nanjing Med. Univ., Nat. Sci, 2021, 41(2): 193-7. |
| [13] |
宋忠花, 张金庆, 王言森. PIK3CA基因对人非小细胞肺癌A549细胞侵袭及迁移能力的影响[J]. 解剖科学进展, 2018, 24(3): 293-5. Song Z H, Zhang J Q, Wang Y S. Effect of PIK3CA gene on invasion and migration of human non-small cell lung cancer A549 cells[J]. Prog. Anat. Sci, 2018, 24(3): 293-5. |
| [14] |
朱茜文, 安海燕, 张亚平. miR-363-3p靶向PIK3CA调节非小细胞肺癌细胞增殖、侵袭和迁移[J]. 中国免疫学杂志, 2020, 36(12): 1473-7, 1480. Zhu Q W, An H Y, Zhang Y P. miR-363-3p targets PIK3CA to regulate the proliferation, invasion and migration of non-small cell lung cancer cells[J]. Chin J Immunol, 2020, 36(12): 1473-7, 1480. doi:10.3969/j.issn.1000-484X.2020.12.013 |
| [15] |
Jung J H, Kwon T R, Jeong S J, et al. Apoptosis induced by tanshinone IIA and cryptotanshinone is mediated by distinct JAK/STAT3/5 and SHP1/2 signaling in chronic myeloid leukemia K562 cells[J]. Evid Based Complement Alternat Med, 2013, 2013: 805639. |
| [16] |
Kim J H, Jeong S J, Kwon T R, et al. Cryptotanshinone enhances TNF-α-induced apoptosis in chronic myeloid leukemia KBM-5 cells[J]. Apoptosis, 2011, 16(7): 696-707. doi:10.1007/s10495-011-0605-1 |
| [17] |
Cao S G, Chen R, Wang H, et al. Cryptotanshinone inhibits prostaglandin E2 production and COX-2 expression via suppression of TLR4/NF-κB signaling pathway in LPS-stimulated Caco-2 cells[J]. Microb Pathog, 2018, 116: 313-7. doi:10.1016/j.micpath.2017.12.027 |
| [18] |
张倩钰, 李亚丽, 王礼群, 等. 隐丹参酮对肺纤维化相关细胞的抑制作用研究[C]. 第十三届中国西部营养与健康高峰论坛, 中国四川成都, 2018: 1. Zhang Q Y, Li Y L, Wang L Q, et al. Study on the inhibitory effect of cryptotanshinone on pulmonary fibrosis-related cells[C]. The 13th Western China Nutrition and Health Summit Forum, Chengdu, Sichuan, China, 2018: 1. |

