

洪桂祝(1966-),女,博士,教授,研究方向:心脑血管药理学,通信作者,E-mail: 13559102126@163.com
脑卒中是由于血液循环受阻而引起的疾病,约有75%的患者产生不同水平的残疾,且极易复发。缺血性脑卒中是脑卒中的主要类型,约占87%[1]。组织型纤维蛋白溶酶原激活剂(tissue plasminogen activator,tPA)是临床首选治疗药物,其治疗时间窗窄(仅4.5 h左右),且只对3%~5%的脑卒中病人有治疗效果[2]。因此,迫切需要研发更安全、更有效的药物。
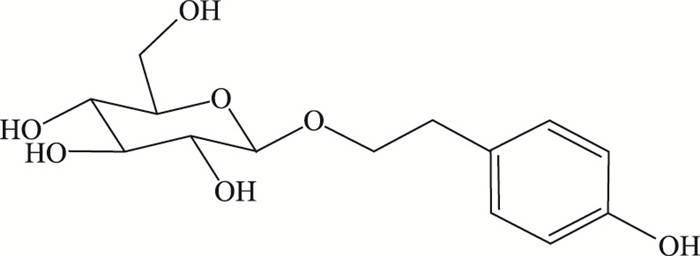
红景天苷(salidroside,sal)见Fig 1,是中药红景天的主要有效成分及药效物质基础的标志物。课题组前期研究证明,红景天苷具有抗炎、抗氧化、抗细胞凋亡的作用[3-5]。由于红景天苷是多羟基化合物,极性大,水溶性极好,脂溶性差,作用于中枢神经系统时具有局限性。一方面,红景天苷难以通过脂质膜,不易被肠胃吸收进入组织,亦难透过血脑屏障; 另一方面,其在体内易被代谢,药效降低,药理活性减弱。一次给药后,3 h后在血液和脑组织中几乎检测不到红景天苷,其在血液中的半衰期约40 min[6-7]。
|
| 图 1 Salidroside |
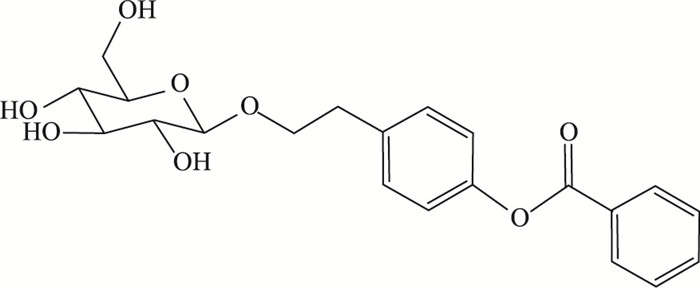
为改善红景天苷的脂溶性、优化传输、提高在体内的稳定性,达到增强药效的目的,课题组对红景天苷进行了结构修饰,通过酯化红景天苷分子中苷元上的酚羟基以及糖基上的醇羟基,接入不同的基团,合成了29个红景天苷衍生物,并进行体外药效筛选,优选出具有更好疗效的衍生物对苯甲酰红景天苷(pOBz,见Fig 2)[8]。课题组已就pOBz的结构及其应用申报国家发明专利(申请号:201710756613.1)[9]。pOBz对于在体内是否具有更好的改善脑卒中疗效,本研究将进一步探讨。
|
| 图 2 pOBz |
SPF级健康♂SD大鼠72只,体质量(260±10)g,购自上海斯莱克实验动物有限责任公司,生产许可证号:SCXK(沪)2014-0002,合格证号:2015000518015。于福建中医药大学实验动物中心进行饲养,使用合格证:SYXK(闽)2014-0005,适应性喂养1周。本动物实验均遵循动物实验伦理要求。
1.2 实验药物与主要试剂对苯甲酰红景天苷(福建中医药大学药学院提供,纯度≥99%,用含5% Tween-80的生理盐水配制成10 g·L-1); 红景天苷(福建中医药大学药学院提供,纯度≥99%,用0.9%生理盐水配制成10 g·L-1); NeuN抗体(Abcam,货号:ab177487);β-actin抗体(Trans Gen Biotech,货号:110813);Bax抗体(货号:#2772),Bcl-2抗体(货号:#2762),均购自CST; EGR1抗体(Santa Cruz Biotech,货号:sc-110)。
1.3 实验仪器凝胶成像分析系统(Bio-Rad公司,型号:ChemiDoc XRS+); 7.0T小动物核磁共振成像仪(德国Broker公司,型号:Biospec70/20 USR); 荧光倒置显微镜(Leica公司,型号:DMI8);石蜡切片机(Thermo公司,型号:HM325);紫外可见分光光度计(Thermo公司,型号:ND2000C); 多功能酶标仪(TECAN公司,型号:Infinite M200 Pro); 大鼠脑模具(瑞沃德公司,型号:68709);线栓(广州佳灵,货号:L3600)。
2 方法 2.1 分组及给药 2.1.1 不同剂量pOBz对MCAO大鼠的影响30只健康成年♂SD大鼠,随机分为Sham组、MCAO组、MCAO+pOBz低、中、高剂量组(25、50、100 mg·kg-1),每组6只。造模成功后,Sham组和MCAO组大鼠腹腔注射(ip)生理盐水(10 mL·kg-1),对MCAO+pOBz给药组分别ip 25、50、100 mg·kg-1pOBz,每天记录体质量,连续给药2 d后取材。
2.1.2 pOBz和Sal对MCAO大鼠的影响24只健康成年♂SD大鼠,随机分为Sham组、MCAO组、MCAO+pOBz组和MCAO+Sal组,每组6只。Sham组和MCAO组大鼠ip生理盐水(10 mL·kg-1),MCAO+pOBz组ip pOBz(50 mg·kg-1),MCAO+Sal组红景天苷(50 mg·kg-1),给药1 d后取材。2.1.3 pOBz对MCAO大鼠大脑皮层NeuN表达的影响18只健康成年♂SD大鼠,随机分为Sham组、MCAO组和MCAO+pOBz组,每组6只。Sham组和MCAO组大鼠ip生理盐水(10 mL·kg-1),MCAO+pOBz组ip pOBz(50 mg·kg-1),连续给药2 d后灌注固定取脑。
2.2 MCAO模型的制备大鼠禁食(不禁水)12 h后,2%戊巴比妥钠(2 mL·kg-1)麻醉。分离颈总动脉、颈外动脉和颈内动脉,在颈总动脉剪一小口,插入线栓, 结扎颈内动脉。阻塞2 h后拔线栓,实现再灌注。Sham组除不插入线栓外,其余操作同MCAO组。手术中维持大鼠体温,术后自由摄食饮水。待大鼠清醒参考Zea-Longa 5级评分制[10]进行神经功能损伤评分,2~3分说明模型成功,可用于后续实验。
2.3 取材麻醉大鼠后,使用采血针对腹主动脉放血,剪断大鼠颈部,剪开头部的皮肤,暴露头骨并用线剪剪开,使用手术钳翻开头骨,使整个脑组织暴露,取出大脑并分离左右脑,迅速放入做好标记的冻存管中,移入液氮保存。
2.4 MRI检测MCAO大鼠脑梗死体积将大鼠用异氟烷麻醉,俯卧位固定于动物床上,利用大鼠头部表面线圈检测,冠状定位扫描,采用T2W1增强系列。成像参数:T2W1采用TSE序列,TE 33 ms,TR 2700 ms,24层,矩阵30 mm×30 mm,Rfov 60%,NSA 15,扫描5 min 50 s。
2.5 Western blot检测蛋白表达提取总蛋白,测定蛋白浓度,经电泳分离总蛋白后,转膜,5%BSA封闭,一抗4 ℃孵育过夜,各一抗稀释倍数分别为NeuN(1 ∶3 000)、EGR1(1 ∶1 000)、Bcl-2(1 ∶1 000)及Bax(1 ∶1 000)。TBST洗3次,10 min/次,二抗室温孵育2 h,TBST洗3次,10 min/次。检测目标条带并分析条带的灰度值。
2.6 免疫荧光染色观察NeuN的表达将固定24 h的脑组织进行切片、脱水、透化、石蜡包埋及制作组织片。之后脱蜡复水、热抗原修复,5% BSA封闭2 h,一抗4 ℃孵育过夜,NeuN抗体稀释倍数(1 ∶200)。次日复温40 min,PBS摇洗3次,3 min/次。荧光二抗室温避光孵育2 h,PBS避光摇洗3次,3 min/次。甩去PBS,DAPI染色8 min,PBS避光摇洗3次,每次3 min。采用抗淬灭剂封片,于荧光倒置显微镜观察组织染色情况。
2.7 统计学分析采用SPSS 21.0软件对数据统计分析,数据用x±s表示,进行One-way ANOVA分析。
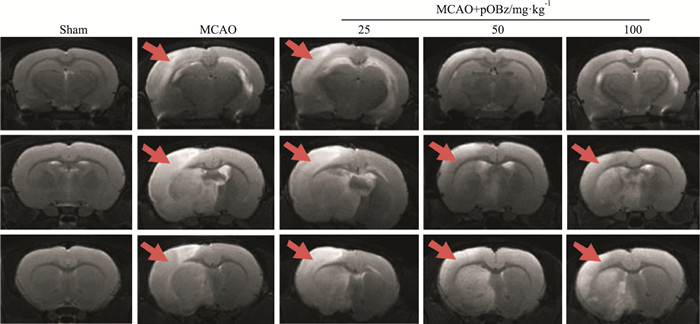
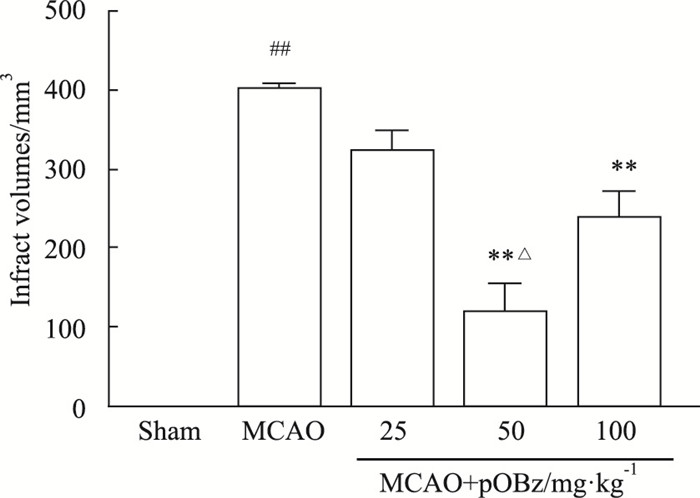
3 结果 3.1 不同剂量pOBz对MCAO大鼠的影响 3.1.1 pOBz对MCAO大鼠脑梗死体积的影响同MCAO组比较,MCAO+pOBz中剂量组(50 mg·kg-1)和MCAO+pOBz高剂量组(100 mg·kg-1)的脑梗死体积明显减少(P < 0.01),且50 mg·kg-1pOBz的脑梗死体积改善优于100 mg·kg-1(P < 0.05),见Fig 3,4。
|
| 图 3 Effect of pOBz on cerebral infarction volume in rats |
|
| 图 4 Effects of different doses of pOBz on volume of cerebral infarction in MCAO rats (x±s, n=6) ##P < 0.01 vs sham; **P < 0.01 vs MCAO; △P < 0.05 vs MCAO+pOBz (100 mg·kg-1) |
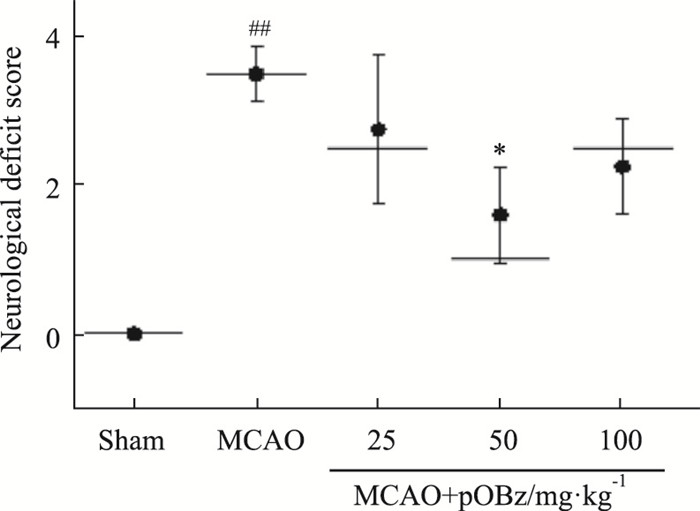
大鼠神经功能损伤评分在2-3分视为造模成功,pOBz给药后,大鼠神经功能损伤评分呈下降趋势,50 mg·kg-1pOBz给药2 d后评分下降(P < 0.05),见Fig 5。
|
| 图 5 Effects of different doses of pOBz on neurological function damage score of MCAO rats (x±s, n=6) ##P < 0.01 vs sham; *P < 0.05 vs MCAO |
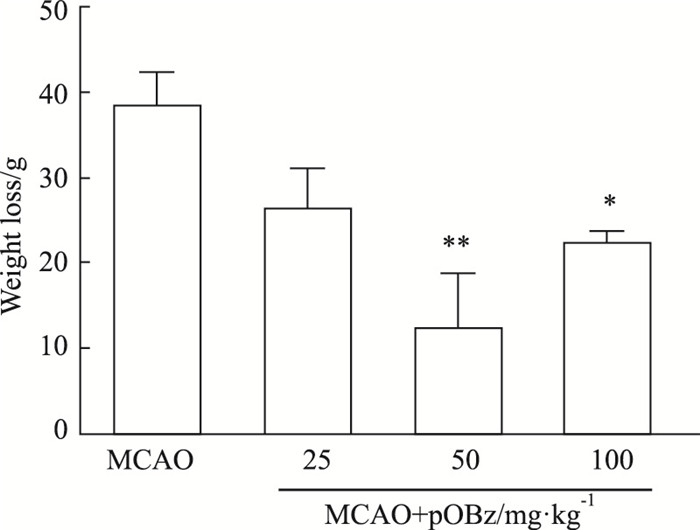
造模后,大鼠的体质量减轻,同MCAO组比较,MCAO +pOBz中剂量组(50 mg·kg-1)(P < 0.01)和MCAO+pOBz高剂量组(100 mg·kg-1)(P < 0.05)的体质量减轻小于模型组,见Fig 6。
|
| 图 6 Effects of different doses of pOBz on body weight of MCAO rats (x±s, n=6) *P < 0.05, **P < 0.01 vs MCAO |
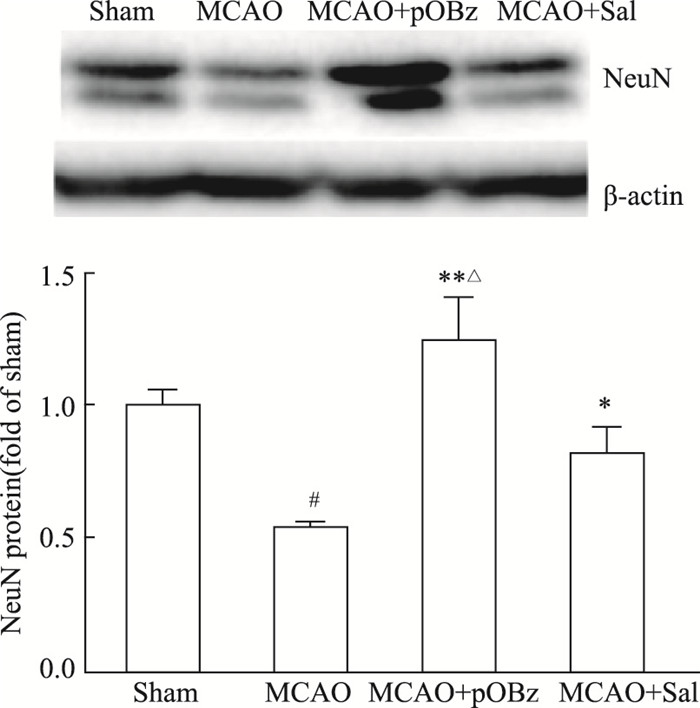
与Sham组相比,MCAO组大鼠脑组织的NeuN表达减少(P < 0.05),pOBz给药组和Sal给药组NeuN的表达升高,且pOBz给药组升高的程度明显高于Sal给药组(P < 0.05或P < 0.01),见Fig 7。
|
| 图 7 Effects of pOBz and salidroside on NeuN in MCAO rats (x±s, n=6) #P < 0.05 vs Sham; *P < 0.05, **P < 0.01 vs MCAO; △P < 0.05 vs MCAO+Sal |
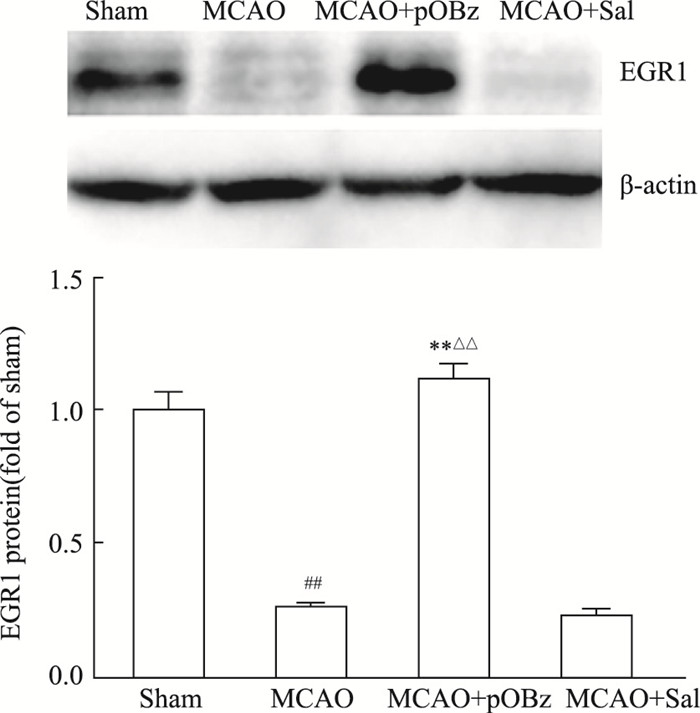
与Sham组相比,MCAO大鼠脑组织的EGR1表达减少,pOBz给药组表达升高,Sal给药组无明显变化(P < 0.05或P < 0.01),见Fig 8。
|
| 图 8 Effects of pOBz and salidroside on EGR1 in MCAO rats (x±s, n=6) ##P < 0.01 vs sham; **P < 0.01 vs MCAO; △△P < 0.01 vs MCAO+Sal |
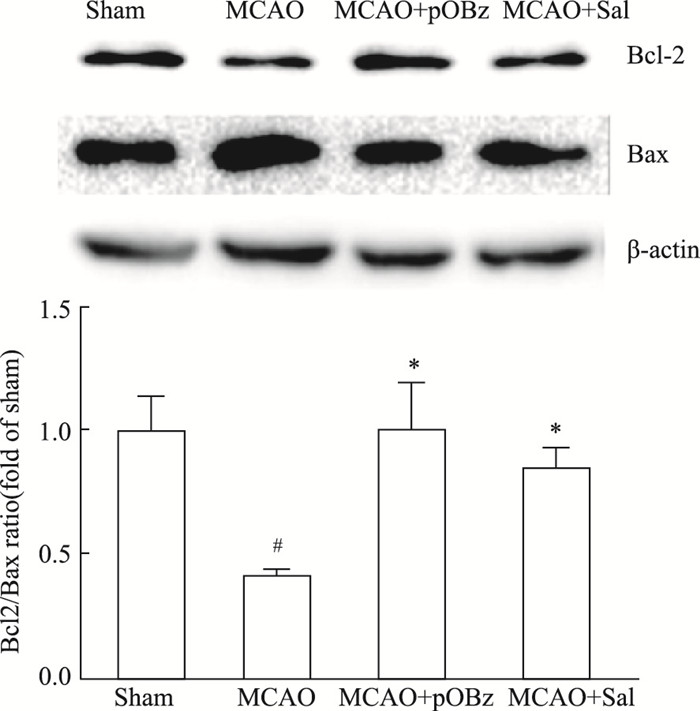
与Sham组相比,MCAO大鼠脑组织的Bcl-2/Bax比值降低,pOBz给药组和Sal给药组增加了Bcl-2/Bax的比值,升高的程度相同,见Fig 9。
|
| 图 9 Effects of pOBz and salidroside on Bcl-2/Bax in MCAO rats (x±s, n=6) #P < 0.05 vs sham; *P < 0.05 vs MCAO |
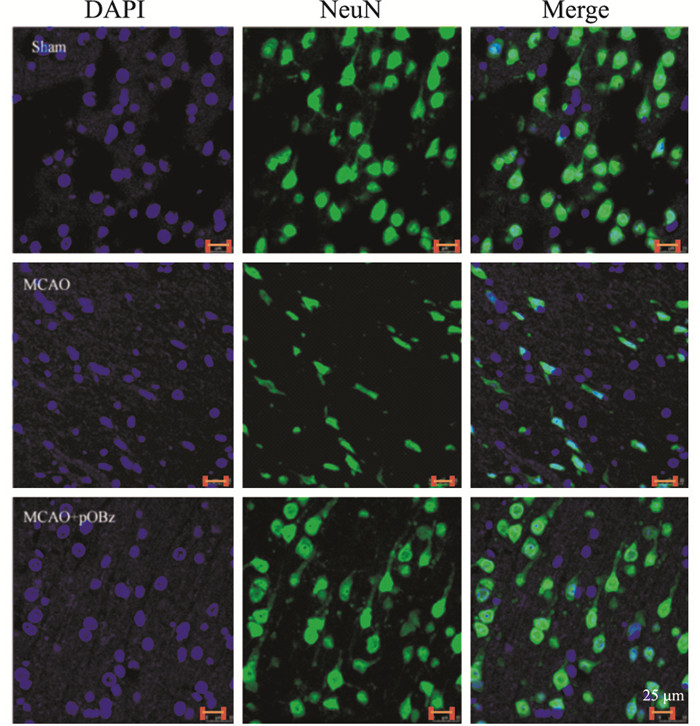
与Sham组相比,MCAO大鼠脑组织的NeuN表达减少,且形态上发生改变; pOBz给药组(50 mg·kg-1)NeuN表达增加,形态上也得到很大程度的恢复,见Fig 10。
|
| 图 10 Effects of pOBz on NeuN immunofluorescence expression in MCAO rats (400×) |
本研究采用MCAO模型能够较好地模拟脑缺血疾病。MRI结果确认了pOBz能够改善48 h的MCAO大鼠脑梗死体积,并确定最佳给药剂量是50 mg·kg-1。课题组前期TTC结果显示pOBz给药2 d能够显著改善MCAO大鼠的脑梗死体积,而Sal给药2 d没有改善梗死体积,到d 6 Sal才表现出改善梗死面积。刘俊杰[11]、谢秀利[12]等也报道连续给药6 d后观察到Sal改善脑梗死体积。
神经功能损伤评分结果显示pOBz给药后评分均呈下降趋势,50 mg·kg-1pOBz给药组大鼠的神经功能损伤评分得到显著改善。课题组前期报道Sal给药d 6可以观察到神经功能损伤评分的改善[3],与脑梗死体积结果一致。同时本研究还观察到,50和100 mg·kg-1pOBz给药2 d可以显著改善MCAO大鼠体质量的减少,这在Sal的研究中未见报道。临床上脑卒中患者发病后机体大量蛋白质损失,加上进食减少,导致营养不良、体质量下降,使得患者预后较差,死亡率提高[13]。神经功能损伤的程度越高,体质量恢复能力就越差,Long等[14]研究表明,促进体质量的恢复可以改善神经功能缺损,二者相辅相成。pOBz给药2 d可以改善体质量的降低,也反映了对神经缺损的改善,同时体质量的增加促进MCAO大鼠神经功能的改善,有益于疾病预后恢复。
不管是脑梗死还是神经功能损伤,其本质都是由于脑供血中断导致的神经元损伤和神经功能丧失。目前已经发现Sal在MCAO模型中具有神经保护作用[3, 12, 15]。神经元核抗原(NeuN)是成熟神经元细胞的标记,MCAO大鼠NeuN减少,是神经元特异质基因的改变[16]。从免疫荧光染色结果中可见pOBz给药2d对MCAO大鼠NeuN蛋白表达在形态和数量上都有明显的改善。课题组前期研究显示,Sal可以升高24h MCAO大鼠NeuN的表达[4],而本研究显示pOBz诱导NeuN的升高程度优于Sal。EGR1是早期生长反应蛋白之一,缺血性脑卒中发生后关键差异表达的基因,其表达可以预防神经元损伤以及减轻脑卒中后的血栓形成和炎症[4, 17]。课题组前期发现,Sal在缺血后24 h不改善EGR1的表达,而48 h后能够观察到EGR1升高[3],本研究中pOBz在24 h时即可显著升高MCAO大鼠EGR1的表达。这些结果提示pOBz在蛋白表达水平对脑缺血/再灌注大鼠的神经保护作用优于Sal。
线粒体在细胞凋亡过程中扮演重要角色。抗凋亡蛋白Bcl-2和促凋亡蛋白Bax蛋白同属Bcl家族,对调节线粒体膜通透性、线粒体功能及Cyt-c释放起至关重要的作用。缺血性脑卒中发生后,Bax在脑中表达增加,抑制Bax或表达Bcl-2可减轻缺血性损伤发挥脑保护作用[18]。与Lai等[4]报道Sal改善缺血后24 h MCAO大鼠中Bcl-2和Bax比值相吻合,研究发现红景天苷与pOBz均能改善MCAO大鼠脑组织Bcl-2 /Bax的比值降低,并且pOBz的改善程度与Sal相当,分析可能的原因有:(1)患侧半脑除了神经细胞,胶质细胞、内皮细胞也含有Bcl-2和Bax,检测结果为患侧半脑总蛋白结果,pOBz和Sal抑制神经细胞凋亡的结果并未检测到; (2)线粒体凋亡相关的蛋白不只有Bcl-2和Bax,还有Bad、Bak、Bcl-xl、Mcl-1等其他指标,本研究中并未全部筛选检测,pOBz表现出优于Sal的神经保护作用,也有可能是通过其他凋亡靶蛋白来抑制MCAO大鼠脑组织凋亡; (3)pOBz对MCAO大鼠的神经保护作用不仅通过改善线粒体诱导细胞凋亡途径,还可能通过其它途径,如通过对大脑炎症的调控,改善脑内炎症环境来增强对神经的保护作用。
综上,pOBz给药2 d可降低MCAO再灌注大鼠的脑梗死体积,改善体质量减轻,具有优于红景天苷的神经保护作用,该研究为进一步研究pOBz对MCAO大鼠的神经保护作用打下坚实基础。
| [1] |
Benjamin E J, Virani S S, Callaway C W, et al. Heart disease and stroke statistics-2018 update: A report from the American Heart Association[J]. Circulation, 2018, 137(12): e67-492. |
| [2] |
Prabhakaran S, Ruff I, Bernstein R A. Acute stroke intervention: A systematic review[J]. JAMA, 2015, 313(14): 1451-62. doi:10.1001/jama.2015.3058 |
| [3] |
Lai W F, Zheng Z W, Zhang X Q, et al. Salidroside-Mediated neuroprotection is associated with induction of early growth response genes (Egrs) across a wide therapeutic window[J]. Neurotox Res, 2015, 28(2): 108-21. doi:10.1007/s12640-015-9529-9 |
| [4] |
Lai W F, Xie X L, Zhang X Q, et al. Inhibition of complement drives increase in early growth response proteins and neuroprotection mediated by salidroside after cerebral ischemia[J]. Inflammation, 2018, 41(2): 449-63. doi:10.1007/s10753-017-0701-7 |
| [5] |
杨泽霖, 黄鑫, 刘俊杰, 等. 红景天苷调控PI3K/Akt信号通路对LPS诱导的BV2小胶质细胞的抗炎作用[J]. 中国药理学通报, 2019, 35(8): 1145-9. Yang Z L, Huang X, Liu J J, et al. Anti-inflammatory effects of salidroside on LPSinduced BV2 microglia cells via PI3K/Akt signaling pathway[J]. Chin Pharmacol Bull, 2019, 35(8): 1145-9. |
| [6] |
吴浩, 狄留庆, 单进军, 等. 大鼠血浆中红景天苷UPLC-MS/MS检测方法的建立及其在药动学研究中的应用[J]. 中成药, 2014, 36(6): 1176-81. Wu H, Di L Q, Shan J J, et al. Development and validation of a UPLC-MS/MS method for determination of salidroside in rat plasma: Application to the pharmacokinetics study[J]. Chin Tradit Pat Med, 2014, 36(6): 1176-81. doi:10.3969/j.issn.1001-1528.2014.06.014 |
| [7] |
郭娜. 红景天苷及其代谢产物酪醇在大鼠体内的药物代谢动力学研究[D]. 哈尔滨: 东北林业大学, 2012. Guo N. Pharmacokinetic studies of salidroside and its metabolite p-tyrosol in rats[D]. Haerbing: Northeast Forestry Univ, 2012. |
| [8] |
Yang Z L, Huang X, Lai W F, et al. Synthesis and identification of a novel derivative of salidroside as a selective, competitive inhibitor of monoamine oxidase B with enhanced neuroprotective properties[J]. Eur J Med Chem, 2021, 209: 112935. doi:10.1016/j.ejmech.2020.112935 |
| [9] |
陈立典, 洪桂祝, 褚克丹, 等. 红景天苷在制备补体抑制剂药物中的用途[P]. 福建: CN107625777A, 2018-01-26. Chen L D, Hong G Z, Chu K D, et al. Application of salidroside in preparation of complement inhibitor drugs[P]. Fujian: CN107625777A, 2018-01-26. |
| [10] |
Longa E Z, Weinstein P R, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. doi:10.1161/01.STR.20.1.84 |
| [11] |
刘俊杰, 杨泽霖, 唐宇恒, 等. 红景天苷对永久性大脑中动脉闭塞模型大鼠的神经保护作用[J]. 中国药理学通报, 2020, 36(8): 1063-8. Liu J J, Yang Z L, Tang Y H, et al. Neuroprotective effects of salidroside on rat model of permanent middle cerebral artery occlusion[J]. Chin Pharmacol Bull, 2020, 36(8): 1063-8. |
| [12] |
谢秀利, 洪海棉, 赖文芳, 等. 红景天苷对大脑中动脉闭塞模型大鼠的神经保护作用[J]. 中国药理学通报, 2015, 31(10): 1452-7. Xie X L, Hong H M, Lai W F, et al. Protective effects of salidroside in MCAO rats[J]. Chin Pharmacol Bull, 2015, 31(10): 1452-7. |
| [13] |
Zhang J, Zhao X, Wang A, et al. Emerging malnutrition during hospitalisation independently predicts poor 3-monthoutcomes after acute stroke: Data from a Chinese cohort[J]. Asia Pac J Clin Nutr, 2015, 24(3): 379-86. |
| [14] |
Long D, Bouvignies G, Kay L E. Measuring hydrogen exchange rates in invisible protein excited states[J]. Proc Natl Acad Sci USA, 2014, 111(24): 8820-5. doi:10.1073/pnas.1405011111 |
| [15] |
Liu X, Wen S, Yan F, et al. Salidroside provides neuroprotection by modulating microglial polarization after cerebral ischemia[J]. J Neuroinflammation, 2018, 15(1): 39. doi:10.1186/s12974-018-1081-0 |
| [16] |
Cotrina M L, Lou N, Tome-Garcia J, et al. Direct comparison of microglial dynamics and inflammatory profile in photothrombotic and arterial occlusion evoked stroke[J]. Neuroscience, 2017, 343: 483-94. doi:10.1016/j.neuroscience.2016.12.012 |
| [17] |
Li Y Y, Guo J H, Liu Y Q, et al. PPARγ activation-mediated Egr-1 inhibition benefits against brain injury in an experimental ischaemic stroke model[J]. J Stroke Cerebrovasc Dis, 2020, 29(12): 105255. doi:10.1016/j.jstrokecerebrovasdis.2020.105255 |
| [18] |
何军娜. 瑞替加滨对实验性脑梗死小鼠的脑保护作用: 下调calpain-1、Bax, 上调Bcl-2的表达[D]. 石家庄: 河北医科大学, 2016. He J N. Neuroprotective effect of retigabine in the mouse model of cerebral ischemia: Down-regulated the expression of calpain-1 and Bax, up-regulated Bcl-2[D]. Shijiazhuang: Hebei Med Univ, 2016. |

