

心血管病现患人数3.30亿,其中冠心病1 100万,心力衰竭890万[1]。随着心肌梗死患者接受血管再通治疗的比例增多,心肌梗死后存活患者比例增高,这部分患者最终会发展成为心力衰竭[2]。心肌梗死中缺氧导致血管内皮细胞损伤是心肌梗死后心力衰竭病理发展的主要原因[3]。在缺氧刺激下,内皮细胞发生炎症、氧化应激和凋亡,导致内皮细胞增殖减少、舒张功能障碍、细胞数量减少[4]。此外,内皮细胞自噬流受阻是缺氧诱导内皮细胞损伤的主要病理改变[5]。因此,明确缺氧条件下内皮细胞损伤的机制,对发现防治心脏缺血损伤新的干预靶点至关重要。
溶酶体组织蛋白酶B(CTSB)是一种溶酶体酶,其在维持溶酶体功能、细胞凋亡和自噬中发挥重要作用[6]。研究表明CTSB在心血管疾病中发挥重要作用。Mehra等[7]报道CTSB在扩张型心肌病患者血浆中表达增高与射血分数降低密切相关。CTSB可通过激活炎症小体和促进细胞凋亡而加剧柯萨奇病毒B3诱导的心肌炎[8]。以往的研究发现,CTSB基因敲除小鼠可通过TNF-α-ASK1-JNK途径减轻压力负荷下的心肌重构[9]。但是CTSB是否可以通过调控自噬参与缺氧诱导的内皮细胞损伤尚不清楚。本研究拟通过分离培养CTSB基因敲除小鼠心脏微血管内皮细胞,探讨CTSB在缺氧诱导的内皮细胞损伤中的作用。
1 材料与方法 1.1 材料CTSB基因敲除(KO)小鼠购买于Jackson Lab(货号: 030971,美国); C57BL6J野生型(WT)小鼠购买于北京华富康公司; TNF-α、IL-1、IL-6 ELISA试剂盒购买于Biolegend公司(货号:430901, 432604, 431304美国); CD31(货号:ab28364)、钙粘蛋白(Cadherin,货号:ab33168)一抗购买于Abcam公司(美国); LC3-GFP-mCherry双标腺病毒购买于山东维真公司; Tunel染色试剂盒购买于Millipore公司(货号:S7111,美国); 巴弗洛霉素(BAF,货号:19-148)购买于Sigma公司; caspase-3活性检测试剂盒购买于碧云天公司(上海,货号:C1115);CTSB过表达腺病毒购买于山东维真公司。
1.2 方法 1.2.1 内皮细胞分离培养4~6周C57BL6J小鼠或CTSB基因敲除小鼠心脏剪出后置于D-Hanks平衡液中冲洗,心脏剪碎后采用胶原酶在37 ℃消化心脏15 min,分5次消化后收集消化液,置于终浓度为10%FBS的DMEM-F12中,将细胞过滤后重悬,采用CD31磁珠吸附内皮细胞,将内皮细胞置于含10%FBS的DMEM-F12中培养。
1.2.2 内皮细胞分组处理 1.2.2.1 第一部分实验分组:① WT-常氧组:分离C57BL6J野生型小鼠心脏微血管内皮细胞,采用常氧(5%CO2,95%空气)培养48 h; ② KO-常氧组:分离CTSB基因敲除小鼠心脏微血管内皮细胞,采用常氧处理48 h。③ WT-缺氧组:分离C57BL6J野生型小鼠心脏微血管内皮细胞,采用缺氧(5%氧气,95%N2)培养48 h; ④ KO-缺氧组:分离CTSB基因敲除小鼠心脏微血管内皮细胞,采用缺氧处理48 h。
1.2.2.2 第二部分将细胞分组:① Ad-NC-常氧组:分离C57BL6J野生型小鼠心脏微血管内皮细胞,采用腺病毒空载体感染内皮细胞8 h,采用常氧培养48 h; ② Ad-CTSB-常氧组:分离C57BL6J野生型小鼠心脏微血管内皮细胞,采用腺病毒感染内皮细胞过表达CTSB(Ad-CTSB)8 h,采用常氧处理48 h。
③ Ad-NC-缺氧组:分离C57BL6J野生型小鼠心脏微血管内皮细胞,采用腺病毒空载体感染内皮细胞8 h,采用缺氧刺激48 h; ④ Ad-CTSB-缺氧组:分离C57BL6J野生型小鼠心脏微血管内皮细胞,采用腺病毒感染内皮细胞过表达CTSB(Ad-CTSB)8 h,缺氧处理48 h; ⑤ Ad-NC-常氧+巴弗洛霉素组(BAF)组:分离C57BL6J野生型小鼠心脏微血管内皮细胞,采用腺病毒空载体感染内皮细胞8 h,BAF (100 nmol·L-1)处理12 h,常氧处理48 h; ⑥ Ad-CTSB-缺氧+BAF组:分离C57BL6J野生型小鼠心脏微血管内皮细胞,采用腺病毒感染内皮细胞过表达CTSB 8 h,BAF(100 nmol·L-1)处理12 h,缺氧处理48 h。
1.2.3 内皮细胞CD31和钙黏连蛋白免疫荧光染色采用CD31和钙黏连蛋白免疫荧光染色鉴定分离的心脏微血管内皮细胞。细胞采用4%多聚甲醛固定5 min,采用0.1%TritonX通透后,采用8%羊血清封闭,采用抗CD31抗体和抗钙黏连蛋白抗体(1 ∶100稀释)4 ℃孵育过夜,采用Alexa FluorH 488羊抗小鼠和568羊抗兔二抗孵育1 h,采用DAPI进行细胞核染色,荧光显微镜下观察。
1.2.4 ELISA检测炎症细胞因子的释放各组处理完毕后收集细胞,将细胞在含有RIPA的裂解液中裂解后在冰上放置10 min,根据Elisa试剂盒配置标准蛋白,将样本和标准品加入酶标板中,在37 ℃孵育30 min,洗涤后加入100 μL酶结合物,洗涤后加入1μLTMD,15 min后加入硫酸终止液,在酶标仪(Synergy HT, BioTek, 美国)450 nm处读取吸光度。根据标准品浓度制作标准曲线,计算各样本的浓度。
1.2.5 TUNEL染色检测细胞凋亡细胞采用4%多聚甲醛固定5 min,采用0.1%TritonX通透后,采用Tunel试剂酶在37 ℃孵育1 h,采用DAPI进行细胞核染色,荧光显微镜(OLYMPUS BX43,日本)下观察。细胞凋亡数量计算单个视野内TUNEL阳性细胞数*100%/总细胞数。
1.2.6 caspase-3活性检测使用RIPA裂解液裂解细胞,加入检测缓冲液,再加待测样品,随后再加入10 μL Ac-DEVD-pNA(2mM),37 ℃孵育60 min。在酶标仪(Synergy HT,BioTek,美国)下检测405 nm处吸光度。
1.2.7 LC3-GFP-mcherry双标病毒检测细胞自噬流细胞接种于24孔板,在处理前感染LC3-GFP-mcherry双标病毒8 h,随后进行各组处理,将细胞爬片取出,在荧光显微镜OLYMPUS BX43,日本)下计数细胞内红色和绿色LC3数量。
1.2.8 统计学分析采用SPSS 23.0软件进行分析,计量资料以x±s表示,计数资料以%表示,两样本间比较采用独立样本t检验,多组间比较采用单因素方差分析,时候检验采用LSN检验。
2 结果 2.1 CD31和钙黏连蛋白染色鉴定内皮细胞采用CD31和钙黏连蛋白免疫荧光双染色鉴定分离培养的内皮细胞,结果显示分离出的细胞均表达CD31和钙黏连蛋白(Fig 1A),提示心脏微血管内皮细胞分离成功。采用免疫印迹鉴定内皮细胞CTSB蛋白的表达,结果显示,KO组小鼠内皮细胞CTSB完全不表达,WT组内皮细胞正常表达CTSB蛋白(Fig 1B)。
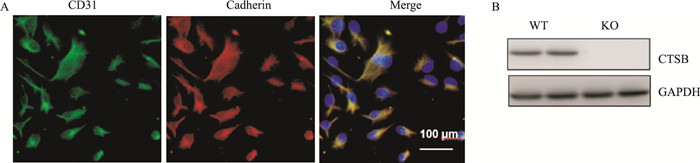
|
| 图 1 Identification of endothelial cells(×200) Legend: Green represents CD31, red represents Cadherin, and blue represents cell nucleus |
采用Elisa检测野生型小鼠内皮细胞和CTSB基因敲除内皮细胞缺氧刺激后TNF-α、IL-1和IL-6的释放,结果显示:与WT-常氧组相比,WT-缺氧组内皮细胞TNF-α、IL-1和IL-6的释放明显增加(P < 0.05);而KO-缺氧组内皮细胞TNF-α、IL-1和IL-6的释放高于缺氧组(P < 0.05),KO-常氧组与WT-常氧组之间上述炎症因子的释放无差异(P>0.05)。见Tab 1。
| Group | WT-normoxic | KO-normoxic | WT-hypoxia | KO-hypoxia | F value |
| TNF-α/ng·L-1 | 24.0±6.2 | 25.8±7.3 | 442.4±53.5* | 702.0±127.3# | 139.0 |
| IL-1/ng·L-1 | 12.1±5.8 | 16.55±7.2 | 241.5±57.0* | 372.1±37.5# | 158.6 |
| IL-6/ng·L-1 | 37.0±7.5 | 32.4±10.9 | 270.6±41.9* | 465.9±48.8# | 241.0 |
| *P < 0.05 vs WT-normoxic group; #P < 0.05 vs WT-hypoxia group | |||||
采用TUNEL染色检测细胞凋亡,结果显示:与WT-常氧组相比,WT-缺氧组内皮细胞凋亡细胞数量明显增加(P < 0.05);而KO-缺氧组内皮细胞凋亡细胞数量明显高于缺氧组(P < 0.05);KO-常氧组与WT-常氧组细胞凋亡数量无差异(P>0.05), 见Fig 2,Tab 2。
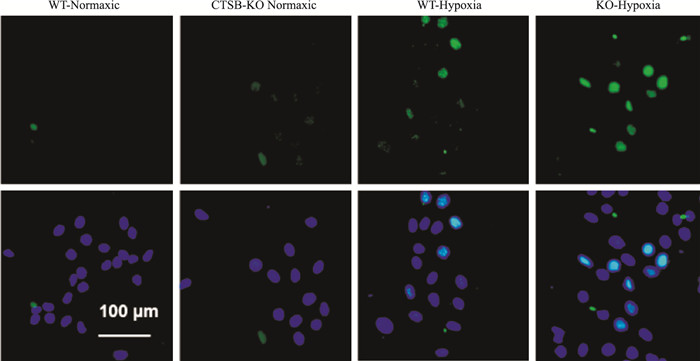
|
| 图 2 Endothelial cell apoptosis aggravated by CTSB knockout (×200) Legend: Green represents Tunel positive, and blue represents cell nucleus |
| Group | WT-normoxic | KO-normoxic | WT-hypoxia | KO-hypoxia | F value |
| TUNEL/% | 2.5±1.2 | 2.99±1.71 | 19.6±3.1# | 26.9±2.3# | 183.2 |
| caspase3 activity (Fold) | 1±0.25 | 0.91±0.23 | 2.14±0.19# | 3.11±0.38# | 81.1 |
| LC3-GFP (per cell) | 20.8±4.2 | 22.8±6.7* | 43.6±4.8# | 55.6±4.6# | 62.8 |
| LC3-mCherry (per cell) | 61.3±5.6 | 50.2±6.1 | 43.0±12.7 | 55.0±6.3 | 5.34 |
| *P < 0.05 vs WT-normoxic; #P < 0.05 vs WT-hypoxia group | |||||
采用caspase-3活性检测试剂盒检测细胞凋亡执行器caspase-3的活性,结果显示:与WT-常氧组相比,WT-缺氧组内皮细胞caspase-3活性明显增加(P < 0.05);而KO-缺氧组内皮细胞caspase-3活性明显高于缺氧组(P < 0.05);KO-常氧组与WT-常氧组caspase-3活性无差异(P>0.05), 见Tab 2。
2.4 CTSB敲除阻断内皮细胞自噬流采用LC3-GFP-mCherry双标腺病毒检测内皮细胞自噬流,结果显示:与WT-常氧组比,WT-缺氧组LC3-GFP(绿色荧光点)数量明显增多(P < 0.05);而KO-缺氧组内皮细胞LC3-GFP数量多于WT-缺氧组(P < 0.05)。KO常氧组LC3-GFP数量与WT-常氧组无差异(P>0.05)(Fig 3,Tab 2)。4组LC3-mCherry(红色荧光)数量无差异(P>0.05),提示CTSB基因敲除导致自噬降解受阻。
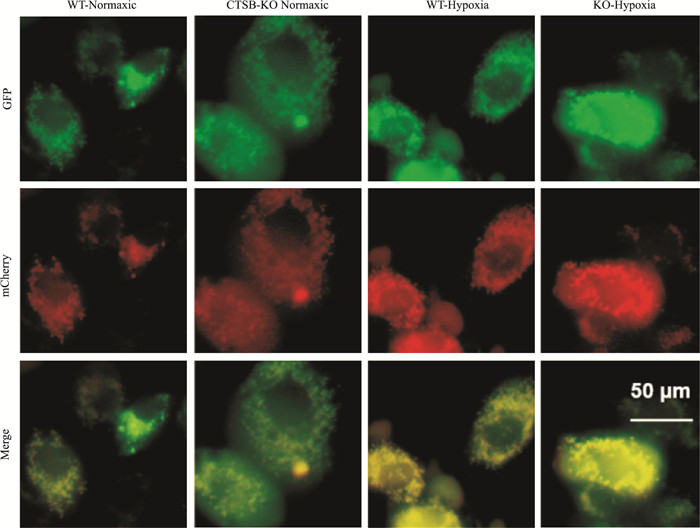
|
| 图 3 Autophagy flow in endothelial cells blocked by CTSB knockout (×400) Legend: Green represents GFP, and red represents mCherry |
第二部分实验,采用腺病毒载体感染C57BL6J野生型小鼠来源的心脏微血管内皮细胞,免疫印迹结果显示:当采用MOI=50时,Ad-CTSB感染效率最佳(Fig 4)。
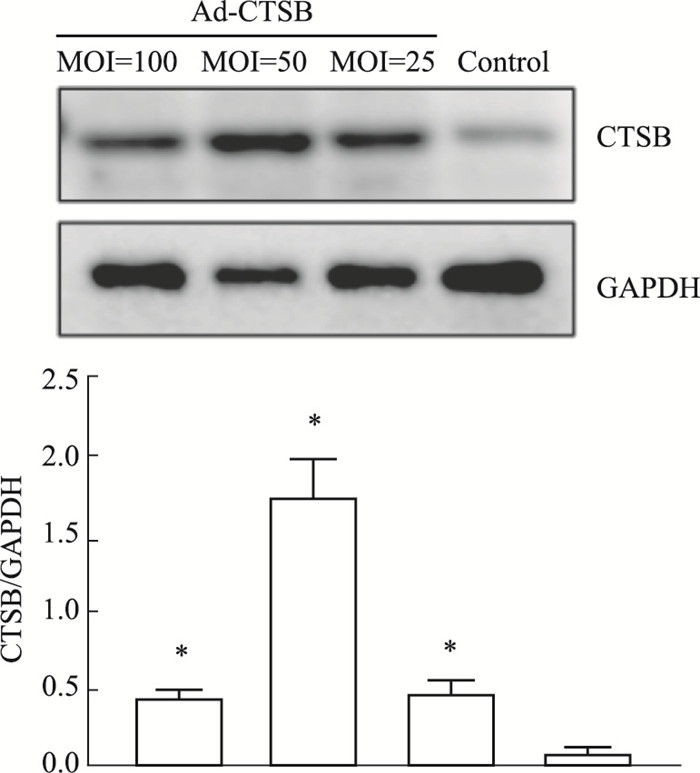
|
| 图 4 Endothelial cell adenovirus vector overexpression CTSB (n=6) Legend: a indicates *P < 0.05 vs the empty vector control group (Ad-GFP) |
采用ELISA检测各组细胞TNF-α、IL-1和IL-6的释放,结果显示:与Ad-NC-常氧组相比,Ad-NC-缺氧组内皮细胞TNF-α、IL-1和IL-6的释放明显增加(P < 0.05);而Ad-CTSB-缺氧组内皮细胞TNF-α、IL-1和IL-6的释放低于缺氧组(P < 0.05);Ad-NC-常氧+BAF组细胞炎症因子的释放高于Ad-NC-常氧组(P < 0.05);Ad-CTSB-缺氧+BAF组高于Ad-CTSB-缺氧组(P < 0.05),见Tab 3。
| Group | TNFα/μg·L-1 | IL-1/μg·L-1 | IL-6μg·L-1 |
| Ad-NC-Normoxic | 27.8±4.8 | 16.0±3.2 | 28.6±8.1 |
| Ad-CTSB-Normoxic | 19.8±7.0 | 11.2±4.7 | 23.9±8.6 |
| Ad-NC-hypoxia | 441.9±74.5* | 258.9±25.0* | 308.8±49.1* |
| Ad-CTSB-hypoxia | 143.4±47.8# | 85.9±10.3# | 116.9±24.7# |
| Ad-NC-Normoxic+BAF | 308.9±87.4* | 175.1±39.4* | 198.0±29.1* |
| Ad-CTSB-hypoxia+BAF | 434.7±69.8△ | 265.6±41.3△ | 318.1±61.3△ |
| F value | 65.4 | 117.8 | 79.5 |
| *P < 0.05 vs Ad-NC-normoxic group; #P < 0.05 vs Ad-NC-hypoxia group; represents △P < 0.05 vs Ad-CTSB-hypoxia group | |||
采用Tunel检测细胞凋亡水平,结果显示:与Ad-NC-常氧组相比,Ad-NC-缺氧组内皮细胞凋亡细胞数量明显增加(P < 0.05);而Ad-CTSB-缺氧组内皮细胞凋亡低于缺氧组(P < 0.05)。Ad-NC-常氧+BAF组细胞细胞凋亡数量高于Ad-NC-常氧组(P < 0.05);Ad-CTSB-缺氧+BAF组细胞凋亡数量高于Ad-CTSB-缺氧组(P < 0.05),见Fig 5,Tab 4。
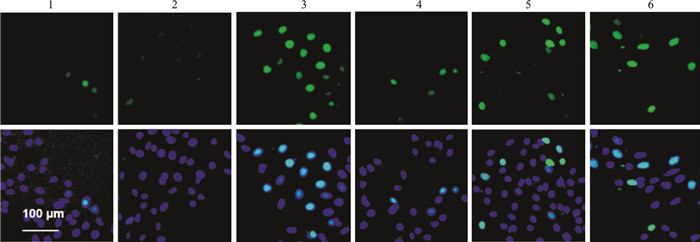
|
| 图 5 Endothelial cell apoptosis induced by hypoxia reduced by CTSB overexpression (×200) 1:Ad-NC-Normoxic; 2:Ad-CTSB-Normoxic; 3:Ad-NC-hypoxia; 4: Ad-CTSB-hypoxia; 5: Ad-NC-Normoxic+BAF; 6: Ad-CTSB-hypoxia+BAF; Legend: Green represents Tunels positive, and blue represents cell nucleus |
| Group | Tunel/% | caspase3 activity(Fold) | LC3-GFP(per cell) | LC3-mCherry (per cell) |
| Ad-NC-Normoxic | 3.5±1.0 | 1.0±0.31 | 15.1±1.7 | 67.8±6.0 |
| Ad-CTSB-Normoxic | 2.7±1.3 | 0.98±0.21 | 12.5±0.8 | 68.0±4.9 |
| Ad-NC-hypoxia | 20.3±3.5* | 2.92±0.35* | 60.6±5.9* | 62.5±5.1 |
| Ad-CTSB-hypoxia | 10.0±1.1# | 1.35±0.4# | 32.1±3.6 # | 67.3±6.2 |
| Ad-NC-Normoxic+BAF | 15.2±4.2* | 2.48±0.31* | 51.8±5.4* | 64.7±4.8 |
| Ad-CTSB-hypoxia+BAF | 19.1±0.3△ | 2.83±0.21△ | 63.2±3.5△ | 62.1±4.6 |
| F value | 62.04 | 52.92 | 194.9 | 1.51 |
| *P < 0.05 vs Ad-NC-normoxic group; #P < 0.05 vs Ad-NC-hypoxia group; △P < 0.05 vs Ad-CTSB-hypoxia group | ||||
采用LC3-GFP-mCherry双标腺病毒检测内皮细胞自噬流,结果显示:与Ad-NC-常氧组相比,Ad-NC-缺氧组LC3-GFP数量明显增多(P < 0.05);而Ad-CTSB-缺氧组内皮细胞LC3-GFP数量低于缺氧组(P < 0.05)。Ad-NC-常氧+BAF组LC3-GFP数量高于Ad-NC-常氧组(P < 0.05);Ad-CTSB-缺氧+BAF组LC3-GFP数量高于Ad-CTSB-缺氧组(P < 0.05)(Fig 6,Tab 4)。LC3-mCherry数量在6组之间无显著性差异(P>0.05)。
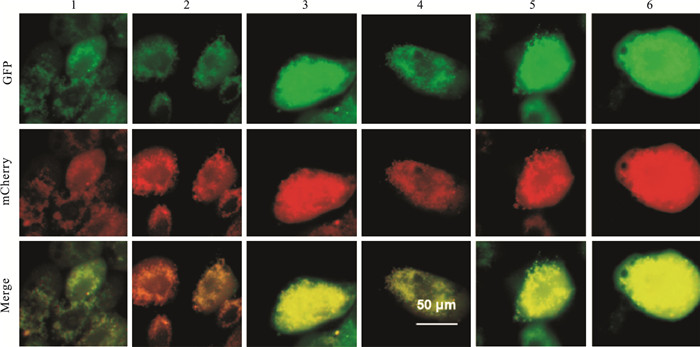
|
| 图 6 Endothelial cell autophagy flow improved by CTSB overexpression (×400) Legend: Green represents GFP, and red represents mCherry; 1:Ad-NC-Normoxic; 2:Ad-CTSB-Normoxic; 3:Ad-NC-hypoxia; 4: Ad-CTSB-hypoxia; 5: Ad-NC-Normoxic+BAF; 6: Ad-CTSB-hypoxia+BAF |
内皮细胞排列在心血管系统的血管内,在维持心脏所需的氧气和营养供应方面起着重要作用[10]。正常生理条件下,成人内皮细胞在血管内保持静止,但是当受到外界刺激损伤时可迅速激活[11]。在缺氧条件下,过度的内皮细胞损伤可导致其本身舒张功能障碍,增殖减少,小管形成功能降低,内皮细胞凋亡增多。在心脏持续缺氧条件下,上述病理改变可导致心脏组织微血管数量减少,心肌细胞供氧减少,导致心肌细胞功能障碍和死亡,从而诱导心衰的发生发展[12]。因此,维持正常的心脏微血管内皮细胞功能对保护病理条件下心脏功能至关重要。我们的研究发现CTSB可参与缺氧条件下内皮细胞的损伤发生,在内皮细胞中缺失CTSB,可加重缺氧条件下内皮细胞的炎症和凋亡; 然而在内皮细胞中过表达CTSB可减轻缺氧条件下内皮细胞的炎症和凋亡。细胞自噬在内皮细胞病理损伤中发挥重要作用。细胞自噬是一个保守的过程,它是细胞器和长寿蛋白通过囊泡和溶酶体系统降解的主要途径。自噬水平的改变对细胞而言可能是保护性的,也可能是有害性的,这取决于自噬的程度和细胞环境[13-14]。Martello等[15]报道,内皮细胞基础水平自噬降低可导致内皮细胞功能受损,心脏微血管密度降低。而Tang等[16]报道,通过减少自噬/线粒体自噬可保护内皮细胞缺氧/复氧损伤。目前对自噬在内皮细胞中的作用报道不一。主要原因在于多数研究并未检测细胞自噬流的水平。作为自噬溶酶体降解的主要酶之一,CTSB在自噬溶酶体降解中发挥关键作用[17]。我们的研究采用CTSB全基因敲除小鼠,分离其心脏微血管内皮细胞。采用LC3-GFP-mcherry自噬双标病毒标记自噬流的动态。在未发生自噬的细胞及含有自噬体的细胞中,由于mCherry与GFP共同表达,细胞呈现黄色荧光。当自噬体与溶酶体融合形成自噬溶酶体后,酸性的溶酶体环境使酸敏感的GFP荧光淬灭,而mCherry不受影响,进而使自噬溶酶体呈现红色荧光[18]。因此,绿色荧光越多,提示自噬降解受阻。我们发现在缺氧条件下,GFP绿色荧光明显增多,而红色荧光不变,提示内皮细胞自噬降解明显受阻。CTSB基因敲除内皮细胞发现在缺氧条件下,其绿色荧光明显增加,红色荧光与缺氧组无差异,提示CTSB基因敲除阻断了内皮细胞自噬溶酶体的降解,细胞自噬流受阻,凋亡增多。
巴弗洛霉素是V-ATPase酶抑制剂,可抑制细胞质膜和溶酶体膜表面的V-ATPase酶,减少细胞质内H+离子向溶酶体转运。巴弗洛霉素通过降低溶酶体的酸性环境减少自噬溶酶体的降解。本研究通过CTSB腺病毒载体感染内皮细胞,增加内皮细胞内CTSB蛋白的表达,发现细胞过表达CTSB能够减轻缺氧诱导的炎症和细胞凋亡。此外,CTSB蛋白过表达可增加自噬降解(表现为LC3-GFP绿色荧光明显减少,而红色荧光不变)。当采用巴弗洛霉素处理细胞后,CTSB蛋白过表达对内皮细胞的保护作用不再发生(表现为细胞炎症和凋亡明显增高)。提示CTSB通过调控自噬溶酶体降解在内皮缺氧损伤中发挥保护作用,CTSB保持自噬流的通畅是其保护内皮细胞缺氧损伤的基础。
以往的研究报道,CTSB在扩张型心肌病中表达增高,其与射血分数降低密切相关。CTSB可加剧柯萨奇病毒B3诱导的心肌炎[8]。CTSB基因敲除小鼠可减轻压力负荷下的心肌重构[9]。而这些研究均与我们的研究结果相悖。上述研究均在着重于CTSB在心肌细胞中的作用和机制,然而作为溶酶体蛋白之一,CTSB广泛表达于除心肌细胞以外的其他细胞,如成纤维细胞、内皮细胞、免疫细胞等。其在不同的细胞中可能发挥不同作用。另外一种可能是CTSB单独缺失,内皮细胞可能通过其他补偿机制平衡自噬和凋亡(我们的结果发现单独过表达或者敲除CTSB并不会影响内皮细胞自噬和凋亡),但是在合并缺氧的条件下,CTSB缺失诱发的自噬抑制能够大大增加内皮细胞死亡。
综上所述,CTSB参与内皮细胞缺氧损伤,CTSB通过增加自噬降解改善缺氧导致的内皮细胞自噬流阻塞,以CTSB作为靶点的治疗方法可能成为延缓心肌梗死后心力衰竭的新手段。
| [1] |
中国心血管健康与疾病报告编写委员会. 《中国心血管病健康和疾病报告2019》[J]. 中国循环杂志, 2020, 35(9): 833-54. The Writing Committee of the Report on Cardiovascular Health and Diseases in China. Report on Cardiovascular Health and Diseases in China 2019: An Updated Summary[J]. Chin Cir J, 2020, 35(9): 833-54. |
| [2] |
Bahit M C, Kochar A, Granger C B. Post-myocardial infarction heart failure[J]. JACC Heart Fail, 2018, 6(3): 179-86. doi:10.1016/j.jchf.2017.09.015 |
| [3] |
Hao H, Chen H, Bu D, et al. Loss of endothelial CXCR7 impairs vascular homeostasis and cardiac remodeling after myocardial infarction: Implications for cardiovascular drug discovery[J]. Circulation, 2017, 135(13): 1253-64. doi:10.1161/CIRCULATIONAHA.116.023027 |
| [4] |
Wong B W, Marsch E, Treps L, et al. Endothelial cell metabolism in health and disease: Impact of hypoxia[J]. EMBO J, 2017, 36(15): 2187-203. doi:10.15252/embj.201696150 |
| [5] |
Vion A C, Kheloufi M, Hammoutene A, et al. Autophagy is required for endothelial cell alignment and atheroprotection under physiological blood flow[J]. Proc Natl Acad Sci USA, 2017, 114(41): E8675-84. doi:10.1073/pnas.1702223114 |
| [6] |
Ni J, Wu Z, Stoka V, et al. Increased expression and altered subcellular distribution of cathepsin B in microglia induce cognitive impairment through oxidative stress and inflammatory response in mice[J]. Aging Cell, 2019, 18(1): e12856. doi:10.1111/acel.12856 |
| [7] |
Mehra S, Kumar M, Manchanda M, et al. Clinical significance of cathepsin L and cathepsin B in dilated cardiomyopathy[J]. Mol Cell Biochem, 2017, 428(1-2): 139-47. doi:10.1007/s11010-016-2924-6 |
| [8] |
Wang Y, Jia L, Shen J, et al. Cathepsin B aggravates coxsackievirus B3-induced myocarditis through activating the inflammasome and promoting pyroptosis[J]. PLoS Pathog, 2018, 14(1): e1006872. doi:10.1371/journal.ppat.1006872 |
| [9] |
Wu Q Q, Xu M, Yuan Y, et al. Cathepsin B deficiency attenuates cardiac remodeling in response to pressure overload via TNF-alpha/ASK1/JNK pathway[J]. Am J Physiol Heart Circ Physiol, 2015, 308(9): H1143-54. doi:10.1152/ajpheart.00601.2014 |
| [10] |
Dalal P J, Muller W A, Sullivan D P. Endothelial cell calcium signaling during barrier function and inflammation[J]. Am J Pathol, 2020, 190(3): 535-42. doi:10.1016/j.ajpath.2019.11.004 |
| [11] |
Fang Y, Wu D, Birukov K G. Mechanosensing and mechanoregulation of endothelial cell functions[J]. Compr Physiol, 2019, 9(2): 873-904. |
| [12] |
Gogiraju R, Bochenek M L, Schafer K. Angiogenic endothelial cell signaling in cardiac hypertrophy and heart failure[J]. Front Cardiovasc Med, 2019, 6: 20. doi:10.3389/fcvm.2019.00020 |
| [13] |
马静, 吴娅妮, 黄德伦, 等. 杨桃根DMDD调控ROS介导的自噬通路减轻糖尿病大鼠心肌损伤[J]. 中国药理学通报, 2021, 37(6): 823-7. Ma J, Wu Y N, Huang D L, et al. Averrhoa Carambola L. Roots DMDD alleviates myocardial injury in diabetes mellitus mice by regulating ROS-mediated autophagy pathway[J]. Chin Pharmacol Bull, 2021, 37(6): 823-7. |
| [14] |
Dong Y, Chen H, Gao J, et al. Molecular machinery and interplay of apoptosis and autophagy in coronary heart disease[J]. J Mol Cell Cardiol, 2019, 136: 27-41. doi:10.1016/j.yjmcc.2019.09.001 |
| [15] |
Martello A, Lauriola A, Mellis D, et al. Trichoplein binds PCM1 and controls endothelial cell function by regulating autophagy[J]. EMBO Rep, 2020, 21(7): e48192. |
| [16] |
Tang Q, Cao Y, Xiong W, et al. Glycyrrhizic acid exerts protective effects against hypoxia/reoxygenation-induced human coronary artery endothelial cell damage by regulating mitochondria[J]. Exp Ther Med, 2020, 20(1): 335-42. |
| [17] |
Araujo T F, Cordeiro A V, Vasconcelos D A A, et al. The role of cathepsin B in autophagy during obesity: A systematic review[J]. Life Sci, 2018, 209: 274-81. doi:10.1016/j.lfs.2018.08.024 |
| [18] |
Xiao Y, Wu Q Q, Duan M X, et al. TAX1BP1 overexpression attenuates cardiac dysfunction and remodeling in STZ-induced diabetic cardiomyopathy in mice by regulating autophagy[J]. Biochim Biophys Acta Mol Basis Dis, 2018, 1864(5 Pt A): 1728-43. |

