


朱继孝(1981-),男,博士,教授,研究方向:中药与民族药有效成分与作用机制,通信作者,E-mail: zhujx81@sina.com
 ,
ZENG Qing-ya,
OU-YANG Xiang,
WANG Lu,
GUO Min-xia,
LI Na-zhi,
CHENG Hong-yu
,
ZENG Qing-ya,
OU-YANG Xiang,
WANG Lu,
GUO Min-xia,
LI Na-zhi,
CHENG Hong-yu
 ,
ZHU Ji-xiao
,
ZHU Ji-xiao

高尿酸血症(hyperuricemia, HUA)是尿酸生成增加或者排泄减少从而导致体内尿酸高于正常值的代谢性疾病[1],是导致痛风的主要原因。诱发HUA的因素主要有两个,(1)尿酸来源增加,这主要与黄嘌呤氧化酶、次黄嘌呤-鸟嘌呤磷酸核糖转移酶等物质有关;(2)尿酸排出减少,主要与肾脏组织的尿酸转运体有关[2]。氧嗪酸钾(postassium oxonate, OA)是一种典型的尿酸酶抑制剂,可通过抑制尿酸酶活性来阻断尿酸降解,从而导致血尿酸水平升高[3]。现阶段,治疗HUA的药物主要包括以下几类,分别为黄嘌呤氧化酶抑制剂(别嘌呤醇、非布索坦等)、尿酸氧化酶类似物(拉布立酶等)、URAT1抑制剂(丙磺舒、苯溴马隆等),其中别嘌呤醇和非布索坦被认为是治疗普通痛风患者的一线药物[4]。虽疗效较佳,但其易引起肝肾损害等毒副作用,不适合长期服用[5],因此,寻找更为安全有效的抗HUA药物已成为世界医药科技研究者关注的热点之一。
大量文献报道,大车前苷PMS(plantamajoside, PMS)具有很高的药用价值及广泛的药理作用,如可通过抑制食管鳞状细胞癌细胞中的NF-κB信号传导而抑制LPS的上皮-间质转化[6],还可通过抑制肝星状细胞的活化而在肝脏中发挥抗纤维化作用[7],近期研究表明PMS还可通过调节凋亡相关基因的表达水平及PI3K/AKT信号通路的激活来诱导细胞凋亡[8]。课题组前期研究[9]表明藏药短穗兔耳草提取物能降低高尿酸血症小鼠尿酸水平,并对藏药短穗兔耳草的化学成分进行了探索,短穗兔耳草经一系列萃取处理后,从中鉴定出PMS[10],且分别对17个批次短穗兔耳草进行了含量测定,PMS含量最高可达1.29%,平均含量为0.75%,PMS是藏药短穗兔耳草的主要有效成分之一,因此本实验在此基础上基于TLR/MyD88/NF-κB和NLRP3信号通路和肾脏尿酸转运体的变化,检测小鼠肾组织转运体GLUT9、OAT1、URAT1水平以及肝脏“TLR/MyD88/NF-κB”信号通路中蛋白TLR4、TLR2、MyD88、NF-κB和NOD样信号通路中受体蛋白NLRP3及炎症因子IL-1β的表达水平,以期获得短穗兔耳草降尿酸可能的活性成分与作用机制。
1 材料与方法 1.1 实验动物SPF级雄性昆明种小鼠60只,体质量(18-22)g,合格证号:SCXK(赣)2018-0003,购自江西中医药大学实验动物科技中心。自由进水进食,饲养室温度为25 ℃左右,适应性喂养7 d后进行实验,符合实验动物伦理委员会标准。
1.2 药物与试剂大车前苷(成都普瑞法科技开发有限公司,批号PRF20081722,98%);Allopurinol(Sigma公司,批号081M1112V);Allantoxanic Acid Potassium Salt(Sigma公司,批号ST-BD5759V);羧甲基纤维素钠(国药集团,批号F20101222);尿酸、尿素氮、腺苷脱氨酶、黄嘌呤氧化酶检测测试盒(南京建成生物工程研究所,批号分别为20200921、20200909、20200924、20201023);小鼠IL-1β、TNF-α ELISA测试盒(欣博盛生物有限公司,批号如下:M2010001-001a、M2010003-102a);MyD88、NF-κB、NLRP3、TLR2、IL-1β、TLR4、Anti-OAT1、Anti-GLUT9抗体(英国abcam公司,批号分别为ab2064、ab16502、ab214185、ab213676、ab9772、ab217274、ab135924、ab223470);Anti-URAT1一抗(武汉proteintech公司,批号为14937-1-AP);二抗(武汉proteintech公司,批号为SA00001-2);GAPDH(武汉proteintech公司,批号10494-1-AP)。
1.3 主要仪器PowerPac Basic型电泳仪、Chemic Dox XR+型凝胶成像仪(美国BIO-RAD公司)、WD-9405B型水平摇床(沃德生物医学仪器公司)、Centrifuge 5430R型低温冷冻离心机(美国eppendorf公司)、HI1210型捞片机、Nikon elipseci-s生物显微镜(日本尼康公司)、HistoCore Arcadia C型切片机、TP1020-1型包埋机(德国Leica公司)。
1.4 动物分组、造模及给药选取60只昆明种雄性小鼠,适应性饲养7 d后,随机均分为6组:空白组:0.5%羧甲基纤维素钠(CMC-Na),模型组:450 mg·kg-1OA(混悬于0.5% CMC-Na),阳性组:450 mg·kg-1OA+10 mg·kg-1别嘌呤醇(混悬于0.5% CMC-Na),PMS低剂量组:450 mg·kg-1OA+15 mg·kg-1 PMS,PMS中剂量组:450 mg·kg-1OA+30 mg·kg-1 PMS、PMS高剂量组:450 mg·kg-1OA+60 mg·kg-1PMS(PMS溶于水,使用超纯水配制),给予普通饲料、纯水,自由饮食。本实验采用预防性给药联合造模后给药方式,以上各组连续给药7 d,每天1次,最后一次给药之前0.5 h注射450 mg·kg-1 OA至小鼠腹腔造成HUA模型,并禁食。造模1 h后,小鼠眼眶采血,于5 000 r·min-1离心10 min,取其上清液置于4 ℃冰箱待用,立即于冰台上取出小鼠一侧肾脏和肝脏,-80 ℃冰箱贮存待测,摘取小鼠另一侧全肾组织,用4%多聚甲醛溶液固定。
1.5 指标检测 1.5.1 血清尿酸的测定参照小鼠尿酸试剂盒使用说明,检测各组小鼠血清中尿酸表达水平。
1.5.2 血清尿素氮的测定参照小鼠尿素氮试剂盒使用说明,检测各组小鼠血清中尿素氮表达。
1.5.3 血清腺苷脱氨酶活性的测定根据小鼠腺苷脱氨酶试剂盒使用说明,检测各组小鼠血清中腺苷脱氨酶活性。
1.5.4 肝组织黄嘌呤氧化酶活性的测定参照小鼠黄嘌呤氧化酶试剂盒操作说明,检测各组小鼠肝组织中黄嘌呤氧化酶活性。
1.5.5 ELISA法检测血清中IL-1β、TNF-α的表达水平参照小鼠IL-1β、TNF-α试剂盒使用说明,检测各组小鼠血清中IL- 1β和TNF- α水平。
1.5.6 Western blot法检测采用Western blot法检测小鼠肾组织GLUT9、URAT1、OAT1蛋白的表达与肝组织TLR4、TLR2、NLRP3、NF-κB、MyD88、IL-1β蛋白的表达。
1.5.6.1 肾脏组织蛋白提取提取小鼠肾脏皮质刷状缘膜(BBMV)蛋白及肾脏皮层蛋白,于1.5 mL EP管中,加入2% SDS裂解液1 mL,制成肾组织匀浆室温放置20 min待裂解充分,室温1 000×g离心15 min,得上清液,100 ℃变性15 min,测定所有样本的蛋白浓度(BCA试剂盒),计算浓度并稀释一致后,制备样品进行常规上样电泳(电泳条件80 V、30 min,120 V、1 h),电泳完后于有转膜液的转膜槽中转膜(250 mA,90 min),转膜后将PVDF膜浸泡于5%的脱脂牛奶中室温摇床封闭2 h,洗膜3次(使用1×TBST),共30 min,浸没于一抗中,于4 ℃冰箱摇床孵育过夜,一抗的稀释比例如下(TLR2,1∶1 000;TLR4,1∶1 000;NLRP3,1∶1 000;NF-κB,1∶2 000;MyD88,1∶1 000;IL-1β,1∶1 000;GAPDH,1∶5 000),所有抗体用3% BSA稀释,d 2取出洗膜后于水平摇床上二抗(稀释比1∶5 000)孵育1 h,洗膜,ECL显色。
1.5.6.2 肝脏组织蛋白提取剪60 mg小鼠肝脏放置1.5 mL的EP管内,加1 mL 2%SDS裂解液,组织匀浆仪磨碎后室温条件下静置20 min充分裂解,然后于1 000×g离心15 min后取其上清液,后续操作同“1.5.6.1”,一抗的稀释比例为(GLUT9,1∶1 000;URAT1,1∶1 000;OAT1,1∶500;GAPDH,1∶5 000),二抗(稀释比1∶5 000)。
1.5.7 小鼠肾脏HE染色病理组织学检测把肾脏从4%多聚甲醛溶液中转移出,切成小方块,置于包埋盒内,使用流水冲洗2 h,用梯度乙醇进行脱水处理、石蜡浸蜡、包埋、切片、HE染色等步骤,于显微镜下观察,采集图像分析肾脏损伤情况。
1.6 统计学处理采用SPSS 21.0统计软件处理实验数据,结果以x±s显示。使用Image Lab软件扫描蛋白条带灰度值,再用Graphpad Prism处理数据。组间比较采用单因素方差分析(One-Way ANOVA)。
2 结果 2.1 各组药物对高尿酸血症小鼠尿酸、尿素氮、腺苷脱氨酶水平的影响与正常组比较,模型组小鼠尿酸、尿素氮、腺苷脱氨酶水平明显升高(P<0.01);与模型组比较,阳性组小鼠尿酸水平明显降低(P<0.01),PMS中、高剂量组小鼠尿酸水平明显降低(P<0.05),PMS低、中剂量组小鼠尿素氮水平明显下调(P<0.01),PMS高剂量组小鼠尿素氮水平明显降低(P<0.05),阳性组与PMS低剂量组小鼠腺苷脱氨酶水平明显降低(P<0.01),PMS中、高剂量组小鼠腺苷脱氨酶水平明显降低(P<0.05);与阳性组比较,PMS低、中、高剂量组小鼠尿酸水平明显上升(P<0.01),正常组小鼠尿素氮水平明显降低(P<0.05),PMS低、中剂量组小鼠尿素氮水平明显降低(P<0.01),PMS低、中、高剂量组小鼠腺苷脱氨酶水平明显上升(P<0.01或P<0.05),见Tab 1。
| Group | Dosage/mg·kg-1 | UA/μmol·L-1 | BUN/mmol·L-1 | ADA/U·L-1 |
| Normal | - | 43.9±0.05 | 4.1±0.30Δ | 3.7±036 |
| Model | - | 128.9±0.04## | 5.1±0.80## | 5.2±0.58## |
| Allopurinol | 10 | 30.1±0.01** | 4.9±0.40 | 3.1±0.98** |
| PMS-L | 15 | 108.6±0.04ΔΔ | 3.9±0.77**ΔΔ | 4.0±0.90**Δ |
| PMS-M | 30 | 90.6±0.06*ΔΔ | 3.7±0.48**ΔΔ | 4.3±0.79*ΔΔ |
| PMS-H | 60 | 95.8±0.06*ΔΔ | 4.1±0.42* | 4.2±0.90*Δ |
| ##P<0.01 vs normal; *P<0.05, **P<0.01 vs model; ΔP<0.05, ΔΔP<0.01 vs Allopurinol. | ||||
与正常组比较,模型组小鼠肝脏黄嘌呤氧化酶水平明显升高(P<0.05);与模型组比较,PMS中剂量组小鼠肝脏黄嘌呤氧化酶水平明显降低(P<0.05),阳性组、PMS低剂量组、PMS高剂量组小鼠肝脏黄嘌呤氧化酶水平明显降低(P<0.01);与阳性组比较,除模型组外,其他各组黄嘌呤氧化酶水平差异均无显著性,见Tab 2。
| Group | Dosage/mg·kg-1 | XOD/U·g-1 prot |
| Normal | - | 52.5±2.70 |
| Model | - | 58.4±0.98# |
| Allopurinol | 10 | 51.3±3.96** |
| PMS-L | 15 | 52.6±4.80** |
| PMS-M | 30 | 52.9±6.02* |
| PMS-H | 60 | 51.1±4.10** |
| #P<0.05 vs normal; *P<0.05, **P<0.01 vs model. | ||
与正常组比较,模型组小鼠IL-1β、TNF-α水平明显升高(P<0.05);与模型组比较,阳性组、PMS低、中、高剂量组小鼠IL-1β明显降低(P<0.05或P<0.01),阳性组、PMS中剂量组小鼠TNF-α水平明显降低(P<0.05);与阳性组比较,除模型组外,各组IL-1β、TNF-α水平差异均无显著性,见Tab 3。
| Group | Dosage/mg·kg-1 | IL-1β/ng·L-1 | TNF-α/ng·L-1 |
| Normal | - | 50.3±5.91 | 112.4±11.25 |
| Model | - | 59.5±8.04# | 147.0±30.70# |
| Allopurinol | 10 | 48.2±8.46** | 105.7±33.00* |
| PMS-L | 15 | 51.8±8.12* | 135.4±28.74 |
| PMS-M | 30 | 48.7±4.52** | 109.4±9.83* |
| PMS-H | 60 | 47.7±5.79** | 137.8±27.01 |
| #P<0.05 vs normal; *P<0.05, **P<0.01 vs model. | |||
选取各组小鼠的肾组织进行病理切片检查,结果如Fig 1所示,正常组肾小球结构清晰,肾小管上皮细胞结构正常,无明显炎症反应;模型组肾小管周围间质有增生现象,有炎症细胞发生聚集,肾小管出现扩张现象;阳性组肾小管的上皮细胞结构正常,炎症细胞浸润明显减轻,肾小管扩张的情况有所改善;PMS低剂量组肾小管间质增生,有炎症细胞聚集、肾小管出现扩张;PMS中剂量组肾小管部分间质增生,部分炎症细胞聚集、部分肾小管扩张有所改善;PMS高剂量组炎症细胞浸润明显减轻,部分间质轻微增生,少量炎症细胞聚集、肾小管扩张有所改善,图中箭头指出主要炎症部位。
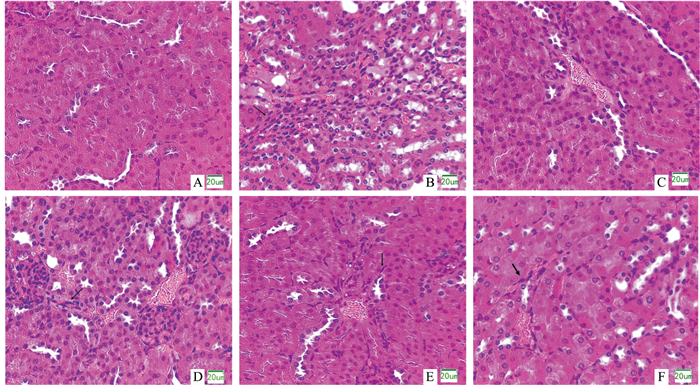
|
| Fig 1 Renal tissue pathological sections of each drug group (×400) A: Normal; B: Model; C: Allopurinol; D: PMS-L (15 mg·kg-1); E: PMS-M (30 mg·kg-1); F: PMS-H (60 mg·kg-1) |
如Fig 2所示,小鼠肝脏组织中,与正常组比较,模型组中的TLR4、TLR2、NLRP3、NF-κB、MyD88、IL-1β蛋白表达水平明显上调(P<0.05或P<0.01);与模型组比较,阳性组、PMS低、中、高剂量组中的TLR4、TLR2、NLRP3、NF-κB、MyD88、IL-1β蛋白表达水平明显下调(P<0.05或P<0.01)。小鼠肾脏组织中,与正常组比较,模型组中的GLUT9、URAT1蛋白表达水平明显上调,OAT1蛋白表达水平明显下调(P<0.01);与模型组比较,阳性组、PMS低、中、高剂量组中的GLUT9蛋白表达水平明显下调(P<0.05), OAT1蛋白表达水平明显上调(P<0.01),与阳性组比较,PMS低剂量组中的NF-κB、IL-1β、OAT1蛋白表达水平明显上调(P<0.05或P<0.01),PMS中剂量组中的OAT1蛋白表达水平明显上调(P<0.01),PMS高剂量组中的NLRP3、IL-1β蛋白表达水平明显下调(P<0.01)、OAT1蛋白表达水平明显上调(P<0.01)。
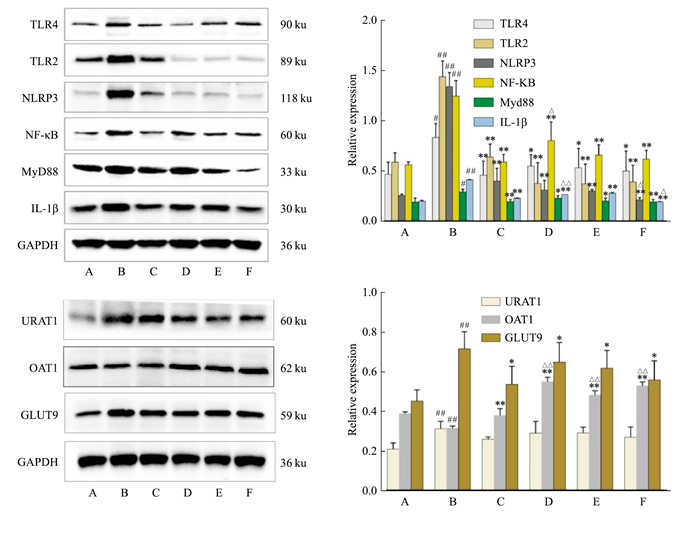
|
| Fig 2 Expression of TLR4, TLR2, NLRP3, NF-κB, MyD88, and IL-1β proteins in liver tissues and GLUT9, URAT1, and OAT1 proteins in kidney tissues of mice in each group A: Normal; B: Model; C: Allopurinol; D: PMS-L(15 mg·kg-1); E: PMS-M(30 mg·kg-1); F: PMS-H(60 mg·kg-1); #P<0.05, ##P<0.01 vs normal; *P<0.05, **P<0.01 vs model. ΔP<0.05, ΔΔP<0.01 vs Allopurinol. |
目前,国内外学者主要通过促进尿酸的排泄和抑制尿酸生成两个方面对治疗痛风做了大有裨益的研究。尿酸生成量异常增加会导致HUA,尿酸的排泄主要经过肾脏组织,当尿素氮水平升高时,通常反应肾脏功能出现损伤,尿酸的排泄也会受到一定的影响[11]。腺苷脱氨酶在腺苷平衡及嘌呤代谢过程中具有关键作用,可以间接调控尿酸的生成。当腺苷脱氨酶活性增强时会造成尿酸的合成速度加快;相反,腺苷脱氨酶活性降低时可减少尿酸的生成[12]。尿酸主要是由于黄嘌呤与次黄嘌呤被黄嘌呤氧化酶催化而产生,则黄嘌呤氧化酶直接影响尿酸的生成[13],此外,尿酸水平的升高会引起多种炎症因子的改变,经治疗后,尿酸水平降低,炎症因子也逐渐恢复正常[14]。
目前认为,TLR-NLRP3信号通路和尿酸转运蛋白在痛风方面发挥重要作用。研究发现调控肾脏尿酸转运体可增加尿酸的排泄[15],“TLR/MyD88/NF-κB”信号通路系统和NLRP3信号通路是机体防御疾病的重要通路之一,其可以识别病原体相关模式从而介导非特异性免疫和获得性免疫而参与炎症、免疫等多种疾病的发生。其中,TLRs和MyD88对急性痛风性炎症反应过程中是必需的[16],尿酸钠结晶可同时激活TLRs、IL-1R,然后与MyD88结合成复合物并活化相关激酶,使NF-κB等激活并转移至细胞核内后启动一系列炎性因子、趋化因子、粘附因子(如IL-1β、TNF-α等)的转录和表达[17];此外,NLRP3蛋白和caspase-1之间的连接体是凋亡相关斑点样蛋白(ASC),研究发现,NLRP3蛋白与ASC相互作用,可刺激caspase-1,形成炎性复合体,诱导其下游产物caspase-1、IL-1β、TNF-α的释放,TLRs/MyD88/NF-κB信号通路与NLRP3炎性体可协同促进IL-1β的表达,加速炎症反应[18]。
本研究在此基础上基于TLR/MyD88/NF-κB、NLRP3信号通路及肾脏尿酸转运体的变化,研究PMS抗HUA作用机制,结果显示:PMS中、高剂量组能使小鼠尿酸水平降低(P<0.05);PMS各剂量组均能明显下调小鼠血清中尿素氮、腺苷脱氨酶水平及小鼠肝组织中黄嘌呤氧化酶水平(P<0.05或P<0.01),表明PMS可通过下调尿酸、尿素氮、腺苷脱氨酶表达水平及小鼠肝组织中黄嘌呤氧化酶活性改善小鼠HUA;此外,PMS各剂量组小鼠血清中IL-1β明显降低(P<0.05或P<0.01),PMS中剂量组小鼠血清中TNF-α水平明显降低(P<0.05)。表明PMS可以通过抑制IL-1β、TNF-α水平改善小鼠HUA。本实验还釆用Western blot检测HUA小鼠肾脏组织GLUT9、URAT1、OAT1蛋白的表达与肝脏组织TLR4、TLR2、NLRP3、NF-κB、MyD88、IL-1β蛋白的表达,结果显示PMS各剂量组均能明显降低小鼠肝脏中TLR4、TLR2、NLRP3、NF-κB、MyD88、IL-1β水平(P<0.05或P<0.01);PMS各剂量组均能明显降低小鼠肾脏中GLUT9水平(P<0.05), 可明显升高OAT1水平(P<0.01),结果表明PMS可通过降低肾组织尿酸转运体GLUT9水平、升高OAT1水平、下调TLR/MyD88/NF-κB、NLRP3信号通路中TLR4、TLR2、NLRP3、NF-κB、MyD88、IL-1β蛋白表达水平而起到降尿酸作用。
综上所述,PMS对OA诱导的急性HUA小鼠会产生一定保护作用,其发挥作用的分子机制与调节肾脏尿酸转运体和TLR/MyD88/NF-κB、NLRP3炎症通路密切相关。
| [1] |
于舒雁. 金钱草总黄酮对高尿酸血症动物模型的影响[D]. 郑州: 河南中医学院, 2014. Yu S Y. Interventional study of total flavone extract of lysimachia on hyperuricemia animal model[D]. Zhengzhou: Henan College Tradit Chin Med, 2014. |
| [2] |
史亚夫, 姚雪莲, 黄小方, 等. 痛风的分子机制与中药治疗研究进展[J]. 中药新药与临床药理, 2018, 29(5): 673-8. Shi Y F, Yao X L, Huang X F, et al. Research progress on molecular mechanisms of gout and treatment of traditional chinese medicine[J]. Tradit Chin Drug Res Pharmacol, 2018, 29(5): 673-8. |
| [3] |
王陈芸, 李哲丽, 叶尤松, 等. 氧嗪酸钾致小鼠急性高尿酸血症动物模型的研究及评价[J]. 中药药理与临床, 2019, 35(1): 176-80. Wang C Y, Li Z L, Ye Y S, et al. Study and evaluation of potassium oxonate-induced acute hyperuricemia animal model[J]. Chin Med Pharmacol Clinic, 2019, 35(1): 176-80. |
| [4] |
Abeles A M, Pillinger M H. The CARES scare: Febuxo statand the risk of cardiovascular disease[J]. Arthritis Rheumatol, 2019, 71(6): 1023-4. doi:10.1002/art.40838 |
| [5] |
杨媛, 李静, 甄健存, 等. 抗痛风药别嘌呤醇、苯溴马隆及秋水仙碱不良反应报告分析[J]. 中国医院药学杂志, 2013, 33(15): 1296-7. Yang Y, Li J, Zhen J C, et al. Analysis of adverse reaction reports of allopurinol, benzbromarone and colchicine[J]. Chin J Hosp Pharm, 2013, 33(15): 1296-7. |
| [6] |
Li X, Chen D, Li M, et al. Plantamajoside inhibits lipopolysaccharide-induced epithelial-mesenchymal transition through suppressing the NF-κB/IL-6 signaling in esophageal squamous cell carcinoma cells[J]. Biomed Pharmacother, 2018, 102(2018): 1045-51. |
| [7] |
Yun W, Dong L Y. Plantamajoside exert santifibrosis effect sinthe liver by inhibiting hepatic stellatecell activation[J]. Exp Ther Med, 2019, 18(4): 2421-8. |
| [8] |
Yan W, Ming Z L, Shenglan C, et al. Plantamajoside represses the growth and metastasis of malignant melanoma[J]. Exp Ther Med, 2020, 19(3): 2296-302. |
| [9] |
熊雯雯, 张红阳, 文乐, 等. 短穗兔耳草提取物对高尿酸血症小鼠黄嘌呤氧化酶和肾脏尿酸转运体的影响研究[J]. 中国新药杂志, 2018, 27(13): 1538-43. Xiong W W, Zhang H Y, Wen L, et al. Effect of Lagotis brachystachys Maxim extract on xanthine oxidase and renal urate transporters in hyperuricemia mice[J]. Chin New Drugs J, 2018, 27(13): 1538-43. |
| [10] |
史亚夫. 藏药短穗兔耳草化学成分与活性研究[D]. 南昌: 江西中医药大学, 2019. Shi Y F. Study on chemical constituents and activity of Lagotis brachystachya Maxim[D]. Nanchang: Jiangxi Univ Chin Med, 2019. |
| [11] |
王军亮, 尤延飞, 赵宝玉, 等. 碎米蕨叶马先蒿对小鼠肝肾和血液指标的影响[J]. 中国兽医科学, 2020, 50(3): 389-95. Wang J L, You Y F, Zhao B Y, et al. Effects of Pedicularis cheilanthifolia on indicators of liver, kidney and hematology in mice[J]. Chin Vet Sci, 2020, 50(3): 389-95. |
| [12] |
裴忆雪. 香叶木素抗高尿酸血症肾损害作用及机制研究[D]. 武汉: 武汉轻工大学, 2019. Pei Y X. Study on the effect and mechanism of diosmetin against renal damage in hyperuricemia[D]. Wuhan: Wuhan Polytechnic Univ, 2019. |
| [13] |
闫祯昕, 尹非, 李雪晨, 等. 黄嘌呤氧化酶抑制剂筛选体系的建立[J]. 中国药理学通报, 2019, 35(10): 1471-7. Yan Z X, Yin F, Li X C, et al. Establishment of a screening system for xanthine oxidase (XOD) inhibitors[J]. Chin Pharmacol Bull, 2019, 35(10): 1471-7. doi:10.3969/j.issn.1001-1978.2019.10.025 |
| [14] |
Cavalcanti N G, Marques C D L, Lins T U L E, et al. AB0068 cytokine profile in gout: IL-18 and IL-6 are associated with inflammatory activity[J]. Ann Rheum Dis, 2015, 74(Suppl 2): 912-3. |
| [15] |
Su J, Wei Y, Liu M, et al. Anti-hyperuricemic and nephroprotective effects of Rhizoma dioscoreae septemlobae extracts and its main component dioscin via regulation of mOAT1, mURAT1 and mOCT2 in hypertensive mice[J]. Arch Pharm Res, 2014, 37(10): 1336-44. doi:10.1007/s12272-014-0413-6 |
| [16] |
Chen C, Shi Y, Hearn A, et al. MyD88-dependent IL-1 receptor signaling is essential for gouty inflammation stimulated by monosodium urate crystals[J]. J Clin Invest, 2006, 116(8): 2262-71. doi:10.1172/JCI28075 |
| [17] |
Qiao H, Wang B, Yin D, et al. Kinsenoside screening with a microfluidic chip attenuates gouty arthritis through inactivating NF-κB signaling in macrophages and protecting endothelial cells[J]. Cell Death Dis, 2016, 7(9): 1-12. |
| [18] |
Wang X, Ding D, Xue Y, et al. Role of TLR4/NF-κB pathway for early change of synovial membrane in knee osteoarthritis rats[J]. China J Orthop Trauma, 2019, 32(1): 68-71. |