

2. 汕头大学医学院神经科学中心,广东 汕头 515041
2. Center for Neuroscience, Shantou University Medical College, Shantou Guangdong 515041, China
胶质瘤是中枢神经系统发病率最高的神经系统原发恶性肿瘤[1]。虽然目前已有手术切除、放化疗及神经导航等治疗手段,但因胶质瘤细胞增殖迅速、多呈浸润性生长、肿瘤组织有较高的侵袭能力,且与正常组织界限不清,胶质瘤的治疗效果仍不理想[2]。阐明神经胶质瘤发病和调控机制,寻找潜在的可延缓胶质瘤浸润、转移的药物已刻不容缓。
细胞因子在肿瘤转移浸润中的调节作用研究比较广泛。神经调节蛋白(neuregulin,NRG)是一类调节细胞生长和分化的多肽类神经生长因子,属于类表皮生长因子(epidermal growth factor-like,EGF-like)超家族。神经调节蛋白主要有1-4四种亚型,即NRG1、NRG2、NRG3和NRG4,因通过不同实验分离、纯化和克隆,故有不同命名。NRG受体为ErbB酪氨酸激酶型受体,主要包括ErbB4 / ErbB4同二聚体、ErbB3 / ErbB2和ErbB4 / ErbB2异二聚体。NRG可直接与ErbB3或ErbB4结合,诱导ErbB3或ErbB4与ErbB2形成异二聚体,活化受体酪氨酸激酶,进而激活多种下游信号转导途径,调控组织细胞的增殖和分化[3]。NRG1表达与神经系统功能密切相关,且在神经系统肿瘤如胶质瘤细胞存活、迁移中发挥作用[4],故我们推测NRG其他亚型NRG3、NRG4也可能在胶质瘤细胞迁移中发挥作用,但迄今为止有关NRG3和NRG4的在胶质瘤病理生理中的作用研究较少。本研究比较分析NRG1、NRG3和NRG4对胶质瘤细胞迁移的影响,并通过GEPIA数据库分析来明确可能的机制。
1 材料和方法 1.1 材料 1.1.1 细胞和试剂U251和U-87MG细胞购自武汉普诺赛生命科技有限公司;SHG44细胞购自广州吉妮欧生物科技有限公司;DMEM培养基购自美国Gibco公司;胎牛血清购自杭州四季青公司;RPMI 1640细胞基础培养基购自美国Gibco公司;0.25% 胰蛋白酶-EDTA购自北京索莱宝公司;青霉素-链霉素混合液购自北京索莱宝公司;人源重组神经调节蛋白1β(recombinant human neuregulin 1β,rNRG1β)购自美国Thermo Scientific公司;人源重组神经调节蛋白3β(recombinant human neuregulin 3β,rNRG3β)和人源重组神经调节蛋白4β(recombinant human neuregulin 4β,rNRG4β)均购自北京义翘神州公司;磷酸盐缓冲液(PBS)购自北京中杉金桥公司;乙醇购自汕头西陇化工股份有限公司。
1.1.2 仪器高压灭菌锅(SX-500,日本Tomy公司);细胞培养箱(HERA cell 240,德国Thermo-Scientific公司);超净工作台(KSP Class II,德国Thermo-Scientific公司);台式高速离心机(Allergra X-22R,美国Beckman Coulter公司);电子天平(BSA223S-CW,北京赛多利斯公司);PH仪雷磁(PHS-3E,上海精科公司);倒置相差显微镜(BX51,日本奥林巴斯公司);台式冷冻离心机(5415R,德国Eppendorf公司);电子恒温水浴锅(HH-11-12,汕头市医用设备有限公司)。
1.2 方法 1.2.1 细胞培养SHG44和U251细胞培养于胎牛血清∶培养基=10 ∶ 100 DMEM培养基中;U-87MG细胞培养于胎牛血清∶培养基=10 ∶ 100 RPMI 1640培养基中培养,培养温度37 ℃。
1.2.2 细胞划痕实验培养人U-87MG、U251和SHG44细胞至其密度接近90%后,用0.25% 胰蛋白酶-EDTA消化液消化处理,待显微镜下细胞明显皱缩时加入含血清培养液终止消化并吹打细胞使之形成均匀悬液,以900 r·min-1离心3 min。弃去上层液体后加新鲜无血清培养基重悬制备成细胞悬浮液,并用血球计数板计数。细胞悬浮液以无血清培养基稀释。于96孔板中每孔加液100 μL,过夜培养。用无RNA酶枪头尖沿直尺在培养板细胞中央进行细胞划痕。使用无血清培养基清洗后,分别加入含有0、2、5和10 nmol·L-1重组NRG蛋白(rNRG1β、-3β和-4β)的无血清培养基100 μL,每个处理组设置3次重复孔。处理完成后在倒置显微镜下进行拍照观察保存,此时记为0 h。根据不同细胞系的生长速度不同,在0-48 h选择相应时间点进行观察。U-87MG细胞的观察时间点为0、6、12和24 h;U251细胞的观察时间点为0、12、24和48 h;SHG44细胞的观察时间点为0、24和48 h。
1.2.3 愈合率计算愈合率/%=(初始划痕面积-最终划痕面积)/初始划痕面积× 100%。
1.2.4 GEPIA数据库分析使用GEPIA数据库分析低级别胶质瘤(low-grade glioma,LGG)和胶质母细胞瘤(glioblastoma multiforme,GBM)样本中NRG1、NRG3和NRG4及其受体ErbB2、ErbB3、ErbB4表达水平,结果绘制箱型图。
1.2.5 统计学分析使用ImageJ软件分析划痕愈合率,使用GraphPad prism 9.0软件处理与统计实验数据,并进行绘图。多组数据间的比较采用单因素方差分析(One-way ANOVA),两组比较用Tukey检验。
2 结果 2.1 rNRG1β对不同胶质瘤细胞迁移的影响rNRG1β对U-87MG、U251细胞和SHG44细胞的迁移率的影响在各时间点均呈现剂量依赖性(Fig 1)。
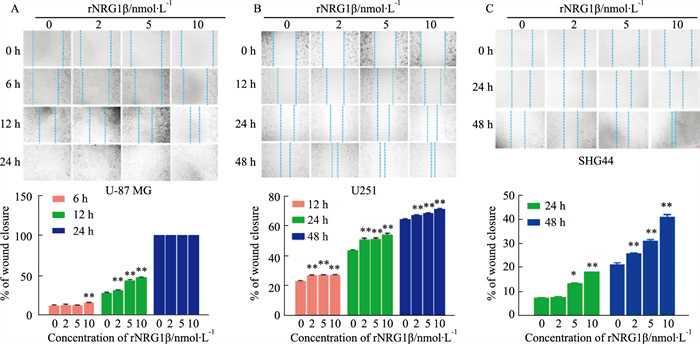
|
| Fig 1 Effect of rNRG1β on migration of different glioma cells (x±s, n=3) Optical microscope image of wound closure after cell scratch in response to rNRG1β treatment in U-87 MG (A), U251 (B), and SHG44 (C) cells (magnification ×100). *P<0.05, **P<0.01 vs control group |
U-87MG划伤后给予rNRG1β处理6 h,与溶剂对照组相比,仅有10 nmol·L-1组的划痕间距明显减小(P< 0.01),划痕愈合速度约为20%;处理12 h时间点,与溶剂对照组相比,各组迁移率均明显增加,呈剂量依赖性,以10 nmol·L-1组迁移率增加最为显著(P<0.01)。24 h时间点,各组均可见细胞划痕消失,愈合完成,表明胶质母细胞瘤来源的U-87MG细胞有较强迁移能力。
U251划伤后给予rNRG1β处理12 h,与溶剂对照组相比,实验组的划痕间距均显著性减小(各剂量组P<0.01),迁移速度呈剂量依赖性;处理24 h时间点,与溶剂对照组相比,各组迁移率均显著增加,呈剂量依赖性,以10 nmol·L-1组迁移率增加最为显著,且2 nmol·L-1组和5 nmol·L-1组的迁移率相近(各剂量组P<0.01)。处理48 h时间点,趋势与处理24 h的趋势相似,10 nmol·L-1组迁移率增加最为显著(各剂量组P<0.01)。
SHG44划伤后给予rNRG1β处理24 h,与溶剂对照组相比,5 nmol·L-1和10 nmol·L-1组的划痕间距均显著性减小(P<0.05),可见迁移速度呈剂量依赖性;处理48 h时间点,与溶剂对照组相比,各组迁移率呈剂量依赖性,以10 nmol·L-1组迁移率最高(各剂量组P<0.01)。
2.2 rNRG3β对不同胶质瘤细胞迁移的影响rNRG3β对U-87MG细胞迁移率未见影响(Fig 2A),对SHG44细胞、U251细胞迁移率的影响在各时间点均呈现剂量依赖性(Fig 2B,C)。
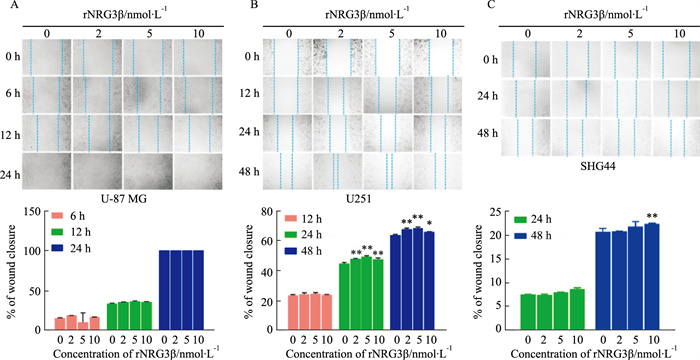
|
| Fig 2 Effect of rNRG3β on migration of different glioma cells Optical microscope image of wound closure after cell scratch in response to rNRG3β treatment in U-87 MG (A), U251 (B), and SHG44 (C) cells (magnification ×100). *P<0.05, **P<0.01 vs control group |
U-87MG划伤后给予rNRG3β处理6 h和12 h,未见实验组与对照组间呈显著性差异;处理24 h时间点,各组均可见细胞划痕消失,愈合完成,表明胶质母细胞瘤来源的U-87MG细胞迁移能力较强。
U-251划伤后给予rNRG3β处理12 h,未见实验组与对照组间呈显著性差异。处理24 h和48时间点,与溶剂对照组相比,各组迁移率均显著增加(各剂量组P<0.01),呈剂量依赖性,以5 nmol·L-1组迁移率增加最为显著,10 nmol·L-1组迁移率较5 nmol·L-1组减小(各时间点P<0.01)。
SHG44划伤后给予rNRG3β处理24 h,未见实验组与对照组间呈显著性差异;处理48 h时间点,与溶剂对照组相比,各组迁移率呈剂量依赖性,以10 nmol·L-1组迁移率增加最为显著(P<0.01)。
2.3 rNRG4β对不同胶质瘤细胞迁移的影响rNRG4β对U-87MG、U251细胞和SHG44细胞的迁移率的影响在各时间点均呈现剂量依赖性(Fig 3)。
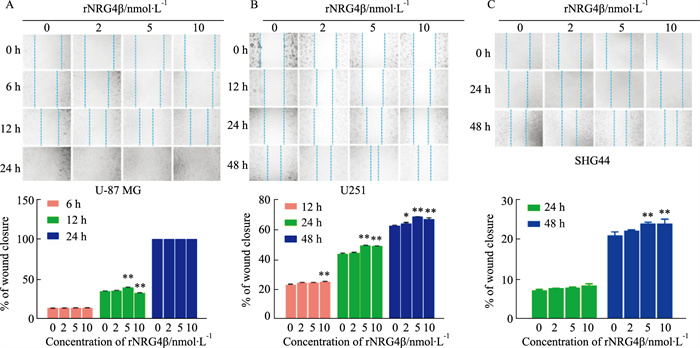
|
| Fig 3 Effect of rNRG4β on migration of different glioma cells (x±s, n=3) Optical microscope image of wound closure after cell scratch in response to rNRG4β treatment in U-87 MG (A), U251 (B), and SHG44 (C) cells (magnification × 100). *P<0.05, **P<0.01 vs control group |
U-87MG划伤后给予rNRG4β处理6 h,未见实验组与对照组间呈显著性差异;处理12 h时间点,5 nmol·L-1组具有显著的促进迁移率增加作用,而10 nmol·L-1则起抑制作用(与对照组相比,两组均为P<0.01)。处理24 h时间点,各组均可见细胞划痕消失,愈合完成,表明胶质母细胞瘤来源的U-87MG细胞迁移能力较强。
U-251划伤后给予rNRG4β处理12 h,仅见10 nmol·L-1组与对照组间呈显著性差异(P<0.01)。处理24 h时间点,仅见5 nmol·L-1组和10 nmol·L-1组与对照组间呈差异显著性(两组P<0.01),处理48 h时间点,与溶剂对照组相比,各组迁移率均明显增加,呈剂量依赖性,以5 nmol·L-1组迁移率增加最为显著(P<0.01),10 nmol·L-1组迁移率较5 nmol·L-1组减小。
SHG44划伤后给予rNRG4β处理24 h,未见实验组与对照组间呈差异显著性;处理48 h时间点与溶剂对照组相比,各组迁移率呈剂量依赖性,5 nmol·L-1组和10 nmol·L-1组迁移率增加明显(两组P<0.01)。
2.4 低级别胶质瘤(low-grade glioma,LGG)和胶质母细胞瘤(glioblastoma multiforme,GBM)样本的NRG1、NRG3和NRG4及其受体ErbB2、ErbB3、ErbB4表达情况GEPIA数据库分析表明,在LGG样本中,NRG1、NRG3和NRG4表达水平均低于正常对照组,仅NRG1和NRG4表达差异较为明显(P<0.05);ErbB2、ErbB3、ErbB4表达水平均高于正常对照组。在GBM样本中,NRG1、NRG4以及受体ErbB3、ErbB4表达水平均低于正常对照组,NRG1、NRG3和NRG4表达差异较为明显(P<0.05),但ErbB2表达水平高于正常对照组, 差异有明显性(P<0.05)(Fig 4)。
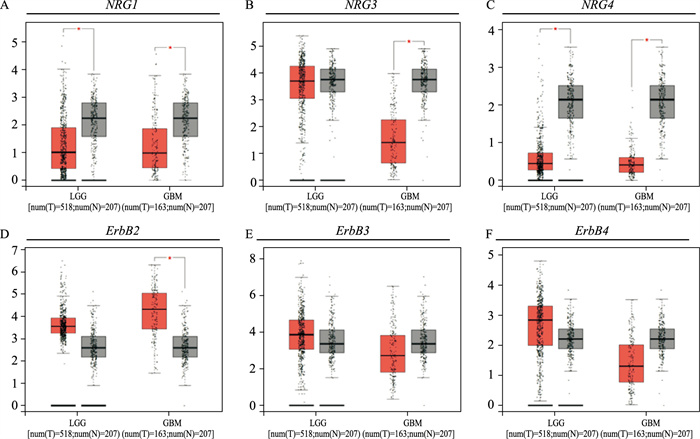
|
| Fig 4 GEPIA-based analysis of gene expression level of NRG1, NRG3, and NRG4, and ErbB2, ErbB3 and ErbB4 in low-grade glioma (LGG) and glioblastoma multiforme (GBM) tissue samples in comparison to those in normal control *P<0.05 vs control group |
胶质瘤,尤其是胶质母细胞瘤细胞多具有较强侵袭性和迁移性,是手术难以彻底根除的主要原因[5]。以往研究表明,NRG1可增强胶质瘤细胞的运动性和迁移性[6]。本实验进一步证实rNRG1β可增强不同恶性程度胶质瘤细胞的迁移率,且其促进作用在浓度0至10 nmol·L-1之间呈剂量依赖性。我们在此基础上进一步检测了NRG家族其他两个重要亚型NRG3和NRG4对胶质瘤细胞迁移的影响。结果表明rNRG3β和rNRG4β对U-87MG细胞迁移无明显影响,仅在高剂量时对U251细胞和SHG44细胞的迁移有一定促进作用。以上结果结合GEPIA数据分析结果,提示不同恶性程度的胶质瘤细胞在NRG亚型及其受体的表达水平和分布上存在一定程度差异。
NRG1所结合的受体类型具有多样性,已有文献报道U-87MG可表达少量的ErbB2受体,U251细胞可表达ErbB2和ErbB3受体[7]。游离型NRG1首先与ErbB3和ErbB4受体结合,从而进一步激活其与ErbB2受体形成的异二聚体ErbB3/ErbB2、ErbB4/ErbB2,或同二聚体ErbB4/ErbB4[8]。与NRG1相比,NRG3仅结合并激活ErbB4受体[9],NRG4仅对ErbB4受体有低亲和力,不与ErbB2和ErbB3受体结合[10]。由GEPIA结果可知,LGG和GBM中ErbB2表达均高于正常对照组,故rNRG1β的促迁移效果相对明显。ErbB2水平增高可增加胶质瘤细胞对NRG1敏感性,尤其是癌旁神经组织表达有更高水平NRG1,可进一步促进胶质瘤细胞向正常组织迁移[11]。LGG中ErbB4表达水平有升高趋势,GBM中表达则呈下降趋势,可部分解释rNRG3β和rNRG4β对U251细胞和SHG44细胞迁移有促进作用,而对U-87 MG细胞迁移影响不明显。因此,可进一步探究三种不同恶性程度的胶质瘤细胞NRG各亚型和受体以及NRG/ErbB信号通路下游信号分子的表达差异,从而进一步明确其对不同恶性程度胶质瘤细胞迁移的差异化影响。
GEPIA数据库分析表明,正常脑组织中NRG1, NRG3和NRG4表达水平均高于胶质瘤组织,提示癌旁脑组织神经元可释放多种NRG亚型,以弥散或血流运输方式进入肿瘤实质,促进胶质瘤细胞存活和迁移,进而侵袭周围健康脑组织[12]。已报道NRG可与ErbB4 / ErbB4、ErbB2/ErbB3和ErbB2/ErbB4受体结合,激活MAPK以及PI3K/Akt途径,参与细胞增殖和迁移调控[13]。ErbB受体抑制剂可以拮抗该作用,抑制肿瘤细胞迁移。已有临床研究证实,ErbB3单克隆抗体GSK2849330可通过抑制ErbB3/ErbB2信号通路治疗肺部浸润性黏液腺癌,具有一定的实用价值[14]。新近研究发现,ErbB2受体拮抗剂阿法替尼可通过抑制NRG3/ErbB4信号通路,抑制犬胶质瘤细胞增殖[15]。因此,NRG作为细胞外基质的成分影响肿瘤细胞的迁移[16],其受体ErbB2、ErbB3和ErbB4有望成为胶质瘤治疗靶点(Fig 5)。
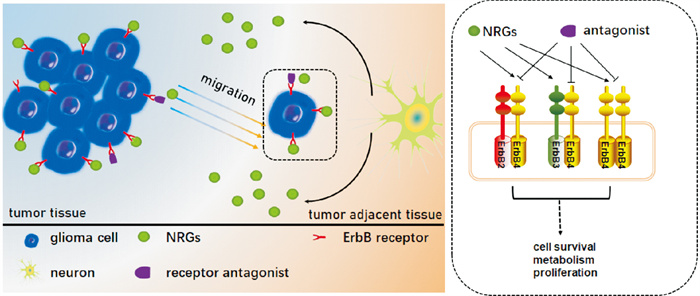
|
| Fig 5 Neuron-derived NRGs on glioma cell migration and mechanisms underlying therapeutic effects of ErbB receptor antagonists |
此外,我们以往研究表明NRG1可诱导多种胶质瘤细胞中细胞黏附分子CHL1蛋白表达水平增加[17],而CHL1在体外和体内均能促进人类神经胶质瘤细胞的增殖、转移和迁移[18],而NRG3、4是否具有相似作用尚需进一步探究。
| [1] |
刁婷婷, 张雨晨, 吕伟, 等. 山楂叶总黄酮对胶质瘤U87细胞的抑制作用[J]. 中国药理学通报, 2019, 35(10): 1448-52. Diao T T, Zhang Y C, Lyu W, et al. Experimental study on inhibitory effect of hawthorn leaves flavonoids on human glioblastoma U87 cells[J]. Chin Pharmacol Bull, 2019, 35(10): 1448-52. doi:10.3969/j.issn.1001-1978.2019.10.021 |
| [2] |
Nilsson P, Gedda L, Sjöström A, et al. Effects of dextranation on the uptake of peptides in micrometastases: Studies on binding of EGF in tumor spheroids[J]. Tumour Biol, 2001, 22(4): 229-38. doi:10.1159/000050621 |
| [3] |
Amin D N, Tuck D, Stern D F. Neuregulin-regulated gene expression in mammary carcinoma cells[J]. Exp Cell Res, 2005, 309(1): 12-23. doi:10.1016/j.yexcr.2005.04.034 |
| [4] |
Van Der Horst E H, Weber I, Ullrich A. Tyrosine phosphorylation of PYK2 mediates heregulin-induced glioma invasion: Novel heregulin/HER3-stimulated signaling pathway in glioma[J]. Int J Cancer, 2005, 113(5): 689-98. doi:10.1002/ijc.20643 |
| [5] |
Qi X T, Zhan J S, Xiao L M, et al. The unwanted cell migration in the brain: Glioma metastasis[J]. Neurochem Res, 2017, 42(6): 1847-63. doi:10.1007/s11064-017-2272-2 |
| [6] |
Ritch P S, Carroll S L, Sontheimer H. Neuregulin-1 enhances survival of human astrocytic glioma cells[J]. Glia, 2005, 51(3): 217-28. doi:10.1002/glia.20197 |
| [7] |
Lammering G, Hewit T H, Valerie K, et al. Anti-erbB receptor strategy as a gene therapeutic intervention to improve radiotherapy in malignant human tumours[J]. Int J Radiat Biol, 2003, 79(7): 561-8. doi:10.1080/0955300031000102632 |
| [8] |
Britsch S. The neuregulin-I/ErbB signaling system in development and disease[J]. Adv Anat Embryol Cell Biol, 2007, 190: 1-65. |
| [9] |
Zhang D, Sliwkowski M X, Mark M, et al. Neuregulin-3 (NRG3): A novel neural tissue-enriched protein that binds and activates ErbB4[J]. Proc Natl Acad Sci USA, 1997, 94(18): 9562-7. doi:10.1073/pnas.94.18.9562 |
| [10] |
Harari D, Tzahar E, Romano J, et al. Neuregulin-4: A novel growth factor that acts through the ErbB-4 receptor tyrosine kinase[J]. Oncogene, 1999, 18(17): 2681-9. doi:10.1038/sj.onc.1202631 |
| [11] |
Bonavia R, Inda M-D-M, Cavenee W K, et al. Heterogeneity maintenance in glioblastoma: A social network[J]. Cancer Res, 2011, 71(12): 4055-60. doi:10.1158/0008-5472.CAN-11-0153 |
| [12] |
Vollmann-Zwerenz A, Leidgens V, Feliciello G, et al. Tumor cell invasion in glioblastoma[J]. Int J Mol Sci, 2020, 21(6): 1932. doi:10.3390/ijms21061932 |
| [13] |
Liu M, Solomon W, Cespedes J C, et al. Neuregulin-1 attenuates experimental cerebral malaria (ECM) pathogenesis by regulating ErbB4/AKT/STAT3 signaling[J]. J Neuroinflammation, 2018, 15(1): 104. doi:10.1186/s12974-018-1147-2 |
| [14] |
Drilon A, Somwar R, Mangatt B P, et al. Response to ErbB3-Directed targeted therapy in-rearranged cancers[J]. Cancer Discov, 2018, 8(6): 686-95. doi:10.1158/2159-8290.CD-17-1004 |
| [15] |
Noguchi S, Inoue M, Ichikawa T, et al. The NRG3/ErbB4 signaling cascade as a novel therapeutic target for canine glioma[J]. Exp Cell Res, 2021, 400(2): 112504. doi:10.1016/j.yexcr.2021.112504 |
| [16] |
Vitorino P, Meyer T. Modular control of endothelial sheet migration[J]. Genes Dev, 2008, 22(23): 3268-81. doi:10.1101/gad.1725808 |
| [17] |
Lin W W, Ou G Y, Lin J Z, et al. Neuregulin 1 enhances cell adhesion molecule L1 like expression levels and promotes malignancy in human glioma[J]. Oncol Lett, 2020, 20(1): 326-36. |
| [18] |
Yang Z, Xie Q, Hu C L, et al. CHL1 is expressed and functions as a malignancy promoter in glioma cells[J]. Front Mol Neurosci, 2017, 10: 324. doi:10.3389/fnmol.2017.00324 |

