

2. 贵州医科大学附属医院肝胆外科,贵州 贵阳 550004
2. Dept of Hepatobiliary Surgery, the Affiliated Hospital of Guizhou Medical University, Guiyang 550004, China
在中国,乳腺癌为女性发病率最高的癌症(19.2%),致死率为9.1%[1]。他莫昔芬是一种人工合成的化合物,其可与雌激素竞争性结合雌激素受体而发挥抗雌激素的作用,常用于雌激素受体阳性的乳腺癌的治疗,可降低乳腺癌的复发率和死亡率,但他莫昔芬的长期使用产生的获得性耐药会导致疗效降低[2]。地高辛(digoxin)是一种源自洋地黄的强心苷,主要用于治疗充血性心力衰竭,其作用机制是抑制Na+/K+-ATP酶[3]。近年来,有文献报道地高辛具有抗癌作用[4]。有研究发现地高辛可以逆转MCF-7细胞对阿霉素的耐药性[5],表明地高辛具有提高其他抗癌药疗效的潜能,然而,地高辛联合他莫昔芬对乳腺癌的增殖和凋亡的影响及其机制尚未见文献报道。此外,乳腺癌造成的死亡大多与癌细胞的迁移相关,而癌细胞的迁移与上皮-间质转化(epithelial-mesencymal transition,EMT) 密切相关[6]。目前地高辛对乳腺癌细胞迁移、侵袭和EMT的影响以及地高辛和他莫昔芬联合用药是否能协同抑制乳腺癌细胞的迁移、侵袭和EMT尚未见文献报道。
本研究测试了地高辛、紫杉醇、吉西他滨和阿霉素与他莫昔芬联合用药对乳腺癌MCF-7细胞增殖的抑制作用,检测地高辛与他莫昔芬联合用药对MCF-7细胞迁移、侵袭和EMT的影响,并探索其对PI3K-AKT信号通路的影响,以期为临床增强他莫昔芬的疗效提供参考。
1 材料与方法 1.1 材料 1.1.1 细胞人乳腺癌细胞MCF-7购自中国科学院昆明细胞库。
1.1.2 主要试剂DMEM(dulbecco’s modified eagle medium)培养基(C11995500BT,Gibco)、青霉素-链霉素双抗(J180027)购自Hyclone公司;胎牛血清(FBS)(1913444)购自Biological Industries公司;地高辛(HY-B1049)、他莫昔芬(HY-13757A)购自MedChemExpress公司,紫杉醇(MB1178)、阿霉素(MB1087)购自大连美仑公司,吉西他滨(G8970)、MTT噻唑蓝(M8180)购自北京索莱宝公司;细胞凋亡试剂盒(KGA106)购自凯基生物公司;多克隆抗体PI3K(AP0230)、α-tubulin(BS1699)、二抗山羊抗兔(BS13278)、二抗山羊抗鼠(BS12478)购自Bioworld公司;多克隆抗体E-cadherin(20874-I-AP)、N-cadherin(22018-I-AP)、Vimentin(10366-I-AP)、caspase-3(66470-2-Ig)、caspase-9(10380-1-AP)、Bcl-2(12789-1-AP)、p-AKT(66444-I-Ig)购自Proteintech公司;多克隆抗体AKT(Gb111114)购自Servicebio公司,单克隆抗体p-PI3K(17366S)购自Cell Signaling公司;Immobilon Western HRP底物(WBKLS0500)购自EMD Millipore公司。
1.1.3 仪器恒温CO2细胞培养箱(2001HY-6003,美国Thermo Fisher Scientific公司);超净工作台(SW-CJ-2D,苏州净化设备有限公司);Epoch型全波长酶标仪(美国Bio-Tek公司);Novoexpress流式细胞仪(美国艾森生物公司);多功能成像系统(ChemiDoc MP, 美国Bio-Rad公司);倒置显微镜(Olympus公司)。
1.2 方法 1.2.1 细胞培养与药液配置乳腺癌MCF-7细胞培养在DMEM培养基(高糖,含4.5 g·L-1葡萄糖、10% FBS和1%青霉素-链霉素)中,置于37 ℃、5%CO2的培养箱中培养。他莫昔芬、地高辛、紫杉醇、吉西他滨、阿霉素分别用DMSO配置为10 mmol·L-1的母液。
1.2.2 MTT法检测细胞活力取对数生长期的MCF-7细胞(4×103个/孔) 接种于96孔板,每孔100 μL;培养于37 ℃、5% CO2培养箱中。待细胞贴壁后,分别加入他莫昔芬(0、1、2.5、5、10 μmol·L-1)、地高辛(0、10、15、20、25 nmol·L-1)、紫杉醇(0、100、200、300、400 nmol·L-1)、吉西他滨(0、1、5、10、25 μmol·L-1)、阿霉素(0、1、5、10、25 μmol·L-1)以及上述浓度的他莫昔芬与地高辛、紫杉醇、吉西他滨、阿霉素联合用药,每组设置6个复孔。各组培养48 h后,每孔加入20 μL MTT试剂,继续在培养箱中避光孵育4 h后用酶标仪在490 nm处检测OD值。细胞增殖率/% = (试验组OD值-空白组OD值) /(对照组OD值-空白组OD值) × 100%。用金氏公式[7]计算协同作用,q=E(A + B) /(EA +(1-EA) ·EB),其中E(A + B)为药物联合作用的抑制率,EA、EB分别为单独药物作用组的抑制率,q>1.15为协同作用,q=0.85-1.15为相加作用,q<0.85为拮抗作用; 实验独立重复3次。
1.2.3 平板克隆实验检测细胞增殖能力取对数生长期的MCF-7细胞(1×103个/孔) 接种于6孔板中,培养于37 ℃、5% CO2培养箱。分为等体积DMSO(对照组)、他莫昔芬10 μmol·L-1单药处理组、地高辛10 nmol·L-1单药处理组和联合用药组,每组3个复孔,每组独立重复实验3次。待14 d后吸去6孔板中的培养基,用4%的多聚甲醛溶液固定细胞30 min,再用结晶紫常温下染色30 min,烘箱烤干,拍照,计数各组的克隆形成数。
1.2.4 划痕愈合实验检测细胞迁移能力取对数生长期的MCF-7细胞接种于6孔板中,每孔接种1×106个细胞,培养至90%-100%融合度,用200 μL枪头在6孔板底做轻柔划痕,划一条竖线和一条横线,用磷酸盐缓冲液(PBS)清洗细胞2次,将6孔板放在倒置显微镜下观察,在竖线和横线交界处附近拍照,拍照后加药,加药分组为5 μmol·L-1他莫昔芬单药组、10 nmol·L-1地高辛单药组、联合用药组和等体积DMSO对照组,24 h后在相同的位置再次拍照。使用ImageJ软件测量划痕宽度,迁移率/%=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。每个加药组设置3个复孔,实验独立重复3次。
1.2.5 Transwell小室实验检测细胞侵袭能力将无血清的DMEM培养基和Matrigel放在4 ℃冰箱预冷,按培养基:Matrigel=11∶1的比例配制基质胶,Transwell小室放置于24孔板中,每个Transwell小室均匀铺100 μL基质胶,放回培养箱中静置3 h,使其成为胶状,取出24孔板,弃去上清液后加入PBS,静置15 min后除去PBS。Transwell上室中加入200 μL细胞悬液使每个小室细胞数为2×104个,下室每孔加入600 μL含20%胎牛血清的DMEM培养基,加药分组为5 μmol·L-1他莫昔芬单药组、10 nmol·L-1地高辛单药组、联合用药组和等体积DMSO对照组,置于37 ℃、5%CO2培养基中培养24 h后,吸去上室和下室中的培养基,使用甲醇固定15 min,PBS清洗小室2遍,加入结晶紫染色30 min,PBS清洗2遍,棉签轻轻擦去上室中未穿膜的细胞,放入烘箱烘干,取出置于倒置显微镜下观察,随机选取5个视野拍照并计数。每个加药组设置3个复孔,实验独立重复3次。
1.2.6 流式细胞术检测细胞凋亡取对数生长期的MCF-7细胞接种于6孔板中,每孔接种1×106个细胞,放入37 ℃、5% CO2培养箱中过夜,待细胞完全贴壁后加药,分为他莫昔芬10 μmol·L-1单药处理组、地高辛50 nmol·L-1单药处理组、联合用药组、等体积DMSO对照组,加药24 h后,用不含EDTA的胰酶消化并收集细胞,加入5 μL的异硫氰酸荧光素(fluorescein isothiocyanate isomer,Annex V-FITC)和5 μL的碘化丙啶(propidium iodide,PI)室温避光反应15 min后进行流式细胞仪的检测。实验独立重复3次。
1.2.7 Western blot法检测PI3K、p-PI3K、AKT、p-AKT、Bax、Bcl-2、caspase-3、cleaved-caspase-3、caspase-9、cleaved-caspase-9、N-cadherin、E-cadherin、Vimentin及tubulin蛋白的表达取对数生长期的MCF-7细胞接种于6孔板中,培养细胞至70%-80%融合度后加药,采用与划痕实验相同的药物浓度和分组,用以检测EMT相关蛋白(N-cadherin、E-cadherin和Vimentin)的表达。采用与流式实验相同的药物浓度和分组,用以检测凋亡相关蛋白(Bax、Bcl-2、caspase-3、cleaved-caspase-3、caspase-9和cleaved-caspase-9)和PI3K-AKT信号通路相关蛋白(PI3K、p-PI3K、AKT和p-AKT)的表达,加药后继续培养48 h,加入RIPA细胞裂解液(使用前,先加1%的苯甲基磺酰氟混匀),放置于冰上裂解20 min,收集含蛋白的裂解液于1.5 mL离心管中,4 ℃、12 000 r·min-1离心30 min后取上清液,BCA法定量蛋白浓度,将蛋白样品与上样缓冲液混合,100 ℃煮5 min。每个泳道上30 μg蛋白样品,SDS-PAGE电泳90 min分离蛋白,然后将蛋白电转移至PVDF膜120 min,用5%的脱脂奶粉封闭2 h,分别加入PI3K、AKT、p-AKT、Bax、Bcl-2、caspase-3、caspase-9、N-cadherin、E-cadherin、Vimentin(1∶1 000)及tubulin(1∶20 000)一抗,4 ℃孵育过夜,TBST清洗3次(10 min/每次)后再加入相应的二抗(1∶10 000),室温孵育2 h,TBST清洗3次(10 min/每次),在膜上均匀滴加曝光液,后曝光显影。以tubulin作为内参蛋白,目的蛋白(PI3K、p-PI3K、Bax、Bcl-2、cleaved-caspase-3、cleaved-caspase-9、N-cadherin、E-cadherin、Vimentin)与内参蛋白条带灰度值的比值为其相对表达量;p-AKT与AKT灰度值的比值为p-AKT的相对表达量。实验独立重复3次。
1.2.8 统计学方法采用GraphPad Prism 7.00软件对数据进行统计学分析,数据以x±s表示,不同用药组之间的显著性差异比较采用单因素方差分析,组内两两比较用LSD-t检验。
2 结果 2.1 紫杉醇、吉西他滨、阿霉素和地高辛联合他莫昔芬对人乳腺癌细胞MCF-7增殖的影响MTT结果(Fig 1)显示,紫杉醇、吉西他滨、阿霉素、地高辛、他莫昔芬单独用药对MCF-7细胞的活力均有显著的抑制作用(P < 0.05),经金氏公式检验,各浓度紫杉醇、吉西他滨、阿霉素分别与他莫昔芬联合用药对MCF-7细胞活力的抑制作用均无协同效应(q值均小于1.15),而各浓度的地高辛与他莫昔芬联合用药对MCF-7细胞活力的抑制作用均有明显的协同效应(q值均大于1.15)。
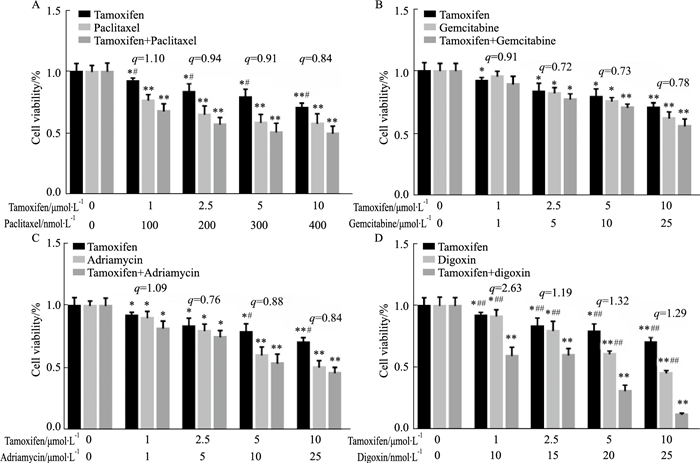
|
| Fig 1 Effects of different concentrations of tamoxifen combined with paclitaxel, gemcitabine, adriamycin and digoxin on proliferation of MCF-7 cells in vitro (x±s, n=18) A: Effect of tamoxifen combined with paclitaxel on proliferation of MCF-7 cells; B: Effect of tamoxifen combined with gemcitabine on proliferation of MCF-7 cells; C: Effect of tamoxifen combined with adriamycin on proliferation of MCF-7 cells; D: Effect of tamoxifen combined with digoxin on proliferation of MCF-7 cells. *P < 0.05, **P < 0.01 vs control, #P < 0.05, ##P < 0.01 vs combination. |
克隆形成实验结果(Fig 2)显示,溶剂对照组、他莫昔芬单药组、地高辛单药组、联合用药组中MCF-7细胞克隆形成数分别为(355±9)个、(237±7)个、(215±7)个、(50±4)个。各用药组与对照组相比差异均有显著性(P < 0.05),药物联合组与各单独用药组相比,差异均有显著性(P < 0.01)。
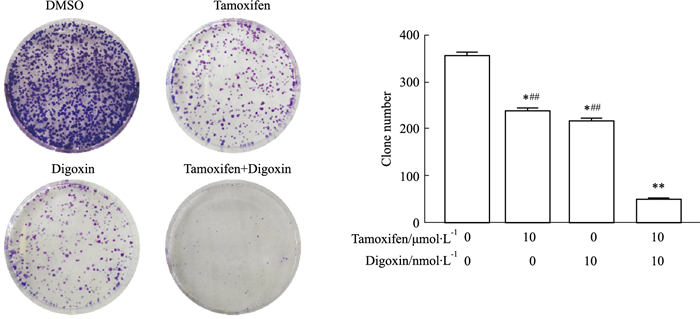
|
| Fig 2 Effect of tamoxifen, digoxin and combination treatment on cell colonies of MCF-7 cells (x±s, n=9) *P < 0.05, **P < 0.01 vs control, ##P < 0.01 vs combination. |
流式细胞术结果(Fig 3)显示,对照组、他莫昔芬组、地高辛组和联合用药组的凋亡率分别为(0.58±0.05)%、(1.33±0.08)%、(7.42±0.22)%、(22.59±0.87)%,各用药组与对照组相比,差异均有显著性(P < 0.05);联合用药组和单药组相比,差异均有显著性(P < 0.01)。
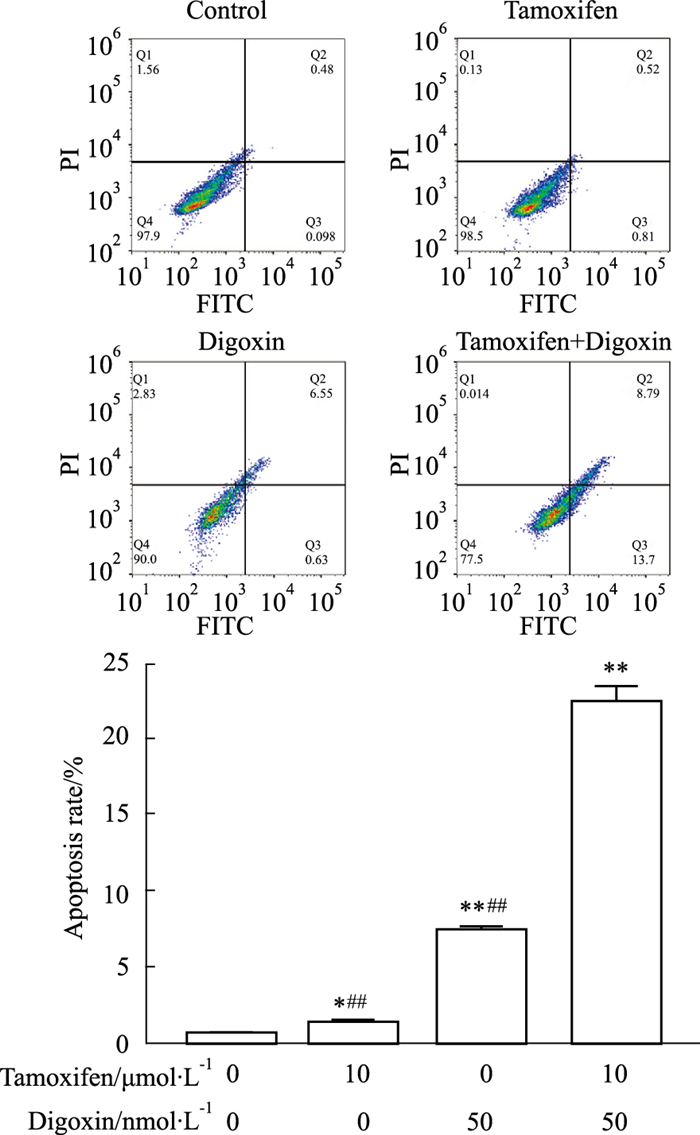
|
| Fig 3 Effect of tamoxifen, digoxin and combination treatment on apoptosis of MCF-7 cells (x±s, n=3) *P < 0.05, **P < 0.01 vs control, ##P < 0.01 vs combination. |
Western blot结果(Fig 4)表明,与对照组相比,他莫昔芬、地高辛和联合用药对caspase-3、caspase-9无明显影响;促凋亡蛋白Bax、cleaved-caspase-3、cleaved-caspase-9的表达明显增多(P < 0.05),抗凋亡蛋白Bcl-2的表达明显减少(P < 0.05),和单独用药组相比,联合用药组的变化更为明显(P < 0.05)。
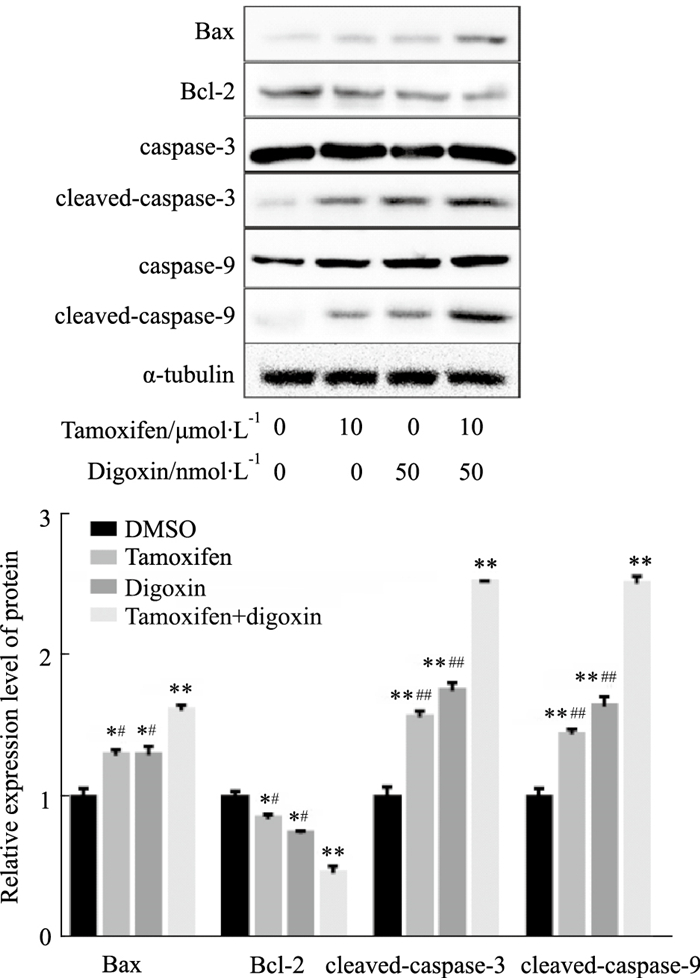
|
| Fig 4 Effect of tamoxifen, digoxin and combination treatment on expression of Bax, Bcl-2, caspase-3, cleaved-caspase-3, caspase-9 and cleaved-caspase-9 proteins in MCF-7 cells detected by Western blot (x±s, n=3) *P < 0.05, **P < 0.01 vs control, #P < 0.05, ##P < 0.01 vs combination. |
划痕实验结果(Fig 5)显示,对照组、他莫昔芬单药组、地高辛单药组、联合用药组的迁移率分别为(80.42±1.46)%、(64.15±1.19)%、(55.93±1.59)%、(31.08±4.17)%。与对照组相比,他莫昔芬、地高辛单药组迁移率均明显下调(P < 0.05),和单药组相比,联合用药组迁移率明显下调(P < 0.05)。
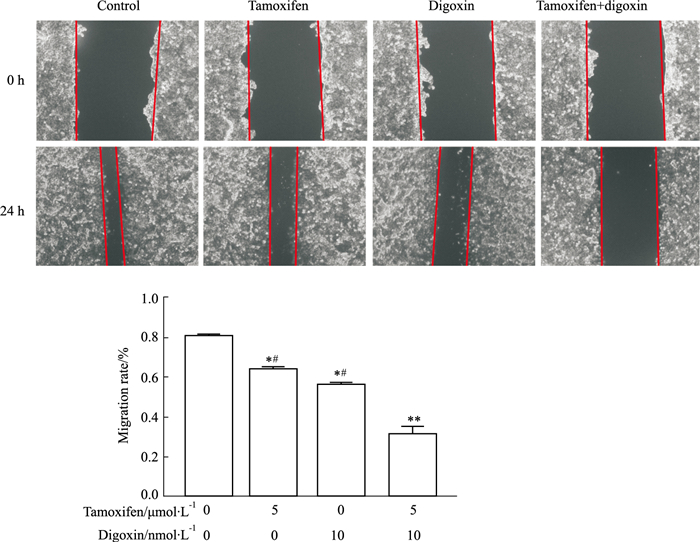
|
| Fig 5 Effect of tamoxifen, digoxin and combination treatment on migration of MCF-7 cells using wound healing assay (x±s, n=9) *P < 0.05, **P < 0.01 vs control, #P < 0.05 vs combination. |
Transwell小室实验结果(Fig 6)显示对照组、他莫昔芬单药组、地高辛单药组和联合用药组发生侵袭的细胞数分别为(406.00±9.16)个、(226.67±11.71)个、(211.67±10.59)个、(54.33±4.04)个。与对照组相比,单药组侵袭细胞数均显著下调(P < 0.01),与单药组相比,联合用药组侵袭细胞数明显下调(P < 0.01)。
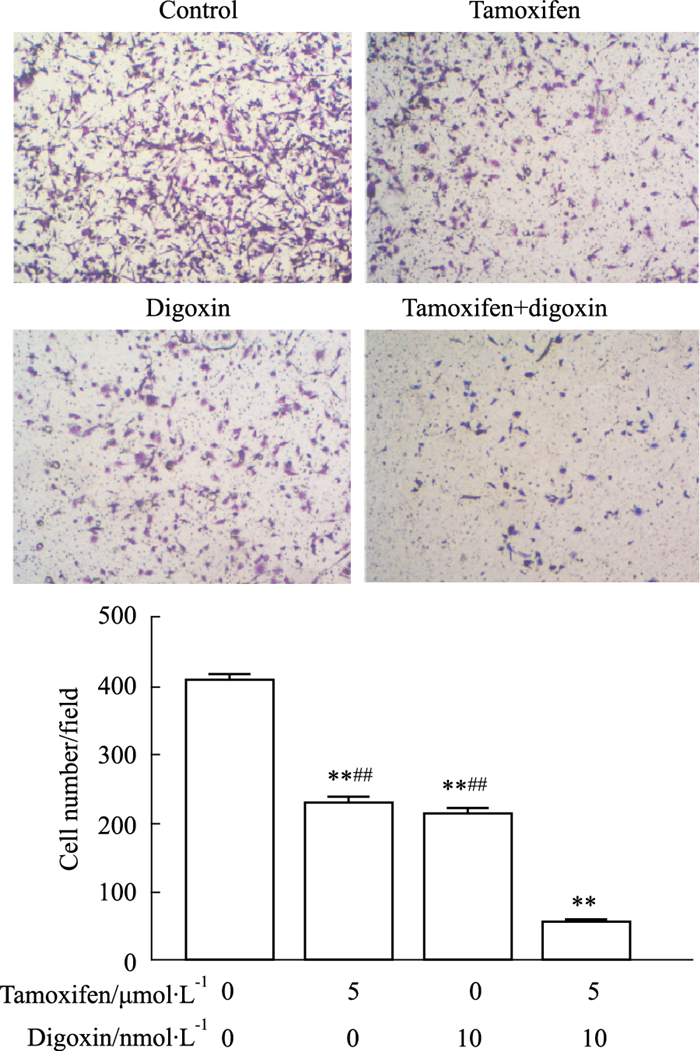
|
| Fig 6 Effect of tamoxifen, digoxin and combination treatment on invasion of MCF-7 cells using transwell assay (x±s, n=9) **P < 0.01 vs control, ##P < 0.01 vs combination. |
Western blot结果(Fig 7)表明,与对照组相比,间质表型指标蛋白N-cadherin和Vimentin的表达明显减少,上皮表型指标蛋白E-cadherin的表达均明显增多(P < 0.05),与单药组对比,联合用药组的变化更为明显(P < 0.05)。
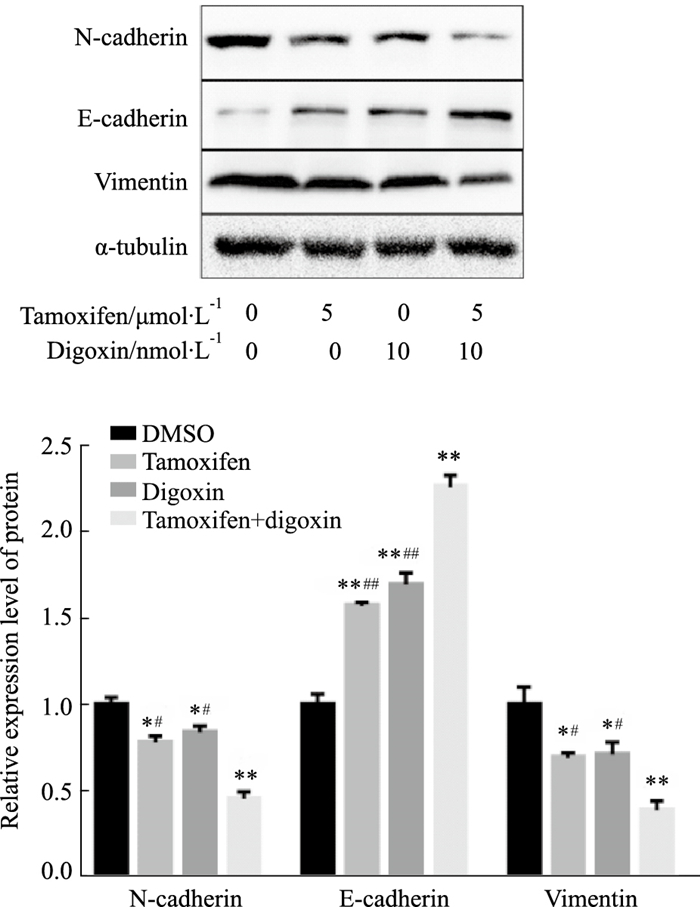
|
| Fig 7 Effect of tamoxifen, digoxin and combination treatment on expression of N-cadherin, E-cadherin and vimentin proteins in MCF-7 cells detected by Western blot (x±s, n=3) *P < 0.05, **P < 0.01 vs control, #P < 0.05, ##P < 0.01 vs combination. |
Western blot结果(Fig 8)显示,和对照组对比他莫昔芬、地高辛和联合用药对AKT的表达无明显影响,PI3K、p-PI3K和p-AKT的表达明显降低(P < 0.05),与单药组对比,联合用药组的变化更为明显(P < 0.01)。
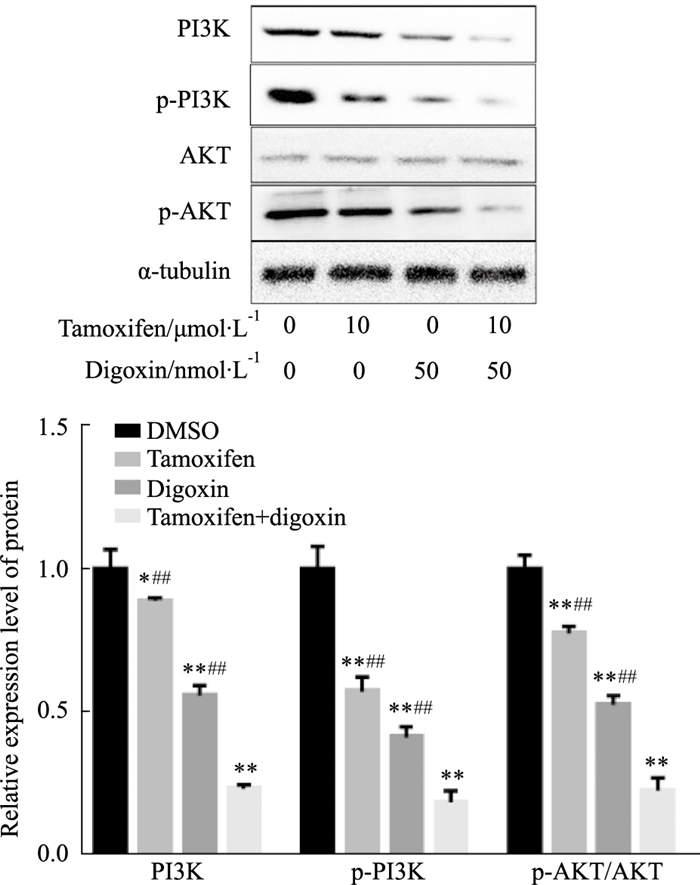
|
| Fig 8 Effect of tamoxifen, digoxin and combination treatment on expression of PI3K, p-PI3K, AKT and p-AKT proteins in MCF-7 cells detected by Western blot (x±s, n=3) *P < 0.05, **P < 0.01 vs control; ##P < 0.01 vs combination. |
乳腺癌是女性最常见的恶性肿瘤,大约有70%的乳腺癌是雌激素受体阳性的[8]。他莫昔芬是雌激素受体阳性的乳腺癌最常用的内分泌治疗药物,可降低乳腺癌的复发率和死亡率,但乳腺癌细胞对他莫昔芬的耐药性,成为降低他莫昔芬治疗效果的主要原因之一[2]。因此有必要寻求增强他莫昔芬疗效的方法,近年已有研究表明法他斯汀(Fatostatin)和没食子酸月桂酯(Lauryl Gallate)等药物与他莫昔芬联合应用可以有效提高他莫昔芬的疗效[9-10]。因此,他莫昔芬与其他药物联合应用可能成为提高疗效的一种可行方法。
有研究发现服用地高辛的心脏病患者癌症发病率降低,Na+/K+-ATP酶抑制剂可以在前列腺癌、乳腺癌、肺癌和白血病等疾病中发挥抗癌作用,一些Na+/K+-ATP酶抑制剂已在临床前研究和临床研究中发挥了很强的抗癌活性,这些结果表明了Na+/K+-ATP酶可能在肿瘤发展中发挥了重要作用,其抑制剂的抗癌活性值得研究[11]。近年来,有研究发现地高辛可与顺铂和阿霉素等抗癌药协同作用[12-13],表明地高辛具有增强其他抗癌药物疗效的潜在价值。
本研究通过MTT实验检测了紫杉醇、吉西他滨、阿霉素和地高辛与他莫昔芬联合用药对乳腺癌MCF-7细胞增殖的影响,MTT结果经金氏公式验证,不同浓度的他莫昔芬与不同浓度紫杉醇、吉西他滨和阿霉素联合用药均无明显的协同作用,而不同浓度的他莫昔芬与不同浓度的地高辛联合用药对乳腺癌MCF-7细胞增殖的抑制作用均大于两者单用之和,具有较明显的协同作用。进一步细胞克隆实验观察确证了他莫昔芬联合地高辛能协同抑制MCF-7细胞的增殖活动。
细胞凋亡是细胞在生理或病理条件下发生的自发的、程序性的死亡,它受到多种信号通路的调节。有研究表明,PI3K-Akt信号通路在乳腺癌中异常活化[14],而PI3K-Akt信号通路可以通过多种途径抑制肿瘤细胞的凋亡,其主要途径有:促进抗凋亡蛋白Bcl-2的表达,阻止Bax的活化而降低其促凋亡作用[15]。在应激刺激下,细胞的凋亡取决于抗凋亡的Bcl-2和促凋亡的Bax的比例,有利于凋亡的蛋白失衡将导致线粒体膜通透性的增加、细胞色素C的释放,caspase的活化[16]。本研究通过流式细胞术发现,地高辛与他莫昔芬可以协同诱导MCF-7细胞的凋亡;Western blot实验发现地高辛与他莫昔芬联合用药可以协同抑制PI3K蛋白表达和PI3K、AKT蛋白磷酸化,同时协同促进促凋亡蛋白如Bax的表达及caspase-3/9活化,并协同抑制抗凋亡蛋白Bcl-2的表达,这与流式细胞术实验结果一致,提示地高辛可以协同他莫昔芬促进细胞凋亡,这可能是减少细胞增殖的重要原因。此外,有文献报道地高辛可下调雌激素受体[17],这可能与地高辛显著增强他莫昔芬疗效相关,具体机制有待进一步探讨。
乳腺癌的转移是乳腺癌患者生存的主要威胁之一,乳腺癌的转移和EMT密切相关,EMT过程促进N-cadherin、vimentin等蛋白的表达,抑制E-cadherin等蛋白的表达[18]。目前,地高辛与其他抗癌药联合应用抑制癌细胞的增殖的研究较多,但关于地高辛联合其他抗癌药对癌症细胞的迁移、侵袭和EMT的作用的研究较少。本研究通过划痕愈合和Transwell小室实验,发现地高辛与他莫昔芬在较低浓度的联合用药可在不明显影响细胞活性的前提下,协同抑制MCF-7细胞的迁移和侵袭能力。与划痕愈合及Transwell小室实验结果一致,我们发现地高辛与他莫昔芬联合用药可协同抑制间质细胞标志蛋白N-cadherin和vimentin的表达,同时促进上皮细胞标志物E-cadherin的表达,提示地高辛与他莫昔芬可协同抑制乳腺癌细胞EMT。
综上所述,地高辛可以协同他莫昔芬通过抑制PI3K-AKT信号通路,诱导乳腺癌MCF-7细胞的凋亡、抑制增殖。此外,地高辛与他莫昔芬在较低浓度时,可通过抑制乳腺癌MCF-7细胞的EMT而抑制迁移和侵袭。
| [1] |
Feng R M, Zong Y N, Cao S M, et al. Current cancer situation in China: Good or bad news from the 2018 Global Cancer Statistics[J]. Cancer Commun (Lond), 2019, 39(1): 22. doi:10.1186/s40880-019-0368-6 |
| [2] |
Chang M. Tamoxifen resistance in breast cancer[J]. Biomol Ther (Seoul), 2012, 20(3): 256-67. doi:10.4062/biomolther.2012.20.3.256 |
| [3] |
Patocka J, Nepovimova E, Wu W, et al. Digoxin: Pharmacology and toxicology-A review[J]. Environ Toxicol Pharmacol, 2020, 79: 103400. doi:10.1016/j.etap.2020.103400 |
| [4] |
Menger L, Vacchelli E, Adjemian S, et al. Cardiac glycosides exert anticancer effects by inducing immunogenic cell death[J]. Sci Transl Med, 2012, 4(143): 143ra99. |
| [5] |
李伯和, 袁磊, 时冉冉, 等. 地高辛逆转乳腺癌MCF-7/阿霉素细胞的耐药性及其机制[J]. 生理学报, 2015, 67(6): 611-7. Li B H, Yuan L, Shi R R, et al. Reversal of adriamycin resistance by digoxin in human breast cancer cell line MCF-7/adriamycin and its mechanism[J]. Acta physiol Sin, 2015, 67(6): 611-7. |
| [6] |
Osuala K O, Ji K, Mattingly R R, et al. , Breast cancer: Proteolysis and migration[J]. Adv Exp Med Biol, 2019, 1152: 401-11. |
| [7] |
薛燕, 曾智锐, 雷珊, 等. 五味子甲素协同吉西他滨抑制肝癌细胞HepG2增殖[J]. 中国药理学通报, 2020, 36(4): 550-5. Xue Y, Zeng Z R, Lei S, et al. Synergy effect of deoxyschizandrin and gemcitabine on proliferation of HepG2 human hepatocellular carcinoma cells[J]. Chin Pharmacol Bull, 2020, 36(4): 550-5. doi:10.3969/j.issn.1001-1978.2020.04.019 |
| [8] |
顾兵, 吴旦平, 张晶晶. 内分泌治疗激素受体阳性乳腺癌的效果及其与ESR1基因位点的关系[J]. 中国医药导报, 2020, 17(26): 26-9. Gu B, Wu D P, Zhang J J. Effect of endocrine therapy on hormone receptor positive breast cancer and its relationship with ESR1 gene locus[J]. Chin Med Herald, 2020, 17(26): 26-9. |
| [9] |
Liu Y, Zhang N, Zhang H, et al. Fatostatin in combination with tamoxifen induces synergistic inhibition in ER-positive breast cancer[J]. Drug Des Devel Ther, 2020, 14: 3535-45. doi:10.2147/DDDT.S253876 |
| [10] |
Samani K G, Farrokhi E, Tabatabaee A, et al. Synergistic effects of lauryl gallate and tamoxifen on human breast cancer cell[J]. Iran J Public Health, 2020, 49(7): 1324-9. |
| [11] |
Alevizopoulos K, Calogeropoulou T, Lang F, et al. Na+/K+ ATPase inhibitors in cancer[J]. Curr Drug Targets, 2014, 15(10): 988-1000. doi:10.2174/1389450115666140908125025 |
| [12] |
Pereira D G, Salgado M A R, Rocha S C, et al. Involvement of src signaling in the synergistic effect between cisplatin and digoxin on cancer cell viability[J]. J Cell Biochem, 2018, 119(4): 3352-62. doi:10.1002/jcb.26499 |
| [13] |
Wang Y, Ma Q, Zhang S, et al. Digoxin enhances the anticancer effect on non-small cell lung cancer while reducing the cardiotoxicity of adriamycin[J]. Front Pharmacol, 2020, 11: 186. doi:10.3389/fphar.2020.00186 |
| [14] |
Levine D A, Bogomolniy F, Yee C J, et al. Frequent mutation of the PIK3CA gene in ovarian and breast cancers[J]. Clin Cancer Res, 2005, 11(8): 2875-8. doi:10.1158/1078-0432.CCR-04-2142 |
| [15] |
Song G, Ouyang G, Bao S. The activation of Akt/PKB signaling pathway and cell survival[J]. J Cell Mol Med, 2005, 9(1): 59-71. doi:10.1111/j.1582-4934.2005.tb00337.x |
| [16] |
Villeneuve C, Baricault L, Canelle L, et al. Mitochondrial proteomic approach reveals galectin-7 as a novel Bcl-2 binding protein in human cells[J]. Mol Biol Cell, 2011, 22(7): 999-1013. doi:10.1091/mbc.e10-06-0534 |
| [17] |
Busonero C, Leone S, Bianchi F, et al. Ouabain and digoxin activate the proteasome and the degradation of the ERα in cells modeling primary and metastatic breast cancer[J]. Cancers (Basel), 2020, 12(12): 3840. doi:10.3390/cancers12123840 |
| [18] |
Aiello N M, Kang Y. Context-dependent EMT programs in cancer metastasis[J]. J Exp Med, 2019, 216(5): 1016-26. doi:10.1084/jem.20181827 |

