


2. 浙江中医药大学研究生院, 浙江 杭州 310053
2. Graduate School of Zhejiang Chinese Medical University, Hangzhou 310053, China
结肠癌是一种常见且致命的人类消化道恶性肿瘤,在全球恶性肿瘤中的发病率和死亡率均位居前列[1],严重威胁人类健康。目前临床主要治疗手段是手术切除联合化疗,但对长期健康产生各种不良影响,包括肠功能障碍、膀胱功能障碍和性功能障碍[2]。因此,迫切需要开发具有低副作用的高效药物。
中药及其提取物在内的天然活性产物,以其资源丰富、作用温和、毒副作用小而用于治疗结肠癌,逐渐成为研究的热点[3]。Hispolon是从药用真菌桑黄中提取分离的一种酚类化合物,具有抗肿瘤、抗氧化和抗炎等多种活性[4-6]。目前已证实在前列腺癌、肝癌、宫颈癌、乳腺癌、鼻咽癌、肺癌、胃癌、膀胱癌、肾癌等多种癌细胞中表现出抗肿瘤作用,而且Hispolon类似物能显著抑制结肠癌细胞的增殖[7],但其作用机制尚未阐明。
网络药理学是基于系统生物学的理论,融合了生物信息学和药理学的概念和方法,探索中药或化合物与疾病的相互作用,指导新药研发[8]。网络药理学强调对信号通路的多途径调节,提高药物的治疗效果,降低毒副作用,从而提高新药临床试验的成功率。本研究拟通过网络药理学筛选出Hispolon治疗结肠癌的作用靶点,研究药物、靶点、通路之间的网络关系,并通过细胞实验验证部分关键靶点,为揭示Hispolon的作用机制提供理论参考,为开发抗结肠癌药物提供一定的科学依据。本研究流程图见Fig 1。
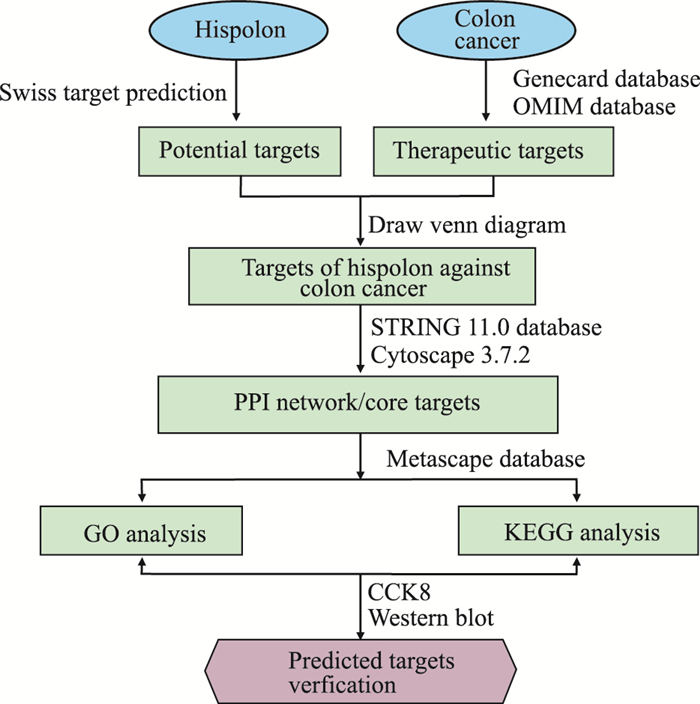
|
| Fig 1 Workflow of Hispolon in treatment of colon cancer |
PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/);Swiss ADME网站(http://www.swissadme.ch/index.php);Swiss Target Prediction网站(http://www.swisstargetprediction.ch/);Genecard数据库(https://www.genecards.org/);OMIM数据库(https://omim.org/);Draw Venn Diagram网站(http://bioinformatics.psb.ugent.be/Webtools/venn/);STRING11.0数据库(https://string-db.org/);Metascape数据库(http://metascape.org)。
1.2 Hispolon的ADME相关特征Swiss ADME(http://www.swissadme.ch/index.php)包含每种化合物的吸收、分布、代谢和排泄(absorption, distribution, metabolism and excretion, ADME)特征的信息,用于评估小分子的理化性质,如相对分子质量(MW)、氢键供体数(hdon)、氢键受体数(hacc)、脂水分配系数(LogPo/w)、溶解度(solubility)等;评估药代动力学,如胃肠道吸收(gastrointestinal absorption);评估类药性,如生物利用度得分(bioavailability score);评估药物化学友好性,如开发成药物的综合可能性(synthetic accessibility)。
1.3 Hispolon潜在靶点获取利用Hispolon的CAS号(173933-40-9)从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)获得Hispolon的2D结构(Fig 2)及SDF文件,将SDF文件导入SwissTargetPrediction网站(http://www.swisstargetprediction.ch/),设置属性为“Homo sapiens”,筛选Probability>0进行靶点预测,获取Hispolon的潜在靶点。
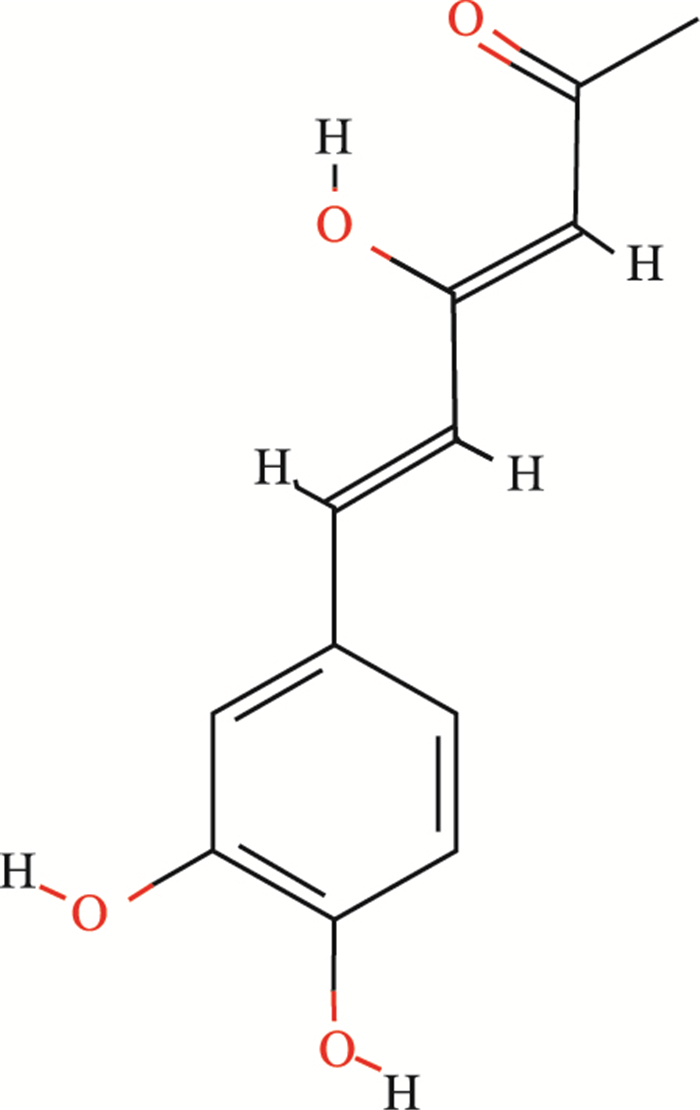
|
| Fig 2 Structure of Hispolon (CAS: 173933-40-9) |
以“结肠癌(colon cancer)”为关键词输入Genecard数据库(https://www.genecards.org/),选取Relevance score>6.25的靶点;输入OMIM数据库(Online Mendelian Inheritance in Man, https://omim.org/),收集验证过的靶点,均设置属性为“Homo sapiens”,将检索结果合并筛重得到结肠癌相关靶点。
1.5 药物与疾病共同靶点筛选及互作网络构建使用Draw Venn Diagram(http://bioinformatics.psb.ugent.be/Webtools/venn/)对结肠癌靶点和Hispolon潜在靶点比对取交集,获取药物与疾病的共同靶点,绘制韦恩图(Venn),这些共同靶点代表Hispolon治疗结肠癌的潜在作用靶点。
利用STRING 11.0数据库(https://string-db.org/)构建共同靶点蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络,将生物种类设定为“Homo sapiens”,其余均为默认设置。采用Cytoscape 3.7.2软件以大于节点度值(Degree)的中位数两倍为拓扑指标,对PPI网络进行拓扑可视化分析,筛选对该网络起主要调控作用的重要靶点。
1.6 核心靶点分析使用Cytoscape3.7.2软件的插件Cytohubba和MCODE挖掘Hispolon作用于结肠癌的PPI网络的核心靶点[9]。
CytoHubba是Cytoscape软件中寻找核心靶点的一个插件,用于发现复杂网络中的关键目标。利用Draw Venn Diagram(http://bioinformatics.psb.ugent.be/Webtools/venn/)对Cytohubba得出的结果进行分析,得到的重叠靶点即为核心靶点。MCODE可以将基因网络中的关键靶点模块提取出来,发现PPI网络中相互作用的密集区域,即各聚集的模块,选择得分最高的模块作为分析对象,从而找出核心靶点。CytoHubba和MCODE的参数均为默认设置。
1.7 GO和KEGG富集分析利用Metascape数据库(http://metascape.org)将获取的Hispolon治疗结肠癌的所有潜在靶点进行生物信息学在线分析,包括基因本体(gene ontology, GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)通路分析,以P < 0.05为标准,筛选出显著性GO富集项目及靶点参与的关键通路信息。应用R语言软件对以上分析结果可视化。同时将药物、相关靶点、通路信息导入Cytoscape3.7.2软件,构建Hispolon治疗结肠癌的“药物-靶点-通路”网络。
1.8 细胞实验验证 1.8.1 材料人结肠癌SW480细胞购自上海吉凯基因化学技术有限公司;Hispolon(纯度98%以上)由浙江中医药大学病原生物与免疫学教研室提供。RPMI 1640培养基、胎牛血清、青链霉素、二甲基亚砜均购自美国Gibco公司;CCK-8试剂盒购自大连美仑生物技术有限公司;BCL-2L1、mTOR抗体、HRP标记的山羊抗兔IgG二抗均购自英国abcam公司。
1.8.2 细胞培养和分组SW480细胞培养于含10%胎牛血清、1%青链霉素的RPMI 1640培养液中,在37 ℃、5% CO2饱和湿度下,细胞生长对数期进行传代、备用。分别设置空白组、对照组(即Hispolon 0 μmol·L-1)、Hispolon实验组(25、50、100 μmol·L-1),用药处理时间为24 h。
1.8.3 CCK-8检测结肠癌SW480细胞增殖情况取对数期细胞以5×104个/孔接种于96孔板,培养24 h后,实验组加入对应的含药培养液,对照组为含细胞等量培养液,并设置不含细胞的空白组,每组设5个复孔。继续培养24 h,每孔加入10 μL CCK-8试剂,于37 ℃孵育2 h,用酶标仪测定各孔450 nm处的吸光度(A)值,根据公式计算细胞存活率。
细胞存活率/%=(A实验-A空白)/(A对照-A空白)×100%
1.8.4 Western blot检测SW480细胞中部分关键靶点的表达收集细胞,加细胞裂解液100 μL,冰上充分裂解30 min,4 ℃、12 000×g离心10 min,收集上清液,采用BCA试剂盒定量蛋白浓度,10% SDS-PAGE胶电泳分离蛋白,冰上转膜120 min。转膜结束,5%脱脂奶粉封闭2 h,加入一抗BCL-2L1(1 ∶1 000)、mTOR(1 ∶1 000)和β-actin(1 ∶1000),4 ℃孵育过夜。除去一抗后,加入酶标二抗(1 ∶2 000)室温孵育2 h。最后ECL化学发光显影,采集图像并分析灰度值。
1.9 统计学分析采用SPSS 19.0软件进行统计处理,计数资料以x±s表示,多组间数据比较选择单因素方差分析(One-Way ANOVA),P < 0.05表示差异有统计学意义。
2 结果 2.1 Hispolon的ADME特征通过Swiss ADME对Hispolon的ADME特征进行了深入研究,如理化性质(包括MW、hdon、hacc、LogPo/w、solubility等)、药代动力学(如gastrointestinal absorption)、类药性(如bioavailability score)和药物化学友好性(如synthetic accessibility),结果显示,Hispolon可溶、胃肠道吸收程度高、生物利用度好,开发成药物的综合可能性高(Tab 1)。
| Name | MW | Hdon | Hacc | LogPo/w | Solubility | Gastrointestinal absorption |
Bioavailability Score |
Synthetic accessibility |
| Hispolon | 220.22 | 3 | 4 | 1.64 | Soluble | High | 0.56 | 2.59 |
利用Swiss Target Prediction网站对Hispolon进行靶点预测,共获得107个潜在靶点(Fig 3)。通过Genecard数据库与OMIM数据库检索,分别得到2 675、499个与结肠癌相关的疾病靶点,通过数据库整合,去除重复靶点,最终获得结肠癌疾病相关靶点3 019个。

|
| Fig 3 Potential target genes related to Hispolon |
绘制Venn图的结果显示,通过匹配107个药物靶点和3 019个疾病靶点,筛选出69个共同靶点(Fig 4),这69个共同靶点即是Hispolon抗结肠癌的潜在靶点。
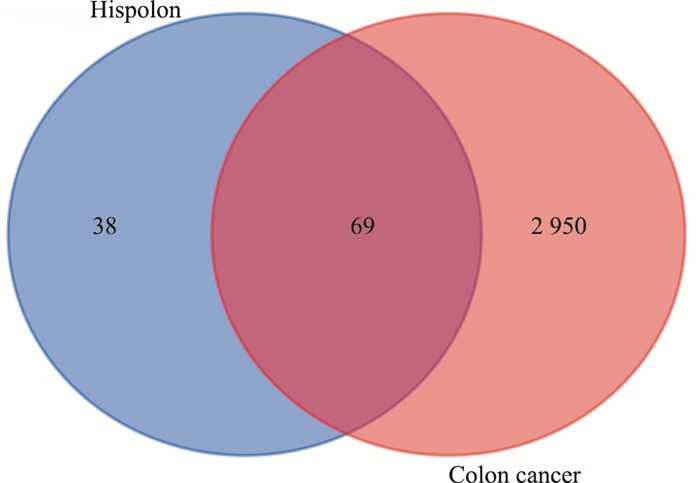
|
| Fig 4 Potential targets of Hispolon against colon cancer |
基于STRING 11.0数据库得到共同靶点的PPI网络,互作网络中有69个节点和326条边,节点代表Hispolon与结肠癌的共同靶点,边代表靶点间的互作关系。Degree常用于说明网络节点的重要性,值越大,说明该节点在网络中越重要。将PPI网络中Degree中位数的两倍即16作为拓扑指标,筛选得到10个重要靶点包括EGFR、MTOR、MMP9、AR、BCL-2L1、MMP2、EP300、TLR4、CDK1、CDK4。
2.4 核心靶点分析结果CytoHubba分析获得BCL-2L1、EP300、CDK1、AR、MTOR、EGFR共6个核心靶点(Fig 5A)。MCODE分析获得了得分最高的模块,分数为7.067。该模块包含了从CytoHubba分析中获得除AR外的其余5个核心靶点,进一步证实了BCL-2L1、EP300、CDK1、MTOR和EGFR 5个核心靶点的重要性(Fig 5B)。
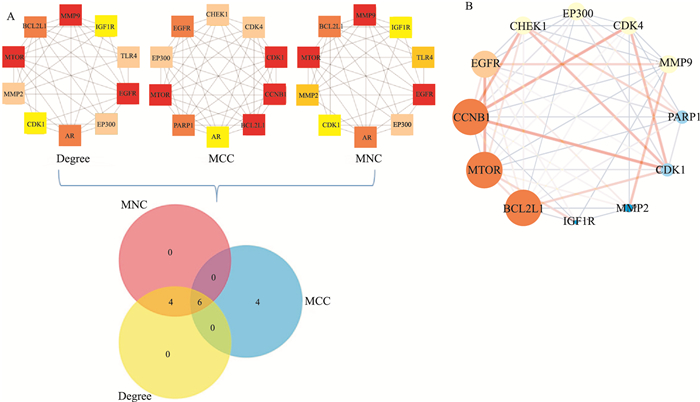
|
| Fig 5 The core genes analyzed by CytoHubba and MCODE A. PPI network was analyzed by CytoHubba ranked by Degree, MNC and MCC, and then Venn diagram was used to get overlapping genes that represented the core genes; B. The most significant module was analyzed by MCODE, and the circular nodes represented core genes contained in (A) |
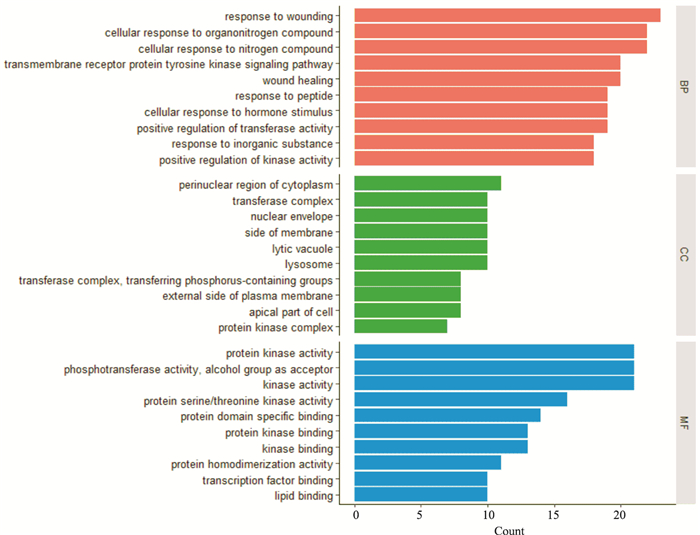
通过Metascape数据库对Hispolon治疗结肠癌的潜在靶点进行GO分析,富集结果显示,具有生物学过程(biological process, BP)1 140条,分子功能(molecular function, MF)61条,细胞成分(cellular component, CC)50条,根据P值大小各筛选出前10条展示(Fig 6)。由图可知,涉及到的主要生物学过程包括对受伤的反应(response to wounding)、细胞对有机氮化合物的反应(cellular response to organonitrogen compound)、跨膜受体蛋白酪氨酸激酶信号通路(transmembrane receptor protein tyrosine kinase signaling pathway)等,参与的分子功能主要包括蛋白激酶活性(protein kinase activity)、磷酸转移酶活性(phosphotransferase activity, alcohol group as acceptor)、丝氨酸/苏氨酸激酶活性(protein serine/threonine kinase activity)等,主要细胞成分有细胞质核周区域(perinuclear region of cytoplasm)、转移酶复合体(transferase complex)、核包膜(nuclear envelope)等。
|
| Fig 6 Go enrichment analysis for targets of Hispolon against colon cancer (TOP 10) |
KEGG通路分析结果表明,Hispolon治疗结肠癌主要集中在120条信号通路中(P < 0.05)。根据P值大小筛选出前20条KEGG通路,利用R语言软件绘制气泡图(Fig 7)。由图可知,69个靶点主要富集在癌症相关通路(pathways in cancer)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、前列腺癌相关通路(prostate cancer)、癌症中MicroRNA相关通路(microRNAs in cancer)等,表明Hispolon可通过多条通路的协调作用发挥抗结肠癌作用。

|
| Fig 7 The bubble chart of KEGG pathway analysis (TOP 20) The gradual color represented the P value and the size of the spots represented the gene number enriched in the pathways |
将筛选的前20条通路、相关靶点、药物,利用Cytoscape3.7.2构建药物-靶点-通路网络。该网络由1个药物、44个靶点、20条通路组成,共有65个节点,252条边,节点代表药物、靶点或通路,边代表药物、靶点及通路之间的关系。以整个网络Degree中位数即8,筛选出重要的节点。结果显示,靶点节点中有11个具有高Degree,包括EGFR、MTOR、BCL-2、IGF1R、BRAF、GSK3B、IKBKB、PDPK1、BCL-2L1、CDK4、EP300;通路节点中有7条通路具有高Degree且与癌症密切相关,分别是癌症相关通路、PI3K-Akt信号通路、前列腺癌相关通路、癌症中microRNAs相关通路、乳腺癌相关通路、肝细胞癌相关通路、膀胱癌相关通路;其中,核心靶点BCL-2L1、EP300、MTOR和EGFR富集在重要通路包括癌症相关通路、PI3K-Akt信号通路、前列腺癌相关通路、癌症中microRNAs相关通路等,提示Hipolon抗结肠癌呈现出多靶点、多通路协同作用的特点。
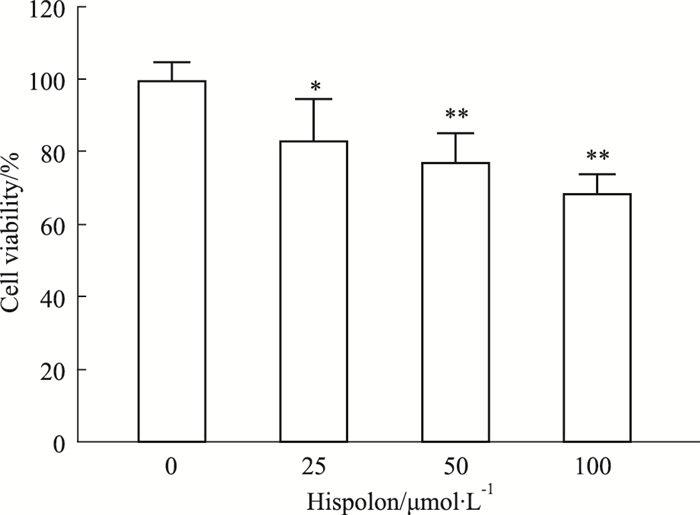
2.7 Hispolon对结肠癌SW480细胞增殖的影响不同浓度Hispolon作用SW480细胞24 h后,呈现出浓度依赖性抑制细胞增殖。与对照组相比,细胞存活率逐渐降低(Fig 8)。
|
| Fig 8 Effect of Hispolon on viability of SW480 cells (x±s, n=3) *P < 0.05, **P < 0.01 vs control group |
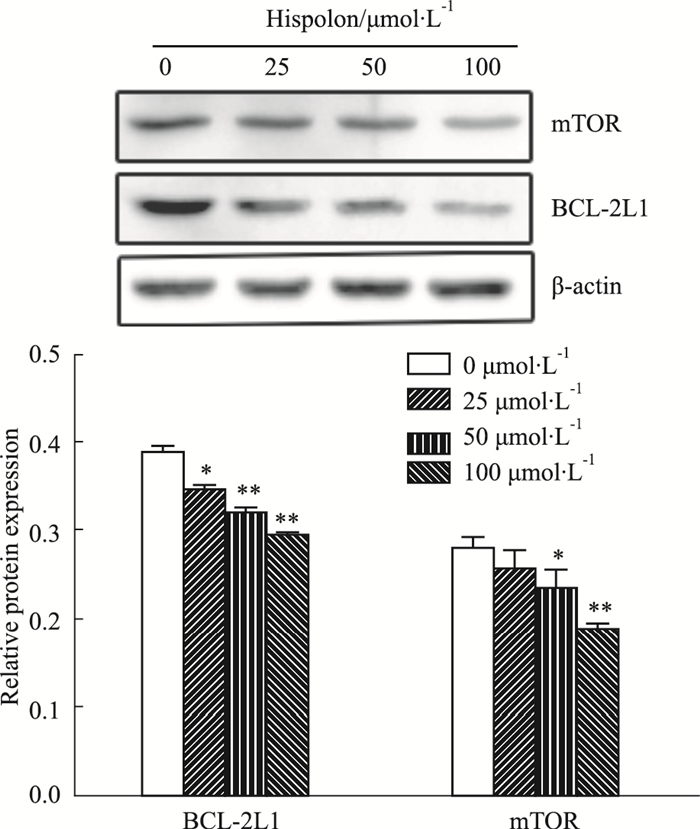
与对照组相比,各组Hispolon能不同程度下调BCL-2L1和mTOR蛋白的表达(Fig 9)。
|
| Fig 9 Effects of Hispolon on protein expression of BCL-2L1 and mTOR in SW480 cells (x±s, n=3) *P < 0.05, **P < 0.01 vs control group |
近年来,随着中医药的不断发展,天然产物已成为发现重要先导药物的主要源泉。尤其从天然产物中分离得到具有较高生物活性的单体成分成为研究热点,对其药理活性和作用机制研究逐渐深入。Hispolon自1996年首次分离以来,至今已报道了其对多种不同类型癌症细胞显示出较强的抑制活性。并且Hispolon类似物能显著抑制结肠癌细胞的增殖[7],具有潜在的抗结肠癌作用,但其分子机制尚不清楚。
网络药理学使研究者从“药物-单一靶点-单一途径”治疗疾病的传统模式向“药物-多靶点-多途径-疾病”的方式转变,挖掘出更多潜在靶点,形成新型药物研发模式。因此,本文采用网络药理学来探讨Hispolon治疗结肠癌的潜在作用机制。首先本研究利用SwissTargetPrediction网站、Genecard数据库、OMIM数据库获得Hispolon治疗结肠癌的潜在作用靶点69个,Cytoscape 3.7.2软件对作用靶点的PPI网络图可视化分析,发现重要靶点包括BCL-2L1、EP300、CDK1、AR、MTOR、EGFR等;其次使用Cytoscape 3.7.2软件的Cytohubba和MCODE插件挖掘Hispolon作用于结肠癌的PPI网络的核心靶点,共筛选出5个核心靶点,包括BCL-2L1、EP300、CDK1、MTOR、EGFR,与PPI网络可视化分析结果一致。其中,BCL-2L1属于Bcl-2蛋白家族,是一个重要的抗凋亡分子,通过与电压依赖性阴离子通道结合,阻止caspase激活剂CYC1从线粒体膜中释放,来阻止细胞凋亡,在细胞凋亡过程中起着重要作用[10]。EP300作为组蛋白乙酰转移酶,在细胞增殖、转化和分化中具有重要作用,细胞中缺乏EP300会增加结肠癌细胞的活动性和侵袭性,诱导上皮间质转化[11]。CDK1是细胞周期G2/M检查点的关键调节剂,被认为是癌症治疗的潜在靶标,El-Huneidi等[12]研究发现紫穗菊通过下调CDK1等使得细胞周期在G2/M期停滞,诱导乳腺癌和结肠癌细胞凋亡。mTOR是调节细胞生长、代谢和免疫的蛋白激酶(一种丝氨酸/苏氨酸激酶),过度激活后,mTOR信号传导促进细胞增殖和代谢,从而促进肿瘤的发生和发展[13]。EGFR在许多癌症尤其是乳腺癌、卵巢癌和非小细胞肺癌中过表达或突变,研究表明抑制结肠癌细胞中的EGFR信号传导可调节细胞因子的分泌并防止M1至M2巨噬细胞极化,从而抑制癌细胞的生长[14]。以上结果表明,BCL-2L1、EP300、CDK1、MTOR、EGFR可能是Hispolon治疗结肠癌的潜在作用靶点。
通过GO功能富集分析,发现Hispolon治疗结肠癌主要涉及对受伤的反应、细胞对有机氮化合物的反应、跨膜受体蛋白酪氨酸激酶信号通路等生物学过程,包括蛋白激酶活性、磷酸转移酶活性、丝氨酸/苏氨酸激酶活性等分子功能;KEGG通路提示Hispolon抗结肠癌可能通过调节癌症相关通路、PI3K-Akt信号通路、前列腺癌相关通路、癌症中MicroRNAs相关通路等发挥作用,并且通路中关键靶点涉及BCL-2L1、EP300、CDK1、MTOR和EGFR核心靶点。GO和KEGG分析的结果与我们的预测相符,即核心靶点主要参与抗癌生物过程和信号通路。其中,核心靶点BCL-2L1和mTOR在筛选的前20条信号通路中富集程度较高。Bcl-2家族蛋白在凋亡调控中起着关键作用,Bax是Bcl-2家族的关键成员,其激活能够促进细胞色素c的释放和线粒体裂变,从而导致凋亡小体的形成和caspase-3的激活,进而促进细胞凋亡。据报道,BCL-2L1能够稳定Bax的线粒体定位,同时使其保持失活状态[15],因此,抑制BCL-2L1的表达可能是促进凋亡的一个潜在途径。Zhang等[16]研究发现结肠癌患者Lin28/let-7c轴发生失调,let-7c通过抑制BCL-2L1的表达来诱导结肠癌细胞凋亡。mTOR信号的激活是促进肿瘤生长的关键,在细胞存活、细胞骨架重排、抗凋亡以及侵袭转移等方面起着基础性的作用[17]。文献报道深绿卷柏提取物通过PI3K-Akt-mTOR信号通路下调了结肠癌细胞HT29和HCT16中mTOR的表达水平,诱导结肠癌细胞凋亡[18]。因此,BCL-2L1和mTOR是参与凋亡过程中重要的治疗靶点,选择这两个靶点的调控作用进行实验验证。
为了验证网络药理学预测结果,最后进行了体外细胞实验。实验结果显示Hispolon有效抑制SW480细胞增殖,呈剂量依赖性;Western blot验证Hispolon可下调SW480细胞中靶点蛋白BCL-2L1和mTOR的表达,发挥促凋亡作用。这进一步验证了网络药理学预测Hispolon抗结肠癌靶点的可行性和准确性。
综上所述,通过网络药理学预测了Hispolon抗结肠癌的潜在分子机制,具有多靶点、多通路的特点,同时选取部分关键靶点进行了实验验证。研究结果表明,网络药理学是一种可靠的方法,可用于预测化合物是否具有发展为药物的潜力。但是,预测的靶点和关键通路还需进一步实验验证。
| [1] |
Dekker E, Tanis P J, Vleugels JLA, et al. Colorectal cancer[J]. Lancet, 2019, 394(10207): 1467-80. doi:10.1016/S0140-6736(19)32319-0 |
| [2] |
Miller K D, Nogueira L, Mariotto A B, et al. Cancer treatment and survivorship statistics, 2019[J]. CA Cancer J Clin, 2019, 69(5): 363-85. doi:10.3322/caac.21565 |
| [3] |
李萍, 沈学彬, 周玉燕, 等. 拟康氏木霉胞外多糖对人结肠癌细胞HCT116增殖及凋亡的影响[J]. 中国药理学通报, 2019, 35(11): 1621-6. Li P, Shen X B, Zhou Y Y, et al. Effect of exopolysaccharide from Trichoderma pseudokoningii on proliferation and apoptosis of human colon cancer cell line HCT116[J]. Chin Pharmacol Bull, 2019, 35(11): 1621-6. doi:10.3969/j.issn.1001-1978.2019.11.025 |
| [4] |
Sarfraz A, Rasul A, Sarfraz I, et al. Hispolon: A natural polyphenol and emerging cancer killer by multiple cellular signaling pathways[J]. Environ Res, 2020, 190: 110017. doi:10.1016/j.envres.2020.110017 |
| [5] |
Chethna P, Iyer S S, Gandhi V V, et al. Toxicity and antigenotoxic effect of hispolon derivatives: role of structure in modulating cellular redox state and thioredoxin reductase[J]. ACS Omega, 2018, 3(6): 5958-70. doi:10.1021/acsomega.8b00415 |
| [6] |
Wu M S, Chien C C, Cheng K T, et al. Hispolon suppresses LPS- or LTA-induced iNOS/NO production and apoptosis in BV-2 microglial cells[J]. Am J Chin Med, 2017, 45(8): 1649-66. doi:10.1142/S0192415X17500896 |
| [7] |
Balaji N V, Ramani M V, Viana A G, et al. Design, synthesis and in vitro cell-based evaluation of the anti-cancer activities of hispolon analogs[J]. Bioorg Med Chem, 2015, 23(9): 2148-58. doi:10.1016/j.bmc.2015.03.002 |
| [8] |
Hopkins A L. Network pharmacology: The next paradigm in drug discovery[J]. Nat Chem Biol, 2008, 4(11): 682-90. doi:10.1038/nchembio.118 |
| [9] |
Huang X F, Zhang J L, Huang D P, et al. A network pharmacology strategy to investigate the anti-inflammatory mechanism of luteolin combined with in vitro transcriptomics and proteomics[J]. Int Immunopharmacol, 2020, 86: 106727. doi:10.1016/j.intimp.2020.106727 |
| [10] |
Warren C F A, Wong-Brown M W, Bowden N A. BCL-2 family isoforms in apoptosis and cancer[J]. Cell Death Dis, 2019, 10(3): 177. doi:10.1038/s41419-019-1407-6 |
| [11] |
Krubasik D, Iyer N G, English W R, et al. Absence of p300 induces cellular phenotypic changes characteristic of epithelial to mesenchyme transition[J]. Br J Cancer, 2006, 94(9): 1326-32. doi:10.1038/sj.bjc.6603101 |
| [12] |
El-Huneidi W, Shehab N G, Bajbouj K, et al. Micromeria fruticosa induces cell cycle arrest and apoptosis in breast and colorectal cancer cells[J]. Pharmaceuticals (Basel), 2020, 13(6): 115. doi:10.3390/ph13060115 |
| [13] |
Hua H, Kong Q, Zhang H, et al. Targeting mTOR for cancer therapy[J]. J Hematol Oncol, 2019, 12(1): 71. doi:10.1186/s13045-019-0754-1 |
| [14] |
Zhang W, Chen L, Ma K, et al. Polarization of macrophages in the tumor microenvironment is influenced by EGFR signaling within colon cancer cells[J]. Oncotarget, 2016, 7(46): 75366-78. doi:10.18632/oncotarget.12207 |
| [15] |
Renault T T, Teijido O, Antonsson B, et al. Regulation of Bax mitochondrial localization by Bcl-2 and Bcl-x(L): Keep your friends close but your enemies closer[J]. Int J Biochem Cell Biol, 2013, 45(1): 64-7. doi:10.1016/j.biocel.2012.09.022 |
| [16] |
Zhang H, Zong Y, Qiu G, et al. Silencing Lin28 promotes apoptosis in colorectal cancer cells by upregulating let-7c targeting of antiapoptotic BCL-2L1[J]. Mol Med Rep, 2018, 17(4): 5143-9. |
| [17] |
Murugan A K. mTOR: Role in cancer, metastasis and drug resistance[J]. Semin Cancer Biol, 2019, 59: 92-111. doi:10.1016/j.semcancer.2019.07.003 |
| [18] |
Li S, Wang X, Wang G, et al. Ethyl acetate extract of selaginella doederleinii hieron induces cell Autophagic death and apoptosis in colorectal cancer via PI3K-Akt-mTOR and AMPKalpha-signaling pathways[J]. Front Pharmacol, 2020, 11: 565090. doi:10.3389/fphar.2020.565090 |

