

类风湿关节炎(rheumatoid arthritis,RA)是一种与关节相关的自身免疫性疾病,在中医上属于“弊证”,它以关节软骨糜烂和损伤、滑膜细胞增生和骨破坏为特征,该病的主要临床特征为侵蚀性、对称性的关节炎,其中双手、腕、膝、踝和足关节的受累最为常见[1]。RA的病因十分复杂,主要包括遗传、吸烟、微生物感染、激素刺激、寒冷刺激及饮食等[2]。RA发展的确切病理机制仍不清楚,炎性细胞因子如白细胞介素6(interleukin-6,IL-6)、IL-1β和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)在RA的免疫发病机制中起着核心作用,炎症因子的增加可诱导炎症细胞浸润和滑膜细胞增殖,导致发炎的滑膜浸润到邻近关节软骨和骨,从而引起软骨和骨骼的破坏[3]。目前广泛用于RA的药物有非甾体类抗炎药(NSAIDs)、减病抗风湿药(DMARDs)及糖皮质激素(GCs)等,但是这些药物生物利用度较差,需要高剂量和频繁的使用,因此产生了一些严重的副作用,如免疫缺陷、胃肠紊乱和体液紊乱等[4]。随着中药治疗RA的研究不断取得突破,中医药治疗RA的疗效显著,副作用少,受到越来越多的关注。
雷公藤甲素(triptolide, TP)又称雷公藤内酯醇,是一种从雷公藤中分离出来的有效的免疫抑制化合物,雷公藤甲素具有多种生物活性,如抗炎、抗增殖、免疫抑制和抗肿瘤等,被用于治疗RA、免疫复合物肾炎、系统性红斑狼疮和器官组织移植等炎症性和自身免疫性疾病[5-6]。然而,TP的溶解度较差,全身性毒副作用严重,药代动力学半衰期短,导致其抗RA作用尚未在临床上得到充分发挥[7-8]。
硫酸软骨素(chondroitin sulfate, CS)是葡糖胺聚糖一个亚族,是一种不分枝的、多分散的、复杂的大分子化合物。CS能显著抑制水肿、滑膜炎和关节软骨破坏,有利于修复关节损伤,再生软骨细胞,增加关节滑液量, 具有减轻关节炎患者疼痛和增加活动能力的作用。它能抑制软骨基质降解,对受损的软骨有保护作用[9-10]。因此,为了降低TP毒性、更好发挥其疗效及增加其骨保护的作用,本研究将TP与CS共同包封于脂质体中,探究其对CIA的治疗作用。
1 材料 1.1 实验动物SPF级SD大鼠48只,雌雄各半,体质量(140-180) g,购于辽宁长生生物技术有限公司,许可证号:SCXK(辽)2020-0001。大鼠饲养于辽宁中医药大学实验动物中心,恒温(22-24) ℃,湿度55%-60%。本研究中所有实验方案均得到动物伦理委员会批准下进行动物研究。
1.2 药材、药品与试剂TP(成都普菲德生物技术有限公司,批号20051508,纯度98.94%);CS(大连美仑生物技术有限公司,批号D1128A,纯度95.4%);卵磷脂、胆固醇(美国Avanti Polar Lipids公司);二硬脂酰磷脂酰乙醇胺-聚乙二醇2000(DSPE-PEG2000)(日本NOF公司);鸡Ⅱ型胶原、弗氏完全佐剂、弗氏不完全佐剂(美国Sigma公司,批号:SLBT1422、SLBT1714、SLBV4134);IL-1β、TNF-α及IL-6 ELISA试剂盒(北京索莱宝生物有限公司,批号:20200817、20200901、20200704);其余试剂均为分析纯,水为纯净水。
1.3 主要仪器JY92-ⅡN型超声波细胞粉碎机(宁波新芝生物科技股份有限公司);XS105型十万分之一天平(Mettler Toledo);Ti-S型荧光倒置显微镜(日本尼康公司);RM2235型石蜡切片机(德国莱卡公司);HBS-1096A型酶标仪(南京德铁实验设备有限公司)。
2 方法 2.1 脂质体的制备采用薄膜分散-硫酸铵梯度法,用甲醇将TP、卵磷脂、胆固醇、DSPE-PEG2000振摇并超声溶解,旋转蒸发仪除去有机溶剂,形成薄膜后用硫酸铵溶液进行水化,用探头超声仪间歇超声后,0.22 μm的微孔滤膜3次,制得雷公藤甲素脂质体(TP-Lips)。将该脂质体密封于透析膜袋中,使用PBS作为透析介质,之后与CS混合,水浴振摇24 h,制得雷公藤甲素联合硫酸软骨素脂质体(TP-CS-Lips)。制得的脂质体性质稳定,可用于后续的研究。
2.2 动物分组与造模将鸡Ⅱ型胶原溶于新鲜配置的的乙酸溶液中,在4 ℃搅拌过夜。次日于冰上将胶原溶液加入到弗氏完全佐剂中,要逐滴加入、搅拌约2 h,将其乳化完全,用作初次免疫;继发免疫剂的制备方法同上,只需将胶原溶液加入弗氏不完全佐剂即可。随机挑选8只大鼠作为对照组(Control),其余40只大鼠,在每只大鼠尾根部皮下注射100 μL初次免疫剂,7 d后,继续注射继发免疫剂加强免疫[11]。将造模成功的大鼠随机分为5组,分别为模型组(Model)、TP组、TP-CS组、TP-Lips组及TP-CS-Lips组。
2.3 给药方法TP组、TP-CS组、TP-Lips组及TP-CS-Lips组分别腹腔注射之前制备的TP、TP-CS、TP-Lips及TP-CS-Lips(TP:30 μg·kg-1, CS:100 mg·kg-1),Control组和Model组大鼠腹腔注射等体积生理盐水,每天1次,治疗周期为28 d。
2.4 体质量称定分别于0 d(给药前)和7、14、21及28 d相同时间段对各组大鼠进行体质量的称定。
2.5 关节炎指数评价分别于0(给药前)和7、14、21及28 d相同时间段对各组大鼠关节进行关节炎指数评分。评分依据为:关节无肿胀计0分;关节轻微肿胀计1分;关节中度红肿计2分;关节严重肿胀计3分;关节严重肿胀并出现功能障碍计4分。
2.6 胸腺指数与脾指数的测定将大鼠处死后,完整剥离胸腺与脾脏,用电子天平称重,计算胸腺指数与脾指数。
2.7 HE染色将大鼠处死后,完整分离大鼠关节膝关节软骨组织,将其放置脱钙液中脱钙,用4 %多聚甲醛进行固定、乙醇脱水、二甲苯透明、放入石蜡中进行包埋,然后切片、脱蜡,进行染色,于显微镜下观察。
2.8 炎症因子的测定大鼠连续治疗28 d后,摘取眼球取血,3 000 r·min-1离心5 min后取上清,于-20 ℃条件保存。用ELISA试剂盒检测各组大鼠血清中IL-1β、TNF-α及IL-6的表达水平,样品处理和实验操作按说明书进行。
2.9 统计学分析采用SPSS软件进行数理统计与分析。所有数据用x±s表示,组间差异比较用单因素方差分析,两组间比较用t检验。
3 结果 3.1 各组药物对大鼠体质量的影响如Tab 1所示,0-28 d,Control组大鼠的体质量显著上升;Model组大鼠的体质量虽也呈上升趋势,但是上升缓慢,与Control相比体质量降低,体质量差异具有统计学意义(P < 0.05);在治疗28 d后,TP-Lips组大鼠相比Model组体质量明显上升,差异具有统计学意义(P < 0.05);在治疗21 d后,TP-CS-Lips组相比Model组体重显著增加,差异具有统计学意义(P < 0.05);而TP组、TP-CS组与Model组相比体质量没有上升,反而有些许下降,差异无统计学意义。
| Group | 0 d | 7 d | 14 d | 21 d | 28 d |
| Control | 215.45±3.76 | 226.91±7.30 | 232.19±8.38 | 247.51±6.31 | 259.60±8.06 |
| Model | 195.59±5.09* | 208.43±4.19* | 208.86±9.60* | 226.96±6.13* | 235.33±6.24* |
| TP | 200.15±3.66 | 201.55±6.01 | 208.10±4.76 | 217.99±4.75 | 229.81±4.17 |
| TP-CS | 198.81±5.58 | 204.34±7.76 | 208.73±5.36 | 222.93±9.71 | 234.34±5.09 |
| TP-Lips | 201.36±7.54 | 207.70±6.83 | 217.23±6.94 | 232.10±7.66 | 244.71±5.92# |
| TP-CS-Lips | 199.35±5.81 | 209.60±6.98 | 219.13±5.24 | 236.98±6.46# | 245.26±5.89# |
| *P < 0.05 vs control;#P < 0.05 vs model | |||||
如Tab 2所示,与Control组相比,Model组大鼠关节炎指数上升明显,差异具有统计学意义(P < 0.05);治疗14 d后,TP-Lips组、TP-CS-Lips组与Model组相比,关节炎指数下降,差异具有统计学意义(P < 0.05);在治疗28 d后,TP-CS组大鼠与Model组相比,其关节炎指数下降,差异具有统计学意义(P < 0.05),TP组与Model组相比,差异无统计学意义(P > 0.05)。
| Group | 0 d | 7 d | 14 d | 21 d | 28 d |
| Control | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 |
| Model | 1.75±1.04* | 2.63±0.52* | 3.75±0.46* | 3.88±0.35* | 3.75±0.46* |
| TP | 1.63±1.19 | 2.38±1.19 | 3.38±0.74 | 3.63±0.52 | 3.25±0.71 |
| TP-CS | 1.63±0.92 | 2.50±0.93 | 3.25±0.71 | 3.25±0.46 | 2.75±0.71# |
| TP-Lips | 1.50±0.76 | 2.36±0.74 | 2.75±0.46# | 2.50±0.93# | 2.38±0.52# |
| TP-CS-Lips | 1.75±0.71 | 2.25±1.04 | 2.50±1.76# | 2.38±0.92# | 2.13±0.83# |
| *P < 0.05 vs control;#P < 0.05 vs model | |||||
与Control组相比,Model组胸腺指数、脾指数上升,差异具有统计学意义(P < 0.05);与Model组相比TP-Lips组、TP-CS-Lips组胸腺指数、脾指数下降,差异具有统计学意义(P < 0.05);而TP组、TP-CS组与Model组相比,差异无统计学意义。
| Group | Thymus index | Spleen index |
| Control | 1.37±0.05 | 1.65±0.14 |
| Model | 2.78±0.15* | 2.94±0.39* |
| TP | 2.75±0.11 | 2.91±0.28 |
| TP-CS | 2.65±0.07 | 2.86±0.19 |
| TP-Lips | 1.97±0.12# | 2.57±0.17# |
| TP-CS-Lips | 1.85±0.17# | 2.37±0.14# |
| *P < 0.05 vs control;#P < 0.05 vs model | ||
大鼠关节软骨HE染色如Fig 1所示,Control组软骨表面平整光滑,细胞排列均匀整齐、软骨陷窝清晰可见,细胞核清晰可见,软骨基质深染、着色均匀,潮线清晰完整;而Model组软骨表面不光整且出现了增生,部分软骨陷窝消失,部分细胞核坏死,软骨基质浅染且着色不均,潮线模糊;各治疗组相比于Model组,症状有所改善,其中TP-CS-Lips组对大鼠滑膜改善作用最显著。
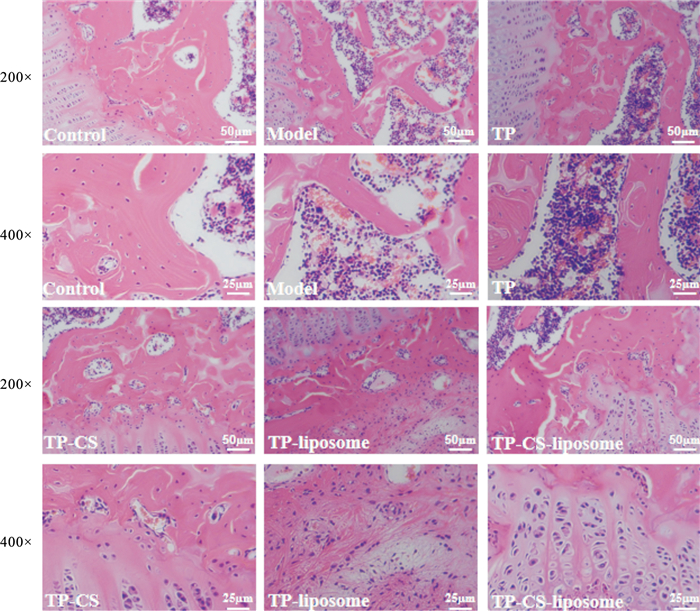
|
| Fig 1 Effects of various formulations on pathological injury of rat cartilage |
如Tab 4所示,相比于Control组,Model组大鼠血清中的IL-1β、TNF-α及IL-6的水平升高,差异具有统计学意义(P < 0.05);各治疗组大鼠血清中的IL-1β、TNF-α及IL-6的水平相比于Model组均明显降低,差异具有统计学意义(P < 0.05),且TP-CS-Lips组IL-1β、TNF-α及IL-6的水平降低最为明显。
| Group | IL-1β | TNF-α | IL-6 |
| Control | 39.07±1.15 | 2.71±0.52 | 16.91±4.00 |
| Model | 123.51±7.95* | 60.29±8.74* | 54.82±4.05* |
| TP | 98.62±2.34# | 47.41±4.48# | 38.63±2.62# |
| TP-CS | 90.40±8.11# | 41.80±9.15# | 37.30±5.15# |
| TP-Lips | 66.40±7.06# | 29.53±6.20# | 32.75±1.19# |
| TP-CS-Lips | 60.84±5.43# | 20.29±3.44# | 32.15±1.75# |
| *P < 0.05 vs control;#P < 0.05 vs model | |||
RA是一种自身免疫性疾病,表现为关节软骨糜烂损伤、血管翳、滑膜炎症和骨破坏。Ⅱ型胶原蛋白诱导的大鼠关节炎模型(CIA)在病理学上的表现与人类RA很类似,是目前公认的RA最佳模型[12]。本研究通过尾部注射鸡Ⅱ型胶原弗氏佐剂以建立CIA大鼠模型。通过造模的大鼠与Control组相比食量减少,体重下降,精神萎靡,关节出现了严重的肿胀,严重影响了其活动能力。且Model组的大鼠胸腺指数、脾指数明显增加;滑膜组织损伤严重;血清中炎症因子IL-1β、TNF-α及IL-6的水平提高,显示CIA模型制备成功。
脂质体是一种将药物包封于类生物膜的微小囊泡中,脂质体的制备简便、生物利用度高,能够显著增加药物的溶解度,并能降低药物的毒性,具有靶向性、缓释性特点,已被广泛应用于RA的治疗。Ren等[13]通过将地塞米松包载于脂质体中,发现地塞米松脂质体相比于游离地塞米松对CIA的治疗作用大大增强。Gawne等[14]将糖皮质激素包封于脂质体中,发现给药糖皮质激素脂质体比游离组在发炎的关节处的药物摄取量高,治疗效果优于游离组。TP可以抗炎、抗增殖、免疫抑制和抗肿瘤,但由于其溶解性差、毒副作用强,限制了它的临床应用。Lu等通过大鼠给药不同浓度TP,发现给药后大鼠肝脏出现了严重的毒性,体重也下降[15]。为了降低TP的毒性,本研究中将TP包载于脂质体中,发现治疗21 d后,TP-Lips组和TP-CS-Lips组大鼠相比于Model组,体重明显上升。而TP组、TP-CS组大鼠体重相比于Model组虽然对关节炎有治疗作用,但是体重却下降,应是其毒性导致。
炎性细胞因子在RA的免疫发病机制中起着核心作用,它可以增加并诱导炎症细胞浸润和滑膜细胞增殖,导致发炎的滑膜浸润到邻近关节软骨和骨,从而导致软骨和骨骼的破坏。在RA患者体内TNF-α、IL-1β及IL-6大量存在[16]。TNF-α主要由巨噬细胞产生,是导致炎症发生的关键炎症因子之一,在RA患者血清中TNF-α水平显著提高,它是导致滑膜炎症和关节破坏的重要因素;IL-1β主要由巨噬细胞产生,它可以诱导血管内皮细胞粘附分子的表达、炎症发生、软骨细胞凋亡等。在许多病例中发现,血浆和滑膜液中IL-1β浓度增高;IL-6由多种细胞产生,如T细胞、B细胞、巨噬细胞、软骨细胞、成纤维细胞等,IL-6通过作用于中性粒细胞,分泌活性氧中间体和蛋白水解酶,引起炎症和关节破坏[17]。本研究中,TP-CS-Lips组的大鼠血清中IL-1β、TNF-α及IL-6的水平相比于Model组显著降低。Ni R等通过荧光成像的方法,发现脂质体在CIA大鼠关节部位集聚,发挥了更好的疗效[18]。本研究中,TP-Lips组和TP-CS-Lips组比TP组、TP-CS组治疗效果更好,也说明TP包封在脂质体后更好的发挥了抗炎的作用。同时TP-CS-Lips组也降低了大鼠关节炎指数评分、胸腺指数和脾指数、改善了软骨组织损伤。
综上所述,TP-CS-Lips对CIA的治疗作用明显,且TP毒副作用被改善,使其充分发挥抗炎作用,同时又增加了CS的骨保护作用。TP-CS-Lips从抗炎和骨破坏两方面同时入手,在临床应用具有很大潜力。本研究为其进一步研究与开发提供了参考。
| [1] |
Kaur I, Behl T, Bungau S, et al. Exploring the therapeutic promise of targeting HMGB1 in rheumatoid arthritis[J]. Life Sci, 2020, 258: 118164. doi:10.1016/j.lfs.2020.118164 |
| [2] |
Zhang S, Meng T, Tang C, et al. MicroRNA-340-5p suppressed rheumatoid arthritis synovial fibroblast proliferation and induces apoptotic cell number by targeting signal transducers and activators of transcription 3[J]. Autoimmunity, 2020, 53(6): 314-22. doi:10.1080/08916934.2020.1793134 |
| [3] |
Hoxha M, Zappacosta B. CYP-derived eicosanoids: Implications for rheumatoid arthritis[J]. Prostaglandins Other Lipid Mediat, 2020, 146: 106405. doi:10.1016/j.prostaglandins.2019.106405 |
| [4] |
Guo X, Ji J, Feng Z, et al. A network pharmacology approach to explore the potential targets underlying the effect of sinomenine on rheumatoid arthritis[J]. Int Immunopharmacol, 2020, 80: 106201. doi:10.1016/j.intimp.2020.106201 |
| [5] |
Yang Y, Ye Y, Qiu Q, et al. Triptolide inhibits the migration and invasion of rheumatoid fibroblast-like synoviocytes by blocking the activation of the JNK MAPK pathway[J]. Int Immunopharmacol, 2016, 41: 8-16. doi:10.1016/j.intimp.2016.10.005 |
| [6] |
Song X, Zhang Y, Dai E, et al. Prediction of triptolide targets in rheumatoid arthritis using network pharmacology and molecular docking[J]. Int Immunopharmacol, 2020, 80: 106179. doi:10.1016/j.intimp.2019.106179 |
| [7] |
Liu Y, Jin J, Xu H, et al. Construction of a pH-responsive, ultralow-dose triptolide nanomedicine for safe rheumatoid arthritis therapy[J]. Acta Biomater, 2020, S1742-7061(20): 30680-2. |
| [8] |
Li P, Yang X, Yang Y, et al. Synergistic effect of all-trans-retinal and triptolide encapsulated in an inflammation-targeted nanoparticle on collagen-induced arthritis in mice[J]. J Control Release, 2020, 319: 87-103. doi:10.1016/j.jconrel.2019.12.025 |
| [9] |
Wang L, Yin J, Yang B, et al. Serious selenium deficiency in the serum of patients with Kashin-Beck disease and the effect of Nano-Selenium on their chondrocytes[J]. Biol Trace Elem Res, 2020, 194(1): 96-104. doi:10.1007/s12011-019-01759-7 |
| [10] |
Bauerova K, Ponist S, Kuncirova V, et al. Chondroitin sulfate effect on induced arthritis in rats[J]. Osteoarthritis Cartilage, 2011, 19(11): 1373-9. doi:10.1016/j.joca.2011.08.006 |
| [11] |
陈天帷, 殷媛, 张瑞, 等. 火针对胶原诱导型关节炎大鼠血清中肿瘤坏死因子-α和抗环瓜氨酸多肽抗体含量的影响[J]. 针刺研究, 2018, 43(8): 501-5. Chen T W, Yin Y, Zhang R, et al. Fire-needle acupuncture intervention relieves ankle-joint inflammatory reactions possibly by down-regulating serum TNF-α and anti-cyclic citrullinated peptide antibody levels in collagen-induced arthritis rats[J]. Acupunct Res, 2018, 43(8): 501-5. |
| [12] |
于坤, 徐枝芳, 余楠楠, 等. 佐剂性和胶原诱导性关节炎模型比较分析[J]. 辽宁中医药大学学报, 2018, 43(1): 106-9. Yu K, Xu Z F, Yu N N, et al. Comparison of adjuvant-induced and collagen-induced arthritis animal models[J]. J Liaoning Univ Tradit Chin Med, 2018, 43(8): 501-5. |
| [13] |
Ren H, He Y, Liang J, et al. Role of liposome size, surface charge, and PEGylation on rheumatoid arthritis targeting therapy[J]. ACS Appl Mater Interfaces, 2019, 11(22): 20304-15. doi:10.1021/acsami.8b22693 |
| [14] |
Gawne P J, Clarke F, Turjeman K, et al. PET imaging of liposomal glucocorticoids using 89Zr-oxine: theranostic applications in inflammatory arthritis[J]. Theranostics, 2020, 10(9): 3867-79. doi:10.7150/thno.40403 |
| [15] |
Lu Y, Xie T, Zhang Y, et al. Triptolide induces hepatotoxicity via inhibition of CYP450s in rat liver microsomes[J]. BMC Complement Altern Med, 2017, 17(1): 15. doi:10.1186/s12906-016-1504-3 |
| [16] |
许冰馨, 王琪珊, 李钦, 等. 地塞米松对CIA大鼠DRG中炎症因子的抑制和关节疼痛的改善作用[J]. 中国药理学通报, 2020, 36(12): 1691-6. Xu B X, Wang Q S, Li Q, et al. Dexamethasone inhibits inflammatory factors in DRG and improves joint pain of CIA rats[J]. Chin Pharmacol Bull, 2020, 36(12): 1691-6. doi:10.3969/j.issn.1001-1978.2020.12.012 |
| [17] |
Mateen S, Zafar A, Moin S, et al. Understanding the role of cytokines in the pathogenesis of rheumatoid arthritis[J]. Clin Chim Acta, 2016, 455: 161-71. doi:10.1016/j.cca.2016.02.010 |
| [18] |
Ni R, Song G, Fu X, et al. Reactive oxygen species-responsive dexamethasone-loaded nanoparticles for targeted treatment of rheumatoid arthritis via suppressing the iRhom2/TNF-α/BAFF signaling pathway[J]. Biomaterials, 2020, 232: 119730. doi:10.1016/j.biomaterials.2019.119730 |

