

2. 国家药品监督管理局药品审评中心,北京 100022
赵春阳(1988-),女,助理研究员,研究方向:神经药理学,Tel:010-85243163,E-mail: zhaocypumc@163.com。
2. Center for Drug Evaluation, National Medical Product Administration, Beijing 100022, China
泛素-蛋白酶体系统(ubiquitin-proteasome system, UPS)是真核生物体内细胞蛋白质降解的重要途径之一,其介导的蛋白质降解在真核生物的生长和发育调节中起着重要作用,调控细胞的增殖、分化、凋亡以及DNA的修复等生理活动。作为具有高度选择性的蛋白质降解途径,泛素-蛋白酶体系统的紊乱会导致细胞内蛋白质动态平衡的打破,引起蛋白质水平的失衡,甚至引发癌症、神经退行性疾病(如阿尔茨海默症和帕金森病)、炎症发生、病毒感染、中枢神经系统紊乱、动脉粥样硬化和代谢功能障碍等多种疾病[1]。
泛素-蛋白酶体通路主要包括底物蛋白质泛素化以及底物经蛋白酶体降解两大过程。泛素是一种存在于真核生物中,由高度保守的76个氨基酸组成的多肽链,主要功能是对待分解的蛋白质进行标记,使其被蛋白酶体降解。泛素-蛋白酶体途径是三类酶催化完成的多酶级联反应,主要由泛素激活酶E1、泛素转移酶E2、泛素连接酶E3等一系列催化酶介导。在ATP水解供能的条件下,泛素首先与泛素激活酶E1通过硫酯键结合而被激活,活化的泛素在E1-泛素复合物中被转移至泛素转移酶E2,并通过硫酯键与E2的活性位点半胱氨酸残基相连。当底物为一些碱性蛋白(如组蛋白)时,泛素可直接从E2转移给底物蛋白形成泛素-蛋白复合物。一般情况下,大多数靶蛋白的泛素化需要借助特异的泛素连接酶E3来实现。E2泛素转移酶将泛素传递给E3泛素连接酶,后者识别特定的底物蛋白,催化泛素羧基端的甘氨酸与赖氨酸侧链的ε-氨基发生共价结合形成异肽键,最终将泛素传递到底物。泛素分子上的48位、63位赖氨酸可以作为修饰位点,进而在底物蛋白上形成不同种类的多泛素链。由于靶蛋白所连接的泛素链的结构和长度不同,泛素化修饰后的靶蛋白可能被降解,也可能被转移至特定部位参与细胞其他生理活动的调节。由48位赖氨酸残基连接的4个及4个以上的泛素共价底物蛋白所形成的K48连接多泛素结合物,最终会被26S蛋白酶体识别和降解,从而对细胞周期以及细胞凋亡等多种细胞生理活动发挥调控作用。此外也有研究表明,泛素链63位赖氨酸残基连接的靶蛋白可通过K63连接发生多泛素化,但不会进入蛋白质的降解过程。通常情况下,通过此途径发生泛素化后的靶蛋白活性会发生改变,并对细胞内信号转导过程和DNA修复等相关生理活动发挥调节作用。
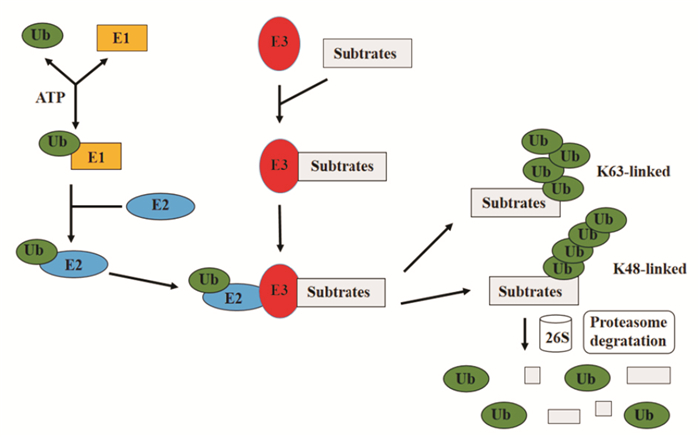
|
| Fig 1 The ubiquitin-proteasome system |
泛素连接酶E3决定靶蛋白的特异性识别,在泛素途径中具有重要的调控作用。人类基因组一共编码2种E1泛素激活酶、38种E2泛素转移酶以及600余种E3泛素连接酶。泛素连接酶E3可以直接与底物发生作用或通过辅助蛋白与底物相互作用,决定泛素-蛋白酶体系统结合的底物的特异性[2]。目前哺乳动物细胞内发现的泛素连接酶E3根据结构特点和作用机制主要包括三大类:含HECT结构域的E3、含环指结构域的E3和U-box蛋白家族E3。
泛素-蛋白酶体系统通过降解异常或受损的蛋白质来维持细胞的正常的生理活动,因此该系统的异常调控会引起各种疾病的发生,其中泛素连接酶E3所发挥的作用尤为重要。大量证据表明,E3连接酶的失调与癌症及神经系统疾病(如少年型帕金森病)的发生存在着密切的联系。此外,泛素连接酶E3还可能成为治疗糖尿病、动脉粥样硬化以及自身免疫性疾病的潜在药物靶点。而绝大多数的去泛素化酶则发挥着显著的促肿瘤作用,针对其开发抑制剂可能为抗肿瘤药物研发提供新的研究思路[3]。
以硼替佐米为代表的蛋白酶体抑制剂已被美国食品药品监督管理局批准上市,用于治疗多发性骨髓瘤,这证明了围绕泛素-蛋白酶体系统开展药物研发具有一定的可行性。但由于该类抑制剂无差别地抑制所有依赖于26S蛋白酶体的蛋白降解途径,因此会对正常细胞造成损伤,具有较大的毒副作用。而在泛素蛋白酶系统的潜在药物靶点中,以E3泛素连接酶作为药物作用靶点则表现出了突出的优点:某些E3泛素连接酶的特定结构决定了针对其进行小分子抑制剂的筛选或特定靶向抗体的开发会具有更好的选择性,且一些E3泛素连接酶在正常细胞内表达水平极低。故针对该靶点进行抑制,对正常细胞的生长及功能影响较小,可以在取得最佳治疗效果的同时最大程度地降低药物的毒副作用。因此针对泛素连接酶E3开发靶向药物,成为了近年来的研究热点之一。
近年来,各大制药公司和研究机构都对靶向泛素连接酶E3药物的研发投入了很大精力, 罗氏制药公司、赛诺菲以及强生等大型制药公司针对泛素连接酶开发的相关药物均处于临床前或临床试验阶段,能否成功上市仍然存在着较大的不确定性。本文将总结靶向E3泛素连接酶药物的研究进展,并就目前已经完成和正在进行临床试验的靶向E3连接酶的药物研究进行综述。
1 靶向E3泛素连接酶的抗肿瘤药物大量证据表明,某些E3泛素连接酶的异常表达与癌症发生关系密切,癌症患者E3泛素连接酶的过度表达有可能增加化疗耐药和临床预后不良的风险。MDM2 E3连接酶、Skp-Cul1-F-box(SCF)家族、HUWE1等E3泛素连接酶都在细胞周期调控及凋亡中发挥重要作用,也是目前开发靶向E3泛素连接酶抗肿瘤药物的重要作用靶点[4]。围绕E3泛素连接酶开发的靶向抗肿瘤药物按照作用机制主要分为三大类:E3泛素连接酶的靶向抑制剂、E3泛素连接酶的靶向激动剂以及蛋白水解靶向嵌合体。
1.1 E3泛素连接酶抑制剂 1.1.1 MDM2/HDM2抑制剂小鼠双微体2基因编码的泛素连接酶MDM2(murine double minute 2,MDM2,人源直系同源分子为HDM2)是RING型泛素连接酶的重要成员之一,具有负调控抑癌蛋白p53的功能。关于MDM2的研究目前较为深入,以MDM2为靶点的抗癌药物研发一直是各大制药公司的重点。抑癌蛋白p53是细胞内的典型的肿瘤抑制因子,p53在DNA损伤或癌基因激活的情况下被活化后,能够作为异常细胞增殖的负调节因子诱导细胞发生周期阻滞、凋亡、衰老等,从而抑制肿瘤细胞的生长和增殖[5]。在生理条件下,MDM2可与p53直接结合抑制p53转录因子活性,同时还可以促进p53蛋白的泛素化以及降解,使p53蛋白保持在较低水平以维持正常的细胞功能。当发生DNA损伤时,MDM2和p53蛋白的结合减弱,p53蛋白的降解受到抑制而发生累积。活化的p53通过转录调控一系列蛋白的表达,引起细胞周期阻滞,为DNA损伤修复提供时间。因此,抑制MDM2/HDM2可能重新激活癌细胞中的p53,进而导致肿瘤细胞凋亡。多年来,许多制药公司对MDM2抑制剂进行了大量的投资,但是还没有成功的药物获批进入市场(Tab 1)。罗氏制药公司第一个MDM2抑制剂RG7112针对实体瘤和急性髓系白血病的Ⅰ期临床试验分别于2007年和2008年启动,但由于毒性过大且效果不明显而失败。随后发现的抑制剂RG7388(商品名Idasanutlin)自2011年首次进行人体试验以来,临床疗效也不尽如人意。2020年6月,罗氏制药公司宣布Idasanutlin针对治疗急性髓系白血病开展的Ⅲ期临床试验失败(NCT02545283)。
| Drug name | Company | Global status | Indication |
| APG-115 | Ascentage Pharma | Phase Ⅱ clinical trial | AML, non-small cell lung cancer, melanoma, urothelial carcinoma, lipoma |
| HDM201 | Novartis | Phase Ⅱ clinical trial | AML, acute lymphoblastic leukemia |
| DS-3032b | Daiichi Sankyo | Phase Ⅱ clinical trial | AML, high-risk myelodysplastic syndrome, solid tumor, lymphoma |
| AMG-232 | Kartos Therapeutics | Phase Ⅱ clinical trial | AML, multiple myeloma |
| ASTX-295 | Astex | Phase Ⅱ clinical trial | Solid tumor |
| ATSP-7041 | Aileron &Roche | Phase Ⅱ clinical trial | AML |
| BI-907828 | Boehringer Ingelheim | Phase Ⅰ clinical trial | Solid tumor |
| JNJ-26854165 | Johnson & Johnson Pharmaceutical | Phase Ⅰ clinical trial | Advanced solid tumor |
| RG7388 | Roche | Discontinued | - |
JNJ-26854165是在p53激动剂筛选中发现的新型HDM2抑制剂。2011年强生制药公司公布了该化合物在晚期实体瘤患者中的Ⅰ期人体内药物动力学和药效学研究结果,JNJ-26854165在缺乏其他治疗方案的晚期实体瘤患者中表现出了较好的治疗效果,但其毒性的相关实验数据仍需要进一步考证(NCT00676910)[6]。
2020年7月,亚盛医药集团原创新药MDM2抑制剂APG-115的Ib期临床研究已在中国完成首例患者给药,后续临床实验尚在进行中(NCT04275518)。APG-115为高选择性小分子MDM2-p53抑制剂,口服给药后可见急性白血病和其他癌症的模型中肿瘤完全持久的消退,目前主要用于治疗成人复发或难治急性髓性白血病(acute myelocytic leukemia,AML)、复发或高危/极高危骨髓增生异常综合征。该药物同时还与默沙东制药公司达成全球临床合作,进一步探索APG-115联合可瑞达联合治疗对非小细胞肺癌、黑色素瘤等患者的疗效和安全性,并已进入Ⅱ期临床试验阶段,临床试验结果还未公布(NCT03611868)。
HDM201(商品名Siremadlin)是诺华制药公司开发的HDM2小分子抑制剂,在复发/难治性急性髓性白血病以及急性淋巴细胞白血病患者的Ⅰ期临床试验中,表现出了显著的临床活性以及安全性(NCT02143635)[7]。该药物还有其他几项Ⅰ期临床试验及Ⅱ期临床试验尚在进行过程中,结果尚未公布。
Milademetan(DS-3032b,商品名Milademetan)也是一种靶向MDM2的小分子抑制剂,它在AML、非霍奇金B细胞淋巴瘤和实体肿瘤的细胞系和移植瘤模型中均显示出了抗肿瘤活性。Milademetan的Ⅰ期临床试验显示其在复发难治性急性髓性白血病或高危骨髓增生异常综合征以及实体肿瘤或淋巴瘤患者中均表现出了显著的初步临床活性[8],Ⅱ期临床试验尚在进行中。
AMG-232(KRT-232)是哌啶酮类靶向MDM2的小分子抑制剂,可以诱导p53活性从而阻滞细胞周期、抑制肿瘤细胞增殖。AMG-232对复发难治性急性髓性白血病治疗效果的临床Ⅰ期试验已经完成,受试者中未显示出剂量限制毒性(NCT02016729)。在另一项TP53-野生型实体瘤或多发性骨髓瘤的临床Ⅰ期试验中(NCT01723020),AMG-232表现出了较高的安全性。其他几项关于AMG-232的临床Ⅰ期及Ⅱ期实验尚在进行中,研究结果尚未公布。
此外,还有一些靶向MDM2的抑制剂也处在临床试验阶段。Astex公司开发的MDM2拮抗剂ASTX-295正在进行Ⅱ期临床试验(NCT03975387)。Aileron公司与罗氏制药公司联合开发的MDM2抑制剂ATSP-7041正在进行对AML的Ⅱ期临床试验。Boehringer Ingelheim公司开发的BI-907828也是一种口服的MDM2抑制剂,目前正在进行治疗实体瘤的Ⅰ期临床试验(NCT03449381)。
1.1.2 Cullin-RING E3泛素连接酶抑制剂Cullin-RING E3泛素连接酶(Cullin-RING E3 ligase,CRL)是包含RING结构域和Cullin蛋白家族的多元蛋白复合体,通常由Cullin家族蛋白、RING蛋白、衔接蛋白和底物识别亚基4个部分组成。SCF泛素连接酶复合体(或称CRL1)是目前研究较为深入的Cullin-RING E3泛素连接酶,由Cullin家族蛋白CUL1、衔接蛋白SKPI以及个底物识别亚基F-box蛋白的F-box结构域部分组成[9]。近年来开发的Cullin-RING E3泛素连接酶抑制剂也是以靶向SCF泛素连接酶复合体的底物识别亚基F-box蛋白的小分子抑制剂为主。
SKP2是F-box蛋白家族的重要成员之一,在前列腺癌、乳腺癌以及淋巴癌等多种肿瘤细胞中均呈现出异常高表达。Chen团队通过高通量筛选发现的小分子化合物Compound A可以特异性地抑制SKP2从而促进p21、p53等底物的积累,抑制G1/ S期的进行进而诱导细胞凋亡[10]。Wu等[11]以SKP2-Cks1-p27晶体结构的蛋白-蛋白相互作用区域为靶点借助计算机辅助虚拟筛选技术发现了小分子SKP2抑制剂C1、C2、C16和C20,该类化合物通过抑制SKP2-Cks1与底物p27的结合,诱导p27蛋白积累,从而干扰肿瘤细胞的细胞周期,促进肿瘤细胞的凋亡。有研究以SCFSKP2复合体晶体结构上的SKP2-SKP1相互作用区域为靶点借助计算机辅助虚拟筛选技术筛选出了以化合物Compound 25为代表的一系列靶向SKP2小分子抑制剂。Compound 25可通过与SKP2结合抑制SCFSKP2泛素连接酶的活性抑制肿瘤增殖,并对肿瘤干细胞表现出了抑制其成球能力的药理作用[11-12]。但以上抑制剂均停留在活性先导化合物发现阶段,具体的作用机制也有待于进一步深入探索,距离开发成为真正的上市抗肿瘤药物还有很遥远的距离。
β-TrCP1和β- TrCP2也是F-box蛋白家族的重要组成成员,其底物涉及的生理功能比较复杂,既包括Emi1、周期蛋白D1等细胞周期蛋白、Twist等细胞迁移蛋白、Pro-caspase-3等细胞凋亡蛋白、也包括PCDC4等抑癌蛋白以及CDC25A等促癌蛋白。因此,靶向β-TrCP对于不同种类的以及来源于不同组织或遗传背景的肿瘤细胞发挥的作用可能不同。Erioflorin是Johanna团队在天然产物中发现的一种靶向β-TrCP的抑制剂,其可以通过阻断β-TrCP与底物细胞凋亡蛋白PCDC4的结合,促进PCDC4在细胞中的积累而发挥抗肿瘤的作用,并对乳腺癌MCF7细胞以及结肠癌RKO细胞的增殖表现出了明显的抑制活性,但其同样还没有进入药物开发阶段,不能作为药物应用[13]。
1.2 E3泛素连接酶激动剂人体中表达了600余种E3泛素连接酶,不同种类的E3泛素连接酶承担的生理作用也各不相同。一些E3泛素连接酶,如FBW7泛素连接酶水平过低也会引起癌症的发生。FBW7是一种拥有重复结构域的F-box蛋白,在SCF型泛素连接酶(E3)复合物中以底物识别亚基的形式存在,起到抑制肿瘤的作用。FBW7可以与周期蛋白E、c-Myc、MCL1和KLF5等多种原癌基因或转录激活因子直接结合发挥作用,并对其进行泛素化修饰,进而影响后续的26S蛋白酶体降解过程。c-Myc蛋白调控细胞生长和分裂,是FBW7泛素化修饰的主要底物之一。冬凌草甲素是一种二萜类天然化合物,可通过上调FBW7连接酶的表达水平,促进过剩的c-Myc蛋白降解,实现促进肿瘤细胞凋亡以及抑制肿瘤生长的功能。
Cereblon是CUL4-DDB1 E3泛素连接酶复合体的一个底物识别亚基,靶向该靶点的免疫调节性酰亚胺类药物沙利度胺及其衍生物来那度胺和泊马度胺是靶向泛素连接酶CRL激动剂的代表类药物。目前很多药企也在研发靶向CRL激动剂类药物,其中一些药物已经进入了临床前及临床试验研究阶段(Tab 2)。
| Drug name | Company | Global status | Indication |
| avadomide | Bristol-Myers Squibb | Phase Ⅱ clinical trial | Cancer, leukemia |
| CC-90009 | Bristol-Myers Squibb | Phase Ⅱ clinical trial | Cancer, AML |
| CC-92480 | Bristol-Myers Squibb | Phase Ⅱ clinical trial | Cancer, myeloma |
| CC-99282 | Bristol-Myers Squibb | Phase Ⅰ clinical trial | Cancer, chronic lymphocytic leukemia |
| iberdomide | Bristol-Myers Squibb | Phase Ⅱ clinical trial | Cancer, myeloma |
| KPG-818 | Kangpu Biopharmaceuticals | Phase Ⅰ clinical trial | Blood cancer |
| lenalidomide analogue | Kangpu Biopharmaceuticals | Phase Ⅰ clinical trial | Cancer, myeloma |
| RET BiDAC | C4 Therapeutics | Preclinical | Solid tumor |
另一类基于E3泛素连接酶设计的抗癌药物是蛋白水解靶向嵌合体(proteolysis-targeting chimeras,PROTACs)。PROTACs为类哑铃结构,一端是靶向目标靶蛋白的配体,另一端是结合E3泛素连接酶的配体,再通过一定长度的linker连接。这类双功能小分子可视为双靶点药物,一端与靶蛋白结合,另一端与E3泛素连接酶结合,从而拉近患者体内靶蛋白和E3泛素连接酶的距离。E3泛素连接酶将泛素转移至靶蛋白上,使靶蛋白被标记为缺陷或受损蛋白,随后靶蛋白通过泛素-蛋白酶体途径被降解[14]。PROTACs具有开发成为治疗多种疾病的药物的潜力,但其目前主要的开发方向为抗肿瘤药物。
首个进入临床试验的PROTAC药物是Arvinas公司开发的ARV-110,用于治疗去势抵抗性前列腺癌。2019年5月,ARV-110获得FDA快速通道批准,进入临床Ⅰ期研究阶段验(NCT03888612)。2020年5月23日,Arvinas公司发布的临床Ⅰ期初始数据表明:ARV-110具有良好的口服利用度、安全性和耐受性,最大耐受剂量以及2期推荐剂量的确定仍需等待Ⅱ期临床试验结果的公布。ARV-110的作用机制是通过利用泛素-蛋白酶系统降解在前列腺癌发展中起关键作用的雄性激素受体靶点AR蛋白,同时由于其作用机制区别于传统的抑制剂,无需通过占据雄性激素受体抑制其功能而发挥抗肿瘤效果,因此ARV-110有望克服耐药性问题。Arvinas公司还开发了用于治疗乳腺癌的PROTAC药物ARV-471,也进入了临床Ⅱ期研究阶段,受疫情影响,临床有效性数据暂缓公布(NCT03888612)。
2 靶向E3泛素连接酶的阿尔茨海默病药物近年来的研究显示,阿尔茨海默病、传染性海绵状脑病、帕金森病以及亨廷顿病等许多神经退行性疾病的发病机制均与UPS功能障碍有关。UPS功能发生障碍,不能及时清理错误折叠的蛋白质而使其在细胞内积累产生细胞毒性,导致神经元细胞死亡,进而诱发某些神经退行性疾病的发生[15]。阿尔茨海默病(Alzheimer′s disease,AD)是中枢神经系统的一种进行性神经退行性疾病,主要在老年人群中发生。临床表现为记忆、注意力、判断等认知功能逐渐丧失,并伴有理解、语言、认知、推理和定向力等多种功能障碍,最终导致严重痴呆,进而严重影响日常生活能力[16]。AD患者脑内的主要病理改变包括以异常磷酸化的Tau蛋白为主的细胞内神经元纤维缠结和以β淀粉样蛋白为主的细胞外老年斑,此外也伴有特定脑区神经元及突触丢失的情况。AD的主要发病机制尚不明确,目前普遍认为Aβ、Tau蛋白异常修饰、神经细胞凋亡、氧化应激和基因等因素均与AD发生有关。
泛素-蛋白酶体系统与AD发病关系密切,其功能障碍会导致细胞内Aβ蛋白和Tau蛋白的积累,从而诱发AD。Parkin为UPS系统中的一种RING-between-RING E3连接酶,介导底物蛋白的泛素化和Aβ蛋白的降解。Lonskaya团队研究发现,E3泛素连接酶Parkin可以促进细胞内Aβ聚合物的降解,降低细胞内Aβ的水平,恢复受损的蛋白酶体活性,并通过UPS途径进一步增加Aβ的清除[17]。在AD小鼠模型中,Parkin还可通过逆转Aβ蛋白对蛋白酶体的有害影响从而改善模型小鼠受损的行为异常症状。Parkin还可以促进Beclin介导的自噬来清除Aβ蛋白[18]。以上研究均表明,E3泛素连接酶Parkin作为治疗AD药物的靶点是非常有潜力的,提高Parkin的活性或者增加Parkin的表达水平均可以作为开发AD药物治疗的新方向。
此外有临床研究发现,泛素连接酶HRD1在AD患者大脑内的表达显著降低。HRD1是细胞内质网膜定位的一种泛素连接酶,可介导多种内质网相关的异常折叠蛋白降解,促进淀粉样前体蛋白(amyloid precursor protein,APP)泛素化和降解,并减少Aβ的产生。HRD1表达受到抑制后所引起的内质网氧化应激,会导致Aβ毒性增加,诱发AD的产生。靶向HRD1开发增加HRD1表达的药物从而促进APP的泛素化以及APP降解,是开发治疗AD药物的新思路。
除针对泛素连接酶开发单靶点药物之外,以泛素连接酶为药物作用靶点的PROTAC技术应用于AD的治疗也取得了重大进展。2020年Arvinas公司发布报告称,该公司基于泛素连接酶设计的蛋白降解靶向嵌合体可降低小鼠大脑中的tau蛋白,该tau蛋白质降解剂可在外周给药并穿越血脑屏障。目前,该药物处于临床前的化合物优化阶段,尚未进入临床试验。
3 靶向E3泛素连接酶的帕金森病药物帕金森病(Parkinson′s disease,PD)是较为常见的神经系统变性疾病,病理表现为中脑黑质多巴胺能神经元进行性地变性与脱失,并伴有α-突触核蛋白、Parkin、泛素等包含体的出现。目前PD的发病机制尚不明确,一般认为是遗传因素与环境因素共同作用的结果。近年的研究发现,泛素蛋白酶体系统的功能异常是PD的发病因素之一。
泛素连接酶E3 Parkin与PD的发生关系密切。Parkin编码基因的缺失、删减及点突变会引发常染色体隐性遗传性少年型帕金森病(AR-JP)。临床研究显示,AR-JP患者脑中变性脑区和未受影响脑区Parkin的水平和酶活性均表现出明显降低。Parkin基因突变使Parkin作为连接酶的功能受到抑制,引起蛋白酶体活性降低、氧化应激水平增加及自由基介导的蛋白质和脂质的损伤,阻止底物蛋白质的泛素化及蛋白酶体的降解。蛋白底物因不能被泛素化和降解而聚集在细胞内,产生神经毒性并最终导致神经细胞的缺失[19]。因此,靶向泛素连接酶Parkin开发药物可作为治疗PD的新策略。
Arvinas公司宣布正在开发以α-突触核蛋白为靶点的蛋白降解靶向嵌合体,其基本设计思路仍然是借助E3泛素连接酶通过泛素-蛋白酶体系统促进α-突触核蛋白的降解。目前PROTAC降解剂PROTAC-A和PROTAC-B显示可以降解聚集形式的α-突触核蛋白,但仍需要更加完善的临床前研究。
4 靶向E3泛素连接酶的抗糖尿病并发症药物E3泛素连接酶在糖尿病、胰岛素抵抗和糖尿病所诱发的冠状动脉疾病中起着关键作用,在胰岛素抵抗中已普遍观察到E3泛素连接酶的异常表达。E3泛素连接酶影响胰岛素抵抗主要包括两种机制: (1)通过UPS直接降解胰岛素受体、胰岛素受体底物等关键胰岛素信号分子。(2)通过调节促炎介质因子如肿瘤坏死因子-α、白介素IL-6、IL-4、IL-13、IL-1β、单核细胞趋化蛋白-1和缺氧诱导因子1α间接参与胰岛素信号通路的调节[20]。
许多E3泛素连接酶是胰岛素抵抗治疗的潜在重要治疗靶点,近年来在糖尿病胰岛素抵抗的治疗中靶向E3泛素连接酶开发药物越来越受到关注。虽然尚未发现可以治疗胰岛素抵抗的E3泛素连接酶选择性抑制剂或活性物质,但某些可以影响胰岛素信号分子泛素化的化合物可作为开发治疗胰岛素抵抗新方法的潜在先导化合物。例如,c-Cbl RING结构域抑制剂可以改善高脂饲料诱导的小鼠肥胖和胰岛素抵抗[21]。目前,开发治疗胰岛素抵抗的靶向E3泛素连接酶药物仍在初级阶段,继续深入研究E3泛素连接酶,从而发现新的治疗靶点和开发特异性E3泛素连接酶抑制剂将会对治疗胰岛素抵抗和糖尿病具有重大意义。
此外,糖尿病已成为诱发冠心病发生的重要诱因之一,会加速冠心病的发展,导致心肌梗死、心力衰竭,甚至猝死。然而截至目前,糖尿病对冠状动脉功能的影响机制尚不完全清楚。越来越多的实验证据表明,平滑肌细胞中的冠状动脉大电导钙激活钾通道在糖尿病冠状动脉疾病的发生中可能发挥了重要作用。通过对E3连接酶的相关通路进行干预,如开发PKC的抑制剂或Nrf2的激动剂,可能对冠状动脉BK-β1蛋白质的表达起到调节作用,从而保护和改善冠状动脉血管功能。此外,激活Akt或Nrf2可通过FBXO或MuRF1通路抑制BK通道的泛素化,可能实现保护糖尿病患者冠状动脉的药理作用[22]。围绕以上靶点进行药物开发,可为糖尿病冠状动脉病变治疗药物的研发提供新策略。
5 靶向E3泛素连接酶的动脉粥样硬化药物近十年的研究发现,E3泛素连接酶Cbl-B、Itch以及GRAIL均在T细胞活化的过程中起到了重要的调节作用。RING型E3泛素连接酶Cbl-B主要在人和小鼠动脉粥样硬化斑块内的T细胞和巨噬细胞中表达。在人动脉粥样硬化斑块中,Cbl-B的表达与坏死核心大小呈负相关,这说明Cbl-B可能阻碍动脉粥样硬化的发展。在动脉粥样硬化形成的初始阶段,Cbl-B的缺乏会增加CCR1、CCR2以及CCR7等单核细胞趋化因子受体的表达,促进这些细胞向血管炎症部位聚集,增加了斑块中巨噬细胞的丰度[23]。因此,Cbl-B的缺乏会加速动脉粥样硬化的疾病进程,而增强Cbl-B的活性则可能是动脉粥样硬化的一种新治疗策略。
Itch是一种HECT E3泛素连接酶,调控T细胞活化过程,其突变会引起小鼠以及人类的多系统自身免疫疾病。Itch会促进泛素介导的IL2受体信号转导中间产物Janus激酶1的降解,进而限制T细胞增殖。Itch还可以通过调节T细胞表面受体活化,促进调节性T细胞的增殖。此外,GRAIL也是一种对T细胞活化起到调控作用的RING型E3泛素连接酶,其主要的生理作用是负调控T细胞活性。截止目前为止,尚没有研发靶向Cbl-B或GRAIL并增强其活性的药物。但随着E3泛素连接酶与动脉粥样硬化相关研究的不断深入,研发靶向E3泛素连接酶的药物将会为动脉粥样硬化的临床治疗带来新的曙光。
6 靶向E3泛素连接酶的炎症性肠病药物炎症性肠病(inflammatory bowel diseases,IBD)是一类以慢性炎症为特征的肠道类疾病,主要包括克罗恩病和溃疡性结肠炎。该类疾病迁延不愈,病变累及胃肠道多个部位,极大地降低了患者的生活质量,严重者会导致死亡。IBD的确切发病机制尚不清楚,目前的研究显示遗传因素和环境因素均会影响IBD的发病,E3泛素连接酶的异常也是引起IBD的重要因素之一。例如NF-κB信号通路参与炎性因子的转录,是调控IBD发生的重要信号通路,而多种E3泛素连接酶均可以通过影响NF-κB信号通路的泛素化修饰进而对IBD的发生产生影响[24]。泛素连接酶Itch通过干涉NOD7与RIP7的结合从而影响NF-κB信号通路的活化。泛素连接酶RNF183也会激活NF-κB信号通路从而诱发炎症性肠病。
E3泛素连接酶在炎症性肠病中的重要作用说明其作为炎症性肠病药物的开发靶点是非常有潜力的。Koutif Therapeutics公司靶向泛素连接酶开发的KT-1002是一个口服的F-box protein 3抑制剂,可以促进多种促炎蛋白降解,目前已开始克罗恩病和溃疡性结肠炎的Ⅰ期临床试验。此外,由于该药具有突出的抗炎作用,Koutif Therapeutics公司也对其在急性肺损伤、类风湿关节炎、闭塞性细支气管炎、慢性阻塞性肺疾病等炎症性疾病以及神经性疼痛方面开展了临床前研究。
7 靶向E3泛素连接酶药物研发的挑战与机遇目前处于开发阶段的靶向泛素连接酶的药物存在一定的问题:针对泛素连接酶开发的小分子抑制剂存在着脱靶情况,可能会引起毒副作用。此外,一些E3连接酶(如Cullin-RING E3泛素连接酶)是以复合体的形式发挥生理作用,泛素化过程是依赖于蛋白-蛋白相互作用进行的,不断改变的蛋白空间构象使小分子药物很难与之结合,因此这类以蛋白质复合物形式存在的E3连接酶缺少明确的小分子抑制剂结合位点。以上情况均为设计开发靶向泛素连接酶的药物带来了巨大挑战,也是近些年小分子靶向泛素连接酶抑制剂开发失败或临床试验结果不理想的重要原因。目前为止,进入临床试验阶段的靶向泛素连接酶的药物并不多。
近几年逐渐兴起的PROTAC技术则为靶向泛素连接酶药物的开发提供了新思路。PROTAC技术通过选择组织特异性或肿瘤选择性E3连接酶作为靶点设计相应的配体,可以实现对目标蛋白的选择性降解。这种蛋白质降解技术与小分子靶向泛素连接酶抑制剂相比的突出优点是PROTACs可对耐药靶点表现出特异的敏感性。与单纯的小分子抑制剂作用机制不同,PROTACs通过清除靶蛋白影响酶活性功能和非酶功能,因此该项技术有望解决抗肿瘤药物的耐药性问题[25]。PROTACs在体内还可以反复利用,并能够在较低剂量发挥出很好的疗效。但目前PROTACs也存在着一些成药性障碍:PROTACs的分子量比一般的小分子靶向泛素连接酶抑制剂更大,因此组织渗透性和细胞渗透性仍然存在较大问题,且其作为药物的临床安全性也仍然需要进一步考证。但无论如何,PROTACs为靶向泛素连接酶的药物研发提供了一种新的设计思路,值得继续深入研究。Arvinas公司研发的ARV-110及ARV-471临床试验的顺利推进也证明了PROTACs作为新型靶向泛素连接酶药物的潜力。PROTACs的广阔前景近年来吸引了众多药企投入研发。Kymera Therapeutics公司开发了靶向泛素连接酶IRAK4的PROTACs药物KYM-001,用于治疗MYD88基因突变的B细胞淋巴瘤,目前在临床前研究阶段。Nurix公司开发的用于治疗B细胞恶性肿瘤的口服BTK嵌合靶向分子以及可刺激T细胞活化和IL-2分泌的口服CBL-B连接酶抑制剂也处于临床前阶段研究阶段。进一步挖掘更多的E3连接酶作为PROTACs的开发靶点以及进一步改善药代动力学和生物利用度,将是未来的重要研发方向。
天然产物也是靶向E3泛素连接酶的药物开发的重要来源。近年来一些靶向泛素连接酶的抑制剂如密花棉毛叶菊素醋酸酯、染料木素和Suramin,以及靶向泛素连接酶的激动剂如植物生长素吲哚乙酸、茉莉酮酸酯、独角金内酯、赤霉素和冬凌草甲素,其来源均是天然产物。
8 我国研发现状及展望目前,我国各大制药企业在靶向E3泛素连接酶的药物研发方面也投入了巨大精力。除亚盛医药集团的原创新药APG-115外,国内其他药企也加大了研发力度。甘李药业2019年7月为新发现的代表化合物申请了泛素连接酶MDM2(HDM2)抑制剂专利,该化合物对SJSA-1人骨肉瘤细胞具有明显的抗增殖活性,其后续研究仍在进行中。苏州开拓药业正在研发以AR-Degrader为代表的PROTAC新药,也在临床前研究阶段,尚未进入临床研究。
9 小结E3泛素连接酶数量众多,作为很多疾病的潜在靶点,为未来多种疾病的新药发现提供可能。高通量筛选、计算机虚拟筛选技术等筛选技术的发展,加快了泛素连接酶小分子抑制剂或激动剂的发现速度,而PROTACs技术在临床的成功转化,则为靶向泛素连接酶药物的设计思想提供了新的思路和线索。这些进展都将对靶向泛素连接酶药物的开发以及提高靶向泛素连接酶药物的临床安全性起到极大的推进和鼓舞作用。
目前针对泛素连接酶开发靶向药物主要围绕抗癌药物展开,但随着近些年的研究深入,泛素连接酶在神经退行性疾病、糖尿病、炎症及自身免疫性疾病等方面的重要程度日益凸显。大量实验证据初步显示,一些泛素连接酶抑制剂或激动剂确实在治疗这些疾病方面表现出了良好的先导化合物活性。这提示研究者应该更加关注泛素连接酶作为神经退行性疾病、糖尿病等疾病的治疗靶点的可能,这将会为这些疾病的新药开发带来新思路。泛素连接酶数量众多,进一步深入研究泛素连接酶在疾病发生过程中所发挥的作用,并发掘更多可作为疾病药物开发靶点的E3泛素连接酶,也是未来的努力方向。此外,我国在天然产物的研究与开发方面具有突出的优势,值得深入挖掘。借助高通量筛选以及计算机模拟对接技术以各泛素连接酶对天然产物库进行筛选,并更加侧重这些天然产物作为E3泛素连接酶抑制剂或激动剂的可能性,将为来源于天然产物的靶向泛素连接酶的小分子药物的发现提供机遇。
| [1] |
Metzger M B, Hristova V A, Weissman A M. HECT and RING finger families of E3 ubiquitin ligases at a glance[J]. J Cell Sci, 2012, 125(Pt 3): 531-7. |
| [2] |
Uchida C, Kitagawa M. RING-, HECT-, and RBR-type E3 ubiquitin ligases: Involvement in human cancer[J]. Curr Cancer Drug Targets, 2016, 16(2): 157-74. doi:10.2174/1568009616666151112122801 |
| [3] |
范广晗, 朱虹, 方倚正, 等. 去泛素化酶在肿瘤中的作用及其抑制剂相关研究进展[J]. 药学学报, 2018, 53(2): 169-76. Fan G H, Zhu H, Fang Y Z, et al. The roles of deubiquitinating enzymes in cancer therapy[J]. Acta Pharm Sin, 2018, 53(2): 169-76. |
| [4] |
张均平, 夏爱娟, 许瑞安. E3连接酶HUWE1与真核翻译起始因子eIF4E的相互作用[J]. 药学学报, 2014, 49(11): 1543-6. Zhang J P, Xia A J, Xu R A. Interaction of E3 ligase HUWE1 and eukaryotic translation initiation factor eIF4E[J]. Acta Pharm Sin, 2014, 49(11): 1543-6. |
| [5] |
Sui P, Li R, Zhang Y, et al. E3 ubiquitin ligase MDM2 acts through p53 to control respiratory progenitor cell number and lung size[J]. Development, 2019, 146(24): dev179820. |
| [6] |
Tabernero J, Dirix L, Schöffski P, et al. A phase Ⅰ first-in-human pharmacokinetic and pharmacodynamic study of serdemetan in patients with advanced solid tumors[J]. Clin Cancer Res, 2011, 17(19): 6313-21. doi:10.1158/1078-0432.CCR-11-1101 |
| [7] |
Seipel K, Marques M A T, Sidler C, et al. MDM2- and FLT3-inhibitors in the treatment of FLT3-ITD acute myeloid leukemia, specificity and efficacy of NVP-HDM201 and midostaurin[J]. Haematologica, 2018, 103(11): 1862-72. doi:10.3324/haematol.2018.191650 |
| [8] |
Gounder M M, Bauer T M, Schwartz G K, et al. A phase 1 study of the MDM2 inhibitor DS-3032b in patients (pts) with advanced solid tumors and lymphomas[J]. J Clin Oncol, 2016, 34: 2581. doi:10.1200/JCO.2016.34.15_suppl.2581 |
| [9] |
Skaar J R, Pagan J K, Pagano M. Mechanisms and function of substrate recruitment by F-box proteins[J]. Nat Rev Mol Cell Biol, 2013, 14(6): 369-81. doi:10.1038/nrm3582 |
| [10] |
Chen Q, Xie W, Kuhn D J, et al. Targeting the p27 E3 ligase SCF(Skp2) results in p27- and Skp2-mediated cell-cycle arrest and activation of autophagy[J]. Blood, 2008, 111(9): 4690-9. doi:10.1182/blood-2007-09-112904 |
| [11] |
Wu L, Grigoryan A V, Li Y, et al. Specific small molecule inhibitors of Skp2-mediated p27 degradation[J]. Chem Biol, 2012, 19(12): 1515-24. doi:10.1016/j.chembiol.2012.09.015 |
| [12] |
Chan C H, Morrow J K, Li C F, et al. Pharmacological inactivation of Skp2 SCF ubiquitin ligase restricts cancer stem cell traits and cancer progression[J]. Cell, 2013, 154(3): 556-68. doi:10.1016/j.cell.2013.06.048 |
| [13] |
Blees J S, Bokesch H R, Rübsamen D, et al. Erioflorin stabilizes the tumor suppressor Pdcd4 by inhibiting its interaction with the E3-ligase β-TrCP1[J]. PloS one, 2012, 7(10): e46567. doi:10.1371/journal.pone.0046567 |
| [14] |
Sun X, Gao H, Yang Y, et al. PROTACs: Great opportunities for academia and industry[J]. Signal Transduct Target Ther, 2019, 4(64): 1-33. |
| [15] |
Desai S, Juncker M, Kim C. Regulation of mitophagy by the ubiquitin pathway in neurodegenerative diseases[J]. Exp Biol Med (Maywood), 2018, 243(6): 554-62. doi:10.1177/1535370217752351 |
| [16] |
Uddin M S, Kabir M T. Emerging signal regulating potential of genistein against Alzheimer's disease: A promising molecule of interest[J]. Front Cell Dev Biol, 2019, 7: 197. doi:10.3389/fcell.2019.00197 |
| [17] |
Lonskaya I, Hebron M L, Desforges N M, et al. Nilotinib-induced autophagic changes increase endogenous parkin level and ubiquitination, leading to amyloid clearance[J]. J Mol Med (Berl), 2014, 92(4): 373-86. doi:10.1007/s00109-013-1112-3 |
| [18] |
Khandelwal P J, Herman A M, Hoe H S, et al. Parkin mediates beclin-dependent autophagic clearance of defective mitochondria and ubiquitinated Abeta in AD models[J]. Hum Mol Genet, 2011, 20(11): 2091-102. doi:10.1093/hmg/ddr091 |
| [19] |
姜懿纳, 娄钰霞, 张钊, 等. Parkin相关疾病的研究进展[J]. 中国药理学通报, 2016, 32(4): 455-8. Jiang Y N, Lou Y X, Zhang Z, et al. Some diseases caused by Parkin[J]. Chin Pharmacol Bull, 2016, 32(4): 455-8. doi:10.3969/j.issn.1001-1978.2016.04.003 |
| [20] |
Yang X D, Xiang D X, Yang Y Y. Role of E3 ubiquitin ligases in insulin resistance[J]. Diabetes Obes Metab, 2016, 18(8): 747-54. doi:10.1111/dom.12677 |
| [21] |
Wu M, Sun L, Pessetto Z Y, et al. Casitas B-lineage lymphoma RING domain inhibitors protect mice against high-fat diet-induced obesity and insulin resistance[J]. PloS one, 2015, 10(8): e0135916. doi:10.1371/journal.pone.0135916 |
| [22] |
Lu T, Sun X, Li Y, et al. Role of Nrf2 signaling in the regulation of vascular BK channel β1 subunit expression and BK channel function in high-fat diet-induced diabetic mice[J]. Diabetes, 2017, 66(10): 2681-90. doi:10.2337/db17-0181 |
| [23] |
Seijkens T T P, Poels K, Meiler S, et al. Deficiency of the T cell regulator Casitas B-cell lymphoma-B aggravates atherosclerosis by inducing CD8+ T cell-mediated macrophage death[J]. Eur Heart J, 2019, 40(4): 372-82. doi:10.1093/eurheartj/ehy714 |
| [24] |
Tao M, Scacheri P C, Marinis J M, et al. ITCH K63-ubiquitinates the NOD2 binding protein, RIP2, to influence inflammatory signaling pathways[J]. Curr Biol, 2009, 19(15): 1255-63. doi:10.1016/j.cub.2009.06.038 |
| [25] |
Zou Y, Ma D, Wang Y. The PROTAC technology in drug development[J]. Cell Biochem Funct, 2019, 37(1): 21-30. doi:10.1002/cbf.3369 |

