

毛晓健(1967-),女,硕士,教授,硕士生导师,研究方向:临床中药学,中药药理学,通讯作者,E-mail: 1224346204@qq.com
溃疡性结肠炎(ulcerative colitis,UC)是炎症性肠病的主要类型之一,病变多从直肠开始,逆向发展累及近端结肠,持续的结肠黏膜炎症引起反复发作的腹痛、腹泻、便血、体质量减轻等临床表现。近年来,UC持续增高的发病率及难以治愈的特点使其受到越来越多研究者的关注。随着研究的进展,已有多种方式可用于诱导实验性UC[1-2],其中,葡聚糖硫酸钠(dextran sulfate sodium,DSS)是应用最广泛的诱导剂,以2.0%-5.0% DSS水溶液自由饮用法较为常见[3]。但由于自由饮用方式下,实验动物摄入DSS量不明确,模型的稳定性和动物间表现的均一性受到不少质疑。本实验选用C57 BL/6小鼠,设置3%及4% DSS溶液自由饮用组和30%及40% DSS溶液灌胃组,其中,30% DSS灌胃组和40% DSS溶液灌胃组的灌胃剂量分别与3% DSS饮用组和4% DSS饮用组小鼠前1 d摄入DSS的平均剂量相等,以4种不同方式诱导小鼠急性UC模型,通过观察比较动物存活率、成模情况和关键指标数据离散程度,优选出成模高效、稳定、可操作性强的模型制备方式。
1 材料 1.1 实验动物C57 BL/6小鼠,♂,SPF级,体质量(20±2) g,购自辽宁长生生物技术股份有限公司,许可证号:SCXK(辽)2015-0001。实验室条件下适应性喂养1周。实验方法及条件经云南中医药大学动物实验中心伦理委员会审查合格,动物伦理审查文件编号:R-06201934。
1.2 试剂0.9%氯化钠注射液(昆明南疆制药有限公司,批号C190521C),DSS (3.6×104-5.0×104,MP Biomedicals公司,批号Q8378),通用型组织固定液(武汉塞维尔生物科技有限公司,批号HJ194602)。
1.3 仪器万分之一电子天平(BT 124S北京赛多利斯仪器系统有限公司),超纯水系统(Milli-Q Academic A10,美国Millipore公司),超低温冰箱(赛默飞世尔科技(中国)有限公司)。
2 方法 2.1 实验动物分组及造模方式C57 BL/6雄性小鼠60只,随机分为正常组、3% DSS溶液自由饮用组、4% DSS溶液自由饮用组、30% DSS溶液灌胃组、40% DSS溶液灌胃组,每组12只。实验从d 0开始造模,24 h后记为d 1,以此类推。灌胃组实验开始时间晚于自由饮用组1 d。30%灌胃组灌胃剂量与3%自由饮用组小鼠前1 d摄入DSS的平均剂量相等;40%灌胃组灌胃剂量与4%自由饮用组小鼠前1 d摄入DSS的平均剂量相等。每日用量筒测量并计算自由饮用组前1 d饮用量,按以下公式计算灌胃组的灌胃体积。配制30%及40%的DSS溶液,灌胃给予相应体积的DSS溶液,每天1次。
2.2 小鼠UC模型的诱导除正常组外,各组采用对应方式给予DSS,于小鼠开始出现明显便血时停止造模,并继续喂养至d 10处死。自由饮用组DSS溶液每2 d更换1次。
2.3 小鼠一般情况观察及DAI评分记录每天记录小鼠体质量、食量、毛色、精神状态、粪便情况等。参考疾病活动指数(DAI)评分规则[4]对小鼠体质量、粪便性状及大便隐血情况进行评分。
2.4 样本采集小鼠处死后,打开腹腔,分离并剪取整段结肠,整齐摆放于滤纸上,测量结肠长度并记录。小心剪取结肠中间部位约0.5-1.0 cm,生理盐水迅速漂洗后置通用型组织固定液中固定过夜。随后剪取小鼠肝脏、肾脏、脾脏、胸腺进行称重并记录,以脏器与体质量的比值作为脏器指数。
2.5 结肠病理组织切片制作及评分组织固定完全后,常规脱水、包埋、切片、染色。参考文献方法[3],镜下观察结肠组织炎症程度、隐窝损伤、炎症深度、炎症浸润面积和病变深度并评分。
2.6 数据统计分析实验数据采用SPSS 21.0进行分析处理,以x±s表示,采用单因素方差分析方法(ANOVA)进行分析。数据预先用Homogeneity of Variances进行方差齐性分析,方差齐则进行LSD检验,方差不齐则进行Tamhane′s T2检验。
3 结果 3.1 小鼠死亡情况至实验d 6,除正常组外,各组小鼠普遍可见血便,提示造模成功,开始出现小鼠死亡,40%灌胃组d 6死亡5只,d 7死亡1只,至d 10死亡率达50%;30%灌胃组d 6、8、9各死亡1只,死亡率为25%。3%自由饮用组和4%自由饮用组至实验d 10均无小鼠死亡。
3.2 UC诱导情况自由饮用方式下,3%浓度组与4%浓度组对比:两组小鼠体质量及DAI评分均显著高于正常组(Fig 1A, 1C)。4%浓度组体质量于d 4开始下降,3%浓度组于d 5开始下降;两组DAI评分均于d 5达到最高值,3%浓度组总体高于4%浓度组,在d 5差异有显著性(P<0.01)(Fig 1A,1C)。
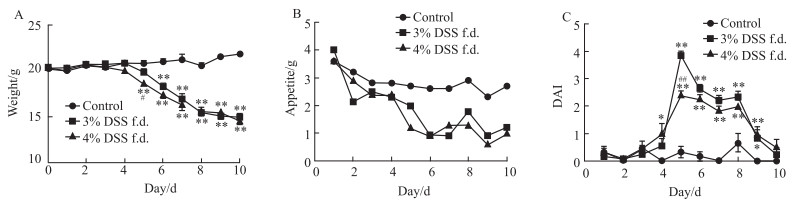
|
| Fig 1 Body weight, appetite and DAI of mice under free drinking condition(x±s, n=12) f.d., free drinking.*P < 0.05, **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs 3% DSS f.d. group |
灌胃方式下,30%浓度组与40%浓度组对比:40%浓度组体质量于d 6显著低于30%浓度组(P<0.05),DAI评分于d 4显著高于30%浓度组(P<0.01)(Fig 2A, 2C)。
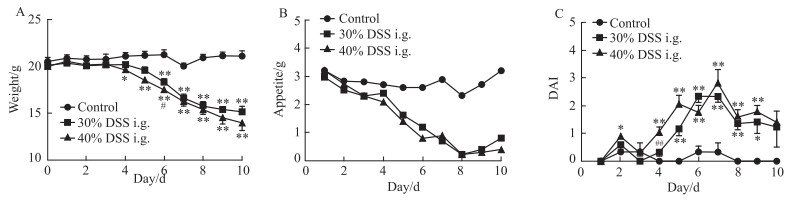
|
| Fig 2 Body weight, appetite and DAI of mice under intragastric condition(x±s, n=12) i.g., intragastric.*P < 0.05, **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs 30% DSS i.g. group |
相同剂量下,30%灌胃和3%自由饮用两种造模方式对比:两组小鼠体质量呈相似下降趋势,从d 7起,灌胃组食量低于饮用组,饮用组及灌胃组DAI评分分别于d 5和d 6达到最高(Fig 3A, 3B, 3C),饮用组DAI评分于d 5、8显著高于灌胃组(P<0.05,P<0.01)(Fig 3C)。
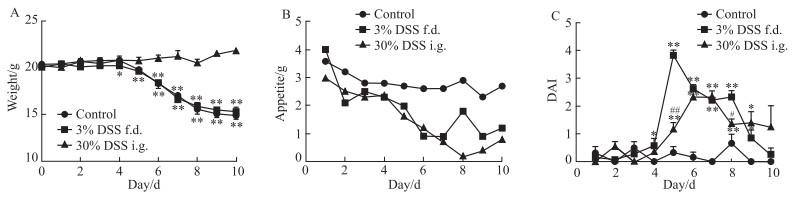
|
| Fig 3 Body weight, appetite and DAI of mice under the same dosage, with different administration methods(x±s, n=12) f.d., free drinking; i.g., intragastric.*P < 0.05, **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs 3% DSS f.d. group |
相同剂量下,40%灌胃和4%自由饮用两种造模方式对比:两组小鼠体质量呈相似下降趋势,灌胃组DAI分别于d 2、7、9显著高于饮用组(P<0.05,P<0.01)(Fig 4A, 4B, 4C)。
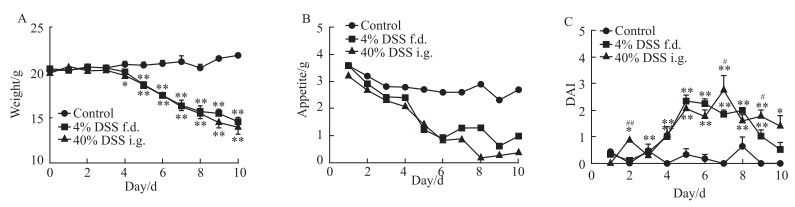
|
| Fig 4 Body weight, appetite and DAI of mice under the same dosage, with different administration methods(x±s, n=12) f.d., free drinking; i.g., intragastric.*P < 0.05, **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs 4% DSS f.d. group |
结肠大体观察及组织病理学观察发现,与正常组相比,4个造模组结肠长度均显著降低,出现不同程度的上皮结构破坏、炎性细胞浸润、结缔组织增生等病理变化,组织病理学评分均显著升高。自由饮用方式下,4%浓度组病理学评分高于3%浓度组(P<0.01);相同剂量下,30%灌胃组高于3%自由饮用组(P<0.01)(Fig 5A, 5B)。
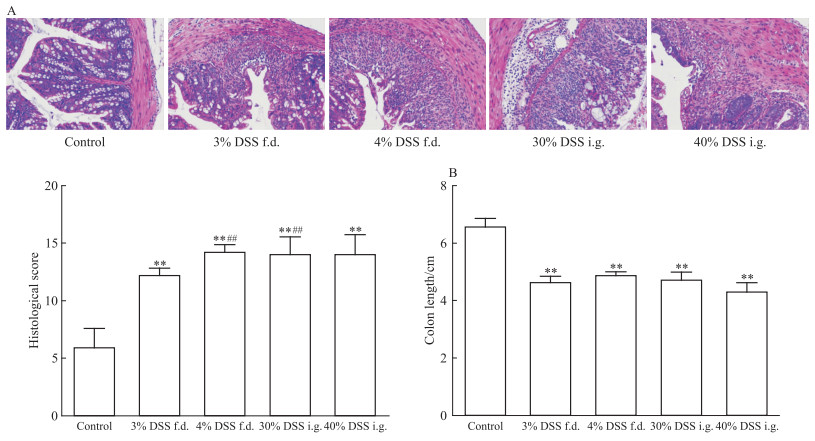
|
| 图 5 Histological changes(A) and colon lengths(B) under different administration methods(x±s, n=12) f.d., free drinking; i.g., intragastric.**P < 0.01 vs control; ##P < 0.01 vs 3% DSS f.d. group |
从脏器指数看,与正常组相比,各造模组肝脏指数无明显变化,胸腺指数显著降低(P<0.01)(Fig 6);肾脏指数中,4%自由饮用组、30%灌胃组及40%灌胃组均有显著升高(P<0.05,P<0.01)(Fig 6B);4%自由饮用组脾脏指数显著升高(P<0.01)(Fig 6C)。相同剂量下,30%灌胃组肾脏指数显著高于3%自由饮用组(P<0.05);40%灌胃组脾脏指数显著低于4%自由饮用组(P<0.01)(Fig 6C)。自由饮用方式下,4%浓度组脾脏指数显著高于3%浓度组(P<0.01)(Fig 6C)。
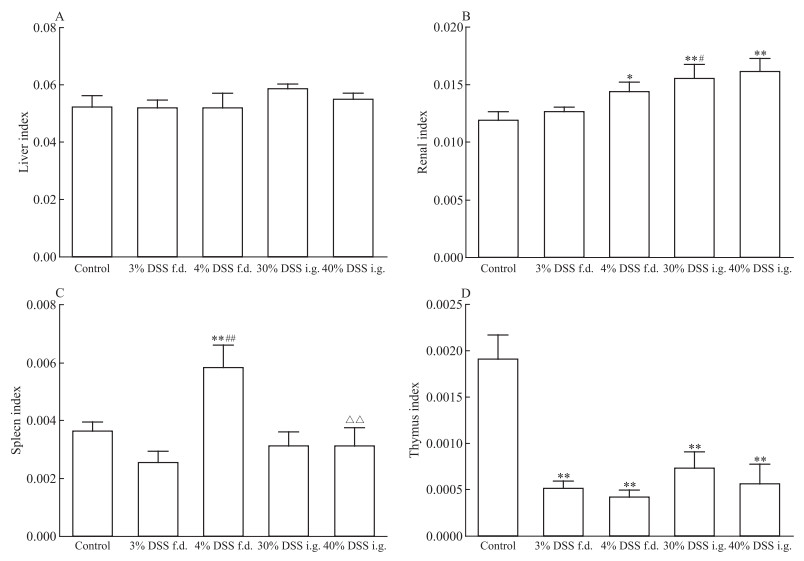
|
| Fig 6 Organ indexes of mice under different administration methods(x±s, n=12) f.d., free drinking; i.g., intragastric.*P < 0.05, **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs 3% DSS f.d. group; △△P < 0.01 vs 4% DSS f.d. group |
为比较不同浓度及不同造模方式下动物间表现的均一性,计算体质量、DAI评分、脏器指数、结肠长度和组织病理学评分的变异系数。自由饮用方式下,3%与4%浓度组体质量变异系数变化趋势相似,4%浓度组于d 8、9略高于3%浓度组(Fig 7A);灌胃方式下,40%浓度组体质量变异系数于d 9、10高于30%浓度45%以上(Fig 7C)。相同剂量下,从d 5起,3%自由饮用组体质量变异系数高于30%灌胃组(Fig 7E);40%灌胃组体质量变异系数于d 10高于4%自由饮用组45%以上(Fig 7G)。
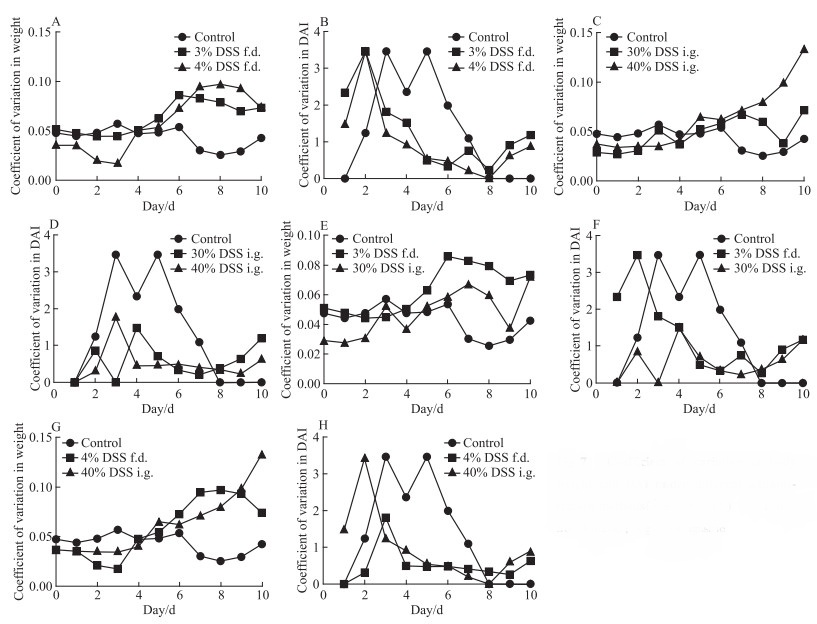
|
| Fig 7 Coefficient of variation of body weight and DAI under different administration methods(x±s, n=12) f.d., free drinking; i.g., intragastric |
DAI评分变异系数显示,自由饮用方式下,3%与4%浓度组变异系数从d 2起无较大差异(Fig 7B);灌胃方式下,d 3,40%浓度组高于30%浓度组,其余时间无较大差别(Fig 7D)。相同剂量下,3%自由饮用和30%灌胃组,前3 d自由饮用组变异系数高于灌胃组,d 4-d 10均无较大差别(Fig 7F);4%自由饮用和40%灌胃组,d 1、2自由饮用组变异系数高于灌胃组,d 4-d 10均无较大差别(Fig 7H)。
脏器指数、结肠长度及病理学评分变异系数显示,各饮用组胸腺指数变异系数均略高于灌胃组;各组结肠长度变异系数无较大差别。自由饮用方式下,3%浓度组病理学评分变异系数高于4%浓度组;相同剂量下,3%自由饮用和30%灌胃组病理学评分变异系数无较大差别,40%灌胃组病理学评分变异系数高于4%自由饮用组(Fig 8)。
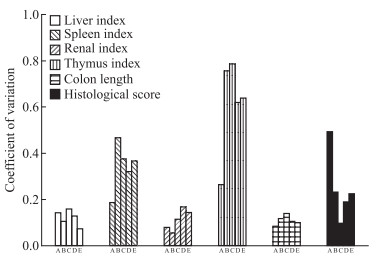
|
| Fig 8 Coefficient of variation of organ index and colonlengths under different administration methods(x±s, n=12) A: Control; B: 3% DSS free drinking; C: 4% DSS free drinking; D: 30% DSS intragastric; E: 40% DSS intragastric |
本实验采用3%和4% DSS溶液自由饮用、30%和40% DSS溶液灌胃4种方式建立小鼠UC模型,其中,30% 灌胃组和40%灌胃组灌胃剂量分别与3%饮用组和4%饮用组小鼠前1 d摄入DSS的平均剂量相等。通过一般体征,DAI评分、结肠长度、结肠组织病理学评分等指标评价模型复制情况,并通过上述指标值的变异系数比较各造模方式下动物间表现的均一性和模型稳定性。结果发现,4种造模方式均能成功诱导UC模型,表现为显著降低小鼠体质量及结肠长度,升高DAI评分及结肠组织病理学评分等。其中,仅在结肠组织病理学评分方面,30%灌胃组高于3%饮用组,4%饮用组高于3%饮用组,其余指标未表现出显著的严重程度差别。观察还发现,30%灌胃组、40%灌胃组死亡率分别为25%、50%,饮用组无死亡,因此,自由饮用方式在实验数据采集、样本收集方面有明显优势。
临床观察发现,重症UC病人可累及肝脏、肾脏与脾脏等器官,可能导致脏器积水,而胸腺为人体质量要免疫器官,UC状态下受损时可发生萎缩[5]。本实验发现,UC小鼠胸腺指数较正常小鼠显著降低,但各造模方式间差异无显著性;脾指数4%饮用组高于3%饮用组,40%灌胃组高于4%饮用组;30%灌胃组肾脏指数高于3%饮用组。
变异系数是评价样本数据离散程度的重要指标。通过比较不同浓度及不同造模方式,尤其是相同剂量下自由饮用和灌胃方式各关键指标的变异系数发现,小鼠出现明显便血(约实验d 6)开始,自由饮用组体质量变异系数总体略高于灌胃组,但DAI评分变异系数无明显差别;结肠长度变异系数在相同剂量自由饮用组和灌胃组间无较大差异;组织病理学评分变异系数3%自由饮用组略高于30%灌胃组,40%灌胃组约为4%自由饮用组的2倍。由此可见,在模型关键评价指标方面,灌胃组动物间表现的均一程度并不优于自由饮用组。
在DSS口服诱导急性UC模型的应用中,尽管2.0%-5.0% DSS水溶液自由饮用是推荐的最为常见的方式,但在实践中仍受到关于模型稳定性和动物间表现均一性的质疑。已有研究对自由饮用和灌胃两种方式进行了比较,发现3%DSS自由饮用组小鼠多项模型评价指标变异系数明显高于灌胃组(DSS灌胃剂量始终为4 g·kg-1)[6]。本实验室在前期实验中发现,自由饮用下,模型组小鼠的饮水体积随着DSS的摄入表现出显著下降趋势,其下降幅度明显超过体质量降低幅度。以3%DSS溶液自由饮用为例,实验d 5,小鼠平均饮水量约为d 0的0.33倍,平均体质量约为d 0的0.97倍,由此可见,在造模过程中,小鼠每天摄入DSS的量是动态变化的。
因此,在本实验中,灌胃组晚于自由饮用组1 d开始给予DSS,灌胃剂量根据自由饮用组小鼠前1 d摄入DSS的平均剂量进行调整,即30%灌胃组和40%灌胃组灌胃剂量分别与3%饮用组和4%饮用组小鼠前1 d摄入DSS的平均剂量相等,尽可能模拟由已造成的损伤导致的饮水量和DSS实际摄入量的动态变化。结果显示,相同剂量下,灌胃组多项指标在动物间的均一性,并未明显优于自由饮用组。究其原因,可能由于DSS摄入量超阈值后,总摄入量上较小的差异不会带来模型严重程度的显著差异[7],或由于模型严重程度取决于用于造模的DSS浓度,而非DSS总摄入量[8-9]。另外,综合考虑造模小鼠饮水量下降幅度远大于体质量降低幅度的现象和本次实验的结论,我们推测,在自由饮用DSS溶液造模过程中,小鼠个体差异带来不同程度的结肠炎症及一般体征改变,同时导致不同程度的饮水量变化,进而影响后续DSS实际摄入剂量,比如结肠炎症相对严重的小鼠,饮水量降低程度更大,相应的,摄入DSS的剂量表现为更大程度的减少,在整个造模周期中,表现出DSS摄入剂量的动态调整,转而在一定程度上减轻了个体差异。
综上所述,与灌胃法相比,3%和4% DSS溶液自由饮用能成功诱导小鼠UC模型,且动物间表现较均一、死亡率低、操作方便,在UC模型制备中具有明显优势;与3% DSS溶液自由饮用相比,4%自由饮用组各项指标未见显著优势,综合考虑实验成本,3% DSS溶液自由饮用法是小鼠急性UC模型较合适的制备方法。
| [1] |
崔国宁, 刘喜平, 董俊刚, 曾庆涛. 溃疡性结肠炎模型建立方法研究进展[J]. 今日药学, 2018, 28(4): 280-4. Cui G N, Liu X P, Dong J G, Zeng Q T. The reasearch progress of the method in the establishment of ulcerative colitis model[J]. Pharm Today, 2018, 28(4): 280-4. |
| [2] |
卢倩, 孙敏哲, 杜雯雯, 等. 复方蜚蠊提取物PB对异体抗原联合醋酸诱导大鼠慢性溃疡性结肠炎的作用机制[J]. 中国药理学通报, 2019, 35(9): 1296-301. Lu Q, Sun M Z, Du W W, et al. Study on mechanism of action of Blattidae compound PB against chronic ulcerative colitis induced by alloantigen and acetic acid in rats[J]. Chin Pharmacol Bull, 2019, 35(9): 1296-301. doi:10.3969/j.issn.1001-1978.2019.09.021 |
| [3] |
Chassaing B, Aitken J D, Malleshappa M, Vijay-Kumar M. Dextran sulfate sodium(DSS)-induced colitis in mice[J]. Curr Protoc Immunol, 2014, 104(1): 15.25: 1-14.
|
| [4] |
Kim J J, Shajib M S, Manocha M M, Khan W I. Investigating intestinal inflammation in DSS-induced model of IBD[J]. J Vis Exp, 2012, 139(60): 3678. |
| [5] |
Eisenstein M. Ulcerative colitis: Towards remission[J]. Nature, 2018, 563(7730): S33. doi:10.1038/d41586-018-07276-2 |
| [6] |
衡宇, 李晰, 孙涛, 等. 葡聚糖硫酸钠自由饮用与灌胃诱导小鼠溃疡性结肠炎模型的对比研究[J]. 中国药师, 2017, 20(4): 603-6. Heng Y, Li X, Sun T, et al. Comparison of ulcerative colitis models respectively induced by free drinking and intragastric administration of dextran sodium sulfate in mice[J]. Chin Pharm, 2017, 20(4): 603-6. doi:10.3969/j.issn.1008-049X.2017.04.002 |
| [7] |
Vowinkel T, Kalogeris T J, Mori M, et al. Impact of dextran sulfate sodium load on the severity of inflammation in experimental colitis[J]. Dig Dis Sci, 2004, 49(4): 556-64. doi:10.1023/B:DDAS.0000026298.72088.f7 |
| [8] |
Egger B, Bajaj-Elliott M, Mac Donald T T, et al. Characterisation of acute murine dextran sodium sulphate colitis: Cytokine profile and dose dependency[J]. Digestion, 2000, 62(40): 240-8. |
| [9] |
李欣, 武文卿, 张卓超, 等. 不同浓度葡聚糖硫酸钠对小鼠炎症性肠病模型建立及其致病相关免疫因子表达的影响[J]. 中国实验动物学报, 2015, 23(4): 336-41. Li X, Wu W Q, Zhang Z C, et al. Influence of different concentrations of dextran sulfate sodium on the establishment of inflammatory bowel disease model and the expression of colitis-associated immune factors in mice[J]. Acta Lab Anim Sci Sin, 2015, 23(4): 336-41. doi:10.3969/j.issn.1005-4847.2015.04.002 |

