

2. 安徽医科大学第二附属医院妇产科,医学安徽省普通高校重点实验室,安徽 合肥 230601;
3. 安徽医科大学第二附属医院麻醉与围术期 医学安徽省普通高校重点实验室,安徽 合肥 230601
2. Dept of Gynaecology and Obstetrics, the Second Hospital of Anhui Medical University, Anhui Medical University, Hefei 230601, China;
3. Dept of Key Laboratory of Anesthesiology and Perioperative Medicine of Anhui Higher Education Institutes, Anhui Medical University, Hefei 230601, China
骨关节炎(osteoarthritis,OA)是一种慢性退行性疾病,被认为2020年致残的4个主要因素之一,并影响着全世界四分之一的中、老年人群[1]。OA临床上主要症状为关节疼痛、僵硬甚至残疾,其病理为进行性关节软骨降解、骨赘形成、软骨下骨重建和滑膜炎症[2]。OA的发病机制是多因素和复杂的,受维持关节损伤发展的信号级联反应激活的影响,在OA疾病的发展中,已经牵涉到活性氧(ROS)和相关信号通路的改变[3]。尽管长期以来首先将其归类为一种主要是非炎症性的关节疾病,其研究重点是生物力学方面和磨损和撕裂的不平衡,但是最新的免疫学的研究有助于改善对该疾病的解释[4]。脂多糖(lipopolysaccharide,LPS)也称为内毒素,是革兰氏阴性菌的外膜成分,在组成性产生的外膜小泡中释放,小泡中也含有蛋白质。脂多糖在L929细胞核和巨噬细胞中诱导自噬[5],在Xue等[6]的研究中发现抑制PI3K/AKT/mTOR信号通路促进骨关节炎大鼠关节软骨细胞自噬并且减轻了炎症反应。也有研究表明抑制PI3K/Akt信号通路可以改善骨关节炎的进展[7]。
白杨素(chrysin,CHR)属于植物类黄酮化合物,它广泛存在于蜂胶、蜂蜜、百香果中,甚至存在于蘑菇和其他植物来源中,抗氧化、抗炎、抗癌和抗病毒的活性,同时已被广泛用于各种退行性疾病的治疗,因此拥有巨大的经济价值和药用价值[8, 9]。有文献报道,在OA的过程中伴随着软骨细细胞自噬,但白杨素对OA的治疗作用暂未有文献报道,且白杨素对自噬的作用机制尚未阐明,因此本研究旨在探索白杨素对LPS诱导软骨细胞自噬的作用和机制。
1 材料 1.1 药品与主要试剂白杨素(纯度≥99.8%)(货号:HY-14589):购自Med Chem Express公司;脂多糖(货号:SMB00610):美国Sigma公司;DMEM培养基(货号:10565018):美国Gibco公司;CCK-8(货号:BS350B):北京兰杰柯科技有限公司;活性氧检测试剂盒(货号:S0033S)、RIPA裂解液(货号:P0013C)、SDS-PAGE蛋白上样缓冲液(货号:P0015A)、BCA测定蛋白浓度试剂盒(货号:P0012S):上海碧云天生物技术有限公司;β-actin一抗(货号:ab8226)、PI3K一抗(货号:ab191606)、p-PI3K一抗(货号:ab182651)、LC3B一抗(货号:ab192890)、Beclin-1一抗(货号:ab210498):购于英国Abcam公司;AKT一抗(货号:AF6261)、p-AKT一抗(货号:AF0016):购于美国Affinity公司。
1.2 主要仪器倒置荧光显微镜(日本Olympus);正置荧光显微镜(德国Zeiss);全波长全自动酶标仪(美国Thermo);CO2培养箱(美国Thermo)。
2 方法 2.1 大鼠软骨细胞分离、培养和传代软骨细胞的提取:SPF级健康SD大鼠10只,♂,4周龄,体质量110-130 g,购自山东省朋悦实验动物繁育有限公司,合格证号:SCXK(鲁)20190003,大鼠分别饲养于室温18 ℃-25 ℃的干燥层流室内,颈椎脱位处死大鼠,将其浸泡于含75%医用酒精中20 min。在无菌培养皿中加入含有1%双抗的完全培养基。在无菌条件下将大鼠下肢截取,去除脂肪组织,同时将分离的膝关节留在培养皿上。分离关节软骨,切除关节软骨面和股骨头,获得肱骨头表面软骨。软骨用培养基冲洗3次,然后用眼用剪刀切成1 mm3大小。再加入含0.25 % EDTA的胰蛋白酶,在37 ℃孵箱中消化软骨组织,并轻轻摇晃1次。孵育30 min后加入新鲜培养基终止消化,后加入0.2% Ⅱ型胶原酶,37 ℃孵育4 h,用200目无菌尼龙网过筛,1 800 r·min-1离心5 min。随后,去掉上清液,加入适量的新鲜培养基制备细胞悬液。细胞接种于25 cm2的培养瓶中,37 ℃,5% CO2进行原代培养。隔天更换培养基,倒置显微镜观察细胞生长情况。当细胞融合率达到80%时进行传代培养。去掉培养瓶中的培养基,用PBS洗涤细胞2次,加入含0.25%EDTA胰蛋白酶1 mL后在显微镜下观察细胞形态。在1 800 r·min-1离心5 min后,去掉上清液,将细胞重新悬浮在新鲜的完全培养基中,使其充分混合。最后,将细胞传代到培养瓶中进行培养。
2.2 分组实验分为四组,分别为空白对照组、LPS组、白杨素(CHR)组和LPS+CHR组,其中空白对照组仅加入完全培养基,LPS组加入LPS,CHR组加入白杨素,CHR+LPS组加入LPS与白杨素。
2.3 大鼠软骨细胞的鉴定 2.3.1 甲苯胺蓝染色将大鼠第3代关节软骨细胞接种于有盖玻片(4%多聚赖氨酸处理过)的六孔板中,每孔5×104个细胞,24 h后观察细胞贴壁情况,并更换培养液,3 d更换1次培养液,倒置显微镜下观察并摄片记录。当细胞铺满盖玻片60%-70%时取出盖玻片,用PBS漂洗玻片3次,滴加4%多聚甲醛,在室温下固定1 h,再用PBS缓冲液漂洗玻片3次,加入2%甲苯胺蓝染色液室温放置1 h,然后用双蒸水漂洗至蓝色基本消失,晾干后用中性树脂封片,倒置显微镜观察收集图像。
2.3.2 二型胶原免疫组织化学染色将大鼠第3代关节软骨细胞接种于有盖玻片(4%多聚赖氨酸处理过)的6孔板中,每孔5×104个细胞,24 h后用10%多聚甲醛固定40 min,用PBS冲洗3次,每次3 min。之后添加50 mL 0.1% TritonX-100,并用PBS进行漂洗。细胞在室温下用3% H2O2孵育10 min,用PBS进行洗涤3次。去除PBS缓冲液后,加入50 mL 5%封闭液室温孵育30 min,向玻片中加入50 mL一抗(1 ∶200),并在4 ℃下孵育过夜,然后用PBS清洗3次,每次3 min。加入50 mL的二抗室温孵育30 min,用PBS洗涤。加入100 mL新制备的二氨基联苯胺(DAB)溶液进行显微镜观察。盖玻片用自来水轻轻冲洗,细胞样本用苏木精复染1 min,用自来水冲洗,盖玻片置于分级酒精中脱水。干燥的盖玻片用二甲苯透明处理,并用中性树脂粘合,将制备好的样品用倒置显微镜观察收集图像。
2.4 白杨素剂量的筛选传代至第二代的软骨细胞在96孔板(每孔5×104个细胞)中培养24 h,加入LPS(100 μg·L-1), 然后继续在不同浓度的白杨素(0、5、10、20、40、80 mmol·L-1)中分别培养24 h、48 h。在规定的时间,用PBS清洗细胞,每孔添加100 μL DMEM,将10 μL的CCK-8溶液加入每个孔中,并在37 ℃培养箱中培养1 h。然后使用全自动酶标仪检测,激发波长450 nm,重复3次以上实验。
2.5 活性氧ROS的检测取对数生长期的细胞,以2×106个·L-1的密度接种于6孔板,分别设置空白组(未处理)、模型组(LPS处理)、加药组(CHR)、实验组(LPS+ CHR),预孵育LPS 2 h,CHR处理24 h,按照1∶1 000的比例使用无血清培养基稀释DCFH-DA荧光探针,使DCFH-DA的终浓度为10 mmol·L-1,每孔加入2 mL稀释的DCFH-DA探针培养基,37 ℃细胞培养箱孵育细胞20 min后,弃去培养液,使用无血清DEME培养基清洗3次,充分洗涤细胞以除去未进入细胞的游离探针;于488 nm激发波长处使用倒置荧光显微镜观察细胞内荧光水平,并摄片。
2.6 Rhodamine 123线粒体膜电位检测取对数生长期的细胞,以2×106个·L-1的密度接种于6孔板,分别设置空白组(未处理)、模型组(LPS处理)、加药组(CHR)、实验组(LPS+ CHR),LPS预处理2 h,CHR处理48 h,按照1 ∶1 000的比例向每孔中加入1 μL的Rhodamine123染料原液,使Rhodamine 123的终浓度为1 mmol·L-1,37 ℃细胞培养箱孵育细胞30 min后,弃尽培养基,使用PBS洗涤3次,充分冲洗以除去多余染液,于488 nm激发波长处使用倒置荧光显微镜观察细胞内荧光水平,并摄片。
2.7 Western blot取对数生长期的细胞以2×106 L-1的密度接种于6孔板,分别设置空白组(未处理)、模型组(LPS处理)、加药组(CHR)、实验组(LPS+ CHR);继续培育24 h后,每孔加入150 μL蛋白裂解液(购自中国Beyotime)及蛋白酶抑制剂PMSF裂解30 min,加入150 μL 2×SDS上样缓冲液,干式恒温器于100 ℃ 10 min,使用4%浓缩胶,12%分离胶进行SDS-PAGE蛋白电泳,转膜至PVDF膜上,5%脱脂牛奶封闭3 h,一抗4 ℃孵育过夜,二抗孵育1 h,TBST清洗3次,3 min/次,使用Tanon imaging system进行成像。
2.8 统计学方法结果以x±s表示。采用Graphpad Prism 6作图,采用SPSS 20.0进行统计学分析,两样本之间比较采用t检验,多组间比较用One-way ANOVA法进行显著性检验。
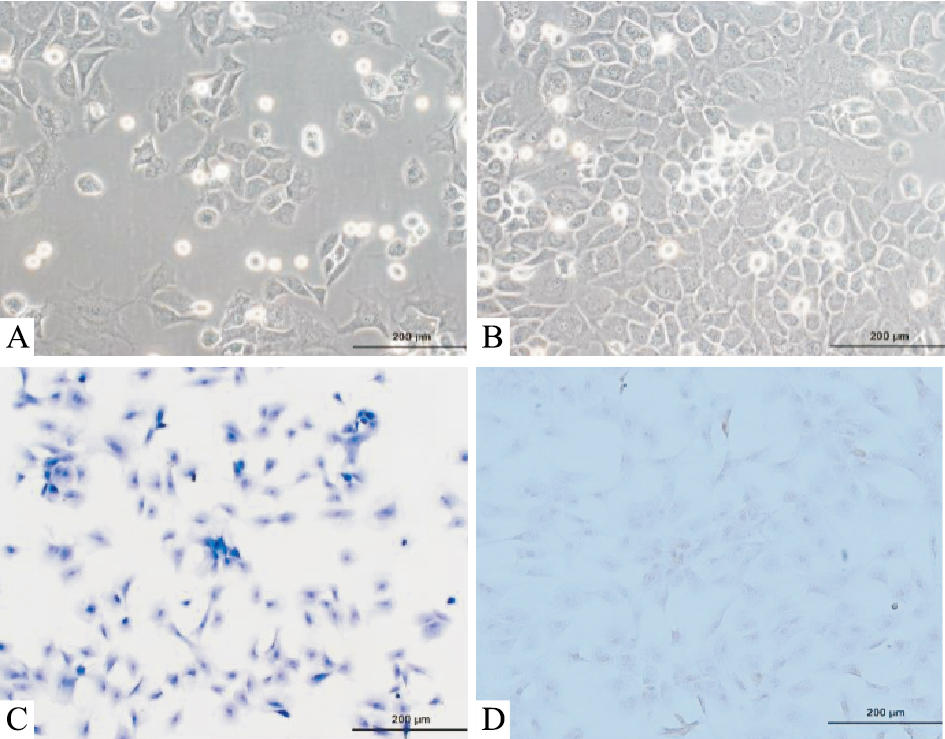
3 结果 3.1 正常软骨细胞形态倒置相差显微镜下观察正常软骨细胞的形态,新分离的软骨细胞悬浮在液体培养基中呈圆形,原代大鼠关节软骨细胞培养24 h,细胞呈椭圆形或梭形,贴壁生长,细胞膜完整光滑,折射率好(Fig 1A);原代培养大鼠关节软骨细胞培养8 d,细胞呈长梭形、不规则型或树突状,多呈“铺路石状”,分布密集, 甚至与可见的屈光性细胞外基质融合成单层,细胞融合率达80%时进行传代培养,传代细胞具有快速生长和良好的基质分泌能力(Fig 1B)。第一代软骨细胞甲苯胺蓝染色,显微镜下观察。结果发现,细胞核呈深蓝色,核仁呈蓝紫色,而软骨细胞质和细胞外基质因其异染性而呈褐红色(Fig 1C)。同时,对第一代软骨细胞爬片进行Ⅱ型胶原免疫组织化学染色,染色结果表明,由于软骨细胞合成分泌的特异性Ⅱ型胶原被染色,细胞质内有大量可见的棕色颗粒,被染成棕色,证明分离的细胞为软骨细胞(Fig 1D)。
|
| Fig 1 Chondrocyte morphologies of normal rat knee cartilage observed with a microscope and identification of chondrocytes (×200) A: Primary rat articular chondrocytes cultured for 24 h; B: Primary rat articular chondrocytes cultured for 8 d; C: Toluidine blue staining for rat articular chondrocytes identification; D: Collagen Ⅱ immunocytochemistry staining for identification of rat articular chondrocytes. |
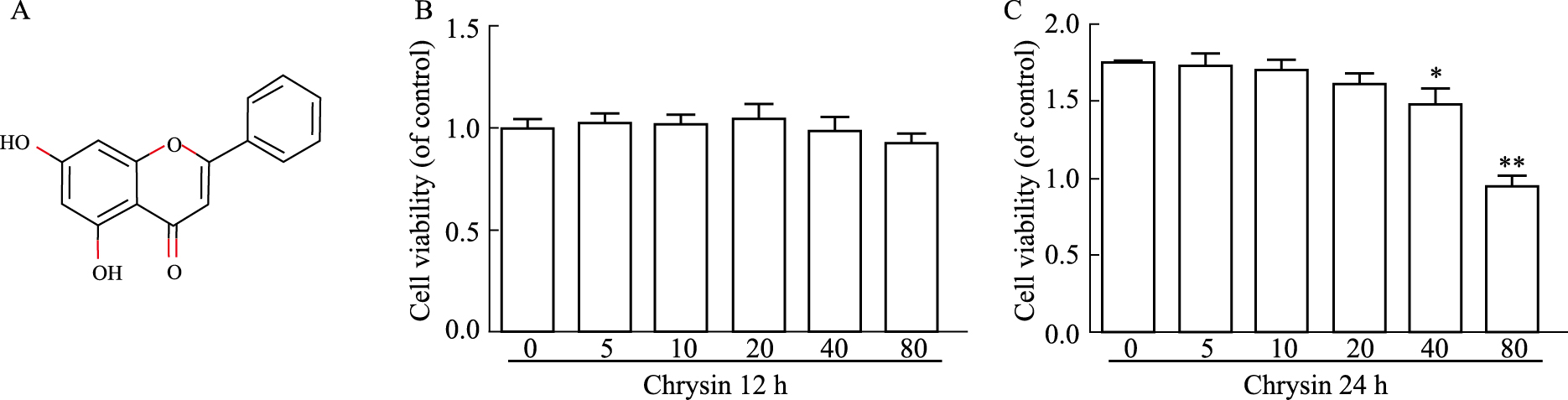
白杨素的化学结构如Fig 2A所示。采用CCK-8法检测不同剂量的CHR对正常软骨细胞的毒性作用。正常软骨细胞在不同浓度的CHR(0、5、10、20、40、80 mmol·L-1)处理12和24 h,在处理12 h时,CHR各浓度对细胞活力没有明显影响(P>0.05),见Fig 2B;在CHR处理24 h后,当CHR浓度≥40 mmol·L-1时,细胞活力受到明显抑制(P < 0.05),而在CHR浓度为(5、10、20 mmol·L-1)对细胞活力无抑制作用, 见Fig 2C。
|
| Fig 2 Effects of different concentrations of chrysin on (x±s, n=3)chondrocytes A: Chemical structure of chrysin; B: Cell viability of chondrocytes treated with chrysin for 12 hours; C: Cell viability of chondrocytes treated with chrysin for 24 hours; *P < 0.05, **P < 0.01 vs control group. |
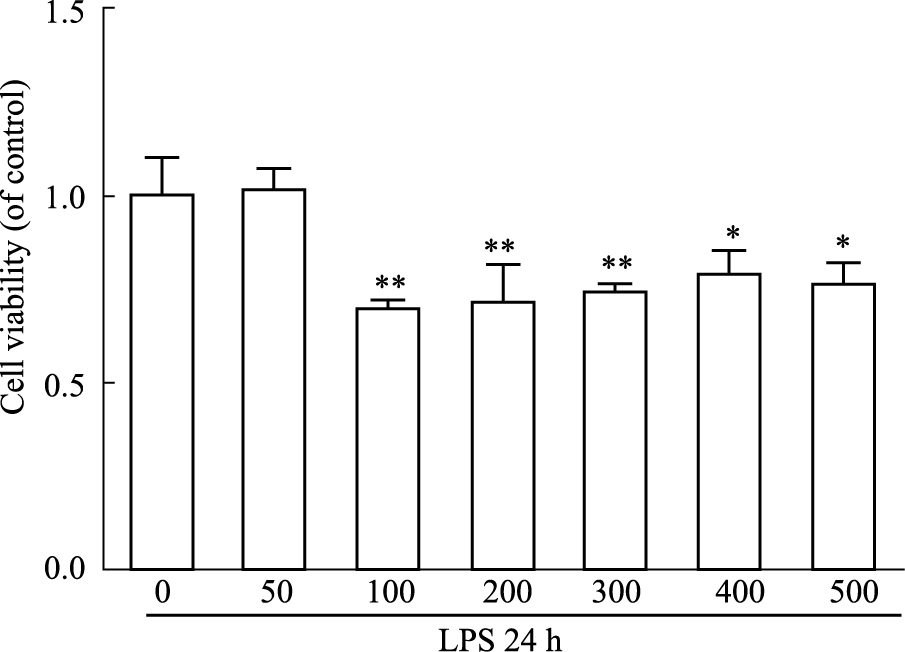
用不同浓度LPS处理大鼠正常软骨细胞24 h后,如Fig 3所示,当LPS的浓度为50 μg·L-1时对软骨细胞的活力无影响,当LPS浓度为100 μg·L-1时可以明显降低软骨细胞的活力(P < 0.01),且当LPS的浓度不断增大,大鼠软骨细胞的活力不再继续降低,因此,本实验选择用浓度为100 μg·L-1的LPS来诱导大鼠软骨细胞损伤模型(Fig 3)。
|
| Fig 3 Effects of different concentrations of LPS on viability of normal chondrocytes (x±s, n=3) *P < 0.05, **P < 0.01 vs control group. |
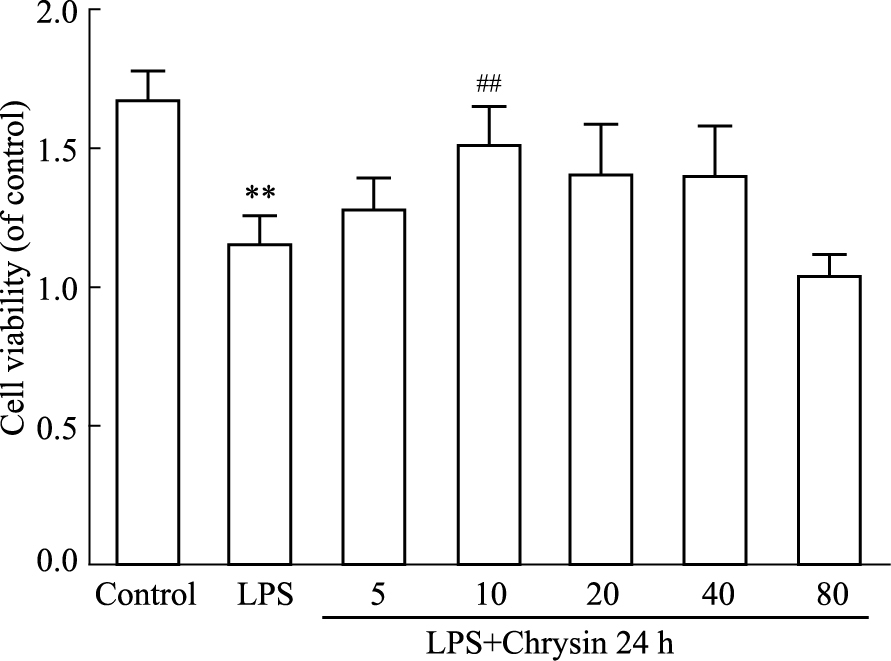
用CCK-8法检测CHR对LPS诱导的软骨细胞损伤模型中细胞活力。软骨细胞分别用未含有或者含有不同浓度CHR的培养基预处理2 h后,再用含有LPS的培养基培养24 h。由Fig 4显示,与空白组比较,LPS刺激细胞后,细胞活力下降,而在CHR预处理的,细胞活力有所恢复,且在浓度为10 mmol·L-1的CHR处理24 h时细胞对LPS诱导的软骨细胞损伤的增殖能力最强,CHR组(10 mmol·L-1)比LPS(100 μg·L-1)组的细胞活力明显增加(P < 0.01)。因此,我们选择10 mmol·L-1的CHR作为后续实验研究受试药物有效使用浓度。
|
| Fig 4 Effect of CHR treatment on activity of rat chondrocytes induced by LPS (x±s, n=3) Cell viability after co-treatment with CHR and LPS for 24 hours.**P < 0.01 vs control group; ##P < 0.01 vs LPS group. |
本研究采用DCFH-DA探针来检测大鼠软骨细胞内活性氧的水平。DCFH-DA能够被细胞内的酯酶水解生成DCFH,细胞内活性氧可以氧化DCFH生成有荧光的DCF,通过检测DCF的荧光强度可以反映细胞内的活性氧水平。实验结果(Fig 5)表明,经过LPS作用24 h后,能够引起大鼠软骨细胞内活性氧水平明显提高,CHR处理后可以明显降低LPS诱导引起的活性氧水平。
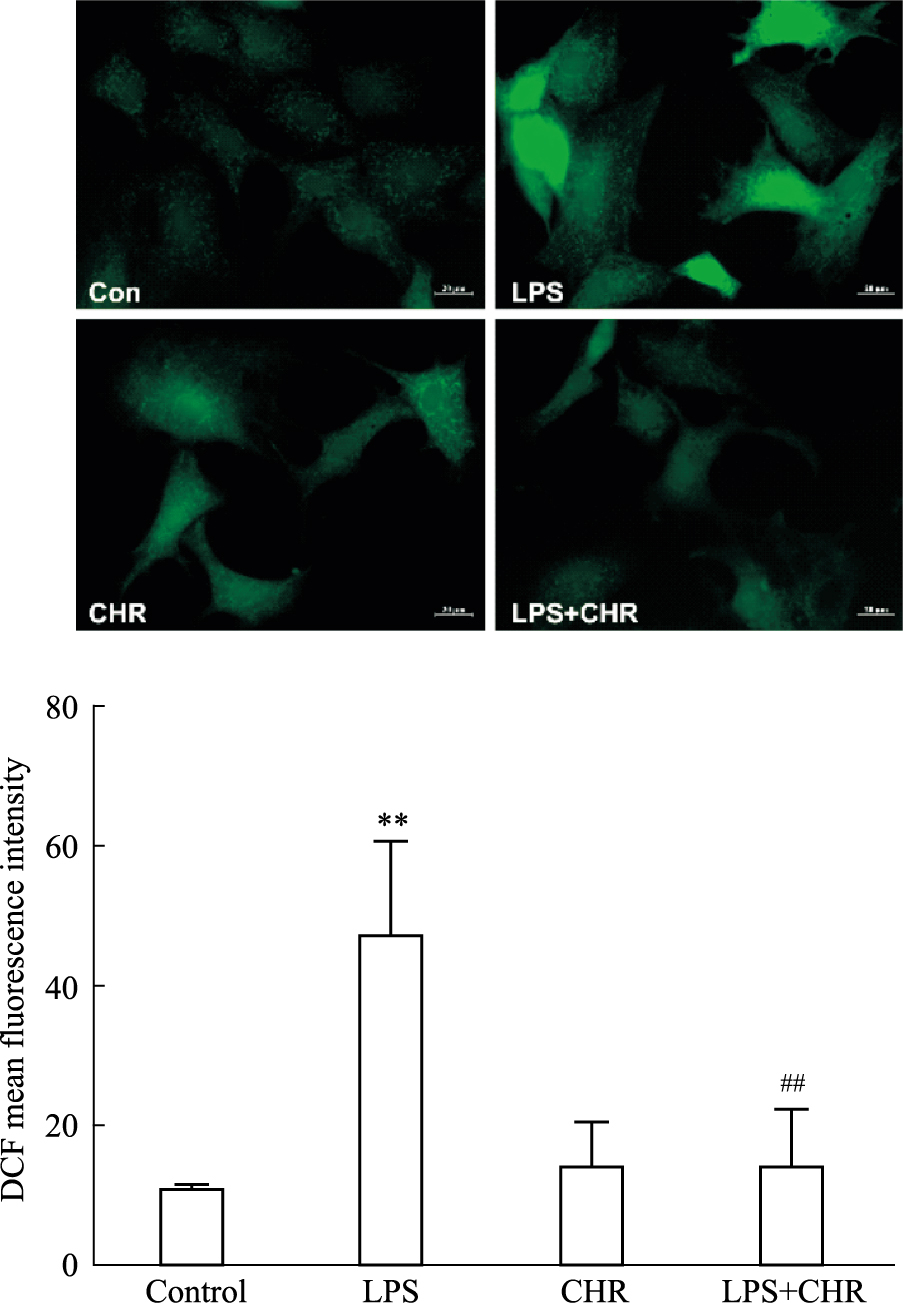
|
| Fig 5 Changes in reactive oxygen species level of chondrocytes (x±s, n=3) **P < 0.01 vs control group; ##P < 0.01 vs LPS group. Scale bar: 20 μm. |
用罗丹明123染色观察线粒体膜电位,评估软骨细胞状态,可以在高膜电位的细胞中观察到绿色荧光。LPS(100 μg·L-1)预处理,与Control组比较,LPS组细胞线粒体膜电位明显下降,其线粒体膜电位低于Control组。CHR处理组可以恢复LPS处理后线粒体膜电位,与LPS组相比表达出更高的荧光强度,线粒体膜电位明显提高(Fig 6)。

|
| Fig 6 Fluorescence expression of mitochondrial membrane potential of cells under different treatment conditions (x±s, n=3) **P < 0.01 vs control group; #P < 0.05 vs LPS group.Scale bar: 20 μm. |
采用Western blot法检测白杨素浓度为10 mmol·L-1时软骨细胞的自噬蛋白的表达水平。Fig 7结果显示,与空白组相比,模型组Beclin-1、LC3Ⅱ的含量上升(P < 0.5);与模型相比,CHR给药可以明显改善组软骨细胞的自噬水平上升的情况,该差异有统计学意义。结果表明,CHR能抑制Beclin-1、LC3Ⅱ自噬蛋白的表达,进而起到抑制自噬的作用。
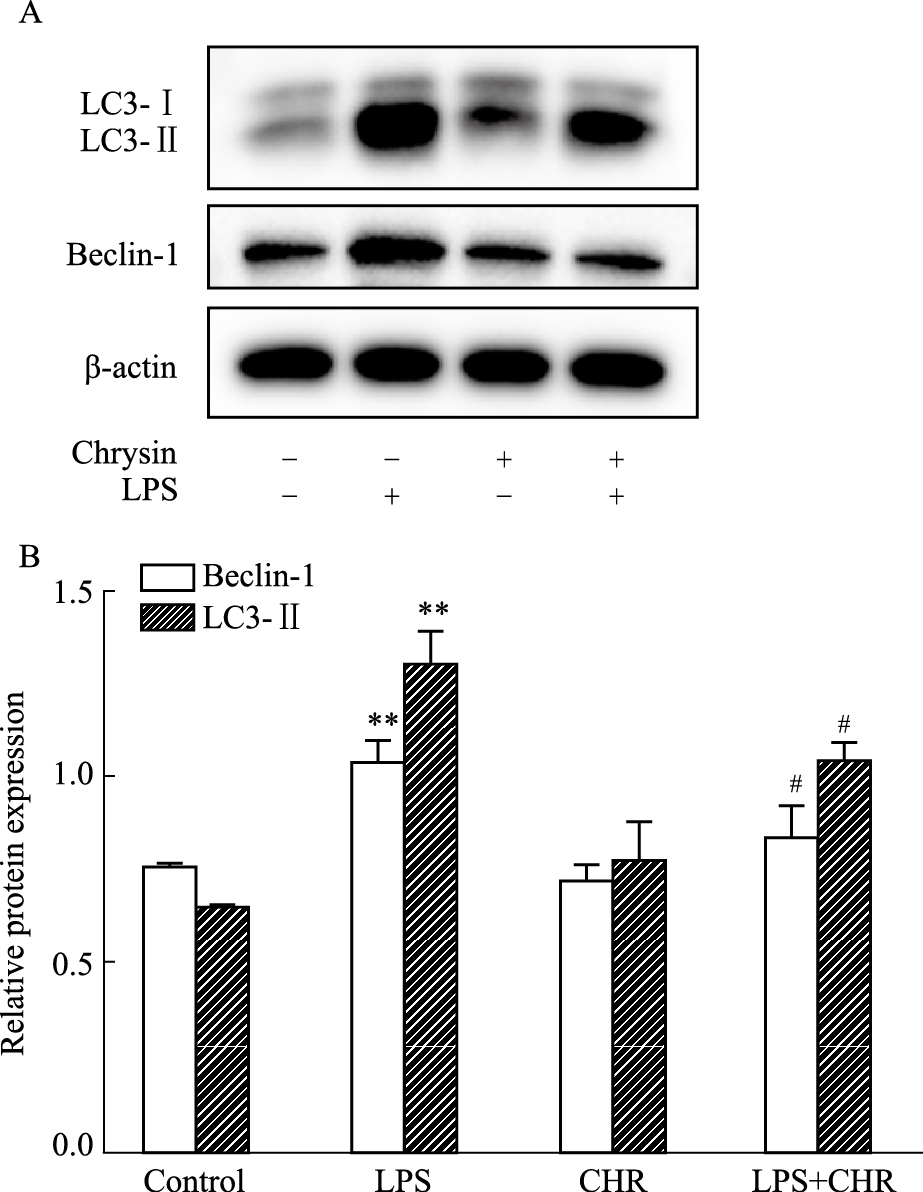
|
| Fig 7 Effect of chrysin on expression of autophagy markers in rat chondrocytes (x±s, n=3) A: The banding patterns of Beclin-1 and LC3Ⅱ by Western blot; B: The relative protein expressions of Beclin-1 and LC3Ⅱ; **P < 0.01 vs control group; #P < 0.05 vs LPS group. |
采用Western blot法检测白杨素对PI3K、AKT、p-PI3K、p-AKT蛋白表达的影响。结果如Fig 8所示,各组细胞总PI3K、AKT的蛋白含量差异无显著性(P>0.05),与Control组相比较LPS组的p-PI3K、p-AKT蛋白含量升高,差异有显著性(P < 0.05);LPS+CHR组与LPS组相比,CHR给药可以明显降低p-PI3K、p-AKT蛋白含量,差异具有统计学意义(P < 0.05)。结果表明,CHR能够抑制p-PI3K、p-AKT蛋白的表达。
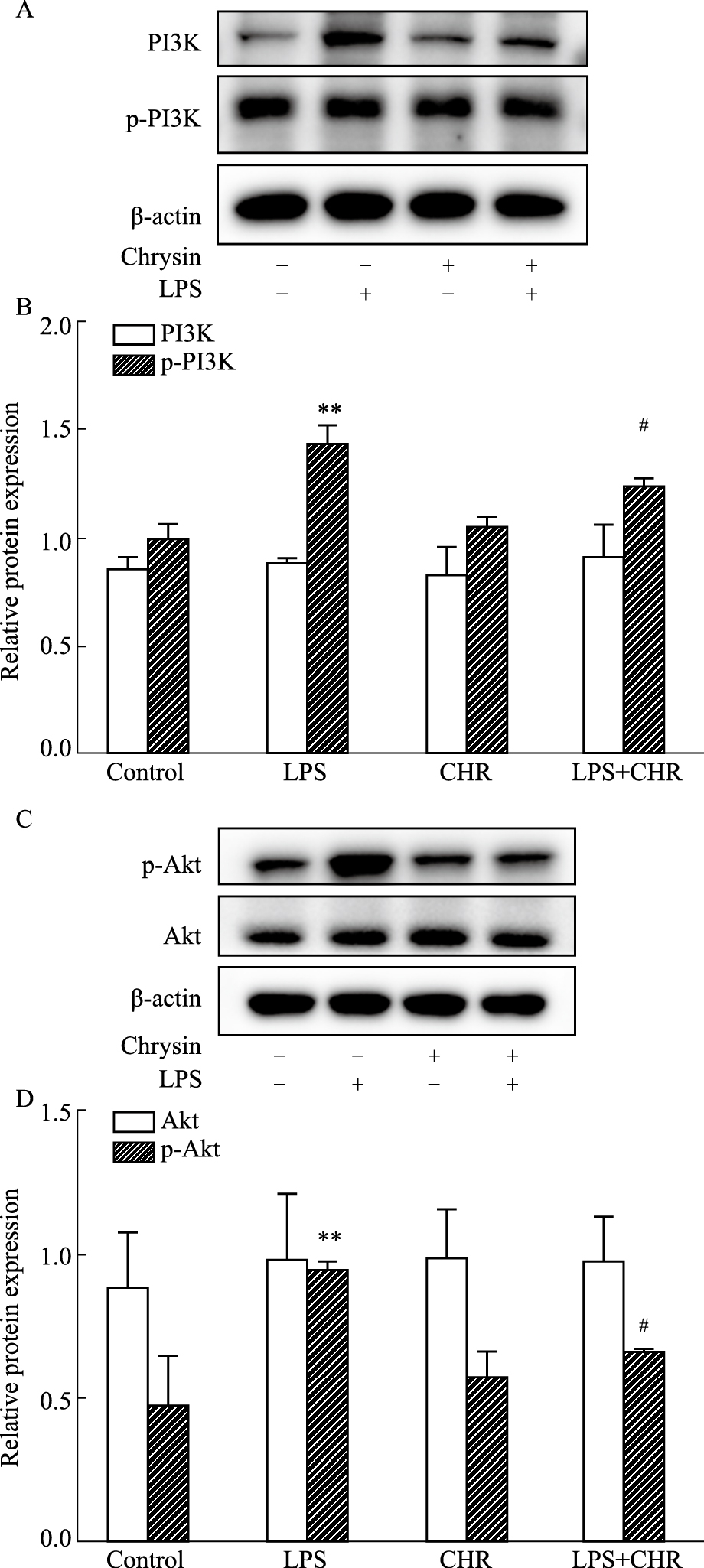
|
| Fig 8 Total and phosphorylation levels of PI3K and AKT among four groups (x±s, n=3) A: The banding patterns of PI3K and p-PI3K by Western blot; B: The relative protein expressions of PI3K and p-PI3K; C: The banding patterns of AKT and p-AKT; D: The relative protein expressions of AKT and p-AKT. **P < 0.01 vs control group; #P < 0.05 vs LPS group. |
骨关节炎致病过程中伴随着关节肿胀、疼痛和活动性丧失,随着中国人口衰老进程的加快,困扰着日益增多的中老年人日常生活[10]。传统的骨关节炎治疗主要是疼痛管理和晚期疾病的关节置换术。在骨关节炎中,自噬被认为是软骨和细胞内稳态的主要机制,其对骨关节炎的负效应和积极作用都有报道[11]。有研究报道,白杨素可以通过降低氧化应激改善粘菌素诱导的细胞损伤、凋亡和自噬[12],在Mehmet的研究中,白杨素保护大鼠肾脏,降低扑热息痛诱导的氧化应激、炎症、凋亡和自噬[13-14], 在本研究中,通过检测ROS的水平和自噬相关蛋白LC3Ⅱ与Beclin-1的表达,提示白杨素可以保护软骨细胞降低脂多糖诱导的软骨细胞氧化应激和自噬。在OA的早期阶段,来自浅表区的软骨细胞显示凋亡细胞死亡和自噬标记的表达增加,有研究认为自噬是作为对致死条件的适应性反应而激活的,目的是避免细胞死亡。随着退变过程的进展,这两种标志物在浅层和中层软骨细胞中的联合表达可能与软骨细胞修复反应的缺陷有关,这是由于死亡信号的激活增加,以及分解代谢机制的盛行。另一方面,研究证明了自噬的缺失和细胞凋亡的增加,这可能与OA晚期出现的软骨异常钙化相关的软骨细胞的替代有关[15]。
细胞内ROS的产生是软骨细胞损伤的主要病理驱动因素,继而在引发炎症中起着至关重要的作用。LPS刺激可显着增加软骨细胞中的ROS水平(Fig 5),降低细胞增殖能力(Fig 3、4)促进自噬(Fig 7A)。CHR处理不仅可以逆转自噬相关蛋白的表达,增加活细胞的百分比,提高细胞活力(Fig 4),而且还可以抑制ROS的产生。氧化应激的增加使软骨细胞易发生抗功能性抗氧化反应和细胞自噬。因此,我们可以推测CHR通过减轻氧化应激来抑制受损软骨细胞的损伤与自噬,而降低ROS可能是治疗炎症的潜在治疗手段。在产生氧化损伤的同时我们通过Rhodamine123染色检测了各组细胞的线粒体膜电位(Fig 6),LPS组的细胞线粒体膜电位明显低于正常组,CHR+LPS组的细胞线粒体膜电位明显低于比LPS组的线粒体膜电位,说明在受到氧化应激损伤时,大鼠软骨细胞的线粒体功能受到抑制,细胞活力下降;Western blot检测发现(Fig 7A), CHR+LPS组的自噬相关蛋白Beclin-1与LC3Ⅱ的表达低于LPS组,说明在加入CHR后软骨细胞的自噬水平下降;PI3K/AKT信号通路调节多种细胞过程,包括细胞凋亡、转录、翻译、代谢、血管生成和细胞周期的调节,磷脂酰肌醇3-激酶(PI3Ks)作为中间信号分子广泛分布与各种细胞的细胞质中,调节多种信号转导途径,并且可以被各种细胞因子受体激活[16]。PI3K/AKT信号通路蛋白在LPS处理后发生磷酸化活化,LPS组p-PI3K和p-AKT蛋白的表达增加被激活,CHR+LPS组中p-PI3K和p-AKT蛋白明显低于LPS组,说明CHR可以抑制LPS对PI3K/AKT信号通路的激活作用。
由此可知,当PI3K/AKT信号通路中的磷酸化蛋白p-PI3K与p-AKT被抑制时,细胞自噬减弱,软骨细胞活力增加。然而,由于本研究使用大鼠关节软骨细胞,而不是大鼠骨关节炎模型进行实验,骨关节炎和大鼠软骨细胞自噬之间的显著关系仍有待确定。因此,需要进一步研究PI3K/AKT信号通路对大鼠软骨细胞自噬的影响,以全面阐明软骨细胞自噬的调节机制与研究进展,可为其临床应用提供实验依据,也可为天然黄酮类中药化合物的现代开发应用提供新方向。
| [1] |
Cooke M E, Lawless B M, Jones S W, et al. Matrix degradation in osteoarthritis primes the superficial region of cartilage for mechanical damage[J]. Acta Biomaterialia, 2018, 78: 320-8. doi:10.1016/j.actbio.2018.07.037 |
| [2] |
Roseti L, Desando G, Cavallo C, et al. Articular cartilage regeneration in osteoarthritis[J]. Cells, 2019, 8(11): 1305-20. doi:10.3390/cells8111305 |
| [3] |
Lepetsos P, Papavassiliou K A, Papavassiliou A G. Redox and NF-κB signaling in osteoarthritis[J]. Free Radic Biol Med, 2019, 132: 90-100. doi:10.1016/j.freeradbiomed.2018.09.025 |
| [4] |
Geyer M, Schönfeld C. Novel insights into the pathogenesis of osteoarthritis[J]. Curr Rheumatol Rev, 2018, 14(2): 98-107. doi:10.2174/1573397113666170807122312 |
| [5] |
Chen S Y, Chiu L Ya, Maa M C, et al. zVAD-induced autophagic cell death requires c-Src-dependent ERK and JNK activation and reactive oxygen species generation[J]. Autophagy, 2011, 7: 217-28. doi:10.4161/auto.7.2.14212 |
| [6] |
Xue J F, Shi Z M, Zou J, et al. Inhibition of PI3K/AKT/mTOR signaling pathway promotes autophagy of articular chondrocytes and attenuates inflammatory response in rats with osteoarthritis[J]. Biomed Pharmacother, 2017, 89: 1252-61. doi:10.1016/j.biopha.2017.01.130 |
| [7] |
Qian Y Q, Feng Z H, Li X B, et al. Downregulating PI3K/Akt/NF-κB signaling with allicin for ameliorating the progression of osteoarthritis: In vitro and vivo studies[J]. Food Funct, 2018, 9(9): 4865-75. doi:10.1039/C8FO01095A |
| [8] |
Mani R, Natesan V. Chrysin: Sources, beneficial pharmacological activities, and molecular mechanism of action[J]. Phytochemistry, 2018, 145: 187-96. doi:10.1016/j.phytochem.2017.09.016 |
| [9] |
Naz S, Imran M, Rauf A, et al. Chrysin: Pharmacological and therapeutic properties[J]. Life Sci, 2019, 235: 116797. doi:10.1016/j.lfs.2019.116797 |
| [10] |
Sun X, Zhen X, Hu X, et al. Osteoarthritis in the middle-aged and elderly in China: Prevalence and influencing factors[J]. Int J Environ Res Public Health, 2019, 16(23): 4701. doi:10.3390/ijerph16234701 |
| [11] |
Jiang L B, Cao L, Yin X F, et al. Activation of autophagy via Ca(2+)-dependent AMPK/mTOR pathway in rat notochordal cells is a cellular adaptation under hyperosmotic stress[J]. Cell Cycle, 2015, 14: 867-79. doi:10.1080/15384101.2015.1004946 |
| [12] |
Aksu E H, Kandemir F M, Küçükler S, et al. Improvement in colistin-induced reproductive damage, apoptosis, and autophagy in testes via reducing oxidative stress by chrysin[J]. J Biochem Mol Toxicol, 2018, 32: e22201. doi:10.1002/jbt.22201 |
| [13] |
Kandemir F M, Kucukler S, Eldutar E, et al. Chrysin protects rat kidney from paracetamol induced oxidative stress, inflammation, apoptosis, and autophagy: A multi-biomarker approach[J]. Sci Pharm, 2017, 85(1): 4. doi:10.3390/scipharm85010004 |
| [14] |
杨琴, 任昊阳, 朱寒雨, 等. 白杨素通过抑制NLRP3炎性小体信号通路对围绝经期抑郁症模型大鼠产生保护作用[J]. 中国药理学通报, 2020, 36(7): 1006-11. Yang Q, Ren H Y, Zhu H Y, et al. Chrysin has a protective effect on peri-menopausal depression rats by inhibiting NLRP3 inflammatory corpuscle signal pathway[J]. Chin Pharmacol Bull, 2020, 36(7): 1006-11. doi:10.3969/j.issn.1001-1978.2020.07.021 |
| [15] |
Musumeci G, Castrogiovanni P, Trovato F M, et al. Biomarkers of chondrocyte apoptosis and autophagy in osteoarthritis[J]. Int J Mol Sci, 2015, 16(9): 20560-75. doi:10.3390/ijms160920560 |
| [16] |
Wen P Y, Lee E Q, Reardon D A, et al. Current clinical development of PI3K pathway inhibitors in glioblastoma[J]. Neuro Oncol, 2012, 14(7): 819-29. doi:10.1093/neuonc/nos117 |

