

2. 中国科学技术大学 附属第一医院(安徽省立医院)药剂科,安徽 合肥 230001
居靖(1975 -),男,博士,主任药师,硕士生导师,研究方向:临床药学和肿瘤药理学,通讯作者,E-mail: ju051205@126.com
2. Dept of Pharmacy, the First Affiliated Hospital of USTC, Division of Life Sciences and Medicine, Anhui Provincial Hospital, Hefei 230001, China
作为仅次于肺癌的最常被诊断出的癌症,乳腺癌也是全球范围内女性癌症死亡的主要原因[1]。近几年乳腺癌发病率在国内正在迅速增长且已位列首位,逐年加重[2]。手术治疗、放疗、化疗、内分泌治疗和靶向治疗,这些都是目前临床乳腺癌治疗的有效手段。其中,化疗在乳腺癌的治疗过程中发挥着关键作用。除了一些传统的化疗药物外,近年来对于中药的抗癌研究逐渐受到研究者的重视。作为一种天然的小分子黄酮类化合物,槲皮素具有抗炎、抗氧化等多种药理学作用, 其抗癌作用日益受到关注,然而其抗肿瘤的分子机制尚未完全明确[3]。
近年来,大量非编码RNA的发现不仅改变了研究者对癌症病理生理的认识,也为癌症治疗开辟了新的前景。长链非编码RNA (long non-coding RNA,lncRNA) 是一类转录本长度大于200个碱基的RNA,不编码蛋白质,利用转录和转录后修饰等途径在基因表达中起关键调控作用,进而参与多种生理和病理途径的调节[4]。越来越多的证据表明,一些lncRNAs在多种癌症(包括乳腺癌)细胞和组织中异常表达,可为恶性肿瘤分子诊断和治疗提供靶点和依据[5]。作为一种肿瘤抑制因子,GAS5在乳腺癌细胞中低表达并有望成为乳腺癌潜在的治疗靶点或预后预测因子。近年来发现,药物通过调控GAS5起到抗肿瘤作用的研究崭露头角,这些研究为探究槲皮素的抗乳腺癌作用机制提供了新的思路[6-7]。
Notch1信号通路涉及多个细胞过程,例如增殖、分化、凋亡,细胞命运决定和干细胞维持。除此之外,它在肿瘤发生发展中的重要作用也不容忽视[8]。有研究显示,GAS5可通过调控Notch1信号通路影响疾病进程,这些研究为我们深入探索乳腺癌中GAS5与Notch1信号通路的相关性提供了有力的参考依据[9-10]。
本研究旨在初步探讨槲皮素是否通过影响GAS5来调控Notch1信号通路从而促进乳腺癌细胞凋亡,为乳腺癌分子诊断和靶向治疗开拓更多可能性。
1 材料与方法 1.1 材料 1.1.1 细胞株人乳腺癌细胞株MCF-7由中国科学技术大学朱涛教授课题组馈赠。
1.1.2 药物与试剂槲皮素(Quercetin, Q),Sigma(货号:Q4951-10G);MTT试剂、DMSO试剂和姬姆萨原液,Solarbio(货号:298-93-1、D8370、G1015);血清、胰酶和RPMI 1640培养基,BI(货号:04-001-1ACS、03-050-1ACS、01-100-1ACS);Opti-MEM,Gibco(货号:31985-070);引物序列,上海生物工程公司;小干扰RNA,上海吉玛基因公司;TRIzol Reagent和LipofectamineTM2000,Invitrogen(货号:15596026、11668-019);逆转录试剂盒和q RT-PCR试剂盒,TaKaRa(货号:RR047A、RR820A);Notch1、Jagged1、Hes1单克隆抗体,Cell Signaling Technology(货号:3608、70109、11988);Caspase3单克隆抗体,Bioss(货号:bs-0081R);Bcl-2、Bax单克隆抗体,BOSTER(货号:BA0412、BA0315-2);β-actin单克隆抗体和辣根过氧化物酶标记的山羊抗兔/鼠二抗,中杉金桥(货号:TA-09、ZB-2301、ZB-2305);Annexin V-FITC凋亡检测试剂盒,BD(货号:556547);BCA试剂盒、一抗稀释液和DEPC无酶水,碧云天(货号:P0010S、P0023A、R0021)。
1.1.3 仪器CO2培养箱(Heal Force);流式细胞仪(Beckman Coulter);ScanDrop2超微量核酸蛋白测定仪(Analytikjena);Thermal Cycler PCR仪(天隆);Applied Biosystems 7500实时荧光定量PCR仪(赛默飞);化学发光成像仪(培清),酶标仪(Molecular Devices)。
1.2 方法 1.2.1 细胞培养MCF-7细胞用RPMI 1640培养基(含10%胎牛血清和1%双抗)在37 ℃、5% CO2培养箱中培养。待细胞处于对数生长期开始后续实验。
1.2.2 细胞转染6孔板接种对数生长期MCF-7细胞, 待细胞密度达40%-60%,将3条GAS5小干扰RNA序列(siGAS5#1, siGAS5#2, siGAS5#3)及其阴性对照的小干扰RNA序列(sncRNA),分别与LipofectamineTM2000混合孵育后加入各孔中(siRNA终浓度约为0.66 mg·L-1)。培养6 h后分别换成含10%胎牛血清的RPMI 1640培养基和槲皮素药液(80 μmol·L-1)继续培养48 h。小干扰RNA序列如下所示:siGAS5#1:正义链5′-GGCUCUGGAU AGCACCUUATT-3′, 反义链5′-UAAGGUGCUAUCC AGAGCCTT-3′; siGAS5#2:正义链5′-GCAAAGG ACUCAGAAUUCATT-3′, 反义链5′-UGAAUUCUG AGUCCUUUGCTT-3′; siGAS5#3:正义链5′-GCAU GCAGCUUACUGCUUGTT-3′, 反义链5′-CAAGCAG UAAGCUGCAUGCTT-3′; sncRNA:正义链5′-UUC UCCGAACGUGUCACGUTT-3′, 反义链5′-ACGUGAC ACGUUCGGAGAATT-3′。
1.2.3 MTT法检测槲皮素对MCF-7细胞活力的影响96孔板接种对数生长期MCF-7细胞,加入100 μL不同浓度的槲皮素(5、10、20、40、80、160和320 μmol·L-1),空白组和对照组加入等量培养基,作用24、48和72 h后,每孔加入100 μL MTT工作液,避光孵育4 h,吸去MTT,每孔加入150 μL DMSO,暗处慢摇,OD值用酶标仪在490 nm处测出。数据处理的公式为细胞活力/%=(药物组OD值-空白组OD值/对照组OD值-空白组OD值)×100%。
1.2.4 平板克隆形成实验检测槲皮素对MCF-7细胞增殖克隆能力的影响6孔板接种对数生长期MCF-7细胞, 加入不同浓度的槲皮素(40、80、160 μmol·L-1),处理24 h后加入完全培养基继续培养。每3 d换液1次,并观察细胞克隆增殖情况。待6孔板中已形成足够菌落,无水乙醇固定,姬姆萨染液染色后,弃除染液,用自来水洗掉残余染液,自然晾干后,在显微镜下观察并用相机拍照。最后对每组的克隆细胞数量进行计算。
1.2.5 Annexin V-FITC/PI法检测槲皮素对MCF-7细胞凋亡的影响6孔板接种对数生长期MCF-7细胞, 加入不同浓度的槲皮素(40、80、160 μmol·L-1), 处理48 h后收集细胞。加入冷PBS洗2次后用100 μL Binding buffer制细胞悬液,依次加入Annexin V-FITC和PI染色液各5 μL。室温避光孵育15 min。加入400 μL Binding buffer混悬细胞后上流式细胞仪检测细胞凋亡率。
1.2.6 qRT-PCR法检测GAS5、Notch1信号通路以及凋亡相关蛋白的表达在乳腺癌MCF-7细胞中,分别采用不同浓度槲皮素(40、80、160 μmol·L-1)、GAS5小干扰RNA(siGAS5#1,siGAS5#2,siGAS5#3)、槲皮素协同siGAS5#1处理24或48 h后,用TRIzol分别提取细胞总RNA,采用ScanDrop2超微量核酸蛋白测定仪将总RNA进行定量后,每组各取500 ng总RNA用TaKaRa逆转录试剂盒逆转录成cDNA。PCR反应程序按以下条件进行: 95 ℃ 30 s;95 ℃ 5 s、60 ℃ 34 s,共40个循环。采用相对定量法,以β-actin作为内参,将各Ct值代入公式2-△△Ct,比较各组的RNA相对表达量。所用引物序列如下所示: β-actin上游: 5′-GCCAACACAGTGCT GTCTGG-3′,下游: 5′-CTCAGGAGGAGCAATGATCT TG-3′;GAS5上游: 5′-CCTGTGAGGTATGGTGCTGG-3′,下游: 5′-CTGTGTGCCAATGGCTTGAG-3′;Notch1上游: 5′-GAATGGCGGGAAGTGTGAAGC-3′,下游: 5′-TAGTCTGCCACGCCTCTGC-3′;Jagged1上游: 5′-CCTGGGCTTTGAGTGTGAGTGTTC-3′, 下游: 5′-GTC GCAGTAGTAGCTGGCAATGAG-3′;Hes1上游: 5′-AAGTGTGCTGGGGAAGTACC-3′,下游: 5′- GGGG TAGGTCATGGCATTGAT-3′;Bcl-2上游: 5′-GGGTC ATGTGTGTGGAGAG-3′, 下游: 5′-AGCCAGGAGA AATCAAACAG-3′;Bax上游: 5′-GAACTGGACAAC AACATGGA-3′,下游: 5′-GCAAAGTAGAAAAGGG CAAC-3′;Caspase3上游: 5′-TGTCTTCTGTAATCGCC AAG-3′,下游: 5′-CCGTTCGTTCCAAAAATTAC-3′。
1.2.7 Western blot检测Notch1信号通路以及凋亡相关蛋白的表达在乳腺癌MCF-7细胞中,分别采用不同浓度槲皮素(40、80、160 μmol·L-1)、siGAS5#1、槲皮素协同siGAS5#1处理48 h后,提取细胞总蛋白,BCA定量法定量后制备8%聚丙烯酰胺凝胶,每孔20 μg上样,经SDS-PAGE凝胶电泳分离后,恒压转膜,使蛋白由胶转至PVDF膜,之后浸入封闭剂(5%脱脂牛奶)中室温封闭2 h,TBST洗涤后,加一抗(1 ∶1 000)4 ℃孵育过夜。TBST洗涤后加入二抗(1 ∶10 000),常温孵育2 h。膜经TBST洗涤后ECL显色,曝光成像。最后通过ImageJ软件对蛋白条带进行灰度分析。
1.3 统计学分析通过SPSS 25.0统计软件进行数据整理分析,实验结果以x±s表示,组间比较常用单因素方差分析(One-way ANOVA)。
2 结果 2.1 槲皮素对MCF-7细胞活力的抑制作用MTT实验结果表明,槲皮素作用24、48和72 h后均可抑制MCF-7细胞活力,并且作用时间越长抑制作用越强,呈时间依赖性。同时,与对照组相比,槲皮素浓度为40、80和160 μmol·L-1时,细胞活力明显受到抑制,如Fig 1所示。随着药物浓度的增大,细胞活力逐渐降低,呈现浓度依赖性。因此我们将采用抑制效果较佳的40、80和160 μmol·L-1的槲皮素浓度组作用48 h后进行后续实验。
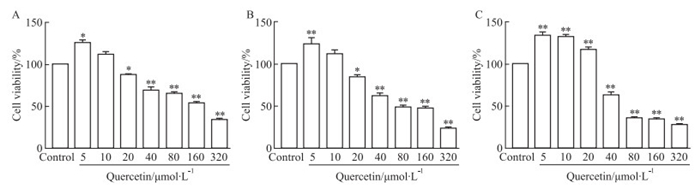
|
| Fig 1 Effect of quercetin on viability of MCF-7 cells at 24, 48 and 72 h(x±s, n=3) A: 24 h. B: 48 h. C: 72 h. *P < 0.05, **P < 0.01 vs control group |
如Fig 2所示,与对照组相比,随着槲皮素浓度增大,细胞菌落变小,细胞克隆数量降低(P < 0.01),说明槲皮素可明显抑制MCF-7细胞的增殖克隆能力且呈浓度依赖性。
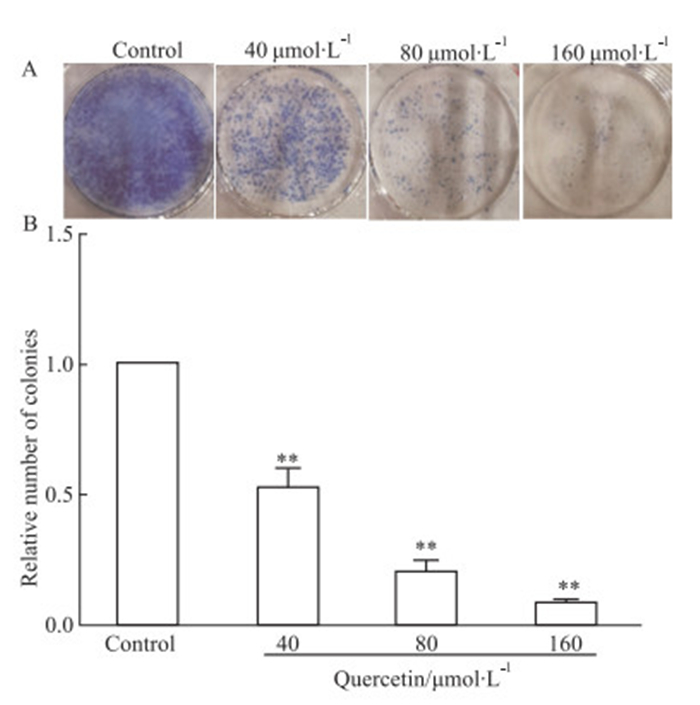
|
| Fig 2 Effect of quercetin on cell colonies of MCF-7 cells(x±s, n=3) A: The colony-forming ability was measured by a colony-forming assay. B: Quantitative analysis showed the number of colonies of MCF-7 cells.**P < 0.01 vs control group |
流式细胞术结果表明,不同浓度槲皮素(40、80、160 μmol·L-1)处理48 h后,其各浓度组均能在一定程度上诱导MCF-7细胞凋亡。与对照组相比,槲皮素处理组(80、160 μmol·L-1)的细胞凋亡率普遍增高(Fig 3)。qRT-PCR和Western blot结果表明, 槲皮素各浓度组均能不同程度地增加MCF-7细胞中凋亡相关蛋白Bax和Caspase3 mRNA和蛋白表达水平,而降低Bcl-2的mRNA(Fig 4A)和蛋白(Fig 4B)表达水平。
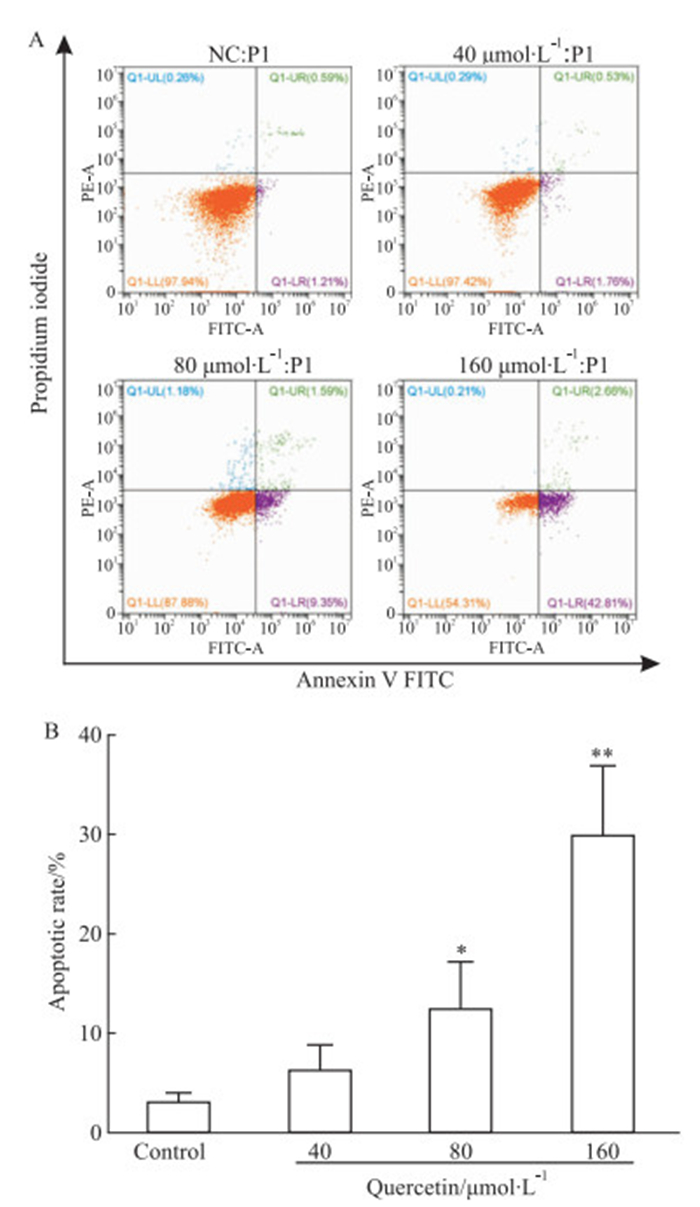
|
| Fig 3 Effect of quercetin on apoptosis of MCF-7 cells(x±s, n=3) A: MCF-7 cell apoptosis was detected by the Annexin V-FITC/PI double staining assay. B: Quantitative analysis showed the apoptotic rate of each group of MCF-7 cells.*P < 0.05, **P < 0.01 vs control group |
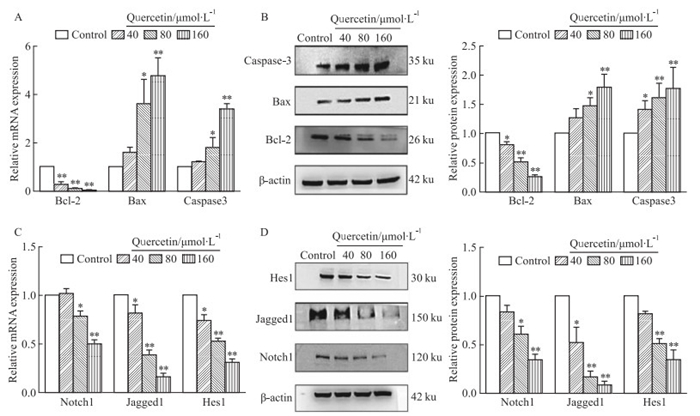
|
| Fig 4 Effect of quercetin on expression levels of Notch1, Jagged1, Hes1, Bcl-2, Bax and Caspase-3(x±s, n=3) A and C: The Notch1, Jagged1, Hes1, Bcl-2, Bax and Caspase-3 mRNA expressions were examined by qRT-PCR. B and D: The Notch1, Jagged1, Hes1, Bcl-2, Bax and Caspase-3 protein expressions were examined by Western blot. *P < 0.05, **P < 0.01 vs control group |
如Fig 5A所示,80、160 μmol·L-1槲皮素处理后,GAS5表达较对照组明显升高,提示槲皮素可明显促进MCF-7细胞中GAS5的表达。
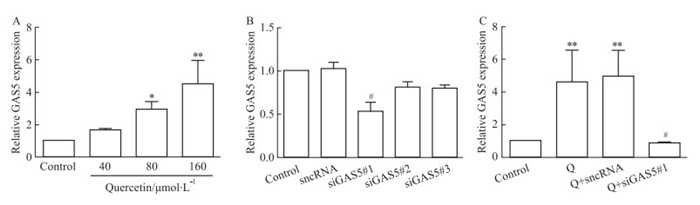
|
| Fig 5 Effects of quercetin and siRNAs on GAS5 expression level in MCF-7 cells(x±s, n=3) A: The expression of GAS5 in MCF-7 cells treated with quercetin was examined by qRT-PCR. B and C: MCF-7 cells were transfected with siRNAs and co-treated with quercetin(80 μmol·L-1). The GAS5 expression was examined by qRT-PCR.*P < 0.05, **P < 0.01 vs control group; #P < 0.05 vs sncRNA group or Q+sncRNA group. |
与对照组相比,不同浓度槲皮素(40、80、160 μmol·L-1)处理MCF-7细胞后,Notch1信号通路中的相关蛋白Notch1、Jagged1、Hes1 mRNA(Fig 4C)和蛋白(Fig 4D)表达水平均不同程度地下调,提示槲皮素可明显抑制MCF-7细胞中Notch1信号通路的激活。
2.6 槲皮素通过靶向GAS5/Notch1信号通路促进MCF-7细胞凋亡如Fig 5B所示,与sncRNA组相比较,三条siGAS5序列中siGAS5#1具有更优的沉默效率,因此选择用于后续实验研究。在MCF-7细胞中,转染siGAS5#1后,发现Notch1信号通路的相关蛋白Notch1、Jagged1、Hes1 mRNA(Fig 6C)和蛋白(Fig 6D)表达水平较其sncRNA组升高, 而凋亡相关蛋白Bax和Caspase3 mRNA和蛋白表达水平降低,Bcl-2 mRNA和蛋白表达水平升高(Fig 6A和Fig 6B)。更有趣的是,当用siGAS5#1与槲皮素(80 μmol·L-1)共处理48 h后,我们发现,与Q+sncRNA组相比,GAS5表达明显下调(Fig 5C),而Notch1信号通路的相关蛋白Notch1、Jagged1、Hes1以及凋亡相关蛋白Bcl-2的蛋白表达水平明显升高, Bax和Caspase3的蛋白表达水平降低(Fig 7D和Fig 7B),与其mRNA表达水平相似(Fig 7C和Fig 7A)。这些结果提示槲皮素可通过靶向GAS5来调控MCF-7细胞中Notch1信号通路,从而诱导乳腺癌细胞的凋亡。
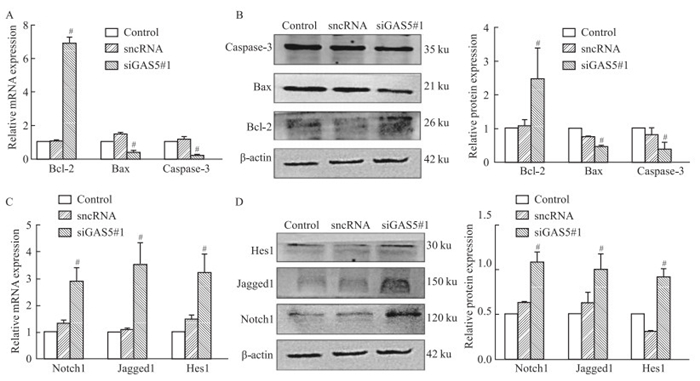
|
| Fig 6 Effect of silencing GAS5 on expression levels of Notch1, Jagged1, Hes1, Bcl-2, Bax and Caspase-3(x±s, n=3) A and C: The Notch1, Jagged1, Hes1, Bcl-2, Bax and Caspase-3 mRNA expressions were detected by qRT-PCR. B and D: The Notch1, Jagged1, Hes1, Bcl-2, Bax and Caspase-3 protein expressions were detected by Western blot. #P < 0.05 vs sncRNA group. |
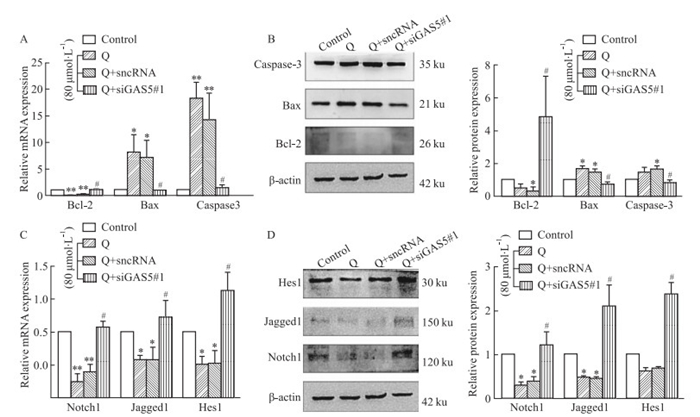
|
| Fig 7 Effects of GAS5 silence and co-treatment with quercetin(80 μmol·L-1) on expression levels of Notch1, Jagged1, Hes1, Bcl-2, Bax and Caspase-3(x±s, n=3) A and C: The Notch1, Jagged1, Hes1, Bcl-2, Bax and Caspase-3 mRNA expressions were examined by qRT-PCR. B and D: The Notch1, Jagged1, Hes1, Bcl-2, Bax and Caspase 3 protein expressions were examined by Western blot. *P < 0.05, **P < 0.01 vs control group; #P < 0.05 vs Q+sncRNA group. |
乳腺癌一直以来因其恶性程度高、预后不良和复发率高等特点成为女性死亡率较高的癌症[1]。近年来,中药在肿瘤治疗包括乳腺癌治疗中因其疗效优和副作用小等特点赢得人们越来越多的关注。然而其潜在的抗癌机制仍不明确,需要更多的研究者们继续深入探究。槲皮素属于黄酮醇类化合物,可抗菌、抗炎、抗过敏、抗氧化以及降血压,还能有效发挥防癌抑癌作用[3]。因此,对槲皮素抗癌分子机制的深入研究将为乳腺癌的防治提供理论依据。目前已有的研究指出槲皮素通过上调miR-146a抑制乳腺癌细胞的增殖和侵袭[11]。本研究中的MTT、平板克隆形成实验、流式细胞术以及Western blot结果均显示槲皮素对乳腺癌细胞的抑制增殖和促凋亡作用。
近年来,越来越多的lncRNAs不仅被发现在多种肿瘤中表达异常,而且对肿瘤进程的影响颇深。GAS5(生长阻滞特异性转录因子5)属于长链非编码RNA,位于人类基因组1号染色体上,与肿瘤的发生发展过程密切相关[12]。作为一种抑癌基因,GAS5可通过影响多种基因组转录和信号传导途径而参与肿瘤的发生发展和耐药性。已有研究显示,GAS5通过调控Wnt/β-catenin信号通路抑制结直肠癌的血管生成和转移[13];GAS5通过调控PTEN表达影响肝癌细胞增殖和耐药性[14]。Mourtada-Maarabouni等[15]研究首次报道,乳腺癌组织中GAS5转录水平显著降低且发现GAS5在乳腺癌中被下调,其低表达水平表明乳腺癌患者的预后不良。有关GAS5在乳腺癌中的调控作用和机制也被报道,例如Zheng等[16]研究指出,GAS5可通过靶向miR-378a-5p/SUFU信号促进三阴性乳腺癌细胞的凋亡;同样,我们课题组前期研究也发现,GAS5/miR-221-3p/DKK2轴可通过Wnt/β-Catenin信号通路调节乳腺癌细胞对ABCB1介导的阿霉素耐药性[17]。这提示我们GAS5将成为一个有潜力的乳腺癌治疗靶点。
近年来,有关中药调控GAS5的癌症研究层出不穷。Chen等[6]研究发现,传统中药补骨脂宁可通过靶向GAS5从而抑制肝癌细胞的发生发展;姜黄素通过抑制致癌的MAPK和PI3K/PKB信号通路上调GAS5,从而促进乳腺癌细胞的凋亡[7]。这些研究为我们的实验奠定了良好的理论基础并提供了一个新思路。有趣的是,本文实验结果发现槲皮素可促进MCF-7细胞中GAS5的表达。
Notch1是一种跨膜蛋白,可作为配体激活的转录因子。配体-受体相互作用引起Notch1细胞外结构域的切割,使胞内的Notch1(ICN1,Notch1的活化形式)从膜中释放并转移到细胞核,从而促进其下游靶基因的转录。Notch1通路是一种重要的促癌信号通路,在乳腺癌中表达上调。Hu等[18]研究揭示,马钱子碱通过抑制Jagged1/Notch1信号通路激活来抑制乳腺癌细胞骨转移。本文实验结果均表明了槲皮素不仅能在mRNA水平,而且可在蛋白水平上均抑制Notch1信号通路相关蛋白的表达,验证了槲皮素对Notch1信号通路的抑制作用。此外,目前已有研究指出GAS5与Notch1之间的强相关性并且表明GAS5可通过调控Notch1信号通路调节疾病的发生发展。Chen等[9]研究发现,GAS5作为与miR-137竞争的内源性RNA通过调控Notch1信号通路从而调节缺血性卒中;Zhao等[10]研究指出,GAS5敲低抑制脑梗死大鼠神经元凋亡可能与Notch1信号通路的激活有关。这些研究让我们产生了新的思考,槲皮素是否能通过靶向GAS5而阻止Notch1促癌信号通路的激活,从而诱导乳腺癌细胞凋亡。我们通过沉默GAS5与槲皮素共处理后发现GAS5与Notch1信号通路之间的强相关性,进一步证明槲皮素是通过靶向GAS5/Notch1信号通路从而促使乳腺癌细胞的凋亡。不足的是,本文研究尚未开展体内实验进一步验证。因此我们课题组后续将采用裸鼠乳腺癌移植瘤模型进行相关研究,以探索和完善槲皮素在体内的作用及其机制。
综上所述,本研究证实了槲皮素抑制人乳腺癌细胞MCF-7细胞的增殖并诱导其凋亡,并表明了槲皮素可通过靶向GAS5/Notch1信号通路发挥其抑癌作用。这对乳腺癌的早期诊断、预后和治疗具有参考价值,为乳腺癌的临床用药开拓了新的治疗方案思路,但其具体机制还有待于进一步验证与阐明。
| [1] |
Ahmad A. Breast cancer statistics: Recent trends[J]. Adv Exp Med Biol, 2019, 1 152: 1-7. |
| [2] |
Wu C, Li M, Meng H, et al. Analysis of status and countermeasures of cancer incidence and mortality in China[J]. Sci Chin Life Sci, 2019, 62(5): 640-7. doi:10.1007/s11427-018-9461-5 |
| [3] |
杨颖, 王芸芸, 蒋琦辰. 槲皮素药理作用的研究进展[J]. 特种经济动植物, 2020, 23(5): 24-8. Yang Y, Wang Y Y, Jiang Q C. Research progress on pharmacological effects of quercetin[J]. Spec Econ Anim Plant, 2020, 23(5): 24-8. doi:10.3969/j.issn.1001-4713.2020.05.009 |
| [4] |
高梦如, 魏小丽, 顾康生. 长链非编码RNA在肿瘤耐药中的作用[J]. 中国药理学通报, 2017, 33(12): 1641-5. Gao M R, Wei X L, Gu K S. Role of long non-coding RNA in drug resistance of tumor[J]. Chin Pharmacol Bull, 2017, 33(12): 1641-5. doi:10.3969/j.issn.1001-1978.2017.12.004 |
| [5] |
Wang J, Ye C, Xiong H, et al. Dysregulation of long non-coding RNA in breast cancer: An overview of mechanism and clinical implication[J]. Oncotarget, 2017, 8(3): 5508-22. doi:10.18632/oncotarget.12537 |
| [6] |
Chen C Y, Chen C C, Shieh T M, et al. Corylin suppresses hepatocellular carcinoma progression via the inhibition of epithelial-mesenchymal transition, mediated by long noncoding RNA GAS5[J]. Int J Mol Sci, 2018, 19(2): 380. doi:10.3390/ijms19020380 |
| [7] |
Squires M S, Hudson E A, Howells L, et al. Relevance of mitogen activated protein kinase (MAPK) and phosphotidylinositol-3-kinase/protein kinase B (PI3K/PKB) pathways to induction of apoptosis by curcumin in breast cells[J]. Biochem Pharmacol, 2003, 65(3): 361-76. doi:10.1016/S0006-2952(02)01517-4 |
| [8] |
Yeh T S, Wu C W, Hsu K W, et al. The activated Notch1 signal pathway is associated with gastric cancer progression through cyclooxygenase-2[J]. Cancer Res, 2009, 69(12): 5039-48. doi:10.1158/0008-5472.CAN-08-4021 |
| [9] |
Chen F, Zhang L, Wang E, et al. LncRNA GAS5 regulates ischemic stroke as a competing endogenous RNA for miR-137 to regulate the Notch1 signaling pathway[J]. Biochem Biophys Res Commun, 2018, 496(1): 184-90. doi:10.1016/j.bbrc.2018.01.022 |
| [10] |
Zhao J H, Wang B, Wang X H, et al. Effect of lncRNA GAS5 on the apoptosis of neurons via the notch1 signaling pathway in rats with cerebral infarction[J]. Eur Rev Med Pharmacol Sci, 2019, 23(22): 10083-91. |
| [11] |
Tao S F, He H F, Chen Q. Quercetin inhibits proliferation and invasion acts by up-regulating miR-146a in human breast cancer cells[J]. Mol Cell Biochem, 2015, 402(1-2): 93-100. doi:10.1007/s11010-014-2317-7 |
| [12] |
Avgeris M, Tsilimantou A, Levis P K, et al. Loss of GAS5 tumour suppressor lncRNA: An independent molecular cancer biomarker for short-term relapse and progression in bladder cancer patients[J]. Br J Cancer, 2018, 119(12): 1477-86. doi:10.1038/s41416-018-0320-6 |
| [13] |
Song J, Shu H, Zhang L, et al. Long noncoding RNA GAS5 inhibits angiogenesis and metastasis of colorectal cancer through the Wnt/beta-catenin signaling pathway[J]. J Cell Biochem, 2019, 120(5): 6937-51. doi:10.1002/jcb.27743 |
| [14] |
Wang C, Ke S, Li M, et al. Downregulation of LncRNA GAS5 promotes liver cancer proliferation and drug resistance by decreasing PTEN expression[J]. Mol Genet Genomics, 2020, 295(1): 251-60. doi:10.1007/s00438-019-01620-5 |
| [15] |
Mourtada-Maarabouni M, Pickard M R, Hedge V L, et al. GAS5, a non-protein-coding RNA, controls apoptosis and is downregulated in breast cancer[J]. Oncogene, 2009, 28(2): 195-208. doi:10.1038/onc.2008.373 |
| [16] |
Zheng S, Li M, Miao K, et al. lncRNA GAS5-promoted apoptosis in triple-negative breast cancer by targeting miR-378a-5p/SUFU signaling[J]. J Cell Biochem, 2020, 121(3): 2225-35. doi:10.1002/jcb.29445 |
| [17] |
Chen Z, Pan T, Jiang D, et al. The lncRNA-GAS5/miR-221-3p/DKK2 axis modulates ABCB1-Mediated adriamycin resistance of breast cancer via the Wnt/beta-Catenin signaling pathway[J]. Mol Ther Nucleic Acids, 2020, 19: 1434-48. doi:10.1016/j.omtn.2020.01.030 |
| [18] |
Hu K F, Kong X Y, Zhong M C, et al. Brucine inhibits bone metastasis of breast cancer cells by suppressing Jagged1/Notch1 signaling pathways[J]. Chin J Integr Med, 2017, 23(2): 110-6. doi:10.1007/s11655-016-2647-2 |

