


2. 广东省心血管病研究所心内科,广东省人民医院医学研究部,广东省医学科学院,广东 广州 510080
 ,
LI Xin1,2,
LI Lu-an1,2,
ZHOU Hui-shan1,2,
PENG De-wei1,2,
ZHANG Meng-zhen2,
WANG Zhao-yu2,
KUANG Su-juan2,
DENG Chun-yu1,2,
RAO Fang1,2,
WU Shu-lin1,2
,
LI Xin1,2,
LI Lu-an1,2,
ZHOU Hui-shan1,2,
PENG De-wei1,2,
ZHANG Meng-zhen2,
WANG Zhao-yu2,
KUANG Su-juan2,
DENG Chun-yu1,2,
RAO Fang1,2,
WU Shu-lin1,2

2. Guangdong Cardiovascular Institute, Guangdong Provincial People's Hospital Medical Research Center, Guangdong Academy of Medical Sciences, Guangzhou 510080, China
房颤(atrial fibrillation,AF)是临床上最常见的心律失常之一,可导致血栓栓塞和心力衰竭, 使患者致死致残[1]。但目前AF的治疗仍有很多局限性,药物治疗副作用多,导管治疗有一定的复发率,而且仅在大型临床中心可以进行[1]。因此,寻找新的治疗药物显得非常重要。高血压是AF的独立危险因素之一, 合并高血压可显著增加AF发生率[2]。目前高血压的治疗率和控制率仍远未达理想,需进一步阐明高血压导致AF的病理机制和寻找新的治疗策略。
心房结构重塑是AF的重要发病机制之一,主要表现为心房间质组织增生和纤维化增多,进而使心房传导异常,产生心房折返通路,导致AF易感性增加[3]。肾素-血管紧张素系统(renin-angiotensin system,RAS)在心房局部组织中的激活,可促进心房的结构和电生理重塑,增加房性心律失常的敏感性[4]。近年研究表明,抑制RAS激活可以减轻心房重构,从而改善AF的发生和发展[5-6]。我们的前期研究也证实,缬沙坦(valsartan,Val)作为一种AT1受体(angiotensin Ⅱ- angiotensin type 1 receptor,AT1R)抑制剂,可抑制自发性高血压大鼠(spontaneously hypertensive rats,SHR)心房组织中的RAS,进而降低AF易感性[7]。而脑啡肽酶抑制剂可以减轻血管收缩、钠储留和适应机体不良重塑时的神经激素激活,进而补充和增强抑制肾素-血管紧张素-醛固酮系统(renin-angiotensin- aldosterone system,RAAS)的作用[8]。沙库巴曲缬沙坦(sacubitril/valsartan,Sac/Val,LCZ696),作为由缬沙坦和脑啡肽酶抑制剂前药沙库巴曲(AHU377)等摩尔比例组成的超分子复合物,可以高选择性抑制AT1受体和脑啡肽酶(中性内肽酶,NEP)[8-9]。近年来,LCZ696在临床上被推荐用于慢性心衰的治疗,并发现其可通过改善心衰患者的左室重塑来减少室性心律失常的发生[10]。动物实验亦发现,沙库巴曲缬沙坦显著减轻兔子心梗后纤维化,减少心室重构[11]。此外,沙库巴曲缬沙坦可以改善压力负荷诱导小鼠的纤维化,进而改善左心房功能[12]。但其是否可防治高血压所致的AF,以及其机制是否通过抑制心房纤维化来减少AF的发生,尚未见相关报道。因此,本研究中,我们拟探究沙库巴曲缬沙坦是否可能通过抑制SHR心房中的RAS,减轻纤维化,逆转结构重构,进而降低AF易感性。
1 材料与方法 1.1 实验动物及分组7周龄,♂, SPF级SHR 24只、Wistar大鼠8只(对照组),购自北京维通利华,生产许可号为SCXK(京)2016-0006,质量检测单位为中山大学实验动物中心。经中山大学实验动物伦理委员会审核(SYSU-IACUC-2020-000220)。将SHR随机分为3组,分别为SHR组、SHR+Sac/Val组(30 mg·kg-1·d-1)和SHR+Sac/Val组(60 mg·kg-1·d-1),以及对照组Wistar大鼠,连续灌胃给药8周,每日1次。
1.2 主要试剂和仪器Ⅰ型胶原蛋白α1链(collagen type Ⅰ α1 chain,Col1A1,GR3334458-1)、抗Ⅲ型胶原蛋白α1链(collagen type Ⅲ α1 chain,Col3A1, GR3272398-8)、ACE-1、ACE2和angiotensin抗体(Abcam);AT1-R抗体(Santa Cruz);抗TGF-β抗体(Cell Signaling Technology);MMP9抗体(Millipore);GAPDH抗体(Proteintech,075501);RIPA裂解液(Beyotime Biotechnology,3228972)。鼠尾无创血压计(IITC Life Science),iWorx数据采集和分析系统,8级心电导管(1.6F)(iWorx Systems),小动物温控加热垫(RDW Life Science),高速冷冻离心机(Beckman Coutler Allegrax-64X),超灵敏化学发光成像仪(GE ImageQuant LAS500)。
1.3 方法 1.3.1 大鼠血压和体质量测定使用IITC大鼠无创血压计测量尾动脉血压。利用固定器将大鼠固定,鼠尾置于感应器中,放入装置内待其安静且温度升至32 ℃后,点击启动按钮测量血压。3次测量大鼠血压并取均值。分别在给药前(7周龄)及给药8周后(15周龄)测定各组每只大鼠的血压。并在给药期间每周测量大鼠体质量,根据体质量调整给药剂量。
1.3.2 大鼠心房快速起搏将大鼠称重,麻醉,腹腔注射3%(45 mg·kg-1)戊巴比妥钠,将其固定于小动物温控加热垫,温度维持在37 ℃-38 ℃。备皮,局部消毒。记录到体表心电图后进行颈静脉置管,沿鞘管送入电极导管至右心房。待记录到腔内心电图后,进行快速起搏,测定起搏阈值和采用心房爆发式(Burst)模式记录AF的诱发率,AF持续时间和窦房恢复时间(SNRT)等。
1.3.3 HE染色和Masson染色动物处死后,取左心房组织,4%多聚甲醛固定,常规包埋、制片后脱蜡、脱水,分别进行HE染色和Masson染色,树胶封片。使用相同参数在光学显微镜(×400)下进行图像随机采集分析。
1.3.4 Western blot实验取绿豆大小的大鼠左心房组织,加入PBS缓冲液清洗残留血液后吸去液体,用眼科剪将组织剪碎。加入200 mL含蛋白酶抑制剂(1 ∶100)的RIPA裂解液,冰上裂解30 min后用电动转子研磨为匀浆,冰上静置20-30 min后12 000 r·min-1离心,15 min,取上清弃沉淀。BCA法测定蛋白浓度,30 μg样本用4×上样缓冲液(TaKaRa) 稀释,40 ℃或100 ℃加热10 min,将蛋白变性。用10% SDS-PAGE分离蛋白,恒压80 mV电泳30 min后转100 mV电泳。将蛋白转至PVDF膜,恒流200 mA转膜2 h。用TBST配制5%脱脂牛奶4 ℃封闭2 h或室温封闭1 h,加入对应的一抗[目的蛋白(1 ∶1 000), GAPDH(1 ∶10 000)],4 ℃孵育过夜。次日用TBST洗膜3次/5 min。用5% 脱脂奶粉稀释抗兔或抗鼠Ⅱ抗(1 ∶1 000),4 ℃孵育2 h或室温孵育1 h后TBST洗膜3次/5 min。ECL试剂盒显影蛋白条带,使用软件ImageJ测量蛋白灰度值,并计算目的蛋白与内参灰度值的比值,进行统计分析。
1.4 统计学处理使用SPSS 26.0进行统计学分析,使用Graphpad Prism 8绘制柱状图,计量资料表示为x±s,多组间比较采用单因素方差分析(One-way ANOVA)。
2 结果 2.1 大鼠血压的变化如Tab 1所示,给药前即7周龄的SHR收缩压,平均血压和舒张压都相较Wistar明显升高(P < 0.01)。干预8周后,SHR组血压仍比Wistar组明显升高(P < 0.01),给药8周后,虽然血压未降至正常,但收缩压、平均血压和舒张压均明显降低(P < 0.01),且SHR+Sac/Val组血压降低效果明显优于SHR+Val组(P < 0.01)。以上结果表明,沙库巴曲缬沙坦可以降低SHR血压,且效果优于缬沙坦。
| Wistar | SHR | SHR+Val | SHR+Sac/Val | ||
| 7W-SBP/kPa | 16.41±0.65 | 22.56±1.32** | 22.88±1.48 | 23.32±2.99 | |
| MBP/kPa | 13.74±0.49 | 18.33±1.87** | 18.65±1.56 | 19.22±3.21 | |
| DBP/kPa | 12.33±0.41 | 16.26±2.22** | 16.57±1.72 | 17.22±3.36 | |
| HR/bpm | 399.4±13.9 | 407.10±14.5 | 394.00±10.40 | 407.60±14.3 | |
| 15W-SBP/kPa | 17.04±1.51 | 26.77±0.28** | 22.84±0.18&& | 21.14±0.84&&## | |
| MBP/kPa | 13.99±1.93 | 23.07±0.69** | 19.01±0.86&& | 17.38±1.05&&# | |
| DBP/kPa | 12.29±2.22 | 21.24±0.93** | 17.12±1.33&& | 15.56±1.36&& | |
| HR/bpm | 394.2±16.30 | 401.30±7.00 | 389.30±12.00 | 397.90±22.60 | |
| Incidence of AF/% | 15.00% | 76.30 %** | 17.50 %&& | 6.30%&&## | |
| Mean AF duration/s | 0.74±0.40 | 3.27±0.60** | 0.87±0.60&& | 0.77±0.50&& | |
| SNRT/ms | 178.10±6.70 | 206.80±9.90* | 197.30±10.30 | 174.00±5.90&& | |
| CSNRT/ms | 38.4±4.90 | 45.80±4.50 | 43.80±6.80 | 34.10±5.40 | |
| PWD/ms | 21.53±0.90 | 28.44±3.10* | 22.00±0.80& | 23.36±0.70 | |
| PR/ms | 41.11±0.90 | 47.19±2.30* | 45.00±1.80 | 47.44±1.50 | |
| SBP, systolic blood pressure; MBP, mean blood pressure; DBP, diastolic blood pressure; HR, heart rate; AF, atrial fibrillation; SNRT, sinus node recovery time; CSNRT, corrected sinus node recovery time; PWD, P -wave duration; PR, PR Interval.*P < 0.05, **P < .01 vs Wistar rats; & P < 0.05, && P < .01 vs SHR; ##P < .01 vs SHR+Val. | |||||
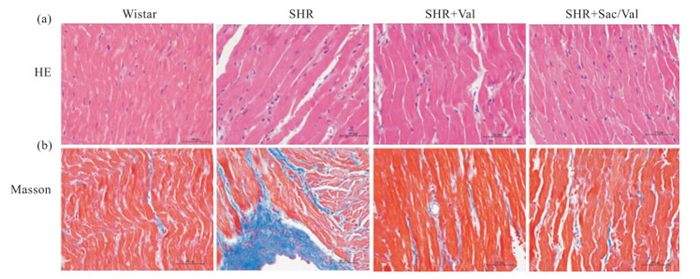
HE染色和Masson染色结果显示,Wistar组心房肌细胞大小正常,细胞排列规则,纤维化不明显; 与之相比,SHR组心房肌细胞肥大明显,可见肌丝断裂,纤维化程度明显加重。而与SHR组相比,SHR+Val组和SHR+Sac/Val组细胞肥大程度有所减轻,且心房肌细胞排列趋于整齐,纤维化明显减轻,并以SHR+Sac/Val组效果更为明显,见Fig 1a和b。
|
| Fig 1 Pathological changes of left atrium observed by HE staining and fibrosis of left atrium determined by Masson staining(×400) (a) HE staining; (b) Masson staining |
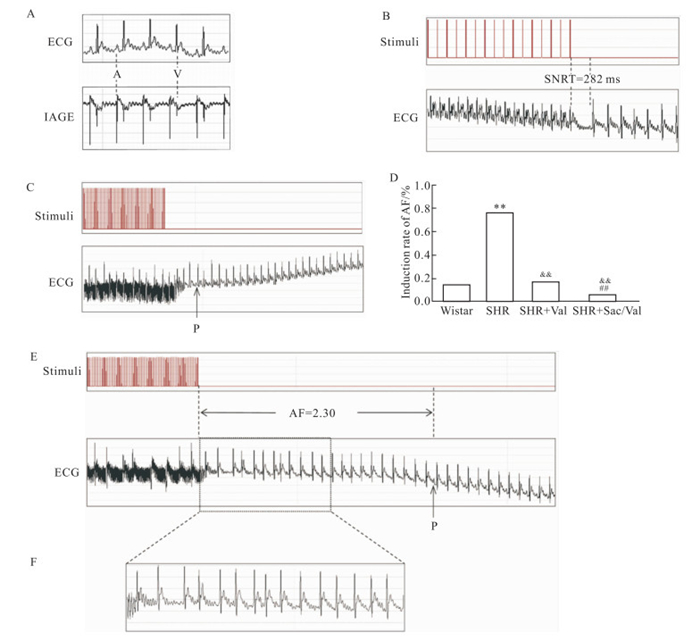
快速起搏心房观察AF的可诱发率,结果发现,与Wistar组相比,SHR组AF诱发率明显升高(P < 0.01);而与SHR组相比,两个给药组AF诱发率明显降低,且SHR+Sac/Val组降低效果明显优于SHR+Val组(P < 0.01)(Fig 2,Tab 1)。各组的AF持续时间结果类似于AF诱发率,SHR组AF持续时间延长,给药后缩短,但各组间差异无统计学意义。SHR组与Wistar组相比,窦房结恢复时间SNRT(ms)明显延长(P < 0.05),给药后SRNT有不同程度的缩短,且SHR+Sac/Val组较SHR+Val组缩短更明显(P < 0.01)。同时,CSNRT结果与SNRT结果一致,但差异无统计学意义。与Wistar组相比,SHR组的P波时限PWD(ms)和PR间期都有明显延长(P < 0.05),给药后均有不同程度的降低,但差异无统计学意义。以上结果表明,沙库巴曲缬沙坦可以降低SHR的AF易感性,且效果优于缬沙坦。
|
| Fig 2 Representative electrophysiology results for atrial rapid pacing in Wistar rats and SHR groups (A) Typical baseline surface electrocardiogram (ECG) and intra-atrial electrocardiogram (IAEG). (B) Typical surface ECG recordings of sinus node recovery time (SNRT) following a 30-s Pacing train. (C) Typical surface ECG recordings of rats maintaining sinus rhythm after atrial burst Pacing. (D) AF incidence in Wistar (n=8), SHR (n=8), SHR+Val (n=8) and SHR+Sac/Val (n=8) groups. **P < 0.01 vs Wistar rats; &&P < 0.01 vs SHR; ##P < 0.01 vs SHR+Val. (E) Typical surface ECG recordings of rats with AF that spontaneously reverted to sinus rhythm. (F) Typical disorganized atrial wave (f wave). |
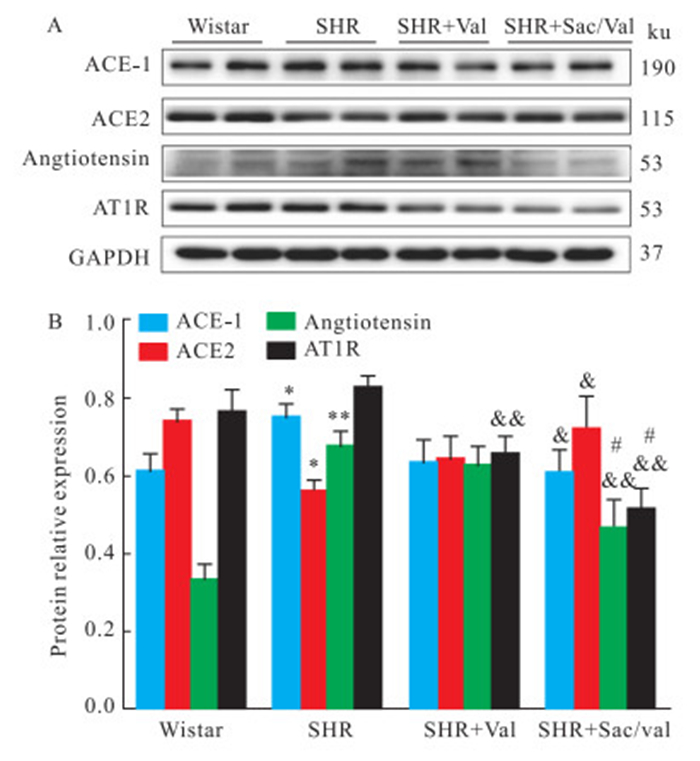
为了观察RAS在其中起的作用,我们对大鼠左心房组织中RAS相关蛋白的表达进行了检测,根据Western blot结果显示,SHR组心房组织中ACE-1和angiotensin蛋白表达明显上调(P < 0.05),给予缬沙坦和沙库巴曲缬沙坦后,上述蛋白及AT1R蛋白表达均有不同程度的下调,且SHR + Sac/Val组下降更为明显(P < 0. 05)。此外,SHR心房组织ACE2蛋白表达明显下调(P < 0.05),沙库巴曲缬沙坦治疗后明显上调(P < 0. 05),见Fig 3。
|
| Fig 3 RAS related proteins expression in left atrial tissues of Wistar rats and SHR groups (x±s) (A) Representative Western blots of ACE-1, ACE2, angiotensin and AT1R protein in left atrial tissues of Wistar rats, SHR, SHR+Val and SHR+Sac/Val. GAPDH was the internal control.(B) Densitometric analysis of ACE-1, ACE2, angiotensin and AT1R protein in left atrial tissues of Wistar rats, SHR, SHR+Val and SHR+Sac/Val(n=6-8). (*P < 0.05, **P < 0.01 vs Wistar rats; &P < 0.05, &&P < 0.01 vs SHR; #P < 0.05 vs SHR+Val) |
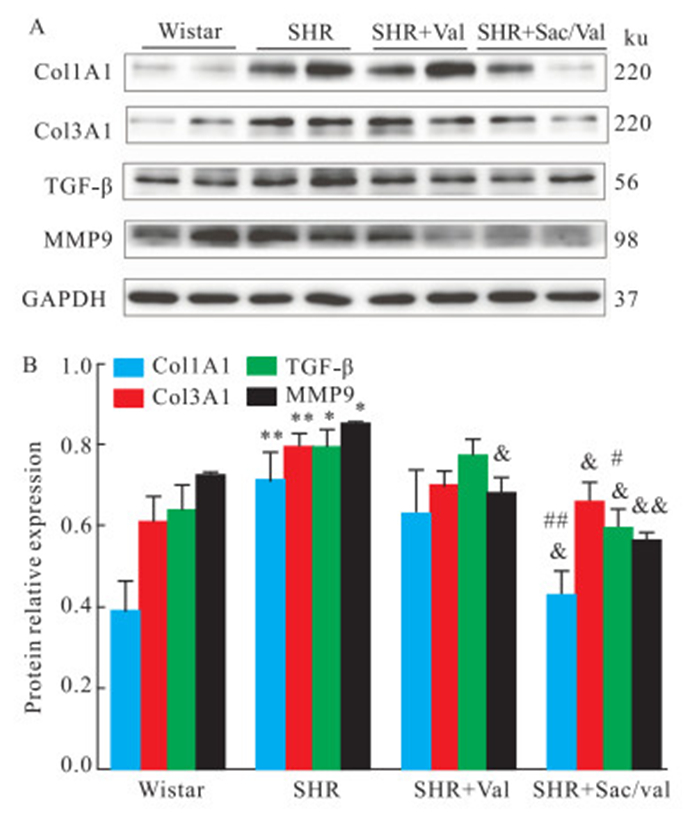
同时,对大鼠左心房组织进行Western blot检测纤维化指标。如Fig 4所示,与Wistar大鼠相比,SHR组心房组织中纤维化蛋白Col1A1、Col3A1、TGF-β和MMP 9均明显上调(P < 0.05),给药后,两种药物使上述纤维化蛋白有不同程度的下调,且以LCZ696效果更明显(P < 0. 05)。提示缬沙坦和沙库巴曲缬沙坦均可使SHR心房纤维化程度明显减轻,但沙库巴曲缬沙坦的效果优于缬沙坦。
|
| Fig 4 Fibrosis related protein expression in left atrial tissues of Wistar rats and SHR groups(x±s) (A) Representative Western blots of Col1A1, Col3A1, TGF-β and MMP 9 protein in left atrial tissues of Wistar rats, SHR, SHR+Val and SHR+Sac/Val. GAPDH was the internal control. (B) Densitometric analysis of Col1A1, Col3A1, TGF-β and MMP 9 protein in left atrial tissues of Wistar rats, SHR, SHR+Val and SHR+Sac/Val (n=6-8). (*P < 0.05, **P < 0.01 vs Wistar rats; & P < 0.05, & & P < 0.01 vs SHR; #P < 0.05, ##P < 0.01 vs SHR+Val) |
本研究结果表明,沙库巴曲缬沙坦可以通过下调ACE-1,angioten sin和AT1R的蛋白表达,抑制SHR心房的RAS激活;并可使Col1A1、Col3A1、TGF-β和MMP9蛋白表达下调,改善大鼠心房纤维化,逆转结构重构,减少AF的发生,且效果优于缬沙坦。
沙库巴曲缬沙坦是由血管紧张素受体拮抗剂-缬沙坦和脑啡肽酶抑制剂前药-沙库巴曲1 ∶1比例组成的超分子复合物,每100 mg中含缬沙坦51 mg和沙库巴曲49 mg,其可以高选择性地抑制AT1受体和脑啡肽酶[8-9]。近年来被认为是慢性心衰药物治疗的重大突破[10]。本研究结果显示,缬沙坦和沙库巴曲缬沙坦可有效降低SHR的血压,且沙库巴曲缬沙坦降压效果更优。沙库巴曲缬沙坦钠通过LBQ657(前药AHU377的活性代谢产物)抑制NEP,同时通过缬沙坦阻断AT1受体。通过LBQ657増加脑啡肽酶所降解的肽类水平(例如利钠肽),缬沙坦可通过选择性阻断AT1受体抑制血管紧张素-Ⅱ(angiotensin-Ⅱ,Ang-Ⅱ)作用,还可抑制Ang-Ⅱ依赖性醛固酮释放。因此沙库巴曲缬沙坦在抑制RAAS的同时可调节利钠肽系统,从而增强血管舒张,降低血压[8]。然而单独抑制脑啡肽酶不会引起临床上有意义的血压降低,因为会引起依赖脑啡肽多肽血管的收缩剂如Ang-Ⅱ的增加。缬沙坦作为AT1受体的抑制剂,还能阻断NEP抑制后NPs水平升高所引起的反射性RAAS激活[13]。临床研究也证实,沙库巴曲缬沙坦剂量依赖性降低患者血压,且效果优于缬沙坦[9]。
慢性心衰治疗的大型临床研究结果显示,沙库巴曲缬沙坦可通过减轻左室重塑减少室性心律失常的发生[10]。动物实验也发现,与独立的脑啡肽酶抑制剂或血管紧张素受体阻滞剂相比,沙库巴曲缬沙坦对心脏纤维化和心脏肥大有明显抑制作用,可减轻大鼠心肌梗死后的心脏重构和功能障碍[14]。以及在糖尿病小鼠心衰模型中,沙库巴曲缬沙坦可通过抑制TGF-β,减少纤维化,改善心脏功能。并且该作用可能是由于脑啡肽酶的特异性抑制,而沙库巴曲缬沙坦中的缬沙坦不起作用[15]。但沙库巴曲缬沙坦对高血压所致的心房纤维化和房性心律失常的作用尚未见相关报道。
体内RAAS激活导致Ang-Ⅱ增加,刺激纤维化因子生成增加,导致心房结构重构和电重构,进而使AF易感性增加[4]。动物实验发现,选择性心脏过度表达ACE小鼠血浆Ang-Ⅱ浓度增加,心房扩张,纤维化和AF敏感性增加。而使用RAAS抑制剂可以使Ang-Ⅱ表达减少,抑制纤维化因子生成。有研究发现,SHR予坎地沙坦治疗后,可降低Ang-Ⅱ水平,抑制TGF-β1的表达,减少纤维化的作用[16]。本研究发现,缬沙坦和沙库巴曲缬沙坦均可明显改善SHR的心房纤维化,以及明显降低AF的可诱发率,且沙库巴曲缬沙坦效果优于缬沙坦。这可能与沙库巴曲缬沙坦同时增强其他肽类物质的作用有关,尤其是神经肽(NPs)和肾上腺髓质素(ADM),两者发挥很强的利尿钠,利尿和血管扩张作用,并具有抗增殖和抗肥大作用[13]。此外,NPs系统中的CNP和BNP似乎在涉及鸟苷酸环化酶-C受体(NPR-C)的心脏成纤维细胞中具有重要的抗增殖作用[17]。
综上所述,沙库巴曲缬沙坦作为血管紧张素受体和脑啡肽酶抑制剂,与AT1受体抑制剂缬沙坦相比,能更好地抑制心房RAS的激活,从而表现出更好的抑制纤维化作用,在防止高血压所致AF中具有很好应用前景。
| [1] |
Nattel S. New ideas about atrial fibrillation 50 years on[J]. Nature, 2002, 415(6868): 219-26. |
| [2] |
January C T, Wann L S, Calkins H, et al. 2019 AHA/ACC/HRS focused update of the 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: A report of the American College of Cardiology/American Heart Association Task Force on clinical practice guidelines and the heart rhythm society[J]. J Am Coll Cardiol, 2019, 74(1): 104-32. |
| [3] |
Burstein B, Nattel S. Atrial fibrosis: Mechanisms and clinical relevance in atrial fibrillation[J]. J Am Coll Cardiol, 2008, 51(8): 802-9. |
| [4] |
January C T, Wann L S, Alpert J S, et al. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: A report of the American College of Cardiology/American Heart Association Task Force on practice guidelines and the Heart Rhythm Society[J]. Circulation, 2014, 130(23): e199-267. |
| [5] |
Waldo A L. Prevention of atrial fibrillation with angiotensin-converting enzyme inhibitors and angiotensin receptor blockers: A meta-analysis[J]. Yearbook Cardiol, 2006, 2006: 421-2. |
| [6] |
Schneider M P, Hua T A, Bohm M, et al. Prevention of atrial fibrillation by Renin-Angiotensin system inhibition a meta-analysis[J]. J Am Coll Cardiol, 2010, 55(21): 2299-307. |
| [7] |
Li X, Deng C Y, Xue Y M, et al. High hydrostatic pressure induces atrial electrical remodeling through angiotensin upregulation mediating FAK/Src pathway activation[J]. J Mol Cell Cardiol, 2020, 140: 10-21. |
| [8] |
Gu J, Noe A, Chandra P, et al. Pharmacokinetics and pharmacodynamics of LCZ696, a novel dual-acting angiotensin receptor-neprilysin inhibitor (ARNi)[J]. Clin Pharmacol, 2010, 103(20): 1569-77. |
| [9] |
Ruilope L M, Dukat A, Böhm M, et al. Blood-pressure reduction with LCZ696, a novel dual-acting inhibitor of the angiotensin Ⅱ receptor and neprilysin: A randomised, double-blind, placebo-controlled, active comparator study[J]. Lancet, 2010, 375(9722): 1255-66. |
| [10] |
Sarrias A, Bayes-Genis A. Is Sacubitril/Valsartan (Also) an antiarrhythmic drug[J]. Circulation, 2018, 138(6): 551-3. |
| [11] |
Torrado J, Cain C, Mauro A G, et al. Sacubitril/Valsartan averts adverse post-infarction ventricular remodeling and preserves systolic function in rabbits[J]. J Am Coll Cardiol, 2018, 72(19): 2342-56. |
| [12] |
Suo Y, Yuan M, Li H, et al. Sacubitril/Valsartan improves left atrial and left atrial appendage function in patients with atrial fibrillation and in pressure overload-induced mice[J]. Front Pharmacol, 2019, 10: 1285. |
| [13] |
Gervasini G, Robles N R. Potential beneficial effects of sacubitril-valsartan in renal disease: A new field for a new drug[J]. Expert Opin Investig Drugs, 2017, 26(5): 651-9. |
| [14] |
Von Lueder T G, Wang B H, Kompa A R, et al. Angiotensin receptor neprilysin inhibitor LCZ696 attenuates cardiac remodeling and dysfunction after myocardial infarction by reducing cardiac fibrosis and hypertrophy[J]. Circ Heart Fail, 2015, 8(1): 71-8. |
| [15] |
Suematsu Y, Miura S, Goto M, et al. LCZ696, an angiotensin receptor-neprilysin inhibitor, improves cardiac function with the attenuation of fibrosis in heart failure with reduced ejection fraction in streptozotocin-induced diabetic mice[J]. Eur J Heart Fail, 2016, 18(4): 386-93. |
| [16] |
周珂, 王芳, 余绍祖. 氯沙坦对自发性高血压大鼠脑组织肾素血管紧张素系统的影响[J]. 中国药理学通报, 2003(4): 441-4. Zhou K, Wang F, Yu S Z. Effects of losartan on renin-angiotensin system in brain tissue of spontaneously hypertensive rats[J]. Chin Pharmacol Bull, 2003(4): 441-4. |
| [17] |
Rose R A, Giles W R. Natriuretic peptide C receptor signalling in the heart and vasculature[J]. J Physiol, 2008, 586(2): 353-66. |