

2. 军事科学院军事医学研究院辐射 医学研究所,北京 100850;
3. 天津中医药大学中医药研究院,天津 301617
高月(1963-),女,博士,研究员,博士生导师,研究方向:中药毒理,通讯作者,E-mail:gaoyue@bmi.ac.cn
2. Institute of Radiation Medicine, Academy of Military Medical Sciences, Beijing 100850, China;
3. Academy of Traditional Chinese Medicine Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
含乌头碱类中药,如附子(乌头的子根)、川乌(干燥母根)、草乌(干燥块茎)、天雄等,早在东汉时期就已经被《神农本草经》收录药用,具有回阳救逆、补火助阳、散寒止痛功效,主治亡阳虚脱、肢冷脉微、心阳不足、肾阳虚衰、寒湿痹痛等病证,尤以附子为甚,常被誉为“回阳就逆第一品药” [1]。现代药理学表明,乌头碱是附子中所含的一种C19-二酯二萜生物碱,具有显著的抗炎、镇痛、强心作用,但同时也兼具极强的心脏毒性和神经毒性,特别是诱发的室性心律失常,被认为是附子最重要毒副作用。因此,国家药典对附子临床药用剂量(≤15 g)以及乌头碱含量有严格的控制标准(≤0.02%)。
部分文献发现,乌头碱作为附子主要药效成分,其安全窗口狭窄,是0.25-4 μmol·L-1[2]。在此浓度范围内,低剂量乌头碱可产生一定的正向肌力作用(强心)和抗炎功效。已有学者利用动物实验发现,参附汤超微粉或炮制附子浓缩颗粒低剂量长时间灌胃后,大鼠心脏等脏器中出现明显的乌头碱蓄积[3-4]。本课题团队前期工作首次证实,小剂量(≤10 μmol·L-1)乌头碱持续给药,蓄积的乌头碱虽不会导致心肌细胞器质性损伤,但可通过Notch1信号通路改变心肌细胞自身节律,存在潜在致心律失常风险[5]。提示,即便是在现有安全剂量窗下,乌头碱或含乌头碱类药物长期使用,也会存在潜在慢性心脏毒性效应。
为确保心肌细胞线粒体功能和形态的完备,每个细胞每4 min更新一个线粒体单位[6]。本团队首次发现,乌头碱(20 nmol·L-1-2.5 μmol·L-1)单次给药即会造成线粒体更新循环加速,且干扰线粒体能量代谢过程[7]。但截至目前,尚无相关研究关注低剂量长期或持续乌头碱给药后,心肌细胞线粒体能量代谢模式是否会产生明显改变。
人诱导多能干细胞分化的心肌细胞(human induced pluripotent stem cell-derived cardiomyocytes, hiPSCs-CM),具备人胚胎干细胞分化心肌细胞类似的生理特性。此外,因克服种属差异、易于体外长时培养且适合高通量筛选等优点,hiPSCs-CM已成为药物心脏毒效筛选的理想工具。鉴于乌头碱种属代谢存在一定差异,同时也为了更加真实反映含乌头碱类中药长期服用过程中,低剂量乌头碱对人体心肌细胞线粒体功能的影响,本文选择构建hiPSCs-CM开展后续相关研究工作[8]。本研究揭示线粒体能量代谢模式的改变,可能是低剂量乌头碱慢性心肌毒性的作用靶点,为临床安全剂量下长期使用含乌头碱类中药提供数据参考。
1 材料与方法 1.1 药品与试剂乌头碱购于成都曼斯特生物科技有限公司,批号MUST-17110910,纯度98.01%。干细胞培养基mTeSRTM Plus(货号05825)、STEMdiffTM Cardiomyocyte Differentiation Kit(货号05010)、STEMdiffTM Cardiomyocyte Maintenance Kit(货号05020)均购自加拿大Stemcell公司。Seahorse XF DMEM培养基(货号103575-100)购自美国Agilent公司。逆转录聚合酶链式反应试剂盒(货号AT311),实时荧光定量试剂盒(货号AQ101)均购自北京全式金生物技术有限公司,PCR引物由生工生物工程(上海)股份有限公司合成(Tab 1); Oct4A Rabbit mAb抗体(货号2890S),α-Actinin Mouse mAb抗体(货号69758S),Anti-mouse IgG(货号8890S)均购自美国Cell Signaling Technology公司;山羊抗兔IgG(货号ab150077,ab6721), 山羊抗小鼠IgG(货号ab6789)均购自英国Abcam公司。
| Gene | Forward primer (5′-3′) | Reverse primer (5′-3′) | TEMP/℃ |
| MCT | AGGTCCAGTTGGATAC ACCCC | GCATAAGAGAAGCCGATG GAAAT | 54 |
| FATP | ACGCCGATGATGTTTC CTG | TATGACTGCCTGCCCCTGTA | 56 |
| ACC | CAAGCCGATCACCAA GAGTAAA | CCCTGAGTTATCAGAGGC TGG | 54 |
| CPT1 | GCGCCCCTTGTTGGAT GAT | CCACCATGACTTGAGCAC CAG | 54 |
| Glut1 | CGGGTGTCTTGTCACT TTGG | TCTTCACTGTGCTCCTGGTT | 54 |
| Glut4 | TTTTGAGATTGGCCCT GGCCCCAT | CTCAGGTACTCTTAAGAAG GTGAAG | 54 |
GeneAmp PCR System 2400型PCR仪(美国Applited Biosystem公司);激光扫描共聚焦显微镜LSM880 (德国ZEISS);微电极应用平台(美国Axion BioSystems公司);Seahorse XFe96细胞代谢呼吸动态分析仪(美国Agilent公司);Opera Phenix双转盘式共聚焦高内涵分析系统(美国Perkin Elmer公司)。
1.3 方法 1.3.1 细胞系和实验分组 1.3.1.1 人源心肌细胞AC16培养由中国人民解放军疾病预防控制中心彭双清研究员团队惠赠(购于ATCC)。AC16细胞铺板于含有10% FBS, 105 IU·L-1青霉素和100 mg·L-1链霉素的DMEM/F-12培养基中,置于5% CO2,37 ℃恒温培养箱中培养。实验分组:①正常对照组, ②乌头碱1 nmol·L-1组, ③乌头碱10 nmol·L-1组, ④乌头碱100 nmol·L-1组, ⑤乌头碱1 μmol·L-1组, ⑥乌头碱10 μmol·L-1组。
1.3.1.2 hiPSCs-CM诱导分化人诱导多能干细胞hiPSCs购于北京赛贝生物技术有限公司。hiPSCs培养于mTeSRTM Plus中,复苏后第3代开始进行诱导分化。铺板当天记为d-2,在d-1更换新的mTeSRTM Plus培养基。确认细胞融合度达到95%以上,分别在d 0、d 2更换含有添加因子A, B的分化培养基,d 4、d 6更换含有添加因子C的分化培养基。d 8-15,进行维持培养。从d 8开始,诱导分化的心肌细胞出现小幅度跳动,d 15后,hiPSCs-CM诱导分化结束,可用于下游实验。
1.3.2 免疫荧光hiPSCs-CM设置正常对照组和给药组,处理10 d。移去培养基,加入免疫染色固定液,室温静置10 min后,加入洗涤液静置洗涤。加入封闭液,室温封闭2 h。移去封闭液,加入适当比例稀释的一抗,4 ℃静置过夜。回收一抗,静置洗涤3次。加入适当比例稀释的二抗,4 ℃避光孵育2 h,静置洗涤3次,最后加入含DAPI抗淬灭封片剂。
1.3.3 qRT-PCRTRIzol法提取hiPSCs-CM RNA,定量检测RNA浓度,合成cDNA,进行qRT-PCR,反应条件为94 ℃进行2 min,94 ℃变性15 s,退火30 s(不同引物退火温度见Tab 1),72 ℃延伸20 s,循环进行40次。采用△△Ct法分析Ct值,以2-△△Ct表示目的基因的表达量。
1.3.4 Western blot移去培养基后加入100 μL细胞裂解液,用刮刀收集细胞,14 000 g离心30 s提取蛋白。将收集管置于冰上,采用BCA定量法进行定量。将定量变性后的蛋白进行凝胶蛋白电泳,转膜,封闭,抗体孵育,化学发光,显影,最后结果用ImageJ软件处理。为获得足量蛋白,此实验在AC16上进行。
1.3.5 微电极阵列记录将hiPSCs-CM铺板到电极板上7 d后,采用Axion BioSystems微电极应用平台检测心肌细胞4个关键指标:收缩性、场电位(field potentials, FP)、胞外局部动作电位(local extracellular action potential,LEAP)和搏动传播的基础值(baseline)后,进行加药,在加药后d 1、4、7、10读取电信号。
1.3.6 细胞能量代谢提前5 h预热检测系统, 水化探针板。实验当天,配制检测液,细胞清洗后放入37 ℃无额外补充CO2的培养箱60 min等待上机检测。实验过程中,注射终浓度分别为10 mmol·L-1葡萄糖、1.5 μmol·L-1寡霉素(oligomycin),50 mmol·L-1 2-脱氧葡萄糖(2-Deoxy-D-glucose, 2-DG)、4 μmol·L-1羰基-氰-4-三氟甲氧基苯腙(Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone,FCCP)、0.5 μmol·L-1抗霉素A(antimycin A)和鱼藤酮(rotenone)。染色细胞核成像,采用Opera Phenix共聚焦高内涵分析系统对所得数据归一化处理。
1.3.7 统计学方法实验数据用GraphPad Prism 8.3软件进行统计并绘制成图,结果以x±s表示,两组间比较采用t-检验。多组间比较采用单因素方差分析(analysis of variance, ANOVA)。
2 结果 2.1 hiPSCs培养并诱导分化为hiPSCs-CM按照Fig 1A所示,经过为期15 d的诱导分化后,取未分化hiPSCs及分化后hiPSCs-CM进行免疫荧光标志物检测。结果如Fig 1B所示,在hiPSCs中仅能检测到干细胞特异性基因八聚体结合转录因子4(octamer-binding transcription-factor 4,Oct4)剪切变体OCT4A的表达,而缺乏心肌细胞标志物辅肌动蛋白(actinin alpha,α-Actinin)表达。hiPSCs-CM中可检测到α-Actinin表达,而OCT4A未见表达;表明hiPSCs-CM诱导分化成功,可用于后续低剂量乌头碱持续给药实验。

|
| Fig 1 The induced differentiation of hiPSCs to hiPSCs-CM A: Protocol of hiPSCs-CM differentiation and maintenance; B: Expression of hiPSCs pluripotency marker OCT4A (green) and hiPSCs-CM marker α-Actinin (red) after differentiation were detected by immunofluorescence. Nuclei were stained by DAPI (blue). |
MEA检测乌头碱100 nmol·L-1持续给药处理后hiPSCs-CM的收缩性、FP、LEAP和搏动传播的变化。如Fig 2所示,与对照组相比,100 nmol·L-1乌头碱持续给药可导致hiPSCs-CM搏动周期缩短,FP和LEAP时程均明显缩短,传导速度增加,兴奋收缩延迟降低,但未见明显的心律失常指征。结果提示,低剂量乌头碱作用于心肌细胞,初期使其出现高频收缩,产生强心功效,持续给药后期虽未诱发心律失常,但使心肌收缩力降低。
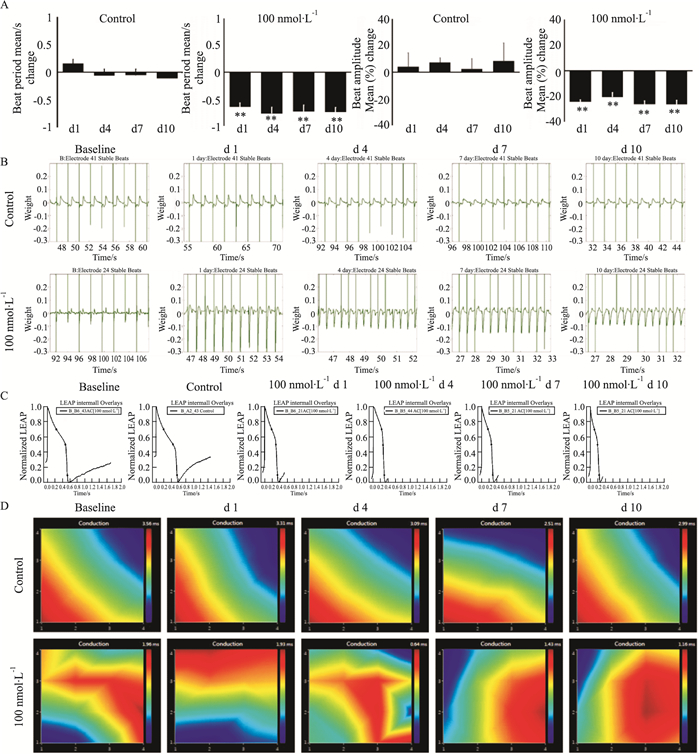
|
| Fig 2 The changes of hiPSCs-CM functions after treated 100 nmol·L-1 aconitine for 10 consecutive days were recorded by MEA A: Contractility was represented by beat periods and beat amplitudes. **P < 0.01 vs baseline (n=4); B: Field Potentials; C: Local extracellular Action Potential; D: Propagation |
与对照组相比,hiPSCs-CM进行100 nmol·L-1乌头碱持续10 d给药处理后,线粒体基础氧耗、ATP合成能力与最大耗氧相应增加(Fig 3A-D),表明hiPSCs-CM的线粒体能量代谢功能增强;同时,抑制氧化磷酸化供能之后,乌头碱给药组利用糖酵解达到最大产生能量的能力增加(Fig 3E);此外,乌头碱可诱导糖酵解来源的ATP产生增加,能量表型分析也显示能量产生向糖酵解方向偏移(Fig 3F、3G)。以上结果均提示,低剂量乌头碱持续给药后,hiPSCs-CM能量代谢方式向快速供能的糖酵解转变,以满足心肌细胞高频搏动的快速供能的需要。
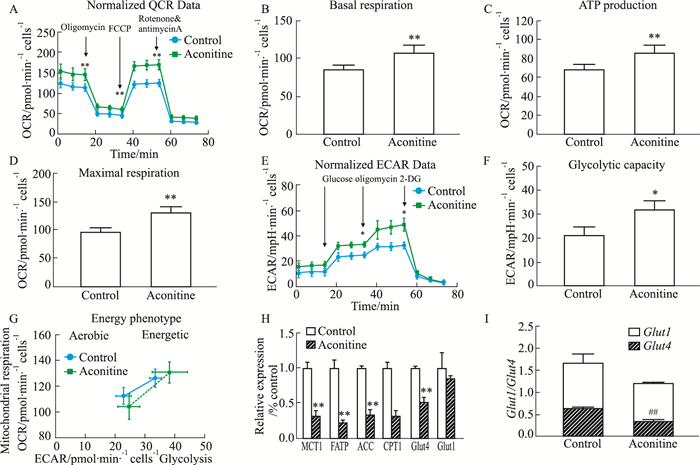
|
| Fig 3 Effect of treatment with 100 nmol·L-1 aconitine for 10 consecutive days on energy metabolism and expression of genes of hiPSCs-CM were determined by seahorse and qRT-PCR A: Mitochondrial stress tests: representative hippocampal OCR curves of hiPSCs-CM. B, C and D: According to mitochondrial stress test curve, the OCR parameters were calculated, including basal respiration, ATP production and maximal respiration; E: Glycolysis stress tests: representative hippocampal ECAR curves of hiPSCs-CM; F: According to glycolysis stress tests curve, the ECAR parameter was calculated, including glycolytic capacity; G: Energy Phenotype Profile: The relative utilization of the two energy pathways of hiPSCs-CM is measured under both baseline phenotype and stressed phenotype conditions; H: The expression of genes were tested by qRT-PCR engaged in MCT1, Glut1 and Glut4 in glycolysis and ACC and CPT1 in lipid metabolism. *P < 0.05, **P < 0.01 vs control, n≥3. I: Glut1/Glut4 in control and 100 nmol·L-1 aconitine. ##P < 0.01, Glut1 vs Glut4. |
qRT-PCR结果显示,与对照组相比,100 nmol·L-1乌头碱连续给药10 d后,参与脂肪酸代谢的脂肪酸转运蛋白(fatty acid transport proteins,FATP)、乙酰辅酶a羧化酶(acetyl-CoA carboxylase,ACC)、肉碱棕榈酰转移酶(carnitine palmitoyl transferase 1,CPT1)表达均显著降低(Fig 3H);调控葡萄糖代谢的重要基因单羧酸转运蛋白(monocarboxylate transporter 1,MCT1)和葡萄糖转运蛋白4(facilitative glucose transporters 4,Glut4)的表达也收到明显抑制(Fig 3H),但葡萄糖转运蛋白1(facilitative glucose transporters 1,Glut1)表达无明显变化,Glut1/Glut4含量比值显著升高(Fig 3I)。提示,低剂量乌头碱长期持续给药处理后,心肌能量代谢底物选择发生改变,可能是乌头碱诱导hiPSCs-CM能量代谢模式重构的重要机制之一。
2.5 低剂量乌头碱持续给药诱导hiPSCs-CM多能性增强Western blot和免疫荧光结果如Fig 4所示,与对照组相比,给药组c-Myc和OCT4A在低剂量组中(≤100 nmol·L-1)表达明显增加,α-Actinin却剂量依赖性降低(Fig 4A、B)。特别是OCT4A,免疫荧光结果也显示在100 nmol·L-1乌头碱组中表达明显(Fig 4C)。表明低剂量乌头碱持续给药处理后,心肌细胞呈现多能性获得的趋势。
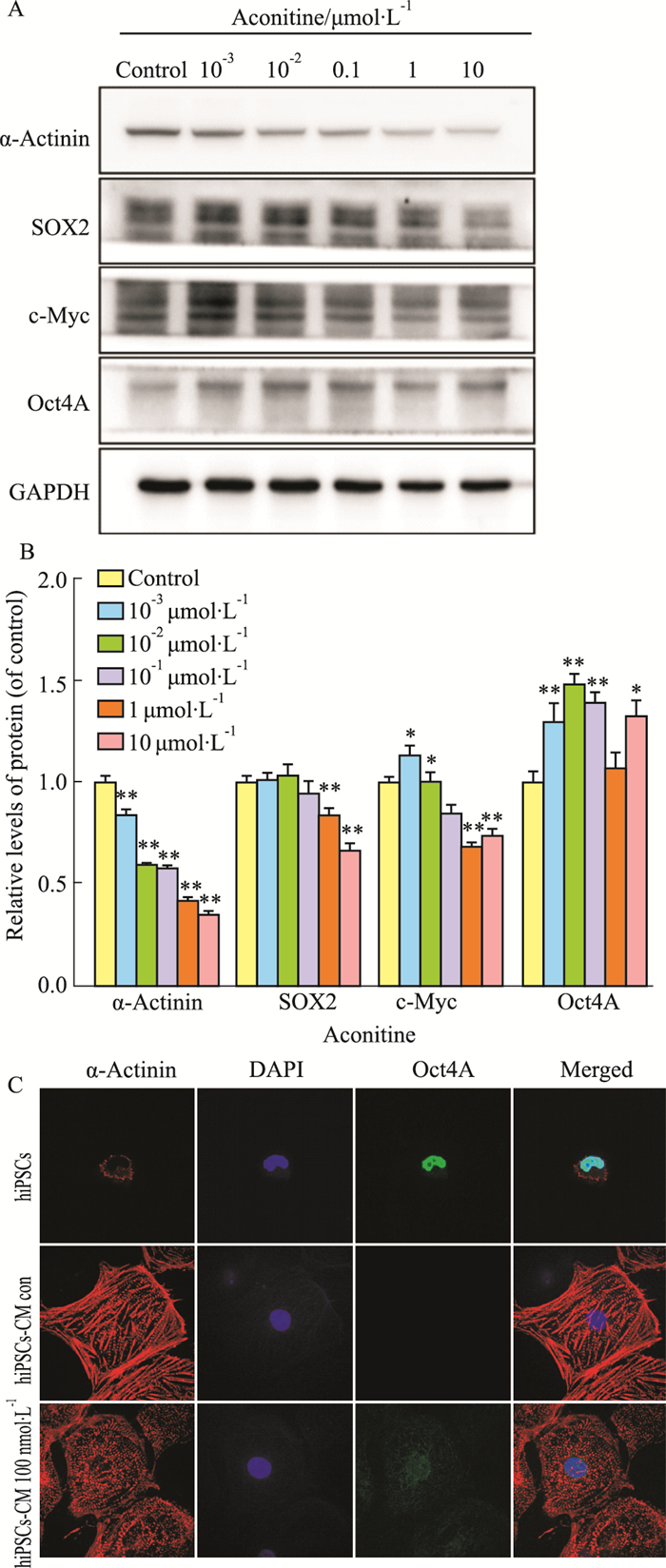
|
| Fig 4 Expression of hiPSCs pluripotency transcription factors in hipscs-CM were detected after treated with low dose aconitine A, B: The protein levels of α-Actinin, SOX2, c-Myc and OCT4A in AC16 cells were detected by WB. *P < 0.05, **P < 0.01 vs control; C: Expression of hiPSCs pluripotency marker OCT4A (green) and hiPSCs-CM marker α-Actinin (red) in hiPSCs-CM after treated with low dose aconitine by immunofluorescence. Nucleus were stained by DAPI (blue). |
含乌头碱类中药对心力衰竭、心源性休克等危重病症疗效显著。乌头碱作为其重要药效成分,主要通过诱发正向肌力作用发挥功效。但该二萜类双酯生物碱安全窗口狭窄且心脏毒性显著,稍过量极易诱发心律失常,甚至猝死等急性毒副作用[9]。目前,乌头碱研究较为多集中在较大药用剂量下引发的急性心脏毒性[10-11],对安全剂量下长期用药风险研究甚少。本研究团队前期首次证实,小剂量乌头碱持续给药存在潜在致心律失常风险,同时还首次发现安全药用剂量下的乌头碱可影响线粒体更新与能量代谢过程。这些前期工作均提示,在安全药用剂量范围内,乌头碱长期用药也存在慢性心脏毒性风险,且线粒体可能是重要的毒性效应靶点。
与之前的研究相一致[12],本研究也证实低剂量乌头碱持续给药可诱导心肌出现高频低幅的搏动方式(搏动周期缩短与收缩速度加快),进而产生正性肌力作用,但该过程中亟需心肌细胞快速提供充足的能量作为支撑。正常成熟心肌的能量供应主要依靠游离脂肪酸β氧化所产生的ATP,该过程中核心环节是脂肪酸氧化产生的系列底物在线粒体中进行氧化磷酸化。虽然,我们发现低剂量乌头碱持续给药后,心肌细胞线粒体能量代谢功能增强,但是其中糖酵解能量代谢水平增加显著,反映心肌细胞的能量代谢表型逐渐从脂肪酸有氧氧化向糖酵解方向偏移。这可能与心肌快速收缩过程,能量供应不足,氧耗较高,糖酵解供能方式更加直接、快速且节约氧有关。同时,通过分析糖、脂代谢调控关键基因表达发现,脂肪酸转运、氧化相关基因,如FATP、ACC、CPT1等被明显抑制[13],相反,Glut1等葡萄糖代谢相关基因表达无明显影响,证实低剂量乌头碱持续给药可以通过影响底物选择由脂肪酸向葡萄糖转变,进而改变心肌细胞能量代谢方式。
在心脏发育早期,幼稚心肌细胞供能方式主要是利用葡萄糖糖酵解产生ATP,此时心肌细胞中Glut1/Glut4约为1/2。随着心肌逐渐分化成熟,Glut4比例明显增加,Glut1/Glut4逐渐降低,心肌细胞糖酵解供能方式也相对弱化[14-15]。低剂量乌头碱持续给药后,hiPSCs-CM中Glut1/Glut4明显增加,且出现多能性调节因子OCT4A表达增加、心肌骨架蛋白α-Actinin表达减少的现象,证实低剂量乌头碱长期给药可诱导hiPSCs-CM多能性获得,呈现一定的去分化状态,此时心肌细胞能量代谢模式向“胚胎样代谢模式”转变,即糖酵解功能增加。有研究表明,无论是底物选择改变还是多能性获得导致的心肌细胞能量代谢模式重构,虽可在短时内保护心肌免受损伤,但长此以往,此类模式与心衰过程中的能量代谢方式类似,可导致心肌纤维张力和韧性受到影响,不利于维持心肌发挥正常收缩功能[16]。因此,低剂量乌头碱诱导的线粒体能量代谢模式重构可能参与其慢性心肌毒性的发生。
综上所述,本研究首次发现低剂量乌头碱持续给药处理,可导致hiPSCs-CM的心肌能量代谢模式重构,以满足正向肌力作用所需能量。该过程中,乌头碱诱导心肌细胞能量代谢底物选择以及多能性获得可能参与其中并发挥重要作用。因此,本研究为安全剂量下乌头碱慢性心肌毒性确证与干预提供重要数据支持。
| [1] |
王守宝, 龚宁波, 段昌令, 等. 乌头类中药毒的历史认识与现代研究[J]. 中药药理与临床, 2019, 35(2): 149-51. Wang S B, Gong N B, Duan C L, et al. Historical cognition and modern evaluation on the toxicity of aconitum-derived Chinese traditional medicines[J]. Pharmacol Clin Chin Mater Med, 2019, 35(2): 149-51. |
| [2] |
Meissner P H A. The positive inotropic effect of aconitine[J]. N-S Arch Pharmacol, 1983, 322(1): 49-58. |
| [3] |
郑爱华, 蔡光先, 刘红梅. 参附汤超微粉单次及多次给药在大鼠体内的组织分布研究[J]. 中国实用医药, 2010, 5(14): 138-9. Zheng A H, Cai G X, Liu H M. Study on the tissue distribution of Shenfu decoction ultrafine powder after single and repeated administration in rats[J]. Chin Prac Med, 2010, 5(14): 138-9. |
| [4] |
Ji X, Yang M, Or K H, et al. Tissue accumulations of toxic aconitum alkaloids after short-term and long-term oral administrations of clinically used radix aconiti lateralis preparations in rats[J]. Toxins, 2019, 11(6): 353. |
| [5] |
Zhou W, Qiu L Z, Liu H, et al. Notch1-mediated histone demethylation of HCN4 contributes to aconitine-induced ventricular myocardial dysrhythmia[J]. Toxicol Lett, 2020, 327: 19-31. |
| [6] |
Gottlieb R A, Stotland A. MitoTimer: A novel protein for monitoring mitochondrial turnover in the heart[J]. J Mol Med, 2015, 93(3): 271-8. |
| [7] |
王宁宁, 王佳, 谭洪玲, 等. 乌头碱抑制血管紧张素Ⅱ诱导的心肌细胞肥大[J]. 中国中药杂志, 2019, 44(8): 1642-7. Wang N N, Wang J, Tan H L, et al. Aconitine ameliorates cardiomyocyte hypertrophy induced by angiotensin Ⅱ[J]. Chin J Chin Mater Med, 2019, 44(8): 1642-7. |
| [8] |
Zhang M, Peng C S, Li X B. In vivo and in vitro metabolites from the main diester and monoester diterpenoid alkaloids in a traditional Chinese herb, the aconitum species[J]. Evid Based Complement Alternat Med, 2015, 2015: 252434. |
| [9] |
Yu B, Yi C, Yao K X. Pharmacokinetics of aconitine-type alkaloids after oral administration of Fuzi (Aconiti Lateralis Radix Praeparata) in rats with chronic heart failure by microdialysis and ultra-high performance liquid chromatography-tandem mass spectrometry[J]. J Ethnopharmacol, 2015, 165: 173-9. |
| [10] |
Li M, Xie X, Chen H, et al. Aconitine induces cardiotoxicity through regulation of calcium signaling pathway in zebrafish embryos and in H9c2 cells[J]. J Appl Toxicol, 2020, 40(6): 780-93. |
| [11] |
Peng F, Zhang N, Wang C E. Aconitine induces cardiomyocyte damage by mitigating BNIP3-dependent mitophagy and the TNFalpha-NLRP3 signalling axis[J]. Cell Prolif, 2020, 53(1): e12701. |
| [12] |
尤欣宇, 马静, 尹清晟, 等. 基于实时细胞分析技术的乌头碱致心律失常体外评价技术研究[J]. 中国药理学通报, 2019, 35(12): 1771-5. You X Y, Ma J, Yin Q S, et al. In vitro evaluation of aconitine-induced arrhythmia based on RTCA Cardio technology[J]. Chin Pharmacol Bull, 2019, 35(12): 1771-5. |
| [13] |
Brownsey R W, Boone A N, Elliott J E, et al. Regulation of acetyl-CoA carboxylase[J]. Biochem Soc Trans, 2006, 34(Pt 2): 233-7. |
| [14] |
Razeghi P, Young M E, Alcorn J L, et al. Metabolic gene expression in fetal and failing human heart[J]. Circulation, 2001, 104(24): 2923-31. |
| [15] |
焦鹏程, 季娇娇, 赵东旭. 胚胎干细胞向心肌细胞分化过程中能量代谢变化的研究[J]. 生物化学与生物物理进展, 2020, 47(11): 1191-8. Jiao P C, Ji J J, Zhao D X. Metabolic phenotyping to identify cellular transitions during cardiomyocytes differentiation from human embryonic stem cells[J]. Prog Biochem Biophys, 2020, 47(11): 1191-8. |
| [16] |
Mccommis K S, Douglas D L, Krenz M, et al. Cardiac-specific hexokinase 2 overexpression attenuates hypertrophy by increasing pentose phosphate pathway flux[J]. J Am Heart Assoc, 2013, 2(6): e000355. |

