


洪桂祝(1966-),女,博士,教授,研究方向:心脑血管药理学,通讯作者,E-mail: 13559102126@163.com
 ,
HUANG Jia-hui,
QIAO Li,
LIU Jun-jie,
TANG Yu-heng,
XU A-juan,
NIE Jing-wen,
HUANG Si-ying,
LUO Rui,
Yang Ze-lin,
LAI Wen-fang
,
HUANG Jia-hui,
QIAO Li,
LIU Jun-jie,
TANG Yu-heng,
XU A-juan,
NIE Jing-wen,
HUANG Si-ying,
LUO Rui,
Yang Ze-lin,
LAI Wen-fang
 ,
HONG Gui-zhu
,
HONG Gui-zhu

缺血性脑卒中是医学史上未解的难题之一,致病机理主要是由于脑动脉血管栓塞进而诱发炎症反应的级联过程[1]。大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型是对临床上常见的缺血性脑卒中疾病的模拟,它具有较低的侵入性,同时也是最接近人类缺血性中风的一种技术[2]。
大黄在我国拥有悠久的药用历史,根据2015版药典描述,大黄是蓼科植物掌叶大黄、唐古特大黄或药用大黄的干燥根和根茎,通常用于清热泻火、凉血解毒等作用,同时,药典中收录的大黄蛰虫丸、逐瘀通脉胶囊以及麝香脑脉康胶囊等诸多制剂也显示着大黄在治疗脑中风方面有着独特的作用[3]。有学者认为,大黄作为泻火、凉血热药,具有抗炎、抗毛细血管凝血和止血的作用,具有直接作用于脑部的可能性[4]。此外,大黄素、大黄酚作为其主要活性成分,也是大黄药效物质基础的重要标志物之一。Ye等[5]指出,不同剂量的大黄素连续作用于SD大鼠13周,无明显毒性。课题组前期研究也发现大黄素可明显抑制脑中风的炎性损伤[6],赵薇等[7]指出大黄酚可以调节氧化应激反应,抑制细胞凋亡起到神经保护作用。而关于大黄提取物对脑损伤的研究目前较少,本文主要通过研究大黄提取物对MCAO大鼠的神经保护作用,并进一步探讨其作用机制。
1 材料 1.1 实验动物SPF级(Sprague Dawley(SD)大鼠,♂,体质量(260-280)g,购于上海斯莱克实验动物有限公司[合格证号:2015000510392,许可证号:SCXK(沪)2012-0002],并于福建中医药大学医学实验动物中心喂养[许可证号:SYXK(闽)2014-0005]。
1.2 药物与试剂大黄,经福建中医药大学中药鉴定学教研室鉴定。DAPI染色液(货号:C1006),抗荧光淬灭封片液(货号:P0126)均购自碧云天生物技术有限公司;PBS磷酸盐缓冲液粉末(货号:17032701),柠檬酸盐缓冲液粉末(货号:17021404)均购自迈新生物技术有限公司;尼氏染色液(北京雷根生物技术有限公司,货号:DK0022);NeuN抗体(货号: ab104224);BDNF抗体(货号:ab205067)均购自美国Abcam公司;NGF抗体(sc-365944)均购自Santa Cruz公司;cDNA逆转录试剂盒(美国Thermo公司,货号:K1622);兔抗(货号:31460),鼠抗(货号:31430)均购自Thermo Scientific公司;β-action抗体(货号AF0003)购自碧云天生物科技有限公司。
1.3 仪器基础电泳仪电源(美国Bio-Rad公司);小型转印槽(美国Bio-Rad公司);倒置荧光显微镜(德国Leica公司,型号:DMI8);凝胶成像分析系统(美国Bio-Rad公司,型号:ChemiDocXRS+);紫外可见分光光度计(Thermo Fisher公司,型号:ND2000C);普通PCR仪(美国Bio-Rad公司,型号:C1000);实时荧光定量PCR仪(美国Applied Biosystems公司,型号:7900H-PCR);石蜡切片机(Thermo Fisher公司,型号:HM325);生物组织石蜡包埋机(Thermo Fisher公司,型号:YB-6LF);3600AAA,3800AAA尼龙线栓(广州佳灵生物技术有限公司)。
2 方法 2.1 大黄提取物制备称取大黄干燥根茎200 g,粉碎后装入500 mL圆底烧瓶,采用250 mL 95%乙醇加热回流提取2 h,取2次上层提取液合并减压浓缩挥干即得相应的粉末(1 g相当于生药含量10 g)[8]。使用含有质量浓度为10 g·L-1的羧甲基纤维素钠的生理盐水溶解粉末使成30 g·L-1悬浊液备用[9]。
2.2 动物分组与处理健康成年♂实验动物随机分为假手术组(sham)、模型组(MCAO)、大黄给药组(MCAO+大黄),每组15只。经适应性喂养1周以后,2%的戊巴比妥钠(2 mL·kg-1)腹腔注射麻醉后,采用线栓法制备模型,沿大鼠颈线中部切开,分离出颈总动脉、颈外动脉、颈内动脉,将颈总动脉和颈外动脉用医院缝合线结扎,用动脉夹夹住颈内动脉,用动脉剪在颈总动脉远心端剪一个V形切口,将线栓自颈总动脉切口处插入颈内动脉,至大脑中动脉起始端,用缝合线缝合切口。2 h后拔出线栓实现再灌注。假手术组做相同处理除不插线栓。大鼠清醒后进行神经功能评分,评分在2-3分视为造模成功[14]。大黄给药组灌服大黄提取物溶液200 mg·kg-1·d-1,其余组则灌服等体积生理盐水。连续给药6 d后取材。
2.3 取材及前处理给药治疗6 d后,2 %的戊巴比妥钠腹腔注射麻醉,每组7只动物腹主动脉取血后于心尖上剪一小缺口,将灌胃针自缺口插入动脉,在右心耳剪一缺口,滴注生理盐水至右心耳流出无色液体滴注甲醛至大鼠脑僵硬,取脑于4 %多聚甲醛中室温固定24 h后,使用专门的脑模具和切片刀将脑组织平均分为6片,保存于70 %的乙醇中,待后续进行免疫荧光实验。每组7只动物腹主动脉取血后断头取脑,将大脑分左右脑,分装于液氮中保存备用。取左脑脑组织磨成粉末,分装待用。
2.4 尼氏染色法检测尼氏体的表达将保存的脑组织脱水、包埋,即可获得组织蜡块。将组织蜡块以3 μm厚度切片,平整摊在40 ℃蒸馏水中,待组织片无褶皱后用载玻片捞片,55 ℃烤片,待无水分时移至60 ℃暗箱内6 h待用。取用准备好的组织片经过脱蜡复水,在56 ℃温箱内,于含有焦油紫的染缸中浸染30 min,之后在酒精灯上加温至切片冒泡约10 min,用去离子水洗去染液后用尼氏分化液分化1-3 min,之后使用无水乙醇脱水,经二甲苯透明,晾干后用中性树脂封片,在镜下观察结果并拍照留存,使用图像分析软件Motic Med 6.0测定脑梗死体积。
2.5 免疫荧光法检测脑组织中NeuN、NF200的表达将保存好的组织片脱蜡复水,在柠檬酸缓冲液中抗原修复,待自然冷却到室温后,用5 %BSA室温封闭2 h后,稀释的一抗4 ℃孵育过夜,次日取出组织片待复温40 min后,用PBS洗3次,每次10 min,二抗室温孵育2 h后(之后避光操作),PBS洗3次,每次10 min,之后DAPI染核8 min,再次使用PBS洗3次,每次10 min,最后滴加抗淬灭剂后封片,结果使用荧光倒置显微镜观察。
2.6 RT-qPCR法检测Egr1、Egr2、Egr4 mRNA的表达取30 mg组织采用TRIzol提取总RNA,-80 ℃保存待用。根据cDNA逆转录试剂盒说明书将RNA逆转录为cDNA,放于-80 ℃保存待用。使用RT-qPCR技术检测Egr1、Egr2、Egr4 mRNA的表达的表达水平。GADPH的上游引物:5′-ACGGCAAGTTCAACGGCACAG-3′,下游引物:5′-GAAGACGCCAGTAGACTVVACGAC-3′;Egr1的上游引物:5′-AAAATGGAATCTCTACGAAGGTCA-3′,下游引物:5′-AGTCGCAGGTCAATGAAGAAGTC-3′;Egr2的上游引物:5′-ACCAGGAGAATCCATACCAGAACC-3′,下游引物:5′-AGGAGGACACGATAGACAGACAAAG-3′;Egr4的上游引物:5′-AAGCTGGAGCAGGAAGAGGTTG-3′,下游引物:5′-GCAGGGAGGAGGTTTTGGATAG-3′,RT-qPCR所用引物由尚亚生物技术有限公司设计合成。以GAPDH为内参校正每个样品的Ct值,计算2-ΔΔCt值从而对基因表达进行定量分析。
2.7 Western blot检测NGF、BDNF蛋白的表达取100 mg组织提取总蛋白,根据SDS-PAGE凝胶电泳配置说明书选择合适浓度配比的分离胶。电泳,转膜,将目标蛋白转移至聚偏二氟乙烯膜(PVDF)膜上,5 % BSA室温封闭2 h,稀释的一抗4 ℃摇床孵育过夜,Tris-HCI Buffer Solution Tween (TBST)洗3次,每次10 min,稀释的二抗室温摇床孵育2 h,TBST洗3次,每次10 min,之后使用凝胶成像分析系统Image Lab 6.0成像并检测分析目标条带灰度值,计算条带与β-actin灰度值的比值并统计分析各组差异。
2.8 统计学分析实验结果使用SPSS 22.0统计软件进行分析,均采用x±s表示,各组间差异采用t检验和单因素方差分析。
3 结果 3.1 大黄提取物对MCAO模型大鼠的缺血侧脑梗死体积的影响MCAO模型大鼠再灌注1 h后,经大黄提取物连续给药6 d,尼氏染色结果显示,与sham组相比,MCAO模型大鼠梗死冠状切面梗死面积及梗死体积升高,经大黄提取物作用后,MCAO模型大鼠脑梗死体积被明显改善(P<0.05),见Fig 1。
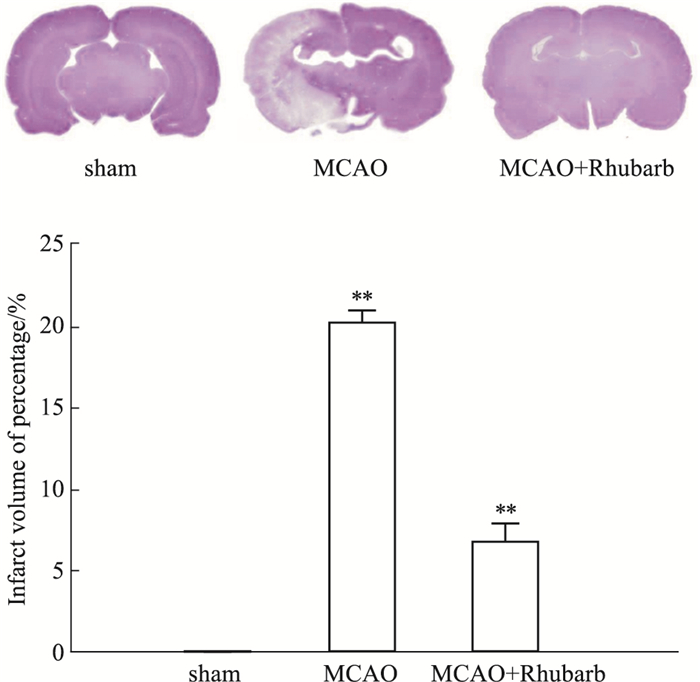
|
| Fig 1 Effect of rhubarb extract on ischemic lateral cerebral infarction volume in MCAO model rats(x±s, n=3) **P < 0.10 vs Sham |
MCAO模型大鼠再灌注1 h后,经大黄提取物连续给药6 d,免疫荧光结果显示,与sham组相比,MCAO模型大鼠NeuN的数目减少,经大黄提取物作用以后,NeuN的数目增多,差异具有统计学意义(P<0.05),见Fig 2。
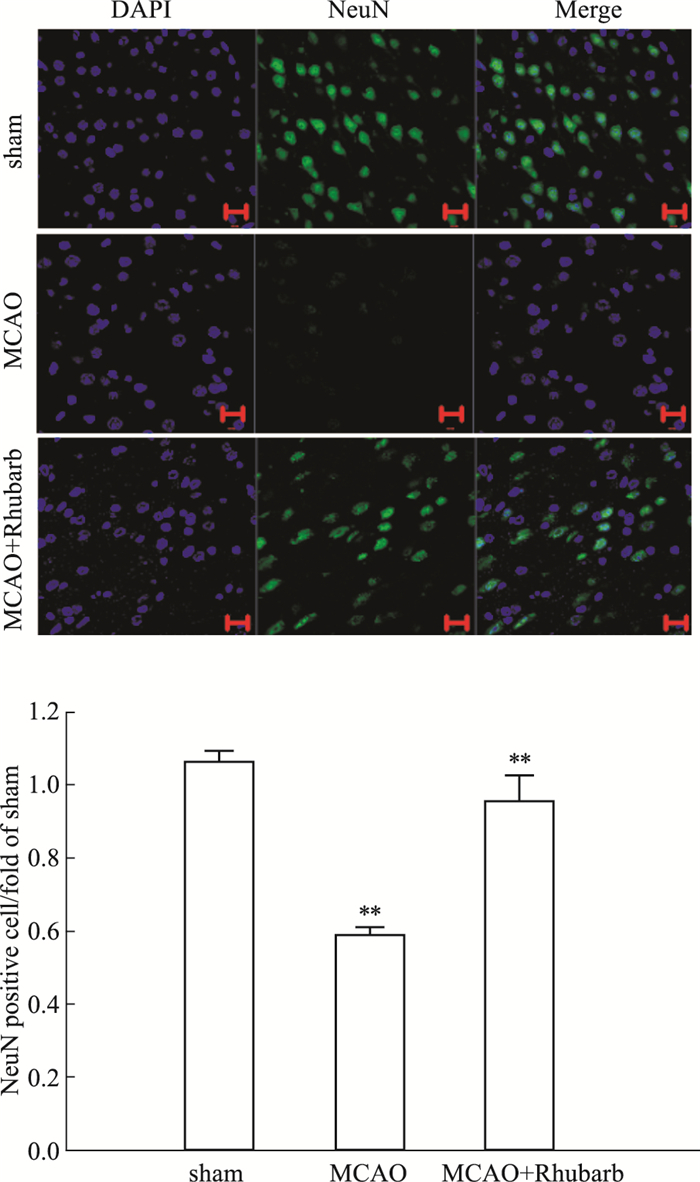
|
| Fig 2 Effect of rhubarb extract on expression of nerve growth factor NeuN in ischemic side of MCAO model rats(×400) (x±s, n=3) #P < 0.01 vs sham |
MCAO模型大鼠再灌注1 h后,经大黄提取物连续给药6 d,免疫荧光结果显示,与sham组相比,MCAO模型大鼠NF200的数目降低,经大黄提取物作用以后,NF200的数目增加,差异具有统计学意义(P<0.05),见Fig 3。
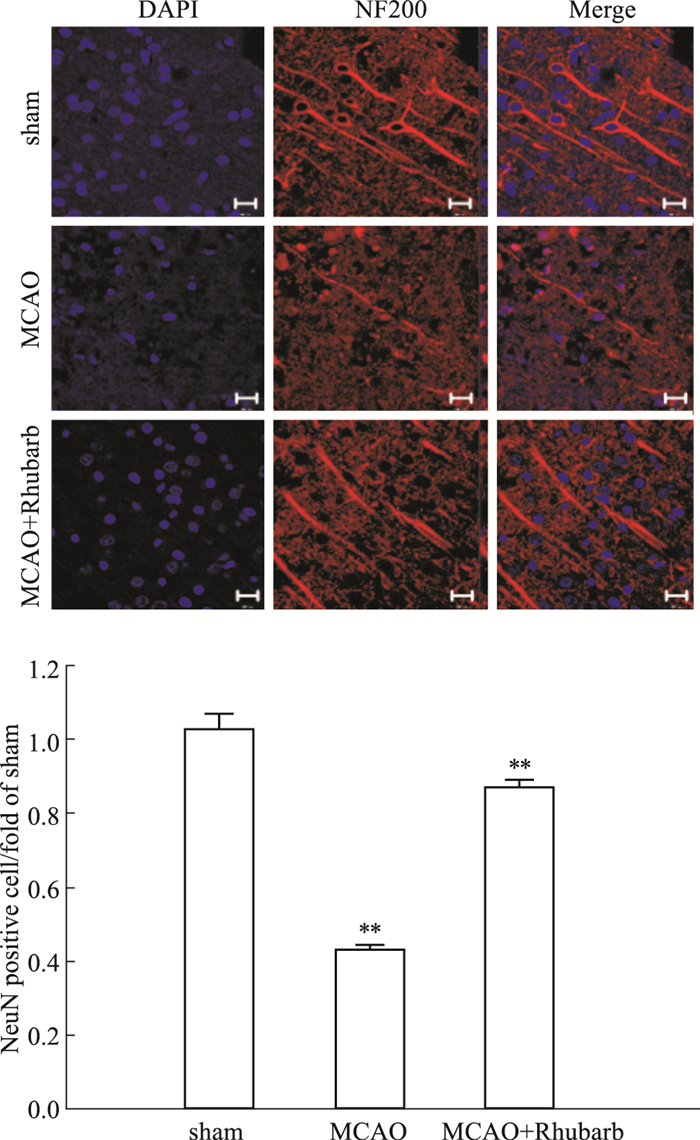
|
| Fig 3 Effect of rhubarb extract on expression of NF200 on ischemic brain tissue of MCAO model rats(×400) (x±s, n=3) **P < 0.01 vs sham |
MCAO模型大鼠再灌注1 h后,经大黄提取物连续给药6 d,RT-qPCR的结果显示,与sham组相比,MCAO模型大鼠Egr1、Egr2、Egr4 mRNA表达降低,经大黄提取物作用以后,Egr1、Egr2、Egr4 mRNA表达升高,差异具有统计学意义(P<0.05), 见Fig 4。
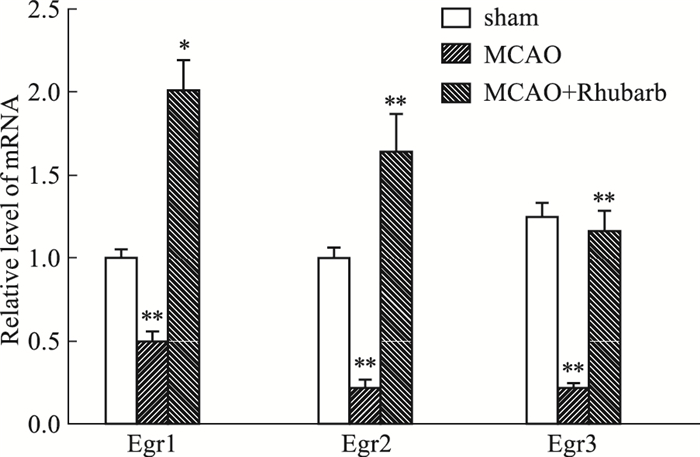
|
| Fig 4 Effects of rhubarb extract on expression of Egr1, Egr2 and Egr4 mRNA in ischemic brain tissue of MCAO model rats(x±s, n=3) #P < 0.01 vs sham |
MCAO模型大鼠再灌注1 h后,连续给药6 d,Western blot结果显示,与sham组相比,MCAO模型大鼠NGF、BDNF蛋白表达量降低,经大黄提取物作用后,该作用被逆转且差异具有显著性(P<0.05),见Fig 5。
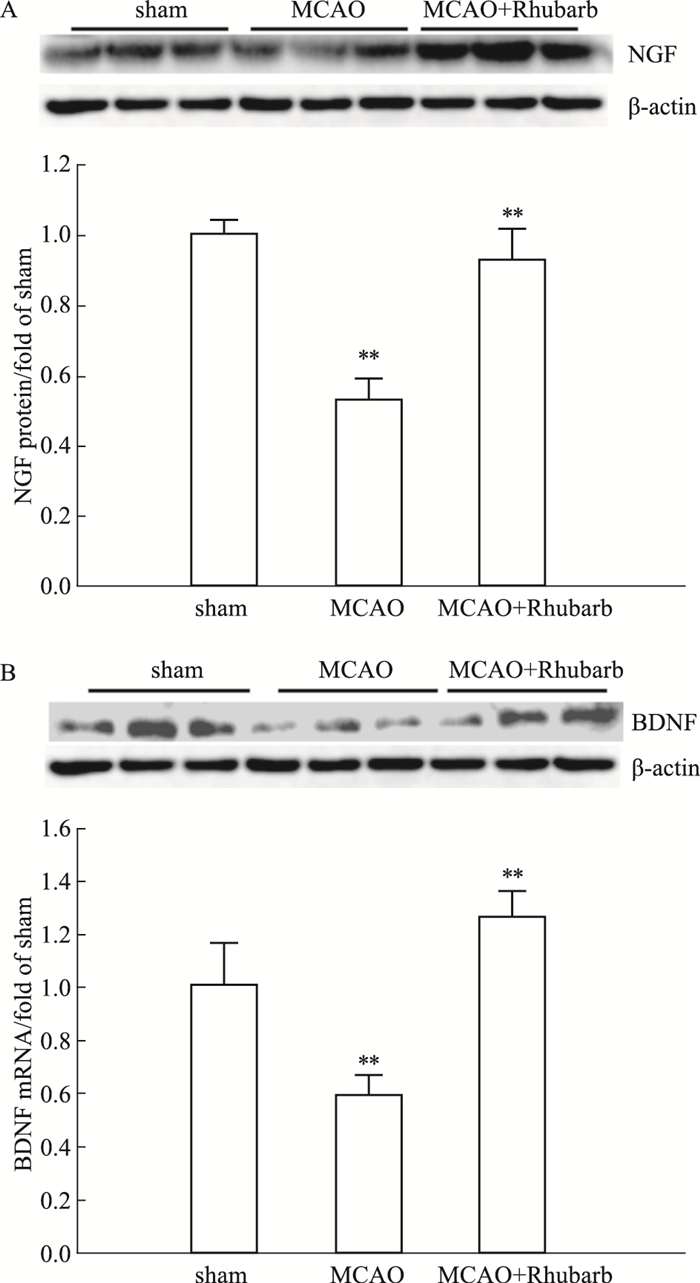
|
| Fig 5 Effect of rhubarb extract on expression of NGF(A) and (B) BDNF protein in ischemic brain tissue of MCAO model rats(x±s, n=3) #P < 0.01 vs sham |
本实验中使用线栓法制造模型,线栓法造模具有操作简单、重复性好、可控制缺血/再灌注时间、损伤小等优点[10]。造模成功后的实验大鼠表现出行走时向病灶对侧跌倒或原地转圈,甚至不能自发行走,意识功能障碍,经大黄提取物连续给药6 d,发现与MCAO模型组相比,大黄给药组能明显改善MCAO模型大鼠神经功能障碍损伤。同时我们采用尼氏染色检测大鼠脑梗死体积发现,MCAO模型大鼠的脑梗死体积明显增加,而经大黄提取物连续治疗6 d后脑梗死体积明显改善。
神经核蛋白(neuronal nuclear protein,NeuN)是有丝分裂后和新生的成熟神经元的标志物,可以在大多数神经元中检测到。大量研究表明其在脑缺血/再灌注损伤后表达量明显下降[11]。免疫荧光结果显示,经大黄提取物治疗以后可以增加缺血侧脑组织NeuN的表达,表明大黄提取物对于MCAO模型大鼠的神经元损伤具有抑制作用。为了进一步证明大黄提取物对于MCAO模型大鼠的神经保护作用,我们检测了MCAO模型大鼠缺血侧脑组织区域成熟神经细胞表型标记物高分子量神经丝蛋白200(neurofilament 200,NF200)的表达。NF200主要存在于神经元细胞质及轴突中,具有髓鞘轴突并对机械刺激作出反应,神经元细胞的数量及其功能状态被它的表达量的高低所反映[12]。结果显示,MCAO模型后,大鼠神经细胞内NF200表达量减少,大黄提取物连续作用6 d后,该作用被逆转,表明大黄提取物可以保护神经细胞。
早期生长反应蛋白(early growth responses,Egrs)是锌指转录因子家族,包括Egr1、Egr2和Egr4,它们共享几乎相同的锌指DNA结合结构域,并结合到一个共同的Egr反应元件共有序列[13-14]。文献报道,Egr1、Egr2和Egr4与神经元存活密切相关[15]。同时神经生长因子(nerve growth factor,NGF)和脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)对神经的发生和可塑性也具有重要的作用[14]。Wang等[12]发现胚胎期缺乏NGF会增加小鼠神经节中神经细胞的凋亡。Song等[16]表明增加的NGF和BDNF表达可能有助于在急性脑损伤和中风早期观察到的神经炎症诱导的神经保护作用。根据RT-qPCR及Western blot结果分析,我们发现大黄提取物可以显著促进MCAO大鼠缺血侧脑组织的Egr1、Egr2、Egr4、NGF及BDNF的表达,促进神经元的再生。
综上,大黄提取物可以通过促进Egrs、NGF及BDNF的表达,促进神经元的再生,进而发挥神经保护作用,为大黄治疗缺血性脑损伤的研究提供新的基础。
| [1] |
Eltzschig H K, Eckle T. Ischemia and reperfusion-from mechanism to translation[J]. Nat Med, 2011, 17(11): 1391-401. doi:10.1038/nm.2507 |
| [2] |
Fluri F, Schuhmann M K, Kleinschnitz C. Animal models of ischemic stroke and their application in clinical research[J]. Drug Des Devel Ther, 2015, 9: 3445-54. |
| [3] |
国家药典委员会. 中华人民共和国药典: 2015年版一部[S]. 北京: 中国医药科技出版社, 2015. Chinese Pharmacopoeia Commission. China Pharmacopeia(2015 e-Dition, Volume I)[S]. Beijing: China medical science and tech-nology press, 2015. |
| [4] |
Lu L, Li H Q, Fu D L, et al. Rhubarb root and Rhizome-based Chinese herbal prescriptions for acute ischemic stroke: A systematic review and meta-analysis[J]. Complement Ther Med, 2014, 22(6): 1060-70. doi:10.1016/j.ctim.2014.10.002 |
| [5] |
Ye B G, Feng Y, Wang S. Scientific evaluation of the acute toxicity and 13-Week subchronic toxicity of Rheum Emodi Rhizome extracts in sprague dawley rats[J]. Food Chem Toxicol, 2014, 66: 278-85. doi:10.1016/j.fct.2014.01.051 |
| [6] |
林昱, 赖文芳, 苏燕青, 等. 大黄素抑制脂多糖诱导星形胶质细胞炎症反应的机制研究[J]. 中国药理学通报, 2018, 34(11): 1528-33. Lin Y, Lai W F, Su Y Q, et al. Effect of emodin on inflammatory response of astrocytes induced by LPS[J]. Chin Pharmacol Bull, 2018, 34(11): 1528-33. doi:10.3969/j.issn.1001-1978.2018.11.011 |
| [7] |
赵薇, 王树, 李方江. 大黄酚对小鼠脑缺血/再灌注脑组织抗氧化应激和AQP4的影响[J]. 中国药理学通报, 2015, 31(10): 1477-8. Zhao W, Wang S, Li F J. Effects of chrysophanol on antioxidative stress and AQP4 in brain tissue of mice induced by cerebral ischemia-reperfusion injury[J]. Chin Pharmacol Bull, 2015, 31(10): 1477-8. doi:10.3969/j.issn.1001-1978.2015.10.030 |
| [8] |
蒋丹. 大黄提取物以及大黄素对缺血性脑卒中的神经保护作用及其机制[D]. 扬州: 扬州大学, 2018. Jiang D. The Neuroprotective effect of Rhubarb Extract and Emodin on cerebral ischemi-reperfusion injury in mice and its mechanism[D]. Yangzhou: Yangzhou University, 2018. |
| [9] |
唐宇恒, 刘俊杰, 黄鑫, 等. 大黄提取物对缺血性脑损伤大鼠细胞凋亡的抑制作用[J]. 中国药理学通报, 2020, 36(9): 1304-9. Tang Y H, Liu J J, Huang X, et al. Inhibitory effect of rhubarb extract on cell apoptosis in rats with ischemic brain injury[J]. Chin Pharmacol Bull, 2020, 36(9): 1304-9. doi:10.3969/j.issn.1001-1978.2020.09.022 |
| [10] |
黄鑫, 林昱, 杨泽霖, 等. 红景天苷抑制补体成分对脑缺血/再灌注大鼠的神经保护作用[J]. 中国药理学通报, 2019, 35(7): 967-72. Huang X, Lin Y, Yang Z L, et al. Salidroside inhibits the neuroprotective effects of complement components on cerebral ischemia/reperfusion rats[J]. Chin Pharmacol Bull, 2019, 35(7): 967-72. doi:10.3969/j.issn.1001-1978.2019.07.016 |
| [11] |
Belayev L, Hong S H, Menghani H, et al. Docosanoids promote neurogenesis and angiogenesis, blood-brain barrier integrity, penumbra protection, and neurobehavioral recovery after experimental ischemic stroke[J]. Mol Neurobiol, 2018, 55(8): 7090-106. doi:10.1007/s12035-018-1136-3 |
| [12] |
Wang S P, Wang Z H, Peng D Y, et al. Therapeutic effect of mesenchymal stem cells in rats with intracerebral hemorrhage: reduced apoptosis and enhanced neuroprotection[J]. Mol Med Rep, 2012, 6(4): 848-54. doi:10.3892/mmr.2012.997 |
| [13] |
Masliukov P M, Korzina M B, Porseva V V, et al. Age-dependent changes of neurochemical properties of sensory neurons[J]. Adv Gerontol, 2014, 4(3): 620-30. doi:10.1134/S2079057014030047 |
| [14] |
赖文芳. 红景天苷对脑缺血再灌注损伤大鼠的保护作用及机制研究[D]. 福州: 福建中医药大学, 2016. Lai W F. Neurprotection of salidroside against middle cerebral artery occlusion injury in rats and its mechanism[D]. Fuzhou: Fujian Univ of Trad Chin Med, 2016. |
| [15] |
Lai W F, Zheng Z W, Zhang X Q, et al. Salidroside-mediated neuroprotection is associated with induction of Early Growth Response Genes (Egrs) across a wide therapeutic window[J]. Neurotox Res, 2015, 28(2): 108-21. doi:10.1007/s12640-015-9529-9 |
| [16] |
Song C, Zhang Y, Dong Y. Acute and subacute IL-1beta administrations differentially modulate neuroimmune and neurotrophic systems: possible implications for neuroprotection and neurodegeneration[J]. J Neuroinflamm, 2013, 10: 59. |