

2. 安徽医科大学临床医学院,安徽 合肥 230601;
3. 安徽医科大学形态学实验中心,安徽 合肥 230032
陈晓宇(1971-),男,博士,教授,研究方向:形态学,通讯作者,E-mail: cxyayd@163.com
2. Clinical Medical College, Anhui Medical University, Hefei 230032, China;
3. Morphological Experimental Center, Anhui Medical University, Hefei 230032, China
心脏骤停(cardiac arrest,CA)是临床较为常见的急危重症,随着心肺复苏(ceardiopulmonary resuscitation,CPR)技术的推广和应用,CA患者的自主血液循环恢复率和存活率显著增加,但CA患者常出现神经功能损伤,故脑复苏在心肺复苏后非常重要[1]。CPR后的患者存在缺血/再灌注损伤(ischemia-reperfusion injury,IRI),脑组织对机体缺血缺氧最为敏感[2]。在CA和CPR过程中,患者经历严重缺血缺氧/再灌注的应激性病理过程,氧化应激损伤始终贯穿在该病理变化进程中[3]。氧化应激与很多疾病的发病有关,线粒体产生的活性氧(reactive oxygen species,ROS)升高,机体内源性抗氧化系统的平衡遭受破坏,抗氧化失衡现象[4]。核因子E2相关因子(NF-E2-related factor 2,Nrf2)是氧化应激的关键转活因子,结合Kelch样ECH相关蛋白1 (Kelch-like ECH-associated protein 1,Keap1)后,可恢复机体氧化失衡的状态[5]。CPR后IRI存在急性脑缺血疾病和氧化应激损伤,但Nrf2-Keap1信号通路在心脏骤停后脑损伤的机制研究中文献报道较少,该研究从海马线粒体结构改变方面探讨大鼠心脏骤停后,实施心肺复苏术对大鼠海马脑组织的保护作用。
1 材料与方法 1.1 主要仪器和试剂动物呼吸机(ALC-V9型,北京吉安得尔),激光共聚焦显微镜(德国Leica公司),透射电镜(日本Hitachi公司),生物机能实验系统(BL-420F,成都泰盟科技),全自动酶标仪(美国Thermo Fisher Scientific公司),荧光定量PCR仪(美国ABI公司),电泳和凝胶成像分析系统(美国Bio-Rad公司)。依达拉奉注射液(西安利君制药,批号H20120042),羊抗鼠Nrf2、羊抗鼠Keap1、兔抗鼠β-actin多隆抗体(美国Abcam公司,批号分别为ab137550、ab118285、ab10005),丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(南京建成生物,批号分别为A003-1-2、A001-3-2),TRIzol试剂(美国Invitrogen公司,批号15596-018),反转录试剂盒(北京聚美生物,批号RP1200)。
1.2 动物模型制备成年雄性SD大鼠40只,清洁级,体质量(290±20)g,购于安徽省动物实验中心(皖动准201901号),在通风透气25 ℃环境温度条件,白天黑夜各12 h交替,适应性饲养1周后进行分组实验。SD大鼠随机均分为对照组(10只)和模型组(30只),大鼠CA/CPR模型制备采用窒息法,参照文献[6],将大鼠麻醉后,气管插管,建立人工通气,夹闭气管插管使大鼠窒息,大鼠动脉血压≤20 mmHg,心率消失时,模型组实施心脏骤停10 min;心肺复苏组实施心脏骤停3 min后行心肺复苏操作,包括人工大鼠胸外按压,机械通气等,使得大鼠动脉血压≥60 mmHg,心率≥100次/min,且血压和心率逐渐平稳,证实心肺复苏完成。对照组SD大鼠行麻醉、气管插管等操作,但不实施气管夹闭和心肺复苏等操作。依达拉奉组在实施心脏骤停3 min后,静脉注射依达拉奉注射液3 mg·kg-1,各组10 min后处死大鼠,每组取3只大鼠脑组织做苏木素-伊红(htoxylin eosin,HE)染色病理组织学评分,2只大鼠海马组织电镜观察线粒体等结构改变,余下5只大鼠海马组织置-80 ℃做后续实验。
1.3 血清氧化应激指标检测心肺复苏实验结束后,在大鼠处死前,每只大鼠抽取静脉血5 mL置离心管中,5 000 r·min-1离心10 min后,分离血清,取上清液放置于-20 ℃冰箱待测。严格按照试剂盒操作说明书检测大鼠血清反映氧化应激指标,应用硫代巴比妥酸法测定血清MDA含量,羟胺法测定血清SOD活性,应用全自动酶标仪检测532 nm处的吸光度值。
1.4 HE染色观察大鼠海马脑组织病理学检查大鼠脑组织置10%福尔马林溶液固定24 h,流水冲洗,梯度乙醇脱水,二甲苯透明、石蜡包埋,厚5 μm切片,HE染色,光镜下寻找海马部位,观察其中神经元结构变化病理学改变。在×40物镜下,每张切片随机挑选3个视野,计数受损神经元占整个视野神经元百分比(%)。
1.5 电镜观察大鼠海马结构准确选取约1×1×1 mm3各组大脑海马脑组织,3%戊二醛溶液固定12 h,锇酸后固定,梯度乙醇脱水,丙酮透明,812树脂包膜,超薄切片,电镜观察并摄片。电镜下对线粒体超微结构观察,了解海马神经元线粒体膜、基质和嵴等结构改变。
1.6 实时荧光定量PCR观察大鼠海马实验采取实时荧光定量PCR(real - time PCR)观察大鼠海马组织中Nrf2、Keap1 mRNA表达,取上述各组大鼠海马脑组织,加入适量TRIzol,提取并测定总RNA浓度,cDNA反转录试剂盒逆转录,引物由上海生工公司合成,引物序列如下:Nrf2 mRNA正链5′-CTCCTTAGACTCAAATCCCACCTT-3′,反链5′-GGACAGATCACAAGCCCTCAAT-3′,长度163 bp;Keap1 mRNA正链5′-AACTCGGCAGAATGTTACTACCC-3′,反链5′-CTACGAAAGTCCAGGTCTCTGTCTC-3′,长度190 bp;内参照β-actin mRNA正链5′-GGCTGTATTCCCCTCCATCG-3′,反链5′-CCAGTTGGTAACAATGCCATGT-3′,长度239 bp。进行荧光RT-PCR,实验结果用2-ΔΔCT相对定量法作统计学处理。
1.7 Western blot检测大鼠海马脑组织中Nrf2-Keap1表达将冻存的大鼠海马组织取出后,适量蛋白裂解液组织匀浆,冷冻离心机10 000 r·min-1×10 min离心,取上清液并定量总蛋白。行SDS-PADGE凝胶电泳时上样量为50 μg,电泳、转膜、封闭,加入特异性一抗(Nrf2浓度1 ∶2 000,Keap1浓度1 ∶1 500,β-actin浓度1 ∶2 500),4 ℃孵育过夜,TBST漂洗,二抗室温孵育1 h,TBST漂洗后显色。用ImageJ软件进行灰度分析,结果以目的蛋白与β-actin相对表达量表示。
1.8 统计学处理本研究中计量资料结果以x±s表示,包括氧化应激指标、病理学检查、RT-PCR、Western blot分析等,采用单因素方差分析。
2 结果 2.1 各组大鼠血清氧化应激指标比较与对照组比较,模型组大鼠血清MDA含量显著升高,SOD活性显著下降,两组比较差异有显著性(P<0.01);与模型组比较,心肺复苏组和依达拉奉注射组大鼠血清MDA含量显著下降,SOD活性显著上升,两组比较差异有显著性(P<0.05,P<0.01)。见Tab 1。
| Group | MDA/mol·g-1 | SOD/kU·g-1 |
| Control | 5.87±0.95 | 182.67±11.08 |
| Ischemia | 16.78±1.26## | 138.24±10.73## |
| Resuscitation | 12.36±1.18* | 153.08±10.58** |
| Edaravone | 12.05±1.07* | 157.61±11.36* |
| ##P<0.01 vs control, *P<0.05, **P<0.01 vs ischemia | ||
海马受损神经元的病理结构改变包括细胞质中Nissl体减少,胞质空泡化和细胞核固缩。对照组大鼠海马脑组织神经元细胞形态完整,细胞核位于中央,核仁清楚,胞质中充满Nissl体。模型组海马脑组织细胞轮廓不清,细胞质中Nissl体明显减少,细胞水肿明显,受损神经元较正常组明显增多(P<0.01)。心脏骤停后心肺复苏组和依达拉奉组海马神经元形态稍不规则,部分神经元胞质中Nissl体消失,细胞间隙轻度增加,发现水肿较缺血组明显好转,进行受损神经元百分比计数,取平均值,受损神经元较缺血组明显好转(P<0.01)。见Fig 1。
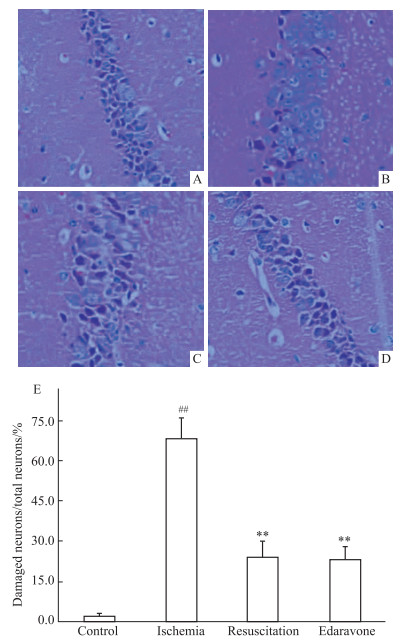
|
| Fig 1 Hippocampal pathological changes of rats in each group (HE×400) A: Normal group; B: Ischemia group; C: Cardiopulmonary resuscitation group; D: Edaravone Group; E: Statistical chart. Note: ##P<0.01 vs Normal group; **P<0.01 vs Ischemia group |
电镜下,对照组大鼠海马神经元线粒体结构正常,可见明显的线粒体膜和嵴状突起;心脏骤停的缺血组大鼠海马神经元线粒体损伤明显,表现为线粒体体积增大、肿胀,膜和线粒体嵴断裂,空泡状;心肺复苏组和依达拉奉组线粒体结构改善明显,见Fig 2。
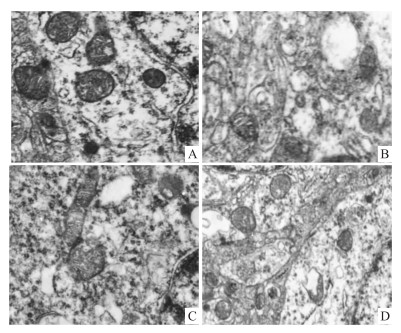
|
| Fig 2 Ultrastructural changes of hippocampal pathology in each group (EM×2 400) A: Control group; B: Ischemia group; C: Cardiopulmonary resuscitation group; D: Edaravone Group |
采用RT-PCR法观察各组大鼠海马组织中Nrf2 mRNA、Keap1 mRNA和β-actin mRNA的表达情况,结果见Fig 3所示。抗氧化调控因子Nrf2 mRNA、Keap1 mRNA的检测发现,与对照组比较,模型组Nrf2 mRNA/β-actin mRNA、Keap1mRNA/β-actin mRNA相对表达量显著升高(P<0.01);与模型组比较,心肺复苏组和依达拉奉组Nrf2 mRNA/β-actin mRNA、Keap1 mRNA/β-actin mRNA表达量显著降低(P<0.05)。提示心脏骤停后,心肺复苏过程中氧化应激可能是通过上调抗氧化基Nrf2 mRNA的表达,下调Keap1 mRNA表达。
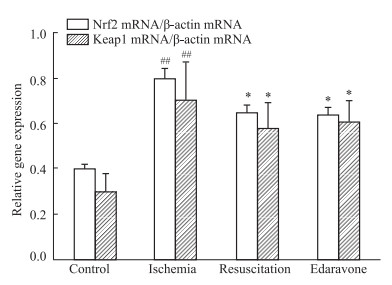
|
| Fig 3 Relative expression levels of hippocampal Nrf2 and Keap1 genes in rats (x±s, n=3) *P<0.05 vs Ischemia group; ##P<0.01 vs Control group |
采用Western blot法观察各组大鼠海马组织中氧化应激蛋白Nrf2和Keap1的表达情况,结果见Fig 4所示。与对照组大鼠比较,模型组大鼠海马中Nrf2/β-actin、Keap1/β-actin蛋白表达显著升高(P<0.01);与模型组比较,心肺复苏组和依达拉奉组Nrf2/β-actin、Keap1/β-actin蛋白表达量显著降低(P<0.05)。
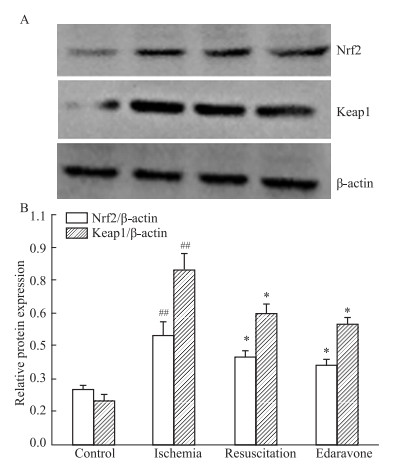
|
| Fig 4 Relative expression levels of hippocampal Nrf2 and Keap1 protein in rats A: Typical protein expression, B: Statistical diagram(x±s, n=3); ##P<0.01 vs Control group, *P<0.05 vs Ischemia group |
决定心跳骤停后患者行心肺复苏过程效果的重要因素之一是脑复苏,但其疗效有限,是全球性难以解决的问题。统计数据表明,美国院外每年约有30万心跳骤停患者,超过半数患者出现死亡,主要是由于患者神经系统出现不可逆性受损[6]。CPR后,患者全身器官存在缺血/再灌注损伤,而大脑对缺血缺氧较为敏感,而且脑组织中海马与学习记忆有关,与患者预后关系密切[7]。故本研究重点观察心跳骤停后大鼠行心肺复苏的海马结构变化,研究表明,模型组海马中损伤的神经元明显增多,细胞质中Nissl体减少,表明神经递质合成减少;而心脏骤停后心肺复苏组受损神经元数目较缺血模型组明显减少,神经元胞质中Nissl体含量明显增多,心跳骤停后及时体外按压,促使心肺复苏,可以促进大鼠自主循环重新建立,恢复全身组织器官,尤其是脑组织的供血供氧,故早期进行心肺复苏有利于神经系统功能恢复。在缺血/再灌注的应激反应过程中,机体产生大量氧自由基,依达拉奉也有一定的清除氧自由基功能,减轻神经细胞凋亡,从而降低氧化应激反应,且有报道显示,依达拉奉能够增加缺血脑组织中神经生长因子,降低脑损伤[8],故本研究将其选为阳性对照药。
临床上,如何降低CPR后脑损伤,改善患者生存质量。缺血/再灌注引起机体氧自由基(ROS)增多,ROS具有强氧化作用,化学性质活泼,引起细胞膜和细胞器膜骨架成分改变,造成细胞结构受损。ROS促使脂质过氧化反应而破坏膜结构和功能,导致膜通透性升高,细胞膜上Na+/Ca2+交换功能紊乱,引起细胞内Ca2+超载,激活磷脂酶类,破坏细胞器膜结构,加重细胞肿胀[9]。线粒体是细胞内氧化磷酸化供能的细胞器,是反映细胞内缺氧损伤的中心结构;脑缺血缺氧时,线粒体氧化磷酸化的代谢底物氧、糖等衰竭,神经元膜电位难以维持,电压依赖性钙通道开放,细胞钙离子内流导致钙超载,同时,线粒体为机体产生内源性活性氧的主要部位,钙超载等降低线粒体电子传递链,引起ROS增多,破坏线粒体膜磷脂,使细胞能量代谢进一步出现障碍[10]。本研究通过检测大鼠血清氧化应激指标,发现心跳骤停大鼠存在氧化应激情况,表现为血清MDA升高,SOD活性下降,而心肺复苏后,大鼠血清MDA含量下降,SOD活性上升,表明心肺复苏降低了大鼠心跳骤停后氧化应激损伤。同时,本研究通过透射电镜也证实了海马神经元中线粒体参与该损伤修复过程,表现为心脏骤停的缺血大鼠海马神经元线粒体损伤明显,线粒体嵴断裂,空泡状,而心肺复苏后线粒体结构改善明显。
锌指蛋白转录因子家族成员Nrf2可调控抗氧化反应原件,Keap1是Nrf2胞质蛋白伴侣分子,Nrf2是机体细胞抗氧化损伤的关键因子,正常情况下,Nrf2可修复细胞损伤,Nrf2与Keap1以二聚体形式存在于细胞质中,并达到相对平衡状态;在氧化应激损伤等刺激后,Nrf2与Keap1解离,激活下游抗氧化反应,提高细胞抗氧化应激功能[11]。心脏骤停产生的应激对机体组织细胞形成极强的刺激,促进呼吸爆发活性,激活氧化信号通路Nrf2-Keap1中相关基因的活性。本研究表明,通过检测大鼠海马组织中与抗氧化相关基因的Nrf2 mRNA和Keap1 mRNA表达,以及进一步在蛋白水平上进行Nrf2、Keap1检测,均得到一致的结果,证实心脏骤停后,实施心肺复苏对大鼠海马脑组织Nrf2、Keap1蛋白表达降低,缓解氧化应激损伤。
综上,心脏骤停后,大鼠机体会出现氧化应激损伤,表现为海马脑组织损伤,线粒体结构出现较为严重的破坏,心肺复苏可部分逆转该破坏,其机制与降低氧化应激损伤Nrf2/Keap1蛋白等有关。
( 本研究在安徽医科大学人体形态实验中心完成,感谢给予帮助的老师和同学们 )
| [1] |
Arrich J, Holzer M, Havel C, et al. Hypothermia for neuroprotection in adults after cardiopulmonary resuscitation[J]. Cochrane Database Syst Rev, 2016, 2(2): CD004128. |
| [2] |
Mehaffey J H, Money D, Charles E J, et al. Adenosine 2A receptor activation attenuates ischemia reperfusion injury during extracorporeal cardiopulmonary resuscitation[J]. Ann Surg, 2019, 269(6): 1176-83. doi:10.1097/SLA.0000000000002685 |
| [3] |
Hsu J, Wang C H, Huang S C, et al. Novel application of amino-acid buffered solution for neuroprotection against ischemia/reperfusion injury[J]. PLoS One, 2019, 14(9): e0221039. doi:10.1371/journal.pone.0221039 |
| [4] |
饶江燕, 李明航, 刁俊玲, 等. 贝沙罗汀上调线粒体自噬减轻小鼠脑缺血/再灌注损伤[J]. 中国药理学通报, 2020, 36(7): 940-5. Rao J Y, Li M H, Diao J L, et al. Bexarotene alleviates cerebral ischemia/reperfusion injury in mice by activating mitophagy[J]. Chin Pharmacol Bull, 2020, 36(7): 940-5. |
| [5] |
Bellezza I, Giambanco I, Minelli A, et al. Nrf2-Keap1 signaling in oxidative and reductive stress[J]. Biochim Biophys Acta Mol Cell Res, 2018, 1865(5): 721-33. doi:10.1016/j.bbamcr.2018.02.010 |
| [6] |
Girotra S, Chan P S, Bradley S M. Post-resuscitation care following out-of-hospital and in-hospital cardiac arrest[J]. Heart, 2015, 101(24): 1943-9. doi:10.1136/heartjnl-2015-307450 |
| [7] |
Chavez-Valdez R, Emerson P, Goffigan-Holmes J, et al. Delayed injury of hippocampal interneurons after neonatal hypoxia-ischemia and therapeutic hypothermia in a murine model[J]. Hippocampus, 2018, 28(8): 617-30. doi:10.1002/hipo.22965 |
| [8] |
Wang H M, Zhang T, Huang J K, et al. Edaravone attenuates the proinflammatory response in amyloid-beta-treated microglia by inhibiting NLRP3 inflammasome-mediated IL-1 beta secretion[J]. Cell Physiol Biochem, 2017, 43(3): 1113-25. doi:10.1159/000481753 |
| [9] |
Santo-Domingo J, Wiederkehr A, De Marchi U. Modulation of the matrix redox signaling by mitochondrial Ca2+[J]. World J Biol Chem, 2015, 6(4): 310-23. doi:10.4331/wjbc.v6.i4.310 |
| [10] |
Hamilton S, Terentyeva R, Martin B, et al. Increased RyR2 activity is exacerbated by calcium leak-induced mitochondrial ROS[J]. Basic Res Cardiol, 2020, 115(4): 38. doi:10.1007/s00395-020-0797-z |
| [11] |
Ding X, Jian T, Wu Y, et al. Ellagic acid ameliorates oxidative stress and insulin resistance in high glucose-treated HepG2 cells via miR-223/keap1-Nrf2 pathway[J]. Biomed Pharmacother, 2019, 110: 85-94. doi:10.1016/j.biopha.2018.11.018 |

