

2. 贵州省高等学校天然药物药理与成药性评价重点实验室,贵州 贵阳 550025;
3. 贵阳市妇幼保健院药学部,贵州 贵阳 550003
沈祥春(1973-),男,博士,教授,博士生导师,研究方向:心血管药物药理,通讯作者,E-mail: shenxiangchun@126.com
 ,
YANG Hong1,3,
LONG Qiu-shuang1,2,
FANG Guan-qin1,2,
GAO Ge1,2,
GAN Shi-quan1,2,
CHEN Yan1,2
,
YANG Hong1,3,
LONG Qiu-shuang1,2,
FANG Guan-qin1,2,
GAO Ge1,2,
GAN Shi-quan1,2,
CHEN Yan1,2
 ,
SHEN Xiang-chun1,2
,
SHEN Xiang-chun1,2

2. the High Educational Key Lab of Guizhou Province for Natural Medicinal Pharmacology and Druggability, Guiyang 550025, China;
3. Dept of Pharmacy, Maternal and Child Health Hospital of Guiyang, Guiyang 550003, China
糖尿病患病率和相关死亡率不断上升。全世界的糖尿病患者人数预计将从2017年的4.51亿增加至2045年的6.93亿。2017年, 全球20-99岁年龄段的糖尿病死亡人数约为500万[1]。这一新的预测使我们警惕糖尿病给全世界人类带来了巨大的社会、财务和卫生系统负担。超过68%的糖尿病病人最终死于心血管系统并发症, 糖尿病心血管并发症已成为糖尿病致死与致残的主要原因[2], 而血管内皮结构与功能的异常是血管并发症的前提与基础[3]。因此, 寻找改善血管内皮功能障碍的发病机制和保护性分子机制已成为近年来研究的重点。
自噬是一种进化上保守的分解代谢过程, 它以溶酶体依赖性的方式介导蛋白质降解, 细胞器周转和细胞质含量的循环[4]。最近的研究表明, 自噬失调与几种心血管病理过程有关, 例如糖尿病心血管疾病、动脉粥样硬化, 心脏肥大和心肌病[5-6]。自噬流是细胞稳态的参数之一, 它是自噬小体生物发生(多种自噬蛋白的隔离和膜状结构的形成)和封闭内容物降解之间的平衡。自噬流障碍会引起非必要的货物积累, 从而导致内质网应激、线粒体功能障碍和异位脂质蓄积。相反地, 自噬流通畅可改善代谢性疾病和心血管功能[7]。血管内皮细胞因其存在的广泛性和敏感性, 会随着外界环境的改变而发生功能改变, 并且伴随着自噬的产生。但自噬在血管内皮细胞中所扮演的角色及具体调控机制尚不明确。
1, 8-桉叶油素(1, 8-Cineole)是一种单萜, 存在于许多植物精油中, 例如迷迭香和艳山姜挥发油[8]。1, 8-Cineole具有抗氧化、抗炎、抗高血压和改善血管内皮损伤作用, 其是用于阿尔茨海默氏病、癌症、呼吸系统疾病、消化系统疾病、心血管疾病、烦躁不安和杆菌的潜在治疗剂[9], 但在心血管疾病研究主要集中在抗氧化和抗炎方面, 对自噬的研究尚少。本文旨在探讨1, 8-Cineole是否通过自噬来改善高糖诱导HAECs损伤, 为1, 8-Cineole防治糖尿病心血管疾病提供理论依据和实验基础。
1 材料与方法 1.1 仪器Heal force型细胞培养箱(中国上海力申科学仪器有限公司)、RM-220实验室专用超纯水机(沃特浦公司)、700-SERIES超低温冰箱(Thermo SCIEMTIFIC)、LS-R35L-I立式压力蒸气灭菌器(江阴滨江医疗设备有限公司)、SW-CJ-2F单人双面净化工作台(苏州净化设备有限公司)和5810R型冷冻离心机(德国Eppendorf公司)。
1.2 试剂及药物 1.2.1 试剂原代人主动脉内皮细胞(HAECs, 6100)购自ScienCell Research Laboratories、Endothelial Cell Medium(ECM, 1001)购自Sciencell technology, ECM中含有5.5 mmol·L-1葡萄糖; 乳酸脱氢酶试剂盒(A020-2)购自南京建成生物工程研究所; LC3(14600-1-AP, 1 ∶1 000)、SQSTM1/p62 (18420-1-AP, 1 ∶1 000)、caspase-3(66470-2-1g, 1 ∶1 000)、caspase-9(10380-1-AP, 1 ∶1 000)购自Proteintech公司、Beclin1(ab207612, 1 ∶1 000)购自Abcam公司。D-glucose(405A0918)和D-mannitol(1126F038)购自北京索莱宝科技有限公司; 1, 8-Cineole(Eucalyptol, K1822141)购自阿拉丁公司。
1.2.2 药物配制精密吸取1, 8-Cineole(纯度 > 99%)10 μL称重, 溶于990 μL二甲基亚砜, 0.22 μm滤头过滤除菌配制成浓度为9.405×106 μg·L-1的母液, 分装后置于-20 ℃保存备用。临用时用2% ECM稀释成所需浓度。
1.3 细胞培养及分组HAECs采用(含有5% FBS、1%双抗、1%血管内皮生长因子)ECM培养, 置于37 ℃、5%CO2的饱和湿度培养箱内培养。实验分为两部分, (1): 正常对照组(Control, 5. 5 mmol·L-1葡萄糖)、甘露醇作为渗透压对照组(MA, 29. 5 mmol·L-1甘露醇+ 5. 5 mmol·L-1葡萄糖)、高糖组(HG, 35 mmol·L-1葡萄糖)、药物1, 8-Cineole低剂量组(0.25 μg·L-1 1, 8-Cineole(CL)+HG)、药物1, 8-Cineole高剂量组(2.5 μg·L-1 1, 8-Cineole(CH)+HG)。各给药组预处理1 h后, 加入HG共同孵育60 h建立HAECs损伤模型。(2): 对照组(Control, 5. 5 mmol·L-1葡萄糖)、高糖组(HG, 35 mmol·L-1葡萄糖)、1, 8-Cineole高剂量组(2.5 μg·L-11, 8-Cineole(CH)+HG)、自噬抑制剂(10 μmol·L-1氯喹(CQ))组、CQ+HG共给药组、CQ+HG+CH 3者联用组。各给药组或抑制剂组预处理1 h后, 加入HG共同孵育60 h, 根据实验需要对细胞进行相应的处理。
1.4 MTT法检测细胞活力以1×108个·L-1密度的细胞接种于96孔板中, 采用MTT法检测细胞活性。计算公式: 细胞存活率/%=各组OD值/对照组OD值×100%。
1.5 LDH检测细胞毒性收集各处理组细胞上清液, 根据南京建成LDH检测试剂盒使用明书进行实验操作, 计算细胞上清液中LDH含量。
1.6 Western blot法检测相关蛋白表达分别收集各处理组的细胞, 加入细胞裂解液, 其中PMSF占总体积1%, RIPA占总体积99%来提取总蛋白, 二喹啉甲酸(BCA)进行定量, 规定上样质量30 μg后进行分装。经12%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳后, 采用湿转法将蛋白转移到0.22 μm PVDF膜上, 采用2%牛血清白蛋白(BSA)进行室温1 h封闭。加入相应一抗, 置于4 ℃冰箱孵育过夜, 次日从冰箱拿出膜于摇床上摇0.5 h后, 回收一抗, 1 × TBST洗膜3次后, 加入二抗室温孵育, 1 h后回收二抗, 洗膜3次。采用化学发光液在暗室显影。
1.7 统计学方法所有实验结果数据均采用x±s表示, 采用GraphPad Prism7软件对独立重复3次实验结果进行统计学处理。组间分析比较采用单因素方差分析所有数据。
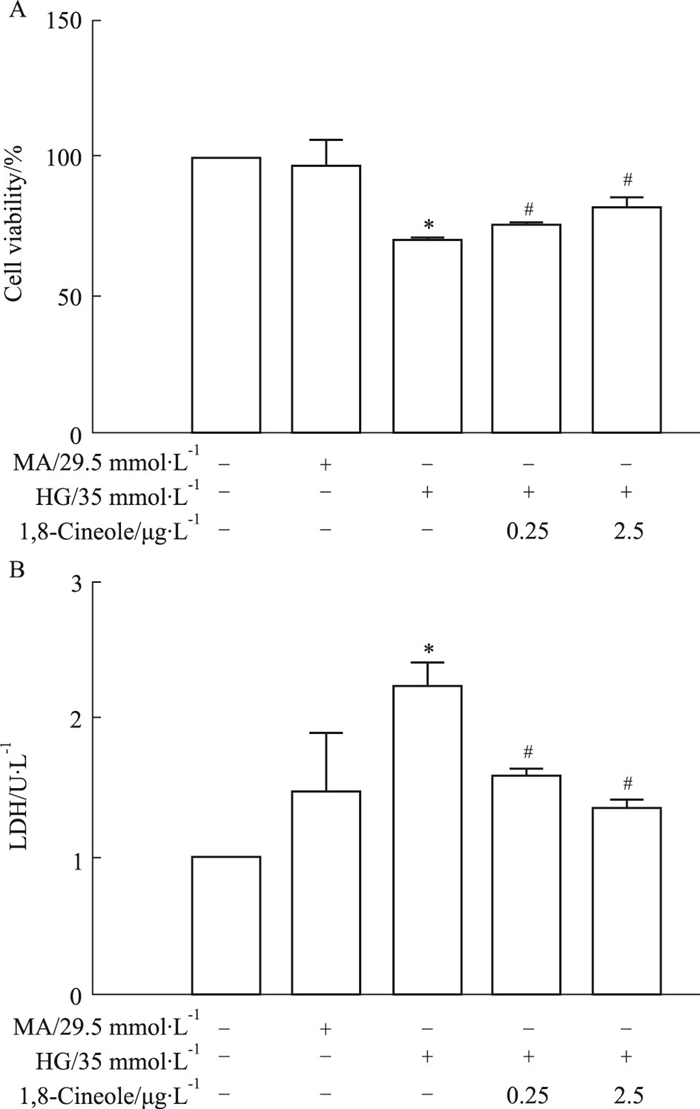
2 结果 2.1 1, 8-Cineole增强HAECs活力和减轻高糖诱导的细胞毒性MTT结果显示,高糖孵育细胞60 h后,HG组细胞活力明显降低(P < 0.05),如Fig 1A所示,1, 8-Cineole组以剂量依赖性增强细胞活力(P < 0.05,与HG模型组比较);HG模型组与Control组比较,LDH含量增加(P < 0.05);1, 8-Cineole组与HG模型组比较,LDH含量减少(P < 0.05)且呈剂量依赖性,如Fig 1B所示。
|
| Fig 1 A. Cell viability enhanced by 1, 8-Cineole x±s n=3); B. HG-induced cytotoxicity reduced by 1, 8-Cineole x±s n=3) *P < 0.05 vs Control; #P < 0.05 vs HG. |
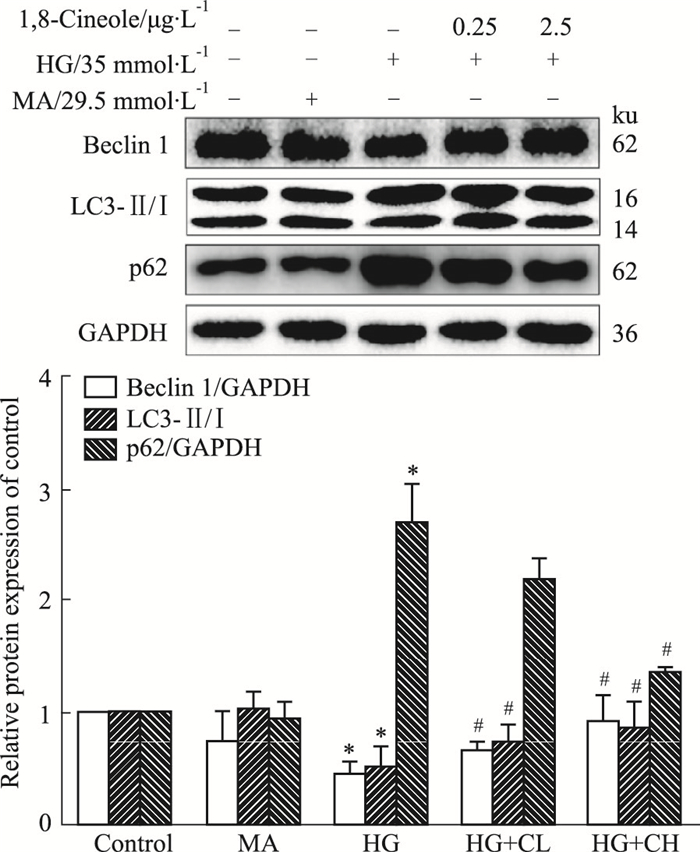
与Control组比较, HG组抑制Beclin1和LC3-Ⅱ/Ⅰ蛋白的表达(P < 0.05), 促进p62蛋白的表达(P < 0.05);与HG组相比较, 1, 8-Cineole处理后可上调Beclin1和LC3-Ⅱ/Ⅰ蛋白的表达和下调p62蛋白的表达(P < 0.05)。结果表明1, 8-Cineole可激活自噬, 使自噬流通畅, 如Fig 2所示。
|
| Fig 2 Effect of 1, 8-Cineole on HG-induced autophagy inhibition (x±s, n=3) *P < 0.05 vs Control; #P < 0.05 vs HG. |
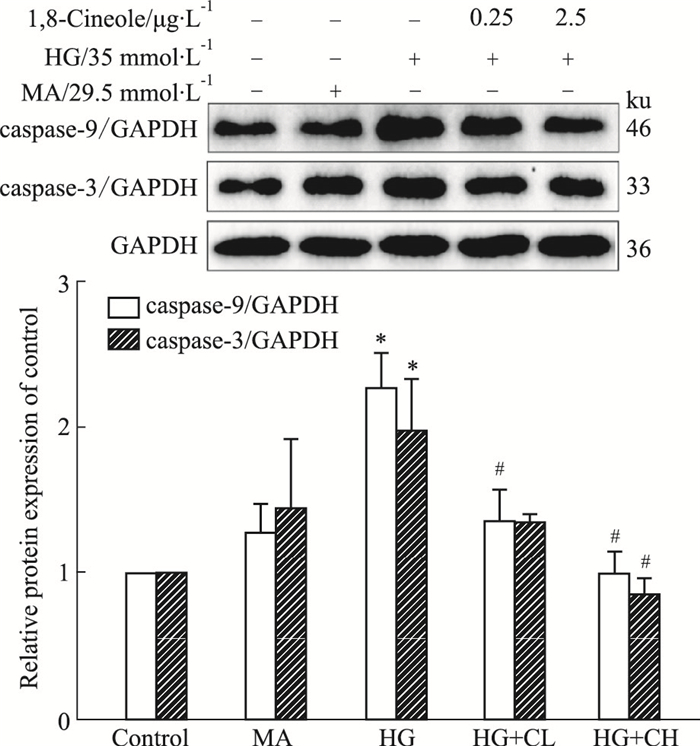
如Fig 3所示, Western blot结果表明, 与Control组比较, HG组促进caspase-9和caspase-3蛋白上调(P < 0.05);与HG组比较, 1, 8-Cineole组二者表达都下调(P < 0.05)。结果说明, 1, 8-Cineole可抑制HG诱导细胞的凋亡。
|
| Fig 3 HG-induced cell apoptosis inhibited by 1, 8-Cineole (x±s, n=3) *P < 0.05 vs Control; #P < 0.05 vs HG. |
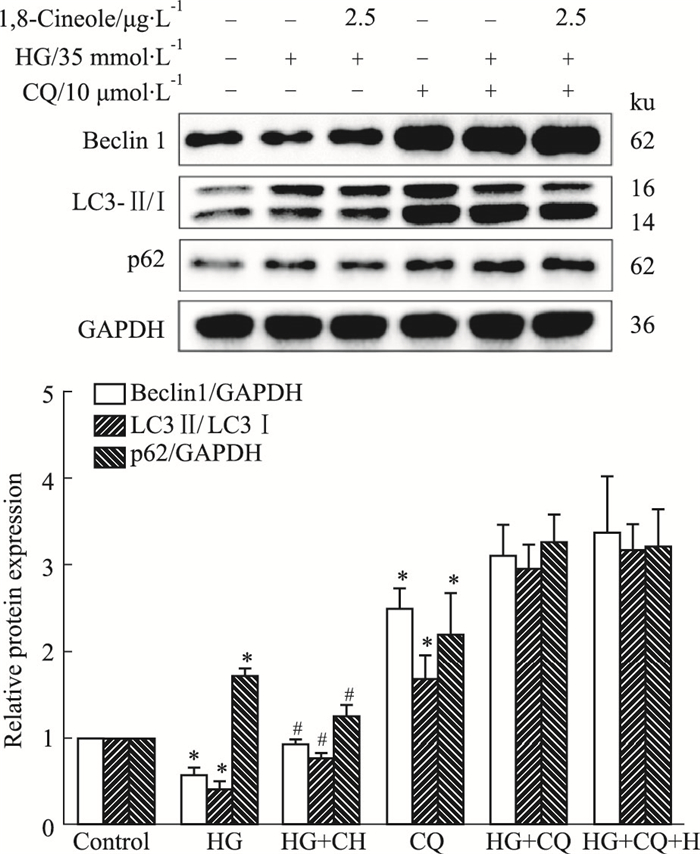
溶酶体抑制剂氯喹(CQ), 可导致自噬流障碍, 从而使自噬小体积聚增加。在本研究中, Western blot结果显示, CQ组与Control组相比, Beclin1、LC3-Ⅱ/Ⅰ和p62表达进一步上调(P < 0.05);CQ+HG+CH组与CQ+HG组比较时三者差异无统计学意义, 如Fig 4所示。结果表明, 给予自噬抑制剂CQ, 发现1, 8-Cineole对HAECs自噬的改善作用被CQ完全减弱, 提示1, 8-Cineole通过调节自噬流改善HG诱导自噬抑制。
|
| Fig 4 Effect of autophagy inhibitors on 1, 8-Cineole in improving autophagy flow (x±s, n=3) *P < 0.05 vs Control; #P < 0.05 vs HG. |
给予自噬抑制剂CQ干预后, caspase-9和caspase-3较Control组明显上调(P < 0.05);CQ+HG+CH组与CQ+HG组比较时二者差异无统计学意义, 如Fig 5所示。结果表明, 1, 8-Cineole通过调节自噬流障碍改善HG诱导HAECs的凋亡。
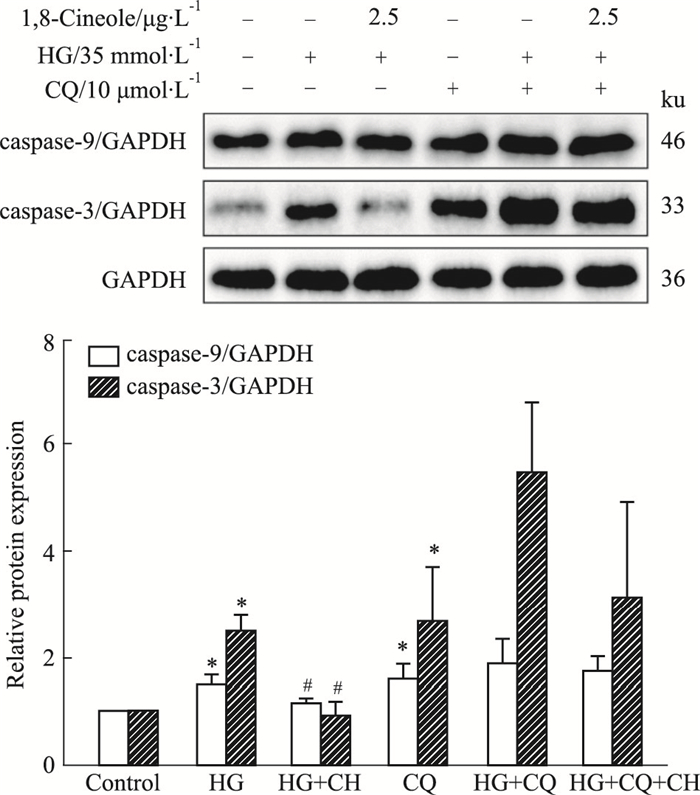
|
| Fig 5 HG-induced apoptosis improved by 1, 8-Cineole via regulating autophagic flux (x±s, n=3) *P < 0.05 vs Control; #P < 0.05 vs HG. |
随着人口老龄化的加剧以及生活方式的改变, 心血管疾病成为严重威胁人类健康的重要疾病之一, 在近几年的流行病调查中, 因心血管疾病死亡人数一直高居因病死亡的榜首, 因此, 心血管疾病的预防和治疗便成为现阶段各国科研和临床研究的重点[10]。研究显示[11], 心脏、血管是糖尿病的主要靶器官, 其中约2/3的糖尿病患者死于心血管疾病。糖尿病与心血管疾病的发生具有密切的关系, 一旦发生心血管疾病后会对心脏、血管造成持续性损害, 严重影响患者预后。
血管内皮细胞在维持心血管系统正常功能中起着关键作用, 而内皮功能障碍已被认为是几乎所有心血管疾病的常见危险因素[12]。在糖尿病血管并发症的发病过程中, 自噬对血管内皮细胞和平滑肌细胞起到了保护的作用。自噬是一种细胞自我保护机制, 通过这种机制, 细胞通过分类为大自噬的溶酶体依赖性机制降解受损的蛋白质和大分子。该过程涉及几个步骤, 包括引发、延伸、成熟、融合和降解。起始时, 在细胞质成分周围形成一个荧光团, 然后被一个双层膜隔离, 形成一个自噬体。随后, 自噬体与溶酶体融合形成自溶体, 封闭的内容物随后降解[13]。Beclin-1是自噬启动的必需基因, 通过与Ⅲ型磷脂酰肌醇3激酶(Ⅲ PI3K)结合形成Beclin1-Ⅲ PI3K复合物, 调节自噬的水平。Beclin-1是第1个被发现的参与自噬对疾病调控的自噬基因, 在自噬溶酶体降解途径中对肿瘤有抑制作用。LC3是自噬体膜的重要标记物, 以LC3Ⅰ和LC3 Ⅱ两种形式存在, LC3在羧基端被具有蛋白内切酶活性的Atg4剪切, 生成存在于细胞质的LC3Ⅰ; LC3Ⅰ通过Atg7和Atg3参与的泛素样反应, 使磷脂酰乙醇胺偶联, 生成脂质化形式的LC3 Ⅱ; LC3Ⅱ是自噬体的结构蛋白, 可以附着到自噬体膜上, 通过监测LC3Ⅰ向LC3Ⅱ的转化可以检测自噬的进展, 所以通常用Western blot检测LC3-Ⅱ/Ⅰ或mRFP-GFP-LC3双荧光实验评估自噬的表达[14]。p62是将LC3与泛素化底物连接的自噬的重要指标。p62被多泛素化蛋白转移到自噬体中, 并在自溶酶体中降解。当在哺乳动物细胞中抑制自噬时, p62的表达增加[15]。自噬紊乱可能是多种疾病的发病机理, 包括心血管疾病, 代谢性疾病, 肾脏疾病, 炎症, 癌症以及神经退行性疾病。Ye等[16]研究提示, 敲除Beclin 1(自噬启动形成的关键组成部分)会加剧大鼠颈动脉损伤后新内膜的形成, 这与延迟的内皮化有关。Beclin1是哺乳动物自噬基因, 对自噬调节至关重要。最新研究表明, 用30 mmol·L-1葡萄糖处理人脐静脉内皮细胞(HUVEC)后p62的表达增加, 但抑制LC3-Ⅱ/Ⅰ的表达, 透射电子显微镜显示, HUVEC膜中自噬泡的减少[17]。在本研究中, HG处理细胞60 h后, 检测到Beclin1和LC3-Ⅱ/Ⅰ蛋白表达水平降低, p62表达增加, 与文献报道结果一致; 文献显示, 使用自噬抑制剂抑制巨噬细胞自噬, 由于线粒体膜稳定性降低或半胱天冬酶抑制作用降低, 可增强凋亡诱导的细胞死亡[18], 在本文中, HG处理细胞后, caspase-3和caspase-9表达增加, 在给予自噬抑制剂CQ干预细胞后, 观察到caspase-3和caspase-9表达进一步增加, 表明CQ促进细胞凋亡。因此筛选有效的天然活性物质调控自噬改善高糖诱导的内皮功能障碍是防治糖尿病心血管并发症的重要策略。
1, 8-Cineole是从植物精油中提取的单体化合物, 目前1, 8-Cineole在心血管药理学研究报道尽显稀缺。本研究结果表明, 高糖作用HAECs 60 h后, 诱导细胞活力下降、增加LDH含量、抑制自噬和促进细胞凋亡, 在给予1, 8-Cineole干预后可增强细胞活力、降低LDH含量、激活自噬和抑制细胞凋亡。给予自噬抑制剂CQ后, 与Control组相比较, 观察到Beclin1、LC3-Ⅱ/Ⅰ和p62表达进一步增加, 而CQ+HG+CH组与CQ+HG组比较时三者差异无统计学意义, 表明1, 8-Cineole对HAECs自噬流的改善作用被CQ完全减弱, 提示1, 8-Cineole通过调节自噬流改善HG诱导自噬抑制; 同时caspase-9和caspase-3较Control组明显上调, 而CQ+HG+CH组与CQ+HG组比较时二者差异无统计学意义, 表明1, 8-Cineole可能通过改善自噬流障碍来抑制细胞凋亡的发生, 从而发挥其对高糖诱导内皮损伤的保护作用。本文不足之处在于只在体外实验中探讨了抑制溶酶体后, 检测1, 8-Cineole对Beclin1、LC3-Ⅱ/Ⅰ和p62表达和caspase-3和caspase-9蛋白表达情况, 并未在体内相对应验证1, 8-Cineole的作用, 从而阐明1, 8-Cineole通过改善自噬流对糖尿病心血管疾病起到保护作用, 未来的研究会对朝着这个方向深入研究, 进一步深入系统阐明糖尿病血管内皮损伤的关键机制与1, 8-Cineole的防治作用。
综上所述, 本研究提示1, 8-Cineole对高糖诱导的人主动脉内皮细胞损伤具有保护作用, 其调控机制可能与自噬流有关。
| [1] |
Cho N H, Shaw J E, Karuranga S, et al. IDF Diabetes Atlas: Global estimates of diabetes prevalence for 2017 and projections for 2045[J]. Diabetes Res Clin Pract, 2018, 138: 271-81. doi:10.1016/j.diabres.2018.02.023 |
| [2] |
Lew J K, Pearson J T, Schwenke D O, et al. Exercise mediated protection of diabetic heart through modulation of microRNA mediated molecular pathways[J]. Cardiovasc Diabetol, 2017, 16(1): 10. doi:10.1186/s12933-016-0484-4 |
| [3] |
Sharma A, Rizky L, Stefanovic N, et al. The nuclear factor (erythroid-derived 2)-like 2 (Nrf2) activator dh404 protects against diabetes-induced endothelial dysfunction[J]. Cardiovasc Diabetol, 2017, 16(1): 33. doi:10.1186/s12933-017-0513-y |
| [4] |
Klionsky D J, Emr S D. Autophagy as a regulated pathway of cellular degradation[J]. Science, 2000, 290: 1717-21. doi:10.1126/science.290.5497.1717 |
| [5] |
Choi A M, Ryter S W, Levine B. Autophagy in human health and disease[J]. N Engl J Med, 2013, 368: 651-62. doi:10.1056/NEJMra1205406 |
| [6] |
Lavandero S, Chiong M, Rothermel B A, et al. Autophagy in cardiovascular biology[J]. J Clin Invest, 2015, 125: 55-64. doi:10.1172/JCI73943 |
| [7] |
Kim H S, Ren G, Kim T, et al. Metformin reduces saturated fatty acid-induced lipid accumulation and inflammatory response by restoration of autophagic flux in endothelial cells[J]. Sci Rep, 2020, 10(1): 13523. doi:10.1038/s41598-020-70347-w |
| [8] |
Yadav N, Chandra H. Suppression of inflammatory and infection responses in lung macrophages by eucalyptus oil and its constituent 1, 8-cineole: Role of pattern recognition receptors TREM-1 and NLRP3, the MAP kinase regulator MKP-1, and NF-κB[J]. PLoS One, 2017, 12: 188-232. |
| [9] |
Cai Z M, Peng J Q, Chen Y, et al. 1, 8-Cineole: a review of source, biological activities, and application[J]. J Asian Nat Prod Res, 2020, 28: 1-17. |
| [10] |
段鹏, 王金鑫, 卫世强, 等. 线粒体ATP敏感钾通道与心血管疾病[J]. 中国药理学通报, 2018, 34(6): 753-6. Duan P, Wang J X, Wei S Q, et al. Mitochondrial ATP-sensitive potassium channels and cardiovascular diseases[J]. Chin Pharmacol Bull, 2018, 34(6): 753-6. doi:10.3969/j.issn.1001-1978.2018.06.004 |
| [11] |
杨敏, 汤云昭, 倪长林. 2型糖尿病患者心血管疾病的发病机制[J]. 医学信息, 2020, 33(6): 56-8. Yang M, Tang Y Z, Ni C L. The pathogenesis of cardiovascular disease in patients with type 2 diabetes[J]. Med Inf, 2020, 33(6): 56-8. |
| [12] |
Jiang F. Autophagy in vascular endothelial cells[J]. Clin Exp Pharmacol Physiol, 2016, 43(11): 1021-8. doi:10.1111/1440-1681.12649 |
| [13] |
Koch EAT, Nakhoul R, Nakhoul F, et al. Autophagy in diabetic nephropathy: a review[J]. Int Urol Nephrol, 2020, 52(9): 1705-12. doi:10.1007/s11255-020-02545-4 |
| [14] |
柴亚男, 马雪莲, 郝娟, 等. 依普利酮抑制盐皮质激素受体活化减缓梗阻性肾病细胞自噬的研究[J]. 中国药理学通报, 2020, 36(2): 256-60. Chai Y N, Ma X L, Hao J, et al. Inhibition of mineralocorticoid receptor activation by eplerenone to reduce autophagy in obstructive nephropathy[J]. Chin Pharmacol Bull, 2020, 36(2): 256-60. |
| [15] |
Wu Q, Hu Y, Jiang M, et al. Effect of autophagy regulated by Sirt1/FoxO1 pathway on the release of factors promoting thrombosis from vascular endothelial cells[J]. Int J Mol Sci, 2019, 20(17): 4132. doi:10.3390/ijms20174132 |
| [16] |
Ye L X, Yu J, Liang Y X, et al. Beclin 1 knockdown retards re-endothelialization and exacerbates neointimal formation via a crosstalk between autophagy and apoptosis[J]. Atherosclerosis, 2014, 237: 146-54. doi:10.1016/j.atherosclerosis.2014.08.052 |
| [17] |
Bai X, Yang X, Jia X, et al. CAV1-CAVIN1-LC3B-mediated autophagy regulates high glucose-stimulated LDL transcytosis[J]. Autophagy, 2020, 16(6): 1111-29. doi:10.1080/15548627.2019.1659613 |
| [18] |
Noguchi M, Hirata N, Tanaka T, et al. Autophagy as a modulator of cell death machinery[J]. Cell Death Dis, 2020, 11(7): 517. doi:10.1038/s41419-020-2724-5 |