


随着环境不断恶化,空气质量日益下降,全球哮喘的患病率和死亡率正逐年攀升[1]。气道重塑作为哮喘的三大病理生理特征之一,是气道炎症慢性发展的必然结果。由于持续性的气道炎症反复发作,反复修复,导致组织增生而发生气道重塑,最终导致气道高反应性的发生[2]。相关研究表明,气道重塑是导致哮喘难以根治的重要原因[3]。目前最有效的抗炎药物糖皮质激素作为一线抗哮喘药物,在临床上被广泛使用。但有研究表明,糖皮质激素对于抑制气道重塑作用有较大的个体化差异,而且若长期应用也会出现代谢紊乱、抑制生长发育等不良反应[4]。因此,仍需不断探寻新的抗哮喘药物。近年来,越来越多的中药已被证实能够通过抑制哮喘相关的免疫反应和细胞因子来抑制哮喘气道重塑,从而预防和治疗哮喘[1]。
麻黄汤始载于张仲景的《伤寒论》,是临床上辛温解表的经典方剂。该方由麻黄、桂枝、苦杏仁、炙甘草四味药材组成,具有发汗解表、止咳平喘的功效,可用于支气管哮喘、流行性感冒等肺部疾病的治疗[5]。但麻黄汤作为中药复方,具有复杂的化学成分,其治疗哮喘的作用机制也相对复杂,若仅仅只通过传统的动物实验或细胞实验的方法研究其药理机制则较为困难。而通过网络药理学可对麻黄汤治疗哮喘的作用机制进行初步的筛选,使后续机制研究能更具有针对性。因此,本研究首先运用网络药理学的方法,筛选麻黄汤治疗哮喘的潜在信号通路,并复制大鼠哮喘模型,探讨麻黄汤对哮喘大鼠气道重塑、气道高反应的影响及其相关机制,以期为其临床治疗哮喘提供相应的理论和实验依据。
1 材料与方法 1.1 网络药理学数据库中药系统药理学数据库和分析平台TCMSP;生物分子功能注释系统MAS3.0;台湾中医药资料库(TCM@Taiwan);Cytoscape 3.6.0软件;PharmGKB数据库;Drugbank数据库;STITCH数据库;OMIM数据库;TTD数据库。
1.2 动物健康雄性SD大鼠,体质量(230±20)g,浙江中医药大学动物实验研究中心提供。动物许可证号: SCXK(浙)2014 -0001。
1.3 药材、仪器与试剂麻黄(批号180801)、桂枝(批号180801)、炙甘草(批号180801)、苦杏仁(批号180910)均购自浙江中医药大学名中医馆。麻黄汤样品为四味组方药材加水煎煮后浓缩制得,每1 mL药液相当于1 g生药量,汤剂的密度值约为1.1 mg·L-1。
384酶标仪(美国MD公司);EMKA动物肺功能检测系统(北京广源达科技发展有限公司);402A1超声雾化器(江苏鱼跃医疗设备有限公司);高速冷冻离心机(Sigma公司);可见紫外分光光度计(Beckman公司);CFX384多重实时荧光定量PCR仪(美国Bio-Rad公司);MICROM HM340E石蜡切片机(德国MICROM公司);OLYMPUS BX60型荧光显微镜摄像机(日本OLYMPUS公司);Leica HI120型摊片机(德国Leica公司)。
地塞米松标准品(批号C10197719)、氢氧化铝(批号C10206974)、氯化乙酰甲胆碱(Mch, 批号C10267781)均购自上海麦克林生化科技有限公司;卵清蛋白干粉(OVA,批号A5253),购自美国Sigma公司;乌拉坦(批号Z23S8Y44213),Rat VEGF、Rat bFGF、Rat TGF-β1、Rat OPN、Rat ET-1 ELISA试剂盒(批号E20190101A),购自上海源叶生物科技有限公司。
1.4 信号通路筛选参照相关文献[6-7],利用TCMSP、TCM@Taiwan数据库并结合文献检索结果收集麻黄汤中的化学成分;通过STITCH数据库检索成分对应靶点以及利用PharmGKB、Drugbank、OMIM和TTD数据库检索哮喘对应靶点,再通过Cytoscape软件构建成分-靶点、麻黄汤靶点蛋白相互作用(protein-protein interaction, PPI)网络、哮喘靶点PPI网络及麻黄汤与哮喘靶点PPI网络,合并相关PPI网络后取其交集部分筛选麻黄汤治疗哮喘的候选靶点,再通过GO分析以及KEGG通路分析筛选麻黄汤治疗哮喘的潜在信号通路。
1.5 分组和给药SD大鼠随机分为6组,分别为空白对照组(N)、哮喘模型组(M)、麻黄汤高剂量组(10 mL·kg-1,MHT-H)、麻黄汤中剂量组(5 mL·kg-1,MHT-M)、麻黄汤低剂量组(2.5 mL·kg-1,MHT-L)、地塞米松组(1 mg·kg-1,DXM),每组6只大鼠。给药组大鼠于首次致敏后d 15起灌胃相应药物,每天1次,对照组及模型组大鼠每天灌胃生理盐水,持续14 d。麻黄汤给药剂量根据人临床给药剂量以及人和大鼠的体表面积换算而来。
1.6 大鼠哮喘模型的复制大鼠适应性喂养3 d后,除空白对照组外,其他各组大鼠参照文献方法[8],于d1及d8腹腔注射1 mL含10% OVA及10%氢氧化铝的生理盐水混悬液致敏,d15起将大鼠放入自制密闭容器内,超声雾化吸入2% OVA混悬液,连续激发2周,每天1次,每次30 min。
1.7 哮喘大鼠气道反应性检测末次激发24 h后,大鼠放入体描箱中,使其稳定5 min以适应环境。首先测定各项Penh基础值3 min,然后加入200 μL用生理盐水稀释的不同浓度Mch溶液,浓度由低到高依次为0、3.125、6.25、12.5、25、50 g·L-1,每次雾化吸入时间2 min,每个激发剂量时的Penh值取雾化吸入后3 min的平均值。
1.8 大鼠血清相关指标检测末次激发24 h后,大鼠按1.2 g·kg-1剂量用20%乌拉坦麻醉后,行腹主动脉采血。血样3 000 r·min-1离心,取血清,分装,冻存于-80 ℃冰箱备用。全部取样结束后,ELISA测定大鼠血清中VEGF、ET-1、OPN、bFGF以及TGF-β1的含量。
1.9 PAS染色及MASSON染色腹主动脉取血后处死大鼠,取大鼠左肺,常规石蜡包埋,行PAS染色观察大鼠气道粘液分泌情况,行MASSON染色观察大鼠气道上皮下胶原沉积情况。
1.10 大鼠肺组织相关基因mRNA测定参考相关文献[9],TRIzol Reagent法提取大鼠肺组织总RNA,将RNA反转录为cDNA。用Primer 5.0软件设计引物如Tab 1所示,PCR扩增体系及反应条件如Tab 2所示。扩增结束后,分析熔解曲线,鉴定PCR产物的特异性。获取各个样本量的Ct值,以GAPDH作对照,计算目的基因mRNA的相对表达量。
| Gene | Sequence number | Primer sequence(5′→3′) | Amplification length | Dissociation temperature/℃ |
| Rat GAPDH | NM_017008.4 | GAAGGTCGGTGTGAACGGATTTG | 127 | 60 |
| CATGTAGACCATGTAGTTGAGGTCA | ||||
| Rat p38 MAPK | NM_031020.2 | GAGGTGCCCGAGCGATACCA | 165 | 60 |
| CCGCAGCTCCCTGTAGGTCCT | ||||
| Rat NF-κB p65 | AY307375 | GCGAGACCTGGAGCAAGCCATTA | 109 | 60 |
| GAGGCGGACCGCATTCAAGTCAT | ||||
| Rat VEGF | NM_001110333 | GTCACCACCACACCACCATCGT | 76 | 60 |
| CTCCTCTCCCTTCATGTCAGGCT |
| 20 μL system | |
| SDW | 8.0 μL |
| Power SYBRⓇ Green Master Mix | 10.0 μL |
| Forward Primer(10 μmol·L-1) | 0.5 μL |
| Reverse Primer(10 μmol·L-1) | 0.5 μL |
| cDNA | 1.0 μL |
| Reaction condition: 95℃, 1 min; 40 recycles(95 ℃, 15 s, 63 ℃, 25 s); 55 to 95 ℃ dissociation curve | |
采用SPSS 19.0软件进行统计分析。数据均以x±s表示,采用单因素方差分析和t检验进行组间比较。
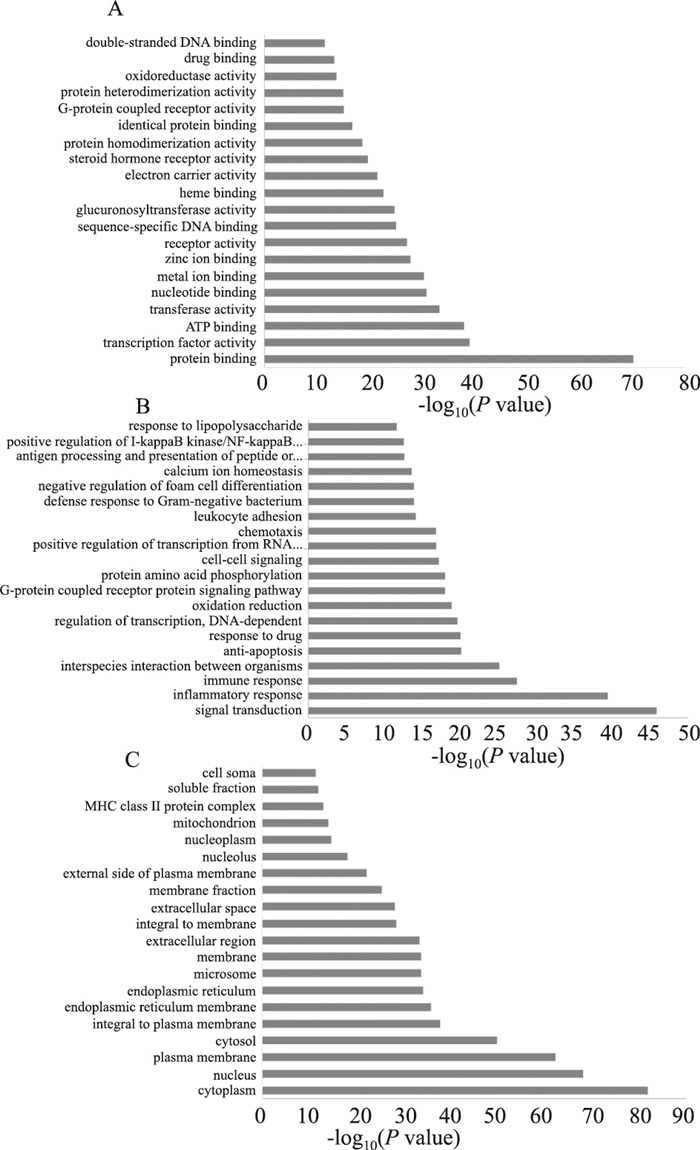
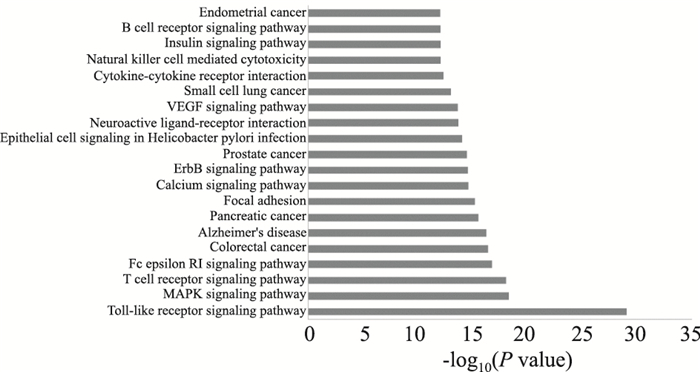
2 结果 2.1 网络药理学结果利用网络药理学共筛选出麻黄汤中58种化学成分,248个成分相关靶点,229个哮喘相关靶点,绘制麻黄汤成分-靶点、麻黄汤靶点PPI网络、哮喘靶点PPI网络及麻黄汤与哮喘靶点PPI网络图:麻黄汤成分-靶点网络图包括306个节点和359条边;麻黄汤靶点PPI网络共有6 093个相互作用蛋白,147 976条相互作用关系;哮喘靶点PPI网络共有4 004个相互作用蛋白,91 454条相互作用关系;麻黄汤与哮喘靶点PPI网络图共有节点458个,相互作用关系912条。合并相交网络筛选得出186个候选靶点。候选靶点进行GO分析和KEGG富集分析后,发现麻黄汤治疗哮喘与蛋白质结合、转录因子活性、信号转导、炎症应答等过程关系密切,GO分析结果结果见Fig 1。KEGG通路注释结果(Fig 2)则发现麻黄汤抗哮喘的作用机制可能涉及到Toll样受体、丝裂原活化蛋白激酶(MAPK)、T细胞受体等信号通路。
|
| Fig 1 Results of GO analysis |
|
| Fig 2 Results of KEGG pathways analysis |
大鼠气道性反应结果见Tab 3所示,与正常组大鼠相比较,当激发剂Mch浓度较高时,模型组大鼠Penh值均高于正常组大鼠(P < 0.01);各给药组大鼠Penh值均低于模型组,当Mch激发浓度达到25、50 g·L-1时,麻黄汤各剂量组均能显著降低哮喘大鼠Penh值(P < 0.05),表明麻黄汤能降低哮喘大鼠气道反应性,改善哮喘气道高反应。
| Group | Baseline | NS | 3.125 g·L-1 | 6.25 g·L-1 | 12.5 g·L-1 | 25 g·L-1 | 50 g·L-1 |
| N | 0.56±0.12 | 0.95±0.26 | 1.38±0.52 | 1.57±0.64 | 1.79±0.55 | 1.66±0.29 | 2.13±0.22 |
| M | 0.89±0.29* | 1.34±0.53 | 1.64±0.62 | 2.37±0.80* | 2.70±0.62* | 3.24±0.44** | 3.60±0.41** |
| MHT-H | 0.69±0.17 | 1.32±0.25 | 1.39±0.39 | 1.83±0.56 | 1.96±0.62 | 2.12±0.93# | 2.32±0.99# |
| MHT-M | 0.92±0.33 | 1.24±0.28 | 1.94±1.31 | 2.09±0.65 | 2.18±0.65 | 2.05±0.96# | 2.39±1.14# |
| MHT-L | 0.76±0.18 | 1.18±0.36 | 1.47±0.38 | 2.27±0.79 | 2.30±0.84 | 2.04±0.65# | 2.47±0.67# |
| DXM | 0.96±0.17 | 1.22±0.21 | 1.51±0.31 | 2.08±0.54 | 2.23±0.75 | 2.13±0.88# | 2.38±0.63# |
| *P < 0.05, **P < 0.01 vs control; #P < 0.05 vs model | |||||||
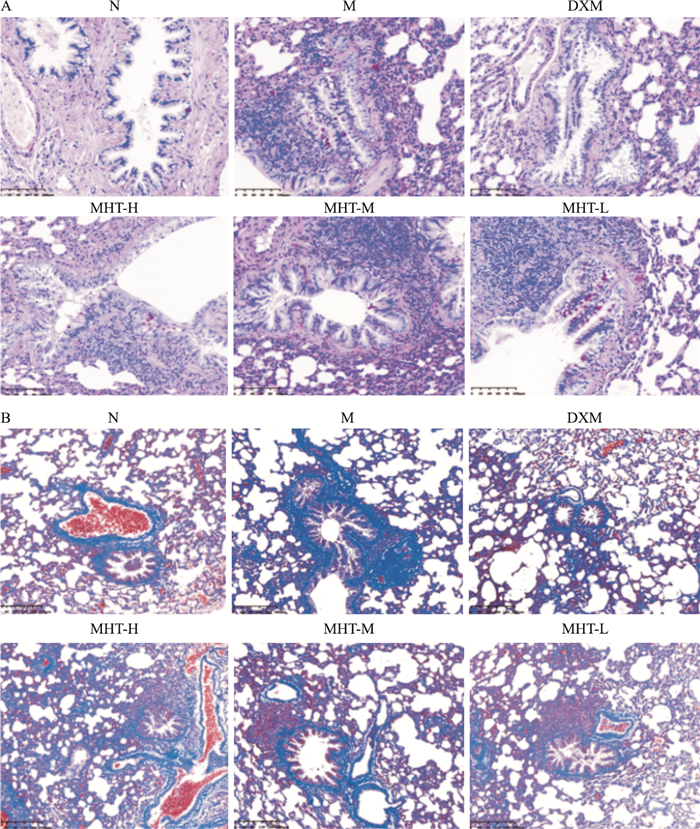
气道粘液分泌及气道上皮下胶原沉积情况见Fig 3A。PAS染色结果表明,正常组大鼠气道上皮杯状细胞数目较少,气道粘液分泌较少;模型组大鼠气道上皮杯状细胞大量增生,管腔中粘液分泌较多,导致气道狭窄;各给药组与模型组相比,杯状细胞数目及管腔内粘液分泌减少,表明麻黄汤能减少哮喘大鼠气道上皮杯状细胞数目,改善气道粘液分泌情况。
|
| Fig 3 PAS staining and Masson staining A: PAS staining(×200);B: Masson staining(×100) |
MASSON染色结果(Fig 3B)表明,正常大鼠肺组织结构清楚,无明显气道上皮下胶原沉积情况;经OVA致敏激发后,大鼠气道重塑现象严重,气道管腔狭窄,且上皮下胶原过度沉积;给予不同药物干预后,各给药组大鼠上皮下胶原沉积情况均得到不同程度的改善,表明麻黄汤能有效改善哮喘大鼠气道重塑情况。
2.3 对哮喘大鼠血清中VEGF、ET-1、OPN、bFGF以及TGF-β1含量表达的影响如Fig 4所示,与对照组比较,模型组大鼠血清中VEGF、ET-1、OPN、bFGF以及TGF-β1的含量均上升(P < 0.05);与模型组比较,麻黄汤各剂量组均能降低大鼠血清中VEGF、ET-1、OPN、bFGF以及TGF-β1的含量(P < 0.05)。

|
| Fig 4 Effect of MHT on content of related factors in serum of asthmatic rats(x±s, n=6) **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs model |
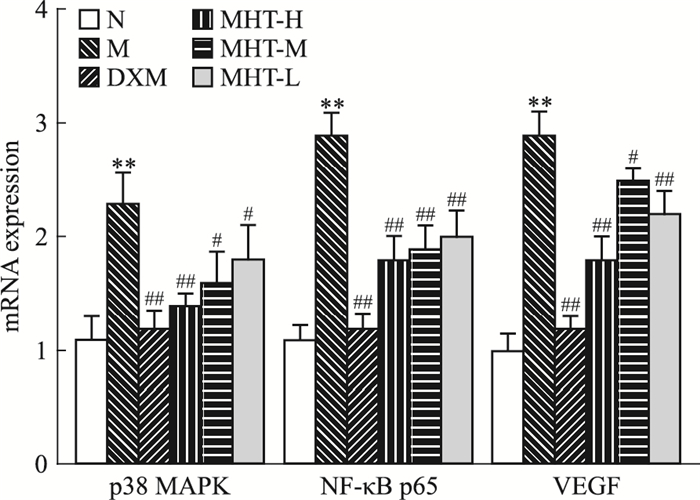
p65、VEGF mRNA表达的影响与对照组大鼠比较,模型组大鼠肺组织中p38MAPK、NF-κB p65、VEGF mRNA表达量增加(P < 0.001);麻黄汤组能下调大鼠肺组织中p38MAPK、NF-κB p65、VEGF的mRNA表达量(P < 0.01),见Fig 5。
|
| Fig 5 Changes of mRNA expression levels of key genes in rat lung tissue(x±s, n=6) **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs model |
在本研究中,通过网络药理学共筛选出麻黄汤治疗哮喘的186个候选靶点。GO富集分析显示,信号转导、炎症应答、免疫响应等生物过程排名较靠前;在分子功能中,上述候选靶点主要涉及到蛋白质结合、转录因子活性等。炎症介质在哮喘的慢性炎症反应中有着重要的作用。课题组前期研究证实,麻黄汤可抑制哮喘大鼠炎症因子的表达,改善其气道炎症[5]。而转录因子如活化蛋白-1则可以快速诱导并协同已存在的转录因子如GATA-3,激活Th2细胞内的IL-4、IL-5及IL-13的基因转录。Th2细胞分泌IL-4、IL-5等细胞因子并促进IgE大量合成,增强免疫应答。在KEGG生物途径富集分析中,Toll样受体信号通路、MAPK信号通路、T细胞受体信号通路等被显著性富集,表明麻黄汤治疗哮喘的机制可能与上述信号通路有关。
气道高反应是哮喘的临床症状之一,持续的气道高反应会导致哮喘患者肺功能的下降,严重影响患者生活。本实验中,OVA致敏激发4周后,随着激发剂Mch浓度的升高,给药组大鼠Penh值显著降低,提示麻黄汤和地塞米松均能显著改善哮喘大鼠气道高反应,减轻哮喘症状。
ET-1作为哮喘中一种重要的致病因子,能促进气道上皮细胞的生长,引发气道平滑肌的强烈收缩,并刺激前列腺素、血栓素等炎症介质的释放,导致气道反应性增高,同时加重机体缺氧、缺血,严重者甚至会造成哮喘性呼吸衰竭[10]。在本实验中,各剂量麻黄汤均可下调哮喘大鼠血清中ET-1的含量,这与本实验中气道反应性结果趋势一致,提示麻黄汤可能通过抑制ET-1分泌以调节哮喘气道炎症,改善气道高反应。
哮喘气道重塑的病理特征主要包括气道平滑肌细胞的增殖迁移、气道上皮下胶原沉积以及血管生成重塑等。本实验中,OVA致敏激发后,大鼠气道杯状细胞大量增加,气道粘液分泌增多,气道上皮下胶原沉积明显,经麻黄汤干预后,上述情况均得到不同程度的改善,这表明麻黄汤可减少哮喘大鼠肺组织病变,改善哮喘气道重塑。
VEGF在哮喘发作时呈现高表达,可通过增加气道的血管通透性以及血管平滑肌的增生,导致气道黏膜增厚,加重气道重塑。TGF-β1是气道重塑过程中的一个关键因子,具有重要的促纤维化和免疫调节作用,可促进气道平滑肌细胞肥大增生,气道胶原的沉积以及结缔组织蛋白的合成,导致不可逆的肺功能改变和气道重塑的形成[11]。bFGF是广泛分布于人体内的成纤维细胞生长因子的一个亚型,在平滑肌细胞的增殖、成肌纤维细胞表型的逆转和气道上皮细胞的迁移增殖中起重要作用[12]。本实验结果显示,OVA致敏后,大鼠血清中VEGF、TGF-β1、bFGF的表达显著升高,而麻黄汤能显著抑制三者的表达;RT-PCR检测结果也证实,麻黄汤能显著抑制哮喘大鼠肺组织中VEGF mRNA的表达。这说明麻黄汤可能是通过抑制VEGF、TGF-β1、bFGF的过度分泌以减轻哮喘大鼠气道重塑症状。OPN是一类多功能细胞,在巨噬细胞、上皮细胞、嗜酸性粒细胞等多种哮喘关键细胞中均有相应受体表达。其可诱导VEGF的表达,促进新血管生成,同时增厚基底膜,加重哮喘气道重塑[13]。本实验证实不同剂量麻黄汤均可显著降低哮喘大鼠血清中OPN的表达水平,说明麻黄汤改善气道重塑可能与抑制OPN的表达相关。
p38MAPK信号途径是MAPK家族的重要组成部分,在哮喘发生、发展的过程中发挥重要作用,在肺部疾病的研究中也较为成熟[14]。NF-κB作为一种与炎症反应密切相关的关键转录激活因子,是p38MAPK的下游通路。p38MAPK磷酸化后的特异性底物可激活NF-κB通路,并进一步激活转录VEGF的表达,调节新血管的发生和生长,加剧气道重塑的进程。另有研究表明,TGF-β1可激活p38MAPK信号通路,调节一系列病理生理过程。而同时TGF-β1基因的转录又有赖于NF-κB的活化,进而使TGF-β1表达增加,加重气道重塑[15]。本实验PCR结果显示,OVA致敏激发可使大鼠肺组织中p38MAPK以及NF-κB p65的mRNA表达水平较正常大鼠显著升高,麻黄汤干预后,两者的mRNA表达水平得到显著抑制,同时NF-κB下游因子VEGF的mRNA表达水平也被显著下调,提示麻黄汤可能通过调节p38MAPK/NF-κB信号通路上的关键基因来改善哮喘气道重塑。
综上所述,本研究证实麻黄汤可以改善哮喘大鼠的气道重塑和气道高反应,其机制可能与下调VEGF、bFGF、TGF-β1、ET-1、OPN含量以及p38MAPK/NF-κB信号通路上的关键基因p38MAPK、NF-κB p65 mRNA表达有关。
| [1] |
邹璐, 孙祝美, 郭春荣, 等. 中医药防治支气管哮喘气道重塑相关信号通路研究进展[J]. 中华中医药杂志, 2018, 33(11): 5057-60. Zou L, Sun Z M, Guo C R, et al. Progress in airway remodeling related signal pathways in the teatment of asthma with traditional Chinese medicine[J]. Chin J Tradit Chin Med Pharm, 2018, 33(11): 5057-60. |
| [2] |
Hirota N, Martin J G. Mechanisms of airway remodeling[J]. Chest, 2013, 144(3): 1026-32. doi:10.1378/chest.12-3073 |
| [3] |
刘红, 黄茂. 气道重塑与难治性哮喘机制的相关研究进展[J]. 医学综述, 2010, 16(6): 866-8. Liu H, Huang M. Research progress on the relationship between airway remodeling and refractory asthma[J]. Med Recapit, 2010, 16(6): 866-8. doi:10.3969/j.issn.1006-2084.2010.06.022 |
| [4] |
Chakir J, Shannon J, Molet S, et al. Airway remodeling-associated mediators in moderate to severe asthma: Effect of steroids on TGF-β, IL-11, IL-17, and typeⅠand typeⅢcollagen expression[J]. J Allergy Clin Immunol, 2003, 111(6): 1293-8. doi:10.1067/mai.2003.1557 |
| [5] |
He Y, Lou X H, Jin Z, et al. Mahuang decoction mitigates airway inflammation and regulates IL-21/STAT3 signaling pathway in rat asthma model[J]. J Ethnopharmacol, 2018, 224: 373-80. doi:10.1016/j.jep.2018.06.011 |
| [6] |
沈霞, 任丹, 高静, 等. 基于网络药理学复方龙脉宁方治疗脑卒中的分子机制研究[J]. 药学学报, 2019, 54(9): 1588-96. Shen X, Ren D, Gao J, et al. The molecular mechanism of stroke treatment by Fufang Longmai Ningfang based on network pharmacology[J]. Acta Pharm Sin, 2019, 54(9): 1588-96. |
| [7] |
吕燕妮, 付龙生, 周健, 等. 参麦注射液主要成分与卒中关联的网络药理作用机制和实验验证[J]. 中国药理学通报, 2017, 33(2): 293-4. Lyu Y N, Fu L S, Zhou J, et al. Network pharmacological mechanism of main components of Shenmai injection related with stroke and experimental verification[J]. Chin Pharmacol Bull, 2017, 33(2): 293-4. |
| [8] |
王坤, 朱慧志, 朱舜之, 等. 基于Treg-SDF-1/CXCR4-STAT6通路观察阳和平喘颗粒对BMSCs移植后哮喘大鼠气道炎症的影响[J]. 中华中医药杂志, 2019, 34(5): 2169-74. Wang K, Zhu H Z, Zhu S Z, et al. Effects of Yanghe Pingchuan Granules on airway inflammation in asthmatic rats after BMSCs transplantation based on Treg-SDF-1/CXCR4-STAT6 pathway[J]. Chin J Tradit Chin Med Pharm, 2019, 34(5): 2169-74. |
| [9] |
刘利飞, 李雅纯, 国芳, 等. Notch通路在糖尿病肾病大鼠的表达及化瘀通络中药的干预作用[J]. 中草药, 2018, 49(8): 1866-70. Liu L F, Li Y C, Guo F, et al. Expression of Notch pathway in diabetic nephropathy rats and intervention effect of Chinese materia medica for dispersing blood stasis and dredging collateral[J]. Chin Tradit Herbal Drugs, 2018, 49(8): 1866-70. |
| [10] |
倪树芳, 程小玲, 张莉. 支气管哮喘患儿血浆内皮素测定及意义研究[J]. 山西医药杂志(下半月刊), 2013, 42(5): 528-9. Ni S F, Cheng X L, Zhang L. Measurement and significance of plasma endothelin in children with bronchial asthma[J]. Shanxi Med J, 2013, 42(5): 528-9. |
| [11] |
魏海龙, 李秀珍, 鲍春英, 等. 丹参注射液对哮喘大鼠气道重塑及肺泡灌洗液中TGF-β1的影响[J]. 西部医学, 2018, 30(8): 1116-21. Wei H L, Li X Z, Bao C Y, et al. Salvia miltiorrhiza injection attenuates airway remodeling and the expression of transforming growth factor beta 1 in bronchoalveolar lavage fluid of asthmatic rats[J]. Med J West Chin, 2018, 30(8): 1116-21. |
| [12] |
仓春霞, 栾斌. 碱性成纤维细胞生长因子与支气管哮喘[J]. 中华哮喘杂志(电子版), 2009, 3(5): 372-4. Cang C X, Luan B. Basic fibroblast growth factor and bronchial asthma[J]. Chin J Asthma(Electronic Version), 2009, 3(5): 372-4. |
| [13] |
王秋琼. 骨桥蛋白与支气管哮喘的关系研究进展[D]. 重庆: 重庆医科大学, 2014. Wang Q Q. Research progress of relation between osteopontin and asthma[D]. Chongqing: Chongqing Med Univ, 2014. |
| [14] |
Hai Y G, Ho C Y. Phellinus linteus extract exerts anti-asthmatic effects by suppressing NF-κB and p38 MAPK activity in an OVA-induced mouse model of asthma[J]. Immune Netw, 2014, 14(2): 107-15. |
| [15] |
Wang Q, Wang J, Wang J F, et al. HMGB1 induces lung fibroblast to myofibroblast differentiation through NF-κB mediated TGFβ1 release[J]. Mol Med Rep, 2017, 15(5): 3062-8. |

