

高尿酸血症已成为我国仅次于糖尿病的第二大代谢性疾病,严重威胁人们的健康,且其患病率在全世界范围内有逐年增长的趋势[1]。高尿酸血症除可引起痛风外,还与肾脏、内分泌、心脑血管等多系统疾病的发生发展密切相关[2]。尿酸持续性升高或长期嘌呤代谢紊乱对于多种神经退行性疾病的发生发展同样起到关键作用,是认知功能障碍的危险因素[3]。因此,阐明高尿酸血症认知功能障碍的分子机制,对于高尿酸血症认知功能障碍的防治具有重要意义。
高尿酸血症与认知功能障碍的关系近年受到国内外学者的高度重视。大量研究表明,尿酸可作为致炎、致氧化应激因子,对神经炎症的发生发展具有推动作用[4]。在中枢神经系统中,皮层和海马是帮助处理学习与记忆事件的大脑区域,其炎症一般出现在神经退行性疾病早期,并且对脑发育产生永久的功能性病变[5]。长期诱导皮层和海马炎症对神经兴奋性与认知功能具有深远影响。在血清尿酸(serum uric acid,SUA)水平升高时,皮层和海马神经元产生炎症,促使学习和记忆能力显著下降,最终发展为认知功能障碍。尽管研究表明高尿酸血症与认知功能障碍有关,但其具体机制目前仍不清楚,需要进一步深入研究。
代谢组学主要用于揭示机体生命活动的代谢本质,通常被用作医药学领域的研究,包括疾病诊断、生物标志物筛查,以及化学物质安全性评估[6]。目前,代谢组学已广泛应用于神经毒性和神经退行性疾病的相关研究领域[7],它能够揭示由高尿酸血症引发神经系统变化的内源性关键代谢物,为进一步了解高尿酸血症认知功能障碍与代谢通路的关系提供一个有利途径。
本文利用1H-NMR技术研究高尿酸血症认知功能障碍模型大鼠皮层和海马组织中的代谢特征,鉴定其差异代谢物和代谢通路。旨在为高尿酸血症认知功能障碍的防治提供潜在生物标志物,并为进一步机制研究奠定坚实的理论基础。
1 材料与方法 1.1 主要试剂及仪器主要试剂:尿酸、氧嗪酸钾购于南京康满林化工实业有限公司;SUA血生化试剂盒购于四川迈克生物科技股份有限公司;色谱级氯仿购于西班牙Scharlau公司;氘水(D2O)购于美国Cambridge Isotope Laboratories公司;3-三甲基硅基[2, 2, 3, 3-d4]氘代丙酸钠(TSP-d4) 购于美国Sigma-Aldrich公司。
仪器:荷兰Noldus Morris水迷宫视频跟踪分析EthosVision 7.0系统;日本Hitachi-7020全自动血生化分析仪;德国Heraeus sepatech高速低温离心机;德国Bruker 600 MHz AVANCE II NMR。
1.2 实验动物和分组本次实验动物选用14只SPF级Wistar雄鼠,体质量为(180-220) g,购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京) 2016-0006。饲养温度(22-24) ℃、湿度40%-60%,提供12 h/12 h白天和黑夜循环照明,自由饮食饮水。适应1周后随机分为2组:正常对照组和模型组,每组7只。模型组给予含2%尿酸和2%氧嗪酸钾的高尿酸复合饲料饲喂12周,制备高尿酸血症模型,正常对照组给予生长维持饲料。本实验所有动物操作均严格按照西南民族大学动物保护和使用规定。
1.3 实验方法 1.3.1 动物模型建立高尿酸血症组大鼠饲喂2%尿酸和2%氧嗪酸钾的高尿酸复合饲料,对照组大鼠饲喂生长维持饲料,连续饲喂12周后,利用10%水合氯醛腹腔注射麻醉大鼠后抽取腹主动脉血,经凝固(4 ℃, 60 min) 后离心(3 000 r·min-1,15 min,4 ℃) 得到血清。SUA水平测定严格按照血生化试剂盒说明书操作。
1.3.2 大鼠学习记忆功能测定高尿酸血症模型构建成功后,利用Morris水迷宫对大鼠学习记忆能力进行评估。训练阶段:将大鼠头朝池壁轻放入水中,记录大鼠找到隐藏水下平台的时间,每只大鼠每天训练4次,两次训练之间间隔30 min,需要连续训练5 d[8]。测试阶段:将检测大鼠由原先训练平台象限的反方向放入水中。记录在目标象限,也就是原先放置平台的象限所需时间,以此逃逸潜伏期作为学习记忆能力检测指标[8]。用视频跟踪分析系统记录大鼠的逃逸潜伏期。
1.3.3 皮层和海马组织样品采集麻醉取血后,解剖大鼠,冰上快速剥离皮层和海马组织,置于液氮中速冻后,转移至-80 ℃冻存备用。
1.3.4 样品预处理取皮层和海马组织样品常温解冻后,准确称重,冰水浴中用50%氯仿-水溶液匀浆(5 mL·g-1皮层、海马组织),离心(12 000 r·min-1,10 min,4 ℃)。将混悬液静置冰上30 min。取上清,40 ℃氮气吹干。加入580 μL含有磷酸缓冲液(0.2 mol·L-1 Na2HPO4-0.2 mol·L-1 NaH2PO4,pH 7.4) 和D2O (含有0.05% W/V TSP-d4)中,离心(12 000 r·min-1,10 min,4 ℃),取550 μL上清液转移到5 mm NMR管中,振荡混匀,待测[6]。
1.3.5 数据采集所有皮层和海马组织样品均在600.13 MHz的核磁共振氢谱下检测,实验温度27 ℃;宽度12 335.5 Hz;采集时间2.66 s,弛豫延迟时间7.66 s,扫采样点数64 K;采集次数128次。
1.3.6 图谱处理及多变量数据分析所有1H-NMR光谱用MestReNova-6.1-6384软件对相位和畸变基线进行校正。因脑组织中乳酸峰相对稳定,故用乳酸(δ 1.336) 为标准对谱图进行化学位移校正,将光谱分割为2325段,范围从δ 0.50-9.80,每个区域宽度相等(δ 0.004),水峰δ 4.60-5.10区域切除。在样品识别分析之前对集成数据进行归一化,以消除由组织重量不同而导致的样品之间的稀释差异或体积质量差异。
将归一化后生成的数据导入SIMCA-P 13.0中进行多元统计分析,首先采用PCA的无监督成分分析方法,随后采用PLS-DA和OPLS-DA的监督成分分析方法。为了防止过度拟合,通过置换分析(200次) 和交叉验证法,对OPLS-DA模型进行验证,同时用R2X、R2Y、Q2等指标进行质量评价。将OPLS-DA模型中所有峰值的变量和变量重要性投影(variable importance in the projection,VIP) 的值作为峰值选择的系数,并认为具有VIP>1的变量与群体分化有关[9]。此外,采用SPSS 20.0统计软件进行两独立样本t检验(P<0.05)进行分析,仅对具有统计学意义P<0.05的变量的数据进行鉴别,并根据P<0.05和VIP>1筛选出差异代谢物。
1.3.7 差异代谢物识别采用双参数法归属差异代谢物,参照前期相关的文献和代谢组学的数据库网站(http://www.hmdb.ca/),只有同时满足相应的化学位移和峰多态性的化合物,才被认为是真实发生变化的代谢物。再结合多变量数据和统计学分析结果,以VIP>1和P < 0.05为筛选条件,最终确定中的差异代谢物。
1.4 统计学方法所有实验结果均采用SPSS20.0软件进行统计学分析,两组之间的比较采用独立样本t检验,并用x±s表示。
2 结果 2.1 高尿酸血症大鼠模型的建立高尿酸复合饲料饲喂大鼠12周后,血生化测定结果显示高尿酸血症组SUA水平明显高于正常对照组高尿酸血症组:243.87±44.25 μmol·L-1,正常对照组:72.65±12.48 μmol·L-1,差异有统计学意义(P<0.05),表明高尿酸血症模型构建成功。
2.2 高尿酸血症大鼠产生认知功能障碍随着测定天数的增加,两组大鼠寻找水下隐藏平台的逃避潜伏期均缩短。与正常对照组相比,高尿酸血症组的大鼠的逃避潜伏期相对较长(Fig 1A),目标象限停留时间较短(Fig 1B),表明高尿酸血症诱导大鼠产生认知功能障碍。
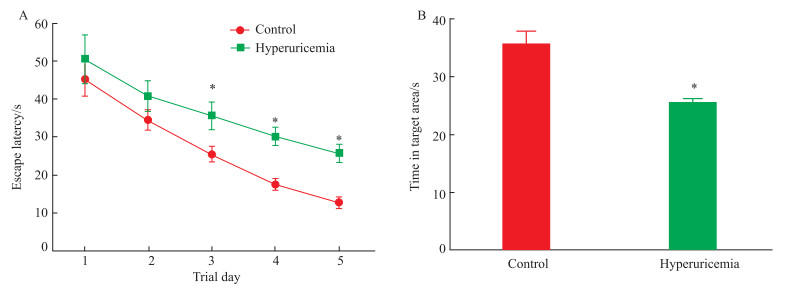
|
| Fig 1 Results of Morris water maze test (x±s, n= 7) A: Escape latency; B: The time spent in the target area in Morris water maze test. *P<0.05 vs control. |
高尿酸血症大鼠皮层和海马组织的核磁图谱见Fig 2。根据化学位移、峰形、偶合常数,并结合Metabolome数据库对图谱进行确认,在大鼠皮层中发现27个差异代谢物,海马中发现18个差异代谢物,包含大量参与多种生化过程的代谢物,如γ-氨基丁酸、谷氨酸、谷氨酰胺、葡萄糖、乳酸、甘露醇、牛磺酸和谷胱甘肽等。
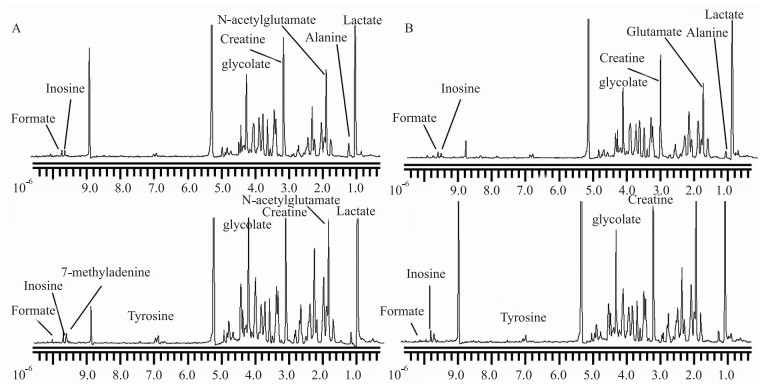
|
| Fig 2 Cerebral cortex and hippocampus 1H-NMR spectrum of control and hyperuricemia groups A: Hippocampus of control groups; B: Hippocampus of hyperuricemia groups; C: Cerebral cortex of control groups; D: Cerebral cortex of hyperuricemia groups. |
采用PCA散点图对所有样本进行分析,以显示数据的原始分类状态,可以在海马(R2=0.853, Q2=0.659) 和皮层(R2=0.874, Q2=0.706) 的PCA散点图中均观察到明显的分离(Fig 3A, 3D),表明模型组大鼠皮层和海马中发生明显的代谢紊乱。为优化两组分离,本研究采用7倍交叉验证法对OPLS-DA模型的可靠性进行验证Fig 3B (R2X=0.769, R2Y=0.925, Q2=0.767) 和Fig 3E (R2X=0.776, R2Y=0.992, Q2=0.928) 分别为海马和皮层的OPLS-DA散点图,同样观察到明显的分离,表明高尿酸血症大鼠神经生理及物质代谢发生明显改变。
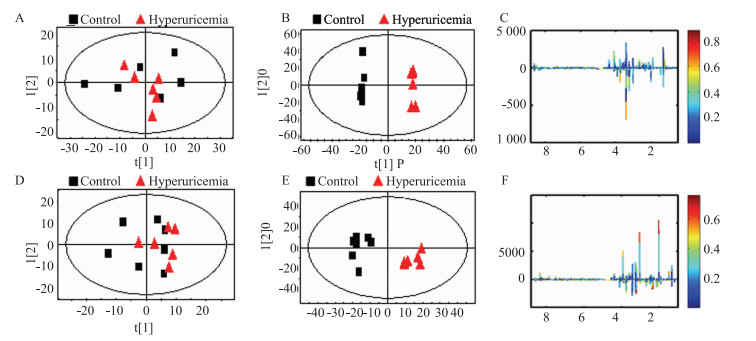
|
| Fig 3 Score plot and loading plot of control and hyperuricemia groups A: PCA scores plot; B: OPLS-DA scores plots; C: Color map of the hippocampus between control and hyperuricemia groups; D: PCA scores plot; E: OPLS-DA scores plots, F: Color map of the cerebral cortex between control and hyperuricemia groups. |
为进一步确定正常对照组和模型组的主要差异代谢物,从OPLS-DA分析中得到评分和相关系数载荷图,根据UV模型的可变权重对载荷进行着色,如图(Fig 3C, 3F)显示出两组差异代谢物,根据两组之间的化学位移(VIP>1和P < 0.05),鉴定出多种差异代谢物(Tab 1,Tab 2)。这些代谢产物均参与糖酵解、三羧酸循环(tricarboxylic acid cycle,TCA)、氨基酸代谢、氧化应激、神经递质转化以及细胞膜功能等关键代谢途径。
| Metabolite | Chemical shift(10-6) | VIPa | P-valueb | FCc |
| Formate | 8.45 | 2.08 | 0.036 | 1.35 |
| Malonate | 3.133 | 2.82 | 0.002 | 1.08 |
| Glutamate | 2.35 | 2.17 | 0.027 | -1.00 |
| Glutamine | 2.14 | 2.01 | 0.044 | 1.00 |
| 2.45 | 2.39 | 0.013 | 1.04 | |
| Mannitol | 3.81 | 2.94 | 0.001 | 1.17 |
| 3.88 | 2.20 | 0.025 | 1.06 | |
| Glucose | 3.84 | 2.94 | 0.001 | 1.17 |
| α-hydroxy-N-valerate | 4.03 | 2.03 | 0.041 | 1.07 |
| 7-Methyladenine | 8.2 | 2.23 | 0.022 | 1.09 |
| Alanine | 1.48 | 2.18 | 0.026 | 1.24 |
| N-acetylasparate | 2.02 | 2.10 | 0.034 | 1.17 |
| 4.39 | 2.71 | 0.003 | 1.13 | |
| Phosphocreatine | 3.04 | 1.97 | 0.049 | 1.12 |
| 3.93 | 2.35 | 0.015 | 1.11 | |
| Creatine | 3.04 | 1.97 | 0.049 | 1.12 |
| 3.94 | 2.35 | 0.015 | 1.11 | |
| Creatinine | 3.04 | 2.35 | 0.015 | 1.11 |
| Glycolate | 3.93 | 1.97 | 0.049 | 1.12 |
| o-HPA | 7.33 | 2.02 | 0.042 | 1.10 |
| p-HPA | 7.51 | 2.12 | 0.032 | 2.65 |
| Phenylacetylglycine | 7.33 | 2.02 | 0.042 | 1.10 |
| Phenylalanine | 7.33 | 2.02 | 0.042 | 1.10 |
| Glycogen | 3.97 | 2.03 | 0.041 | 1.07 |
| Serine | 3.98 | 2.03 | 0.041 | 1.07 |
| N-Acetylglutamate | 2.07 | 2.09 | 0.035 | 1.01 |
| Glutathione | 2.56 | 2.18 | 0.026 | -1.02 |
| Glycerophosphocholine | 3.23 | 2.04 | 0.040 | 1.01 |
| GABA | 1.91 | 2.11 | 0.032 | 1.01 |
| 2-Aminoadipic acid | 1.89 | 2.11 | 0.032 | 1.01 |
| Tyrosine | 6.9 | 2.72 | 0.003 | -1.35 |
| Lactate | 1.33 | 2.32 | 0.016 | 1.05 |
| aVIP>1 was obtained from OPLS-DA analysis; bP-value determined from Student’s t-test; cFold change between hyperuricemia and control rats. Positive sign indicates a higher level in hyperuricemia rats and a negative value indicates a lower level. | ||||
| Metabolite | Chemical shift (10-6) | VIPa | P-valueb | FCc |
| Formate | 8.45 | 2.08 | 0.009 | 1.78 |
| Valine | 1.05 | 2.38 | 0.022 | 1.68 |
| Aspartate | 2.82 | 2.26 | 0.007 | 1.30 |
| 2-Hydroxyisobutyric acid | 1.44 | 1.88 | 0.042 | 1.24 |
| Guanidinosuccinic acid | 2.83 | 2.26 | 0.007 | 1.30 |
| Malonate | 3.133 | 2.42 | 0.030 | 1.18 |
| Malate | 2.64 | 2.00 | 0.018 | 1.17 |
| Glycine | 3.57 | 2.00 | 0.009 | 1.14 |
| Glutamate | 2.35 | 1.42 | 0.041 | 1.08 |
| Mannitol | 3.88 | 2.42 | 0.019 | 1.05 |
| Triacylglycerol | 3.87 | 2.42 | 0.019 | 1.05 |
| Glucose | 3.41 | 2.12 | 0.047 | 1.02 |
| Taurine | 3.43 | 2.12 | 0.047 | 1.02 |
| Scyllo-inositol | 3.43 | 2.12 | 0.047 | 1.02 |
| α-hydroxy-N-valerate | 4.03 | 2.40 | 0.031 | 1.05 |
| 1-Methyladenine | 8.3 | 1.45 | 0.050 | 1.03 |
| 3-Methyladenine | 8.3 | 1.45 | 0.050 | 1.03 |
| Succinate | 2.41 | 1.94 | 0.050 | 1.26 |
| aVIP>1 was obtained from OPLS-DA analysis; bP-value determined from Student’s t-test; cFold change between hyperuricemia and control rats. Positive sign indicates a higher level in hyperuricemia rats and a negative value indicates a lower level. | ||||
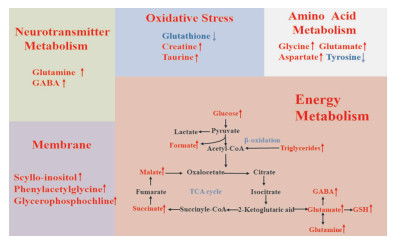
综合分析以上结果显示,在高尿酸血症大鼠皮层和海马中分别发现27和18个潜在差异代谢物,在皮层中,葡萄糖、甘露醇、丙二酸酯、N-乙酰天门冬氨酸、谷氨酰胺、磷酸肌酸、肌酸、肌酸酐、乳酸、7-甲基腺嘌呤和γ-氨基丁酸等代谢物显著增加;而酪氨酸、谷胱甘肽和谷氨酸则明显减少。在海马中,乙醇、甘露醇、三酰基甘油、丙二酸酯、α-羟基-N-戊酸酯、缬氨酸、天冬氨酸、琥珀酸、葡萄糖、牛磺酸、鲨肌醇、甲酸、甘氨酸、苹果酸、2-羟基异丁酸、1-甲基腺嘌呤、3-甲基腺嘌呤和谷氨酸显著增加。综合两组数据发现,葡萄糖、甘露醇、甲酸和谷氨酸在皮层和海马中都发生显著变化。这些差异代谢物可能是高尿酸血症认知功能障碍的潜在生物标志物(Fig 4)。根据筛选出的差异代谢物发现,高尿酸饮食诱发认知功能障碍机制可能与能量代谢的糖酵解和三羧酸循环、氨基酸代谢、氧化应激、神经递质转化以及细胞膜功能的紊乱等有关(Fig 5)。
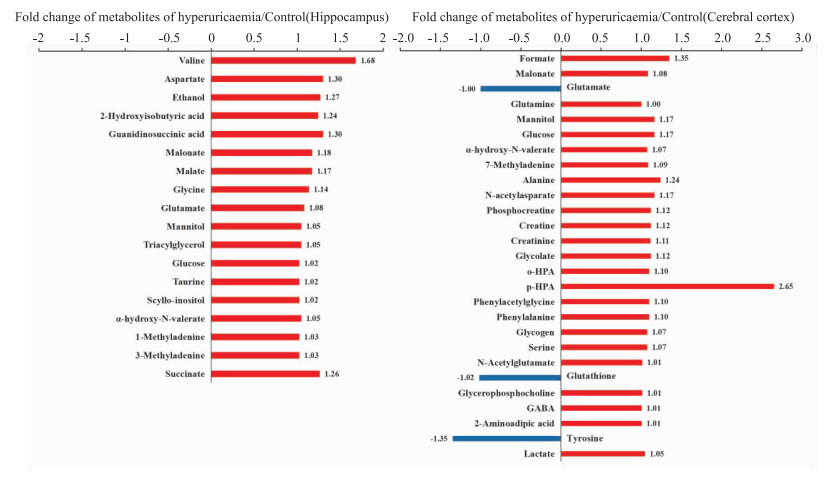
|
| Fig 4 Difference in cerebral cortex and hippocampus metabolites in control and hyperuricemia groups |
|
| Fig 5 Metabolic network of differential metabolites in rat cerebral cortex and hippocampus |
基于1H-NMR的代谢组学技术对高尿酸血症认知功能障碍大鼠的皮层和海马进行检测,分析其差异代谢物和代谢通路动态变化情况。经多元统计分析,模型组和对照组得到良好分离。可见,代谢组学研究可以从高尿酸血症认知功能障碍复杂的内源性代谢物中发现其变化规律,也能够促进此方法的临床应用。
本研究中,高尿酸饮食可干扰皮层和海马组织中糖酵解和TCA途径,导致能量代谢的紊乱。ATP是脑组织主要的能量来源,在神经细胞的细胞膜完整性、突触传递和递质释放与摄取等生理过程中发挥着重要作用[10]。高尿酸血症大鼠的皮层和海马中TCA的多个中间代谢物,包括葡萄糖、苹果酸、琥珀酸等显著增加。苹果酸和琥珀酸的增加,可能是由于线粒体内TCA途径中底物堆积,导致代谢异常和能量供应受限。当脑组织对能量的需求瞬时超过葡萄糖氧化代谢的速率时,同时也需要糖酵解产生乳酸来供应能量[11]。高尿酸血症大鼠的皮层中乳酸显著增加,可能是乳酸脱氢酶活化所致,表明氧化应激增加。N-乙酰天门冬氨酸是神经元存在的标志,在脑组织损伤时下降,与神经元的多种生理功能有关,如神经元线粒体的代谢,髓鞘发生和渗透调节功能[12]。此外,因其是由天冬氨酸和乙酰辅酶A在神经元线粒体中合成的氨基酸,故也可作为线粒体功能异常的标志物。本研究中,高尿酸可诱发脑组织能量代谢失调,进而导致神经元活性和神经可塑性降低,最终引发认知功能障碍。
谷氨酸作为主要的中枢兴奋性氨基酸递质,介导一系列高级神经活动,因此,谷氨酸水平升高对学习记忆功能具有促进作用[13]。谷氨酰胺作为谷氨酸代谢的前体物质,可以透过血脑屏障直接作用于脑组织,故比谷氨酸更具有调节神经功能的作用,对认知功能有重要意义[13]。γ-氨基丁酸作为关键的中枢神经抑制性递质,是由谷氨酸脱羧酶由γ-氨基丁酸能神经元中的谷氨酸转化生成[14],谷氨酸水平降低可直接导致γ-氨基丁酸的产生降低。高尿酸血症大鼠的皮层中谷氨酸显著降低,而γ-氨基丁酸显著升高,表明神经递质的平衡被打破,影响中枢神经系统正常的兴奋与抑制过程,是导致学习记忆损伤的可能机制。因此,神经递质失衡可能成为防治认知功能障碍发生和发展的潜在靶点。
谷胱甘肽、牛磺酸和肌酸均是机体重要抗氧化剂,可保护线粒体免受内源性氧自由基损伤。其中谷胱甘肽是脑组织中最丰富的细胞内抗氧化剂,可调节谷氨酸受体的活性[14];牛磺酸是一种游离氨基酸,能抵消组织中的氧化活性,具有保护神经、钙调节和抑制细胞凋亡的作用[15];肌酸可直接发挥抗氧化作用,并维持线粒体正常功能[16]。本研究中,高尿酸血症大鼠海马中牛磺酸显著增加,而皮层中肌酸也显著增加,表明脑组织对高尿酸诱导的氧化应激产生保护作用。相反,谷胱甘肽在皮层中显著减少,表明高尿酸可诱导抗氧化剂的损耗和神经保护能力损伤。综上结果表明,高尿酸可通过调节牛磺酸、肌酸和谷胱甘肽水平来影响脑组织的抗氧化和能量储存能力。中枢神经系统会采取适应性措施,并通过摄入谷胱甘肽来防止氧化应激损伤,因此,谷胱甘肽可能是防治高尿酸血症认知功能障碍很有前途的靶点,而未来研究可集中在谷胱甘肽的代谢调控机制上。
本研究中,高尿酸血症大鼠海马中鲨肌醇显著增加,皮层中甘油磷酸胆碱和苯乙酰甘氨酸含量升高。甘油、磷脂酰胆碱和肌醇是细胞膜磷脂合成的前体,而磷脂是细胞膜必不可少的成分,对脂质代谢起着至关重要的作用,可作为膜磷脂代谢的生物标志物。甘油已用于研究脑缺血和癫痫发作后脑组织中膜磷脂的降解[17]。此外,肌醇是重要的细胞内渗透液,其变化表明组织渗透压发生改变,而鲨肌醇属于肌醇的一种。这些差异代谢物的升高表明细胞膜降解能力增强,提示高尿酸可诱导脑组织细胞膜运输或屏障功能障碍。
高尿酸还可干扰缬氨酸、甘氨酸、天冬氨酸、苯丙氨酸、谷氨酸以及酪氨酸的代谢。在本研究中,高尿酸血症大鼠海马中缬氨酸、甘氨酸、天冬氨酸和谷氨酸显著增加,以及皮层中丙氨酸,苯丙氨酸显著增加,而酪氨酸显著减少。缬氨酸是支链氨基酸,也是人体的必需氨基酸之一,体内不能合成,需要外部摄入,可参与脑能量供应[18]。氨基酸代谢紊乱,可影响脑能量供应,进一步影响学习和记忆。甘氨酸、天冬氨酸、谷氨酸和丙氨酸作为非必须氨基酸,在调节基因表达、抗氧化反应、神经传导和免疫方面起着重要作用,大多数非必需氨基酸及其衍生物还可以作为神经递质,参与细胞间的突触传递与神经功能调节[18]。酪氨酸、苯丙氨酸均为含硫氨基酸或其产物,当含硫氨基酸代谢受阻时可导致体内蓄积从而对神经系统产生毒性作用,加重认知功能损害[18]。由此可见,高尿酸可能通过干扰皮层和海马氨基酸代谢,导致神经系统能量代谢紊乱、神经递质合成障碍以及干扰神经系统正常兴奋与抑制过程而影响中枢神经系统功能。
综上所述,运用代谢组学的方法研究高尿酸血症认知功能障碍是行之有效的方法。本研究成功地构建了基于高尿酸血症组和正常对照组的OPLS-DA疾病区分模型,通过代谢物初筛,最终在皮层和海马种鉴定出27和18种特征代谢物,这些物质对于高尿酸血症认知功能障碍具有一定的诊断和治疗的效能。在后续的实验过程中,我们将利用各种生物技术进一步探究高尿酸血症诱发认知功能障碍的确切机制。
| [1] |
So A, Thorens B. Uric acid transport and disease[J]. J Clin Invest, 2010, 120(6): 1791-9. doi:10.1172/JCI42344 |
| [2] |
Kang D H, Nakagawa T, Feng L, et al. A role for uric acid in the progression of renal disease[J]. J Am Soc Nephrol, 2002, 13(12): 2888-97. doi:10.1097/01.ASN.0000034910.58454.FD |
| [3] |
Kueider A M, An Y, Tanaka T, et al. Sex-dependent associations of serum uric acid with brain function during aging[J]. J Alzheimers Dis, 2017, 60(2): 699-706. doi:10.3233/JAD-170287 |
| [4] |
Martinon F, Pétrilli V, Mayor A, et al. Gout-associated uric acid crystals activate the NALP3 inflammasome[J]. Nature, 2006, 440(7081): 237-41. doi:10.1038/nature04516 |
| [5] |
Hitti F L, Siegelbaum S A. The hippocampal CA2 region is essential for social memory[J]. Nature, 2014, 508(7494): 88-92. doi:10.1038/nature13028 |
| [6] |
Beckonert O, Keun H C, Ebbels T M, et al. Metabolic profiling, metabolomic and metabonomic procedures for NMR spectroscopy of urine, plasma, serum and tissue extracts[J]. Nat Protoc, 2007, 2(11): 2692-703. doi:10.1038/nprot.2007.376 |
| [7] |
Du C, Shao X, Zhu R, et al. NMR-based metabolic profiling reveals neurochemical alterations in the brain of rats treated with sorafenib[J]. Neurotox Res, 2015, 28(4): 290-301. doi:10.1007/s12640-015-9539-7 |
| [8] |
Chen C Z, Tang Y, Cheng S Q, et al. New candidate proteins for Benzo(a) pyrene-induced spatial learning and memoru deficits[J]. J Toxicol Sci, 2011, 36(2): 163-71. doi:10.2131/jts.36.163 |
| [9] |
罗良, 陈嘉辉, 王园园, 等. 脾气虚证模型大鼠尿液的~1H-NMR代谢组学研究[J]. 中国药理学通报, 2017, 33(10): 1363-70. Luo L, Chen J, Wang Y, et al. 1H-NMR-based metabonomics study on urine of rat with Spleen-Qi deficiency pattern[J]. Chin Pharmacol Bull, 2017, 33(10): 1363-70. doi:10.3969/j.issn.1001-1978.2017.10.008 |
| [10] |
Paglia G, Stocchero M, Cacciatore S, et al. Unbiased metabolomic investigation of Alzheimer's disease brain points to dysregulation of mitochondrial aspartate metabolism[J]. J Proteome Res, 2016, 15(2): 608-18. doi:10.1021/acs.jproteome.5b01020 |
| [11] |
Pellerin L. Lactate as a pivotal element in neuron-glia metabolic cooperation[J]. Neurochem Int, 2003, 43(4-5): 331-8. doi:10.1016/S0197-0186(03)00020-2 |
| [12] |
Demougeot C, Marie C, Giroud M, et al. N-acetylaspartate: A literature review of animal research on brain ischaemia[J]. J Neurochem, 2004, 90(4): 776-83. doi:10.1111/j.1471-4159.2004.02583.x |
| [13] |
Bu Q, Lv L, Yan G, et al. NMR-based metabonomic in hippocampus, nucleus accumbens and prefrontal cortex of methamphetamine-sensitized rats[J]. Neurotoxicology, 2013, 36: 17-23. doi:10.1016/j.neuro.2013.02.007 |
| [14] |
Zhou J, Li Y, Yan G, et al. Protective role of taurine against morphine-induced neurotoxicity in C6 cells via inhibition of oxidative stress[J]. Neurotox Res, 2011, 20(4): 334-42. doi:10.1007/s12640-011-9247-x |
| [15] |
Wu H, Jin Y, Wei J, et al. Mode of action of taurine as a neuroprotector[J]. Brain Res, 2005, 1038(2): 123-31. doi:10.1016/j.brainres.2005.01.058 |
| [16] |
Guidi C, Potenza L, Sestili P, et al. Differential effect of creatine on oxidatively-injured mitochondrial and nuclear DNA[J]. Biochim Biophys Acta, 2008, 1780(1): 16-26. doi:10.1016/j.bbagen.2007.09.018 |
| [17] |
Senaratne R, Milne A M, MacQueen G M, et al. Increased choline-containing compounds in the orbitofrontal cortex and hippocampus in euthymic patients with bipolar disorder: A proton magnetic resonance spectroscopy study[J]. Psychiatry Res, 2009, 172(3): 205-9. doi:10.1016/j.pscychresns.2008.07.007 |
| [18] |
Seyedabadi M, Fakhfouri G, Ramezani V, et al. The role of serotonin in memory: Interactions with neurotransmitters and downstream signaling[J]. Exp Brain Res, 2014, 232(3): 723-38. doi:10.1007/s00221-013-3818-4 |

