


2. 南华大学衡阳医学院2017级临床21班,湖南 衡阳 421001;
3. 南华大学衡阳医学院公共卫生学院,社会医学与卫生事业管理学教研室,湖南 衡阳 421001
 ,
LUO Jin-ding1,
LYU Hui-jie1,
TIAN Ying-ru2,
HE Jian-qin1,
FENG Shui-dong3,
LING Hong-yan1
,
LUO Jin-ding1,
LYU Hui-jie1,
TIAN Ying-ru2,
HE Jian-qin1,
FENG Shui-dong3,
LING Hong-yan1

2. Clinical Class 21, Grade 2017, Hengyang Medical College University of South China, Hengyang Hunan 421001, China;
3. Dept of Social Medicine and Health Management, Public Health College, University of South China, Hengyang Hunan 421001, China
随着生活水平的提升,肥胖呈逐年上升趋势,肥胖不仅影响人体的美感,而且给人们的健康造成极大的危害。因此,肥胖已成为世界性亟待解决的问题[1]。
二氢杨梅素(dihydromyricetin,DHM)多提取自葡萄科蛇葡萄属的一种木质藤本植物,主要有效成分为黄酮类物质,常用于治疗与炎症和氧化应激损伤相关的疾病[2]。研究发现[3],DHM可降低血清总胆固醇(serum total cholesterol,TC)和甘油三酯(triglyceride,TG)水平,增加高密度脂蛋白(high-density lipoprotein,HDL-C)水平;研究还发现,DHM可通过调控去乙酰化酶1(sirtuin1,SIRT1)信号通路降低肝癌细胞内甘油三酯的蓄积,进一步改善肝细胞脂肪变性[4]。另有研究显示:SIRT1可通过LKB1(liver kinase B1)依赖方式介导腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)的作用[5]:AMPK可通过激活棕榈酰基转移酶1(carnitine palmityl transferase 1,CPT1)与过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α,PPARα),抑制乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)、固醇调节元件结合蛋白(sterol regulatory element binding proteins,SREBP-1)与脂肪酸合成酶(fatty acid synthetase,FAS)来调控脂质代谢[6-7]。综合文献分析,我们推测DHM可能通过激活SIRT1-AMPK通路抑制高脂饮食诱导的肥胖小鼠肝脏脂质蓄积。
1 材料与方法 1.1 实验动物3~4周C57BL/6J雄鼠(60只),体质量(17±1.5) g(湖南斯莱克景达实验动物有限公司提供),合格证号为:SCXK(湘)2020-0002。饲养于南华大学动物房(3~5只每笼),动物房内12 h明暗交替;将环境温度设置为(23~24) ℃,并保证小鼠充足的饲料与饮用水,实验过程以美国国立卫生研究院的《国家实验动物健康与管理条例》为标准。
1.2 材料 1.2.1 实验药品、试剂Trizol试剂(G3013)及逆转录试剂盒(WG441-K1622)来自Servicebio公司;兔抗小鼠SREBP-1抗体(AF8055)、FAS抗体(AF6861)、ACC抗体(AF1867)、CPT1抗体(AF6558)、PPARα抗体(AF7794)、SIRT1抗体(AF5300)、AMPK抗体(AF1627)和β-actin抗体(AA128)购于Beyotime公司。
1.2.2 实验仪器中国上海博迅实业公司的普通光学显微镜(BM-139C);美国Bio-Rad公司的荧光定量PCR仪(CFX384 Touch);美国Bio-Rad公司的基础电泳仪(1656001)与电泳槽/转印槽(1703930)。
1.3 二氢杨梅素溶液的配制DHM购于张家界志诚生物科技有限公司。将双蒸水置于70 ℃的恒温水浴箱中加热,20 min后,将一定量的DHM溶解在已经加热好的双蒸水中,并用玻璃棒搅拌均匀,配置为50 g·L-1浓度的DHM溶液。
1.4 肥胖模型的建立和分组实验鼠分笼适应性喂养1周后进行随机分组,采用正常饲料和高脂饲料喂养,同时分别采取或不采取低、高剂量的DHM(125 mg·kg-1·d-1和250 mg·kg-1·d-1)灌胃处理16周。因此,实验共分成6组(n=10):正常对照组(ND组)、正常对照+低剂量二氢杨梅素组(ND+L-DHM组)、正常对照+高剂量二4氢杨梅素组(ND+H-DHM组)、高脂饮食组(HFD组)、高脂饮食+低剂量二氢杨梅素组(HFD+L-DHM组)、高脂饮食+高剂量二氢杨梅素组(HFD+H-DHM组)。在此期间,每4周记录1次小鼠体重。实验结束时(16周末),所有小鼠禁食处理后称重,肥胖模型成功建立的标准为HFD小鼠体质量超过ND小鼠体重的百分之二十或更多。
1.5 体脂和血脂的测量16周末,将小鼠禁食过夜,然后进行称重与眼眶静脉取血,离心取上清液,采用生化分析仪测小鼠血脂(总胆固醇、甘油三酯与高密度脂蛋白)。由于肩胛下、附睾与腹股沟的脂肪体积大且易分离,占小鼠脂肪的大部分,可反应小鼠体脂的变化。因此将小鼠脱颈椎处死后,取肩胛下、附睾与腹股沟的脂肪并用电子秤进行称重,并记录脂肪重量。
1.6 肝脏苏木精-伊红染色取肝脏组织,切取一块厚约5~7 mm,类似等边三角形的肝脏组织,4 ℃磷酸缓冲液冲洗组织后,10%的甲醛溶液固定24 h,用自动包埋机和轮转式石蜡切片机来包埋与切片,切片的厚度约为4 μm。最后通过自动染色机用苏木精与伊红对标本进行染色后封片。于显微镜下观察小鼠肝脏组织石蜡切片染色结果并拍片。
1.7 肝脏油红O染色将1.6步骤中切片的肝脏组织,用4%甲醛固定0.5 h后, 用0.3%油红O染液染色半小时,然后经苏木精复染0.5 min后,甘油封片,显微镜下观察并拍摄。
1.8 实时定量PCR检测肝脏组织SIRT1、AMPK、参与脂质生物合成的(SREBP1、FAS、ACC1)和参与脂质分解的(PPARα、CPT1)的mRNA表达用TRIzol提取肝组织的总RNA。测定其纯度及浓度,随后将RNA进行反转录并扩增。引物如Tab 1所示。Real-time PCR采用20 μL反应体系,3个步骤:(i)双链DNA在95℃下分离,(ii)引物在58℃退火半分钟, (iii)最后72 ℃延伸半分钟, 进行35个循环。用2-ΔΔCt计算每个基因的相对表达量。
| Gene | Sequence (5′→3′) | Length/bp |
| GAPDH | Forward Primer:AGGAGCGAGACCCCACTAACA | |
| Reverse Primer:AGGGGGGCTAAGCAGTTGGT | 247 | |
| Sirt1 | Forward Primer:CAGCATCTTGCCTGATTTGTAA | |
| Reverse Primer:TGGGGTATAGAACTTGGAATTAGTG | 268 | |
| AMPK | Forward Primer:GATGATGACCATGTGCCAACTC | |
| Reverse Primer:TTATTGCGGCCCTCTTCATG | 136 | |
| SREBP1 | Forward Primer:AAACTGCCCATCCACCGACT | |
| Reverse Primer:CCACCACCAGGTCTTTGAGC | 151 | |
| FAS | Forward Primer:GCGGGTTCGTGAAACTGATAA | |
| Reverse Primer:CAGGTTGGCATGGTTGACAG | 80 | |
| ACC1 | Forward Primer:TGTCCGCACTGACTGTAACCAC | |
| Reverse Primer:TAGCCAGACTCGTTTGTCAGGA | 219 | |
| PPARα | Forward Primer:GAGGCAGATGACCTGGAAAGT | |
| Reverse Primer:TGCGTGAACTCCGTAGTGGTA | 312 | |
| CPT1α | Forward Primer:AGAGGATGGACACTGTAAAGGAGA | |
| Reverse Primer:CCGAAAGAGTCAAATGGGAAGG | 103 |
研磨肝脏组织、提取蛋白质,测定浓度。取30μg蛋白进行SDS- PAGE电泳、转膜、封闭后加入抗SIRT1、FAS、AMPK、ACC1、PPARα、SREBP1、CPT1抗体,抗体稀释倍数为1 :1 000,4 ℃摇床过夜之后洗涤。然后放入二抗,室温反应2~4 h,充分洗涤后加入ECL化学发光试剂进行反应。曝光后进行扫描分析。
1.10 统计学处理采用SPSS 20.0软件,组间差异使用单因素方差分析,两两比较使用Q检验,所有数据都以x±s形式。
2 结果 2.1 DHM对高脂饮食诱导的肥胖小鼠体质量、体脂、血脂与肝脏脂肪蓄积的影响 2.1.1 DHM可抑制高脂饮食喂养的肥胖小鼠体质量增加如Fig 1所示:与ND组相比,小鼠经喂食高脂饲料16周后,体质量增加,提示肥胖小鼠模型复制成功。DHM处理的HFD小鼠从第8周体质量开始降低。提示DHM处理可使肥胖小鼠体质量减少,但对正常小鼠的体质量无明显改变。
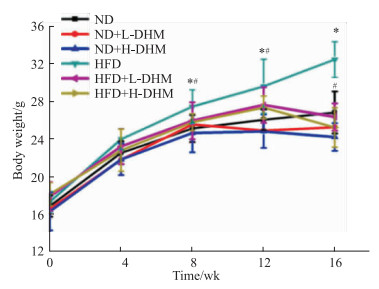
|
| Fig 1 Body mass of c57bl/6j mice fed with high fat diet reduced by dihydromyricetin (x±s, n=10) *P < 0.05 vs ND group; #P < 0.05 vs HFD group. |
如Fig 2所示:相比ND组,HFD组体脂重量升高;高剂量或低剂量DHM能使HFD小鼠体脂重量下降;但与ND组相比,经DHM处理的ND小鼠体脂重量却无明显变化。提示DHM能够抑制HFD小鼠体脂重量升高,但对ND小鼠体脂重量无影响。
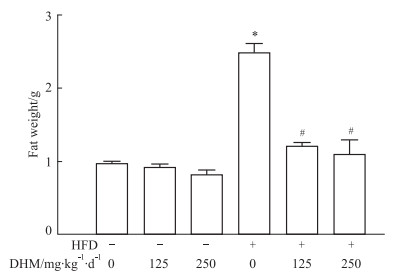
|
| Fig 2 Body fat weight in obese mice induced by a high fat diet reduced by dihydromyricetin (x±s, n=10) *P < 0.05 vs ND group; #P < 0.05 vs HFD group. |
如Tab 2所示:HFD组小鼠的血清TG、TC与HDL含量明显比ND组高;经高、低剂量处理的DHM小鼠血脂低于HFD组;但经高剂量或低剂量DHM处理的ND小鼠与ND组之间的血脂水平无明显差异。提示DHM可降低HFD小鼠的TC、TG和HDL,但对正常小鼠无明显影响。
| Group | DHM/mg·kg-1·d-1 | TC/mmol·L-1 | TG/mmol·L-1 | HDL/mmol·L-1 |
| ND+NS | - | 2.37±0.06 | 0.75±0.23 | 1.42±0.11 |
| ND+L-DHM | 125 | 2.06±0.03 | 0.72±0.41 | 1.31±0.22 |
| ND+H-DHM | 250 | 1.97±0.15 | 0.70±0.22 | 1.40±0.03 |
| HFD+NS | - | 4.28±0.18* | 1.42±0.58* | 1.95±0.08* |
| HFD+L-DHM | 125 | 2.58±0.43# | 1.15±0.21# | 1.39±0.19# |
| HFD+H-DHM | 250 | 2.53±0.26# | 0.9±0.33# | 1.40±0.22# |
| *P < 0.05 vs ND group;#P < 0.05 vs HFD group. | ||||
HE与油红O染色结果表明(Fig 3):ND小鼠肝小叶结构无异常,肝脏细胞分布有序、大小均一、胞质丰富,放射状分布在中央静脉周围,无变性、坏死;而HFD小鼠肝脏细胞排列紊乱,肝细胞肿大,呈气泡状,出现弥漫性脂肪变性,细胞质中富含大小不一的圆状脂质滴,细胞核受脂质滴影响发生变性、偏移;HFD小鼠经DHM处理后肝细胞脂滴状况明显改善,细胞结构恢复正常,肝脏细胞脂肪变性的面积及密度降低。但L-DHM与H-DHM对ND小鼠肝细胞形态无明显影响。提示:DHM可降低HFD小鼠肝脏脂质蓄积。
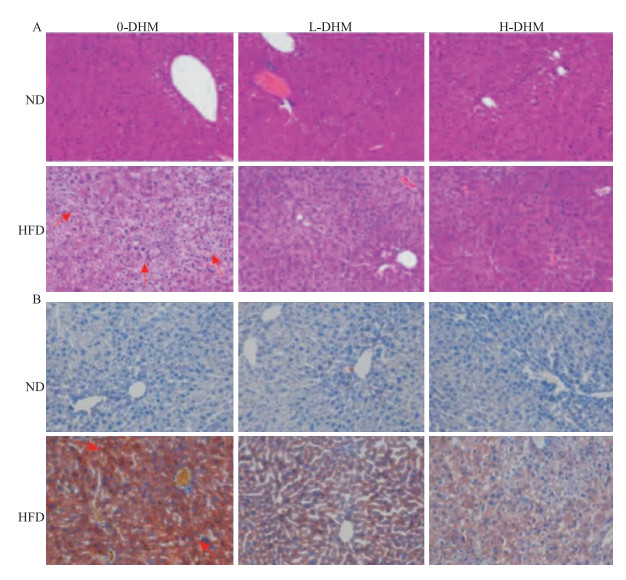
|
| Fig 3 Lipid deposition in liver of obese mice induced by high fat diet reduced by dihydromyricetin A: HE staining (×20);B:oil red O staining(×20).ND:normal control group; HFD:high-fat diet group. *P < 0.05 vs ND group; #P < 0.05 vs HFD group. |
定量PCR(Fig 4A)和Western blot(Fig 4B)结果显示,小鼠肝组织中mRNA和蛋白的表达量:相比ND组,HFD组小鼠SIRT1和AMPK量降低;而相比HFD组,HFD+L-DHM和HFD+H-DHM组小鼠SIRT1和AMPK量升高;但L-DHM与H-DHM对ND小鼠SIRT1和AMPK mRNA和蛋白表达无影响;提示DHM能够增加HFD小鼠SIRT1和AMPK的基因及蛋白表达。
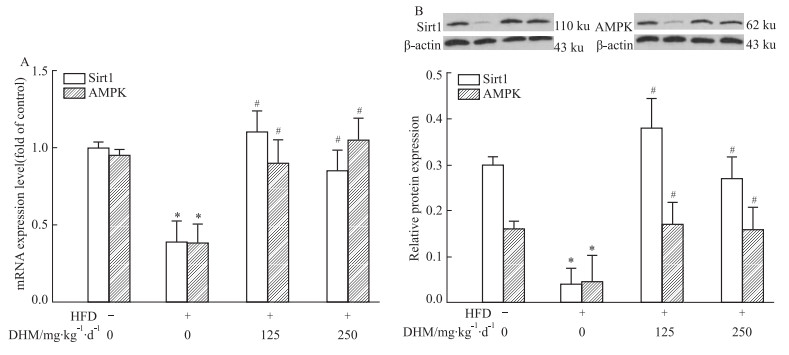
|
| Fig 4 Effects of dihydromyricetin on mRNA and protein expression of SIRT1 and AMPK in livers of obese mice induced by high fat diet (x±s, n=4-5) A:Sirt1 and AMPK mRNA expression level; B:Sirt1 and AMPK protein expression level. *P < 0.05 vs ND group; #P < 0.05 vs HFD group. |
qRT-PCR(Fig 5A)和Western blot(Fig 5B)结果显示小鼠肝组织中mRNA和蛋白的表达量:相比ND组,HFD组SREBP1、ACC1与FAS表达明显升高,而相比HFD组,HFD+L-DHM和HFD+H-DHM组SREBP1、ACC1和FAS表达降低;但ND组、ND+L-DHM和ND+H-DHM 3组间SREBP1、ACC1和FAS mRNA和蛋白表达无明显差异。提示DHM可能通过降低HFD小鼠肝脏中参与脂质生物合成的SREBP1、ACC1和FAS的表达改善其肝脏脂肪沉积。
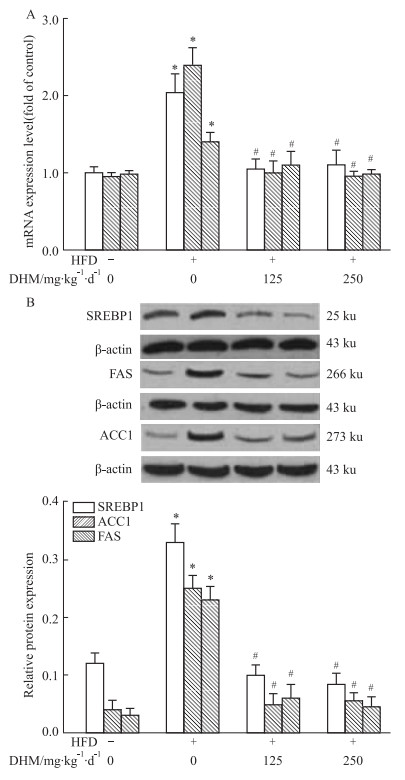
|
| Fig 5 Effects of dihydromyricetin on mRNA and protein expression of SREBP1, ACC1 and FAS in livers of obese mice fed with high fat diet (x±s, n=4-5) A: SREBP1, ACC1 and FAS mRNA expression level; B: REBP1, ACC1 and FAS protein expression level. *P < 0.05 vs ND group; #P < 0.05 vs HFD group. |
qRT-PCR(Fig 6A)和Western blot(Fig 6B)结果显示:相比ND组,HFD组参与肝脏脂质分解的PPARα和CPT1 mRNA和蛋白表达降低,而相比HFD组,HFD+L-DHM和HFD+H-DHM小鼠的肝脏中PPARα和CPT1 mRNA和蛋白表达升高。但ND组、ND+L-DHM和ND+H-DHM 3组间PPARα和CPT1基因和蛋白表达无明显差异。提示DHM可能通过增加HFD小鼠肝脏脂质分解代谢有关因子(PPARα和CPT1)的表达改善其肝脏脂肪沉积。
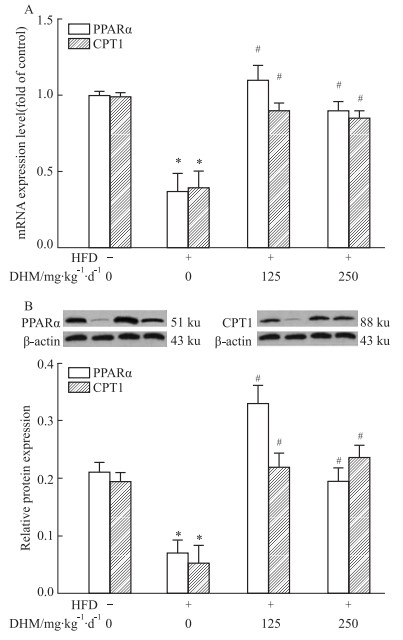
|
| Fig 6 Effects of dihydromyricetin on mRNA and protein expression of PPARα and CPT1 in livers of obese mice fed with high fat diet (x±s, n=4-5) A: PPARα and CPT1 mRNA expression level; B: PPARα and CPT1 protein expression level. *P < 0.05 vs ND group; #P < 0.05 vs HFD group. |
肥胖是一种由于能量摄入过多,造成体内脂肪异常聚积的疾病,是当今世界患病率增长最为迅速的代谢性疾病之一,其中将近80%的肥胖患者,都伴随着程度不同的肝脏脂肪变性[8]。肝脏是机体代谢的重要器官,肥胖的发生发展与肝脏代谢失衡紧密相关,同时肥胖也是肝脏代谢失衡的重要原因。肥胖个体中过量的脂肪组织导致游离脂肪酸大大增加,从而使肝脏、胰腺β细胞等代谢组织内脂质含量增加,引起一些代谢性疾病。肥胖会通过增加肝细胞死亡率、增加活性氧生成、改变脂肪因子、细胞因子平衡等在肝脏形成促纤维脂增生,进而促进一系列肝脏代谢疾病发生发展[9]。虽然药物治疗是肝脏脂质沉积患者的理想选择,但目前仍未找到可长期使用且安全有效的药物。因此,还需要寻找新的靶点研发新的药物,解决肝脏脂质沉积问题的道路仍然艰巨。
本课题组前期工作已经证实:DHM能使高脂饮食喂养的肥胖小鼠的体重与体脂下降,并对白色脂肪组织棕色化起正性作用[10]。也有相关文献表明:高脂饮食是诱导肥胖、肝细胞脂肪变性、胰岛素抵抗等代谢性疾病的重要因子[1]。那么,高脂饮食是否能影响肝脏脂质沉积呢?本研究结果表明:高脂饮食的小鼠体重、体脂、血清总胆固醇、甘油三酯和高密度脂蛋白增加,肝细胞肿大、呈现弥漫性脂肪变性、细胞质中富含大小不一的圆形脂质滴、肝脏细胞呈气泡状,肝脏内脂质生物合成有关基因的表达增加、脂质分解有关基因表达降低,提示:高脂饮食会诱导肥胖小鼠肝脏脂质沉积。
DHM是藤茶中最丰富的天然类黄酮类化合物,具有保护心脏、保护肝脏、改善糖尿病、抑制肿瘤等广泛的药理作用,具体机制可能是通过调节炎症与氧化应激[11];DHM也可降低血清总胆固醇和甘油三酯水平,并增加高脂血症大鼠的高密度脂蛋白水平[12],那么,DHM能否改善高脂饮食喂养的肥胖小鼠肝脏脂质沉积?本研究发现,DHM能使HFD小鼠体质量、体脂、血清总胆固醇、甘油三酯与高密度脂蛋白水平发生明显下降,且DHM能减轻肥胖小鼠肝脏弥漫性脂肪变性、减少胞质中的圆形脂滴,提示:DHM可改善高脂饮食诱导的肥胖小鼠肝脏脂质沉积,其具体机制是什么呢?
SIRT1和AMPK是两种重要的能量传感器。去乙酰化酶1(Sirtuin1, SIRT1)是一类蛋白脱乙酰酶,具有NAD+依赖性,是动物代谢平衡过程中的关键传感器[13]。SIRT1是肝脏代谢的重要调控因子,可以在肝脏糖异生、白色脂肪组织棕色化和胰岛素分泌等过程中发挥作用。腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK)是以丝氨酸/苏氨酸特异性蛋白激酶形式存在的细胞能量传感器,在维持机体代谢平衡过程中发挥关键作用。AMPK的激活能够增加分解代谢并降低ACC、FAS、SREBP等脂质合成有关因子的表达水平,降低合成代谢的速率,调节脂质合成及利用[14]。SIRT1通过LKB1依赖方式介导AMPK的作用,进一步控制下游脂质调控因子[15]。SIRT1的过量表达还能增强机体的AMPK及ACC的磷酸化,进一步抑制高糖诱导的FAS升高及血脂积聚[16]。
最近研究发现,DHM能够通过FLCN/FNIP1/AMPK途径改善胰岛素抵抗和阻止肥胖诱导的慢性肌纤维减少[17]。研究表明AMPK能够通过激活CPT1和PPARα调控脂质分解过程。脂质转运过程中,过氧化物酶体与内质网这两种重要的代谢途径可能会由于CPT1的降低而增强。脂质最初生成由ACC、FAS及SCD先后作用,产生脂酰辅酶A,脂酰辅酶A经过进一步的转化形成脂肪酸,并以TG的形式存贮在肝脏中。PPARα则通过促进线粒体及许多过氧化物酶体对脂肪酸的氧化过程来调控肝脏脂质分解[18]。
本研究结果表明:DHM处理的肥胖小鼠肝脏中SIRT1、AMPK及PPARα和CPT1的表达明显增强,而SREBP1、FAS和ACC1则明显减弱。提示,DHM可能通过激活SIRT1-AMPK通路,进而抑制脂质合成、促进脂质分解,达到改善高脂饮食诱导的小鼠肝脏脂肪蓄积的目的。
| [1] |
Patel J J, Rosenthal M D, Miller K R, et al. The critical care obesity paradox and implications for nutrition support[J]. Curr Gastroenterol Rep, 2016, 18(9): 45. doi:10.1007/s11894-016-0519-8 |
| [2] |
Domingo-Fernandez R, Coll R C, Kearney J, et al. The intracellular chloride channel proteins CLIC1 and CLIC4 induce IL-1beta transcription and activate the NLRP3 inflammasome[J]. J Biol Chem, 2017, 292(29): 12077-87. doi:10.1074/jbc.M117.797126 |
| [3] |
De Nardo D, Latz E. NLRP3 inflammasomes link inflammation and metabolic disease[J]. Trends Immunol, 2011, 32(8): 373-9. doi:10.1016/j.it.2011.05.004 |
| [4] |
Piwowarska J, Wrzosek M, Radziwon-Zaleska M, et al. Serum cortisol concentration in patients with major depression after treatment with clomipramine[J]. Pharmacol Rep, 2009, 61(4): 604-11. |
| [5] |
Huang W C, Peng H L, Hu S, et al. Spilanthol from traditionally used Spilanthes acmella enhances AMPK and ameliorates obesity in mice fed high-fat diet[J]. Nutrients, 2019, 11(5): 991. doi:10.3390/nu11050991 |
| [6] |
Yang S M, Park Y K, Kim J I, et al. LY3009120, a pan-Raf kinase inhibitor, inhibits adipogenesis of 3T3-L1 cells by controlling the expression and phosphorylation of C/EBP-alpha, PPAR-gamma, STAT3, FAS, ACC, perilipin A, and AMPK[J]. Int J Mol Med, 2018, 42(6): 3477-84. |
| [7] |
Fang K, Wu F, Chen G, et al. Diosgenin ameliorates palmitic acid-induced lipid accumulation via AMPK/ACC/CPT-1A and SREBP-1c/FAS signaling pathways in LO2 cells[J]. BMC Complement Altern Med, 2019, 19(1): 255. doi:10.1186/s12906-019-2671-9 |
| [8] |
Bartelt A, Widenmaier S B. Proteostasis in thermogenesis and obesity[J]. Biol Chem, 2019, 10. |
| [9] |
Han K, Kwon O, Park H J, et al. Effect of Daesiho-tang on obesity with non-alcoholic fatty liver disease: a study protocol for a randomised, double-blind, placebo-controlled pilot trial[J]. Trials, 2020, 21(1): 128. |
| [10] |
吕慧婕, 罗金定, 伍迪, 等. 二氢杨梅素经激活AMPK-PGC1α-Sirt1信号通路促进高脂饮食诱导的肥胖小鼠肩胛下脂肪组织棕色化[J]. 中国药理学通报, 2019, 35(12): 1687-92. Lyu H J, Luo J D, Wu D, et al. Dihydromyricetin promoted browning of subscapular adipose tissues in obese mice fed with high-fat diet via activating[J]. Chin Pharmacol Bull, 2019, 35(12): 1687-92. doi:10.3969/j.issn.1001-1978.2019.12.013 |
| [11] |
Zhang J, Chen Y, Luo H, et al. Recent update on the pharmacological effects and mechanisms of dihydromyricetin[J]. Front Pharmacol, 2018, 9: 1204. doi:10.3389/fphar.2018.01204 |
| [12] |
Liu T T, Zeng Y, Tang K, et al. Dihydromyricetin ameliorates atherosclerosis in LDL receptor deficient mice[J]. Atherosclerosis, 2017, 262: 39-50. doi:10.1016/j.atherosclerosis.2017.05.003 |
| [13] |
Tang B L. Sirt1 and the mitochondria[J]. Mol Cells, 2016, 39(2): 87-95. doi:10.14348/molcells.2016.2318 |
| [14] |
Herzig S, Shaw R J. AMPK: guardian of metabolism and mitochondrial homeostasis[J]. Nat Rev Mol Cell Biol, 2018, 19(2): 121-35. |
| [15] |
Carling D. AMPK signalling in health and disease[J]. Curr Opin Cell Biol, 2017, 45: 31-7. doi:10.1016/j.ceb.2017.01.005 |
| [16] |
Zang Y, Fan L, Chen J, et al. Improvement of lipid and glucose metabolism by capsiate in palmitic acid-treated HepG2 cells via activation of the AMPK/SIRT1 signaling pathway[J]. J Agric Food Chem, 2018, 66(26): 6772-81. doi:10.1021/acs.jafc.8b01831 |
| [17] |
Zhou Q, Gu Y, Lang H, et al. Dihydromyricetin prevents obesity-induced slow-twitch-fiber reduction partially via FLCN/FNIP1/AMPK pathway[J]. Biochim Biophys Acta Mol Basis Dis, 2017, 1863(6): 1282-91. |
| [18] |
Liou C J, Wei C H, Chen Y L, et al. Fisetin protects against hepatic steatosis through regulation of the Sirt1/AMPK and fatty acid beta-oxidation signaling pathway in high-fat diet-induced obese mice[J]. Cell Physiol Biochem, 2018, 49(5): 1870-84. |