

贾益群(1961-),男,高级工程师,硕士生导师,研究方向:药物分析,通讯作者,E-mail:yqjia1961@126.com
肝脏是机体重要的新陈代谢和解毒器官,容易被一些化学物质如酒精、四氯化碳和对乙酰氨基酚(acetaminophen,APAP)损伤[1]。APAP是一种广泛使用的解热镇痛药;但是,已有大量的报道过量摄入是急性肝功能衰竭的主要原因,甚至可能导致死亡[2-3]。人们普遍认为,对乙酰氨基酚可被肝细胞色素酶P450(cytochrome P450,CYP450)代谢为N-乙酰基-对苯醌亚胺(N-Acetyl-P-Benzoquinon Imine,NAPQI),后者可以与谷胱甘肽(glutathione,GSH)结合,形成APAP-谷胱甘肽、APAP-半胱氨酸和APAP-N-乙酰半胱氨酸来解毒。但是,过量的NAQPI会使细胞内GSH耗竭,剩余的NAPQI可以共价结合细胞生物大分子形成NAQPI蛋白质加物,扰乱细胞内氧化还原平衡,从而导致氧化应激反应,线粒体功能障碍和细胞核DNA断裂,最终导致肝细胞坏死和肝损伤[4-5]。目前,临床对药物性肝损伤(drug-induced liver injury,DILI)的诊断仍有很多不足,传统检测指标如谷氨酸转氨酶(glutamate aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)等存在敏感性低、特异性差的特点,尚未找到理想的DILI生物标志物。最新版《药物性肝损伤诊治指南》(2015年版)指出,新生物标志物在DILI诊断中的贡献还有待进一步研究[6]。
代谢组学由Nicholson等[7]于1999年首次提出。它是运用高通量仪器,对机体内分子质量小于1 000的代谢物质进行定性定量分析,旨在寻找与生理病理存在规律的特异性分子标志物,适用于研究代谢性疾病的发病机制及治疗药物的作用机制[8]。根据研究发现[9],APAP肝毒性剂量(2.5 g·kg-1)给大鼠口服后48 h,从大鼠肝肾组织的病理切片观察,产生了明显的肝损伤;肝肾组织的活性氧(reactive oxygen species)、一氧化氮(nitric oxide)和丙二醛(malondiadehyde)含量增加和GSH含量以及血清的多项生化指标与空白组相比也产生了显著的差异,说明肝损伤后大鼠机体代谢系统发生了紊乱。因此,本实验在该文献的基础上首次采用液相色谱-高分辨质谱技术(UPLC-Q-Orbitrap-MS)结合多变量数据统计分析方法,探讨大鼠口服对APAP后不同时间段血清中内源性代谢物的变化及可能的通路分析,为临床诊断和用药安全提供依据。
1 材料 1.1 药品与试剂对乙酰氨基酚(Sigma-Aldrich中国,批号099K0127);2-氯苯丙氨酸(上海阿拉丁生化科技股份有限公司,批号D1404053),乙腈为色谱纯(美国Honeywell公司,批号K3021728);甲醇(批号20181113)、甲酸(批号3208K240)(均为色谱纯,德国CNW公司)。
1.2 仪器FA2004N型电子天平(上海精密科学仪器有限公司),Thermo液相色谱-质谱仪(UPLC-Q-Orbitrap-MS);TARGINTMVX-Ⅱ多管涡旋振荡器(北京踏锦科技有限公司);1730R离心机(基因有限公司);SK8200LHC超声波清洗器(上海科导超声仪器有限公司);TBA-40FR生化分析仪(日本东芝公司)。
1.3 实验动物SPF级Wistar大鼠,♂,24只,体质量(180±20)g,由上海中医药大学实验动物中心提供,置于动物饲养笼中,保持室内温度(18~22) ℃,室内昼夜自然明暗交替照明,饲养标准大鼠饲料。动物许可证号:SCXK(沪)2017-0005,伦理审查编号:PZSHUTCM190315013。
2 方法 2.1 大鼠分组及给药健康雄性Wistar大鼠24只,适应性饲养1周后,随机分为4组,即正常对照组和APAP低(1 g·kg-1)、中(2 g·kg-1)、高(3 g·kg-1)剂量组,每组6只。正常对照组口服0.5% CMC-Na溶液,APAP组口服相应剂量0.5% CMC-Na溶液配制的200 g·L-1 APAP溶液。给药前一晚大鼠禁食不禁水;饲养过程中保持温度、光照、湿度等环境条件均衡,自由进食饮水。灌胃后分别于6、24、48 h颈静脉取血;全血于5 000 r·min-1、4 ℃离心10 min,取血清置于4 ℃冰箱备用。在48 h取完血后,取大鼠肝脏,分出肝大叶,立即用福尔马林固定。
2.2 生化指标的测定取50 μL血清,于全自动生化分析仪上测定AST和ALT值。
2.3 肝组织病理学检测取用福尔马林固定的肝大叶,HE染色,光镜下观察肝细胞形态。
2.4 代谢组学 2.4.1 血清样品制备取解冻后血清样品50 μL,加入200 μL甲醇和5 μL 2-氯苯丙氨酸(5 g·L-1),振摇1 min,于4 ℃离心机中以12 000 r·min-1离心10 min,吸取100 μL上清,转入进样小瓶中待检测。同时,各组取等量样品混合,制备质控样品。
2.4.2 LC-MS分析条件① 色谱条件色谱柱:[Waters ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 μm];流速0.3 mL·min-1;柱温为40 ℃;流动相组成为A:纯水+0.1%甲酸,B:乙腈+0.1%甲酸;梯度洗脱程序见Tab 1;体积流量0.3 mL·min-1;进样量4 μL。②质谱条件:静电场轨道离子阱,ESI离子源,正离子模式为加热器温度300 ℃;鞘气体积流量45 arb;辅助气体积流量15 arb;尾气体积流量1 arb;电喷雾电压3.0 kV;毛细管加热温度350 ℃;负离子模式为加热器温度300 ℃;鞘气体积流量45 arb;辅助气体积流量15 arb;尾气体积流量1 arb;电喷雾电压3.2 kV;毛细管加热温度350 ℃。鞘气和辅助气均为氮气,扫描范围m/z:50~1 000。
| t/min | flow rate/mL·min-1 | A/% | B/% |
| 0 | 0.3 | 95 | 5 |
| 2 | 0.3 | 95 | 5 |
| 12 | 0.3 | 5 | 95 |
| 15 | 0.3 | 5 | 95 |
| 17 | 0.3 | 95 | 5 |
通过SPSS20.0软件进行统计分析,计量资料以x±s表示,将LC-MS所得原始质谱数据导入Compound Discover2.1软件(美国Thermo公司)进行提取和预处理,再导入Excel软件中进行归一化,整理成二维数据矩阵形式,通过SIMCA14.0软件进行主成分分析(PCA)和正交偏最小二乘法判别分析(OPLS-DA),根据OPLS-DA模型所得的VIP值和t检验所得的P值(P<0.05)为标准,找出中剂量组3个时间点的交集差异性代谢物;在HMDB、KEGG等数据库对此差异性代谢物进行结构鉴定,找到相应的代谢通路,探讨潜在生物标志物的生物学意义。
3 结果 3.1 APAP对ALT、AST水平的影响ALT和AST水平反映了大鼠肝细胞的损伤程度;与正常对照组相比,在6 h,给药组大鼠血清ALT、AST无显著变化;在24 h,中、高剂量组大鼠血清ALT和AST水平明显升高(P<0.01);在48 h,低、中、高剂量组大鼠血清ALT和AST水平均明显升高(P<0.05,P<0.01),见Fig 1。
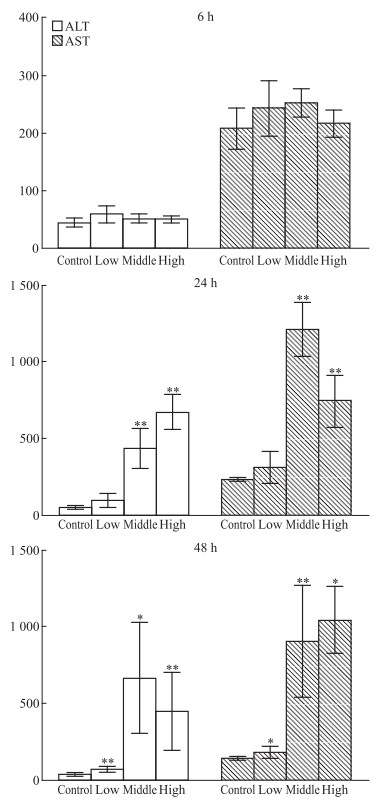
|
| Fig 1 Rat serum ALT, AST detection *P < 0.05, **P < 0.01 vs control |
如Fig 2所示,正常对照组大鼠肝细胞正常,低剂量组大鼠肝组织出现少许空泡状肝细胞,细胞间隙扩大;中、高剂量组大鼠肝细胞严重坏死,有大量炎细胞浸润;损伤程度均较低剂量组的严重,且高剂量组的大鼠肝组织损伤程度比中剂量组更严重。
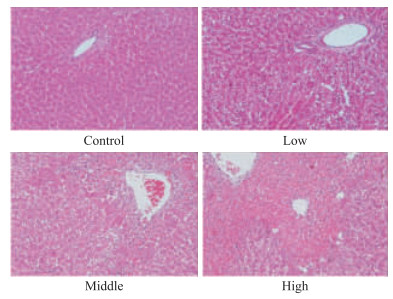
|
| Fig 2 HE staining results of rat liver tissues(HE×200) |
在正模式(ESI+)及负模式(ESI-)下对大鼠血清样本进行PCA分析,从Fig 3可以看出,正常对照组、给药组和质控的血清样品能明显分开。可知给药组大鼠与正常大鼠之间的差异可以通过代谢谱有效地辨别。
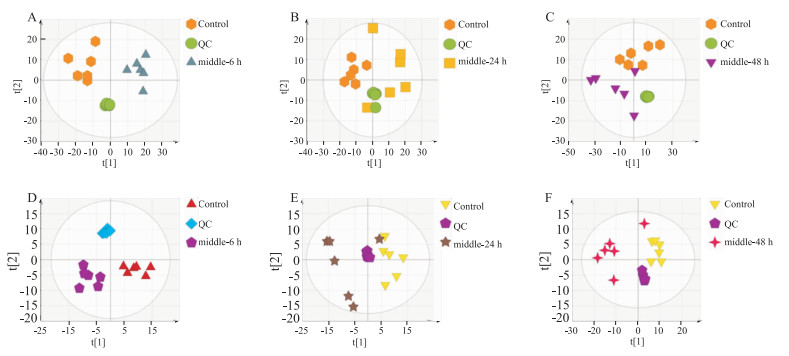
|
| Fig 3 PCA results of APAP(2 g·kg-1)serum metabolomics Positive:A:6 h, B:24 h, C: 48 h; negative: D: 6 h, E; 24 h, F: 48 h |
OPLS-DA分析在正模式(ESI+)及负模式(ESI-)下对大鼠血清样本进行OPLS-DA分析,正常对照组、给药组的血清样品分离,在正离子模式下,6 h的R2X、R2Y、Q2分别为0.619、0.995、0.876,24 h的分别为0.633、0.998、0.657,48 h的分别为0.728、0.999、0.901;在负离子模式下,6 h的R2X、R2Y、Q2分别为0.655、0.998、0.714,24 h的分别为0.644、0.997、0.781,48 h的分别为0.765、0.999、0.902,见Fig 4。结果显示,所建立的模型有效,模式质量良好,可用于后续的组间差异成分的寻找与分析。
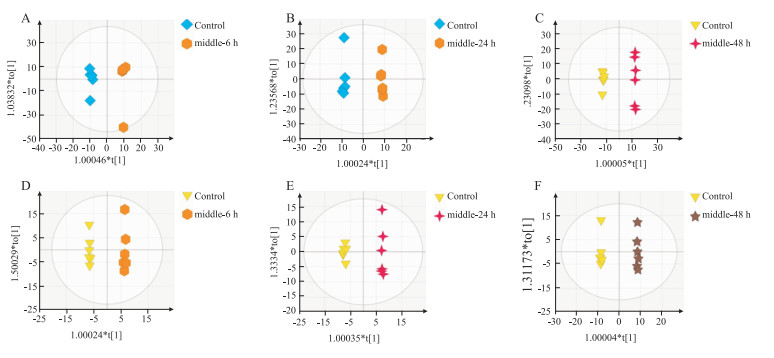
|
| Fig 4 OPLS results of APAP(2 g·kg-1)serum metabolomics Positive:A:6 h, B:24 h, C:48 h; negative:D:6 h, E:24 h, F:48 h |
通过OPLS-DA分析,可以找到变量权重(VIP)>1以及P<0.05的差异性代谢物,经HMDB、KEGG等谱库检索筛选,本实验共找出了45个差异性代谢物,正模式下鉴定出33个,负模式下共鉴定出12个(与正模式下鉴定出的相同物质删去不表),结果见Tab 2、Tab 3。将主要产物大致归类为:磷脂类(LysoPC(22:4(7Z, 10Z, 13Z, 16Z))、LysoPC(14:0)、LysoPE(0:0/16:0)等),鞘脂代谢产物(鞘氨醇:sphinganine),胆酸(牛磺胆酸:taurocholic acid;3a,7a-二羟基胆酸:3a, 7a-dihydroxycholanoic acid)、嘧啶类(尿嘧啶:uracil)、不饱和脂肪酸类(二十碳五烯酸:eicosapentanoic acid)、花生四烯酸产物(N-花生四烯酸甘氨酸:N-arachidonoyl glycine)、糖代谢产物(对乙酰氨基酚葡萄糖醛酸:acetaminophen glucuronide),等。
| tR/min | M/Z | Chemical formula | Metabolite name | APAP |
| 1.677 | 153.042 57 | C7H7NO3 | Mesalazine | ↑ |
| 2.698 | 292.049 51 | C9H8N8O2S | Chlorosesamone | ↑ |
| 6.993 | 397.319 19 | C24H39N5 | Trans-Hexadec-2-enoyl carnitine | ↑ |
| 5.342 | 316.203 68 | C20H28O3 | 2-Methoxyestradiol-3-methylether | ↑ |
| 6.333 | 369.287 98 | C21H39NO4 | Trans-2-Tetradecenoylcarnitine | ↑ |
| 8.49 | 569.347 9 | C30H52NO7P | LysoPC(22:5(7Z, 10Z, 13Z, 16Z, 19Z)) | ↑ |
| 4.087 | 270.052 8 | C9H11N4O4P | 5, 6, 7-trihydroxy-3-phenyl-4H-chromen-4-one | ↑ |
| 7.147 | 467.301 11 | C23H42N5O3P | LysoPC(14:0) | ↑ |
| 6.618 | 281.271 89 | C18H35NO | Oleamide | ↑ |
| 6.819 | 301.298 17 | C18H39NO2 | Sphinganine | ↑ |
| 6.618 | 299.282 54 | C18H37NO2 | Palmitoylethanolamide | ↑ |
| 7.177 | 414.204 26 | C24H30O6 | 4-O-Methylmelleolide | ↓ |
| 3.953 | 179.058 28 | C9H9NO3 | Hippuric acid | ↓ |
| 10.151 | 571.361 07 | C26H60N3O2P3S | LysoPC(22:4(7Z, 10Z, 13Z, 16Z)) | ↓ |
| 3.63 | 129.057 82 | C9H7N | 3-Methylene-indolenine | ↓ |
| 10.964 | 328.240 53 | C22H32O2 | Retinyl acetate | ↑ |
| 11.426 | 262.229 72 | C18H30O | 6, 10, 14-Trimethyl-5, 9, 13-pentadecatrien-2-one | ↑ |
| 10.441 | 378.277 14 | C23H38O4 | 2-arachidonoylglycerol | ↑ |
| 0.959 | 159.125 96 | C8H17NO2 | L-2-Aminooctanoic acid | ↓ |
| 0.936 | 243.085 55 | C9H13N3O5 | Cytidine | ↑ |
| 9.261 | 340.297 46 | C21H40O3 | Polyoxyethylene(600) monoricinoleate | ↑ |
| 8.219 | 453.285 54 | C21H44NO7P | LysoPE(0:0/16:0) | ↑ |
| 4.981 | 189.079 03 | C11H11NO2 | Indole-3-propionic acid | ↓ |
| 2.143 | 327.095 46 | C14H17NO8 | Acetaminophen glucuronide | ↑ |
| 7.805 | 477.285 55 | C24H40N5O3P | LysoPE(0:0/18:2(9Z, 12Z)) | ↑ |
| 9.569 | 330.256 13 | C22H34O2 | Ethyl abietate | ↑ |
| 3.303 | 231.020 08 | C8H9NO5S | Paracetamol sulfate | ↑ |
| 8.697 | 326.224 54 | C16H31N4OP | 15beta-Hydroxydesogestrel | ↑ |
| 0.871 | 136.063 57 | C7H8N2O | N-Methylnicotinamide | ↓ |
| 1.329 | 112.027 09 | C4H4N2O2 | Uracil | ↑ |
| 8.806 | 604.449 19 | C40H60O4 | Cycloartanyl ferulate | ↑ |
| 8.809 | 302.224 49 | C20H30O2 | Eicosapentanoic acid | ↑ |
| 1.982 | 152.033 34 | C5H4N4O2 | Xanthine | ↑ |
| tR/min | M/Z | Chemical formula | Metabolite name | APAP |
| 3.57 | 261.030 08 | C9H11NO6S | 2-methoxyacetaminophen sulfate | ↑ |
| 7.582 | 392.291 26 | C24H40O4 | 3a, 7a-Dihydroxycholanoic acid | ↓ |
| 4.761 | 202.029 53 | C8H10O4S | 4-Ethylphenylsulfate | ↓ |
| 5.341 | 334.213 27 | C16H26N6O2 | 7′-Carboxy-gamma-chromanol | ↑ |
| 11.435 | 280.239 42 | C18H32O2 | Dihomolinoleic acid | ↑ |
| 4.768 | 187.062 95 | C11H9NO2 | Indoleacrylic acid | ↓ |
| 3.864 | 309.083 75 | C14H15NO7 | Indoxyl glucuronide | ↑ |
| 3.983 | 213.009 09 | C8H7NO4S | Indoxyl sulfate | ↓ |
| 7.388 | 240.172 | C14H24O3 | L-Menthyl acetoacetate | ↑ |
| 0.971 | 289.126 4 | C11H19N3O6 | Ophthalmic acid | ↑ |
| 3.758 | 189.993 2 | C6H6O5S | Pyrocatechol sulfate | ↓ |
| 5.165 | 515.289 9 | C24H38N9O2P | Taurocholic acid | ↑ |
热图是数据的一种二维呈现,可以更加清晰地表示代谢物的组间差异,因此将上述化合物构建热图,见Fig 5。其中发现,服用APAP后上调的差异物有Sph、TCA、LysoPC(14:0)、LysoPE(0:0/18:2(9Z, 12Z))等;下调的差异物有LysoPC(22:4(7Z, 10Z, 13Z, 16Z))、3a,7a-二羟基胆酸、硫酸吲哚酚(Indoxyl sulfate)等。
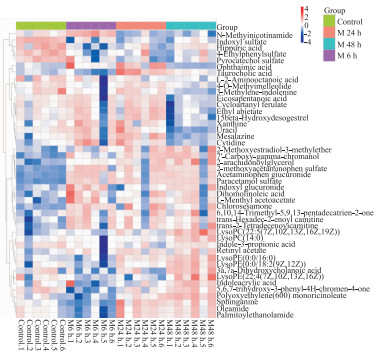
|
| Fig 5 Thermographic analysis of potential biomarkers Normal group(Control 1~Control 6), middle group 6 h(M 6h.1~M 6h.6), middle group 24h(M 24h.1~M 24h.6), middle group 48 h(M 48h.1~M 48h.6) |
将Tab 2、Tab 3中的差异代谢物通过Metabo Analyst进行通路分析得知,对乙酰氨基酚致肝损伤的作用机制可能与嘧啶代谢、甘油磷脂代谢、鞘脂代谢、嘌呤代谢、泛酸和CoA生物合成及初级胆汁酸的生物合成等11条代谢通路有关,见Tab 4、Fig 6。结合KEGG通路分析发现,甘油磷脂代谢、鞘脂代谢,以及初级胆汁酸的生物合成可能是其主要相关代谢通路。
| No. | Metabolism pathway | P | -log(P) | Impact |
| a | Pyrimidine metabolism | 5.31×10-2 | 2.935 7 | 4.89×10-2 |
| b | Taurine and hypotaurine metabolism | 7.20×10-2 | 2.631 2 | 0.00 |
| c | Pentose and glucuronate interconversions | 1.23×10-1 | 2.097 1 | 2.73×10-1 |
| d | Pantothenate and CoA biosynthesis | 1.31×10-1 | 2.032 4 | 0.00 |
| e | Beta-Alanine metabolism | 1.63×10-1 | 1.812 9 | 0.00 |
| f | Sphingolipid metabolism | 1.79×10-1 | 1.721 2 | 1.43×10-1 |
| g | Starch and sucrose metabolism | 1.94×10-1 | 1.638 7 | 3.78×10-2 |
| h | Glycerophospholipid metabolism | 2.46×10-1 | 1.402 3 | 4.44×10-2 |
| i | Biosynthesis of unsaturated fatty acids | 3.28×10-1 | 1.115 5 | 0.00 |
| j | Primary bile acid biosynthesis | 3.53×10-1 | 1.041 | 2.97×10-2 |
| k | Purine metabolism | 4.78×10-1 | 0.739 13 | 3.29×10-2 |
| Match status: the number of identified metabolites/the total number of metabolites in the pathway; P: the raw P value obtained by pathway analysis; Impact: the pathway impact value obtained by topological analysis. | ||||
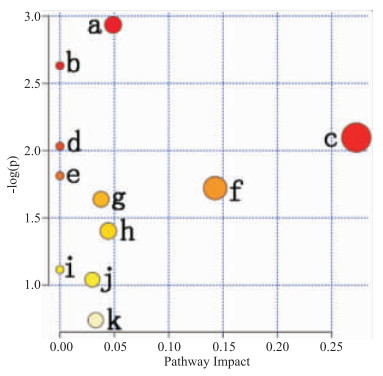
|
| Fig 6 Metabolic pathway of serum samples |
APAP是临床上广为使用的解热镇痛药,但是过量服用会超过机体代谢和排毒的能力,经肝脏代谢后生成的毒性中间产物NAPQI不能及时被谷胱甘肽结合而清除排出体内,从而导致中间产物与肝组织内的蛋白质结合,引起肝细胞坏死,出现血清ALT与AST的急剧升高。血清中ALT和AST含量的升高是肝损伤的特异性标志,可反映细胞损伤和坏死程度[10]。本实验结果表明,3个剂量组大鼠最终血清的ALT与AST水平均明显高于正常对照组,且中、高剂量组于24 h差异就产生显著性;病理组织学显示,随着APAP剂量的递增,炎性细胞浸润增多,结构损伤加重。说明服用过量的APAP可能于24 h开始产生肝毒性,剂量越大肝损伤的程度越严重。
本实验首次采用UPLC-Q-Orbitrap-MS结合多变量数据统计分析方法,探讨大鼠口服APAP后不同时间段血清中内源性代谢物的变化及可能的通路分析;结果表明其可能主要与甘油磷脂代谢、鞘脂代谢,以及初级胆汁酸的生物合成等代谢通路有关。
甘油磷脂代谢:从Tab 2可知,甘油磷脂是肝损伤大鼠血清中主要的生物标记物,包括LPCs、LPEs等;亦是生物体内含有量最丰富、种类最复杂的磷脂之一,是肝细胞以及线粒体膜的重要组成部分[11]。甘油磷脂在磷脂酶的作用下催化降解生成LPC,甘油磷脂还可以通过影响体内药物代谢的酶,如药物Ⅱ相代谢酶尿苷二磷酸葡萄糖醛酸转移酶(UDP-glucuronosyltransferase)、药物Ⅰ相代谢酶CYP450等,从而影响药物的代谢及加重代谢紊乱,并且会导致肝脏疾病;LPC可促进炎症反应,并且与许多疾病的发生有关;LPC亦具有细胞毒性,使细胞结构和功能异常[12]。本实验发现,大鼠口服APAP后体内LysoPC(14:0)、LysoPE(0:0/16:0)、LysoPE(0:0/18:2(9Z, 12Z))、LysoPC(22:5(7Z, 10Z, 13Z, 16Z, 19Z))、LysoPC(22:4(7Z, 10Z, 13Z, 16Z))含量升高;且PE可与PC相互转化,PE与细胞生长、增殖和分化密切相关,是细胞凋亡的诱因[13],由此可知,可能是APAP导致了甘油磷脂代谢紊乱,产生了有毒的代谢产物,导致肝细胞结构破坏和细胞凋亡,引起了肝损伤。
鞘脂代谢:鞘脂(sphingolipids,SPL)的代谢较为复杂,其中神经酰胺(ceramide,Cer)处于鞘脂代谢网络中的核心位置;SPL是一类以鞘氨醇(sphingsine, Sph)为骨架的较复杂的化合物,Sph在体内生成的唯一途径是神经酰胺在神经酰胺酶(ceramidase)的作用下去乙酰化而产生的[14]。有文献报道,神经酰胺可以引起细胞内GSH的耗竭及线粒体去极化,从而诱导肝细胞氧化应激损伤[15]。本实验研究结果显示,大鼠口服APAP后Sph的含量升高,而Sph只能通过Cer转化产生,由此可推测,APAP可能引起鞘脂代谢紊乱,从而导致肝损伤。且有文献报道[16],在多种肝脏疾病如酒精性肝病、肝脏缺血/再灌注损伤、脂肪性肝病等中,其体内的Cer和Sph含量均有明显的变化。尽管有些神经酰胺和鞘氨醇的作用机制还有待研究,但在一定程度上可作为肝损伤的生物标记物。
初级胆汁酸的生物合成:肝脏在胆汁酸代谢中占重要地位,与胆汁酸的合成、分泌、转化等具有密切关系,胆汁酸的变化亦被认为是肝损伤的代谢组学标志物[17]。初级胆汁酸是肝细胞以胆固醇为原料直接合成的,其从肝内被分泌出来后进入肠腔,在一些酶和细菌的代谢下成为次级胆汁酸[18]。本次研究结果所得,大鼠口服APAP后牛磺胆酸(Taurocholic acid,TCA)的含量升高,3a, 7a-Dihydroxycholanoic acid(亦称鹅去氧胆酸)的含量下降;据文献报道[13],TCA为疏水性胆汁酸,可通过与体内甘氨酸及牛磺酸结合产生,其含量升高可引起肝内胆汁淤积,导致肝内胆汁酸代谢紊乱,进而产生肝毒性。
综上所述,本实验在前期研究基础上探讨了低、中、高3个剂量的APAP分别在6、24、48 h对大鼠肝脏造成的影响;首次采用液相色谱-高分辨质谱技术(UPLC-Q-Orbitrap-MS)结合多变量数据统计分析方法进行代谢差异物及通路分析,结果显示,APAP致肝毒性代谢通路可能与甘油磷脂代谢、鞘脂代谢,以及初级胆汁酸的生物合成等代谢通路紊乱有关,为后期深入研究APAP致肝毒性的作用机制及治疗药物的开发提供一定的依据。
| [1] |
屠梦珏, 魏进歌, 陈鑫, 王玉琴. 二氢杨梅素对APAP诱导小鼠急性肝损伤的保护作用[J]. 中国药理学通报, 2018, 34(12): 1707-12. Tu M J, Wei J G, Chen X, Wang Y Q. Protective effects of dihydromyricetin on acute liver injury induced by APAP in mice[J]. Chin Pharmacol Bull, 2018, 34(12): 1707-12. doi:10.3969/j.issn.1001-1978.2018.12.017 |
| [2] |
Guo H, Sun J, Li D, et al. Shikonin attenuates acetaminophen-induced acute liver injury via inhibition of oxidative stress and inflammation[J]. Biomed Pharmacother, 2019, 112: 108704. doi:10.1016/j.biopha.2019.108704 |
| [3] |
郭秋平, 杨威, 郭琳, 等. 对乙酰氨基酚SD大鼠毒代动力学研究及P450的影响[J]. 中国药理学通报, 2014, 30(8): 1183-4. Guo Q P, Yang W, Guo L, et al. The toxicokinetic study of acetaminophe-n SD rats and the effect of P450[J]. Chin Pharmacol Bull, 2014, 30(8): 1183-4. doi:10.3969/j.issn.1001-1978.2014.08.031 |
| [4] |
Pang C, Zheng Z, Shi L, et al. Caffeic acid prevents acetaminophen-induced liver injury by activating the Keap1-Nrf2 antioxidative defense system[J]. Free Radic Biol Med, 2016, 91: 236-46. doi:10.1016/j.freeradbiomed.2015.12.024 |
| [5] |
Feng R, Wang Y, Liu C, et al. Acetaminophen-induced liver injury is attenuated in transgenic fat-1 mice endogenously synthesizing long-chain n-3 fatty acids[J]. Biochem Pharmacol, 2018, 154: 75-88. |
| [6] |
杨虹, 彭芳, 刘刚, 等. 基于脂类代谢组学研究对乙酰氨基酚对小鼠药物性肝损伤的早期毒性[J]. 中国药房, 2019, 30(15): 2031-6. Yang H, Peng F, Liu G, et al. Early toxicity of acetaminophen on drug-induced liver injury in mice based on lipid metabolomics[J]. Chin Pharm, 2019, 30(15): 2031-6. |
| [7] |
Nicholson J K, Lindon J C, Holmes E. "Metabonomics":understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica, 1999, 29(11): 1181-9. doi:10.1080/004982599238047 |
| [8] |
曾晓会, 卓俊城, 谢凯枫, 等. 二甲双胍治疗Ⅱ型糖尿病大鼠的代谢组学研究[J]. 中国药理学通报, 2019, 35(9): 1212-20. Zeng X H, Zhuo J C, Xie K F, et al. Metabolomics study of metformin in the treatment of type 2 diabetic rats[J]. Chin Pharmacol Bull, 2019, 35(9): 1212-20. doi:10.3969/j.issn.1001-1978.2019.09.007 |
| [9] |
Zhao Y L, Zhou G D, Yang H B, et al. Rhein protects against acetaminophen- induced hepatic and renal toxicity[J]. Food Chem Toxicol, 2011, 49(8): 1705-10. doi:10.1016/j.fct.2011.04.011 |
| [10] |
杨宇莎, 时京珍, 雷钟, 等. 血人参乙酸乙酯部位对APAP诱导小鼠急性肝损伤的保护作用[J]. 时珍国医国药, 2018, 29(4): 786-9. Yang Y S, Shi J Z, Lei Z, et al. Protective effect of ethyl acetate fraction in blood ginseng on acute liver injury induced by APAP in mice[J]. Lishizhen Med Mater Med Res, 2018, 29(4): 786-9. |
| [11] |
陆欣.基于LC-MS的肝癌血清及组织代谢组学研究[D].哈尔滨: 哈尔滨工业大学, 2016. Lu X. Study on serum and tissue metabolomics of liver cancer based on LC-MS[D]. Harbin: Harbin Institute Technol, 2016. |
| [12] |
林龙飞.何首乌致肝损伤成分及作用机制研究[D].北京: 北京中医药大学, 2016. Lin L F. Study on the components and mechanism of liver injury caused by Polygonum multiflorum[D]. Beijing: Beijing Univ Chin Med, 2016. |
| [13] |
王夏雷, 苟小军, 陈龙, 等. 土三七致大鼠肝毒性的代谢组学[J]. 中成药, 2019, 41(8): 1826-34. Wang X L, Gou X J, Chen L, et al. Metabolomics of hepatotoxicity induced by Gynura segetum in rats[J]. Tradit Chin Med Patent Prescription, 2019, 41(8): 1826-34. doi:10.3969/j.issn.1001-1528.2019.08.015 |
| [14] |
蒋莹莹, 郑素军. 肝细胞癌的鞘脂组学研究进展[J]. 世界华人消化杂志, 2018, 26(36): 2109-14. Jiang Y Y, Zheng S J. Research progress of sphingolipids in hepatocellular carcinoma[J]. World Chin J Digestol, 2018, 26(36): 2109-14. |
| [15] |
Marí M, Fernández-Checa J C. Sphingolipid signalling and liver diseases[J]. Liver Int, 2007, 27(4): 440-50. doi:10.1111/j.1478-3231.2007.01475.x |
| [16] |
王少媛, 张金兰, 张丹, 等. 鞘脂在肝脏疾病中的研究进展[J]. 药学学报, 2015, 50(12): 1551-8. Wang S Y, Zhang J L, Zhang D, et al. Research progress of sphingolipids in liver diseases[J]. Acta Pharm Sin, 2015, 50(12): 1551-8. |
| [17] |
刘磊, 蒋怀周, 沈斌. 肝豆灵对铜负荷致肝损伤大鼠肝脏代谢产物的影响[J]. 安徽中医药大学学报, 2016, 35(1): 68-72. Liu L, Jiang H Z, Shen B. Effect of Gandouling on liver metabolites in rats with liver injury induced by copper load[J]. J Anhui Tradit Chin Med College, 2016, 35(1): 68-72. doi:10.3969/j.issn.2095-7246.2016.01.021 |
| [18] |
马荣, 谢倩, 王建, 等. 基于代谢组学研究厚朴远志配伍醇提物对尿液代谢物的影响[J]. 中国药理学通报, 2019, 35(6): 870-7. Ma R, Xie Q, Wang J, et al. Effects of alcohol extracts from Polygalae and Magnolia on urine metabolites based on metabonomics[J]. Chin Pharmacol Bull, 2019, 35(6): 870-7. doi:10.3969/j.issn.1001-1978.2019.06.026 |

