


洪桂祝(1966-),女,博士,教授,研究方向:心脑血管药理学,通讯作者,E-mail:13559102126@163.com
 ,
YANG Ze-lin,
TANG Yu-heng,
HUANG Xin,
SUN Chun-xiao,
XU A-juan,
LAI Wen-fang
,
YANG Ze-lin,
TANG Yu-heng,
HUANG Xin,
SUN Chun-xiao,
XU A-juan,
LAI Wen-fang
 ,
HONG Gui-zhu
,
HONG Gui-zhu

脑卒中,俗称脑中风,是一种突然起病的脑血液循环障碍性疾病,也是脑血管疾病最严重的并发症。缺血性卒中患者大约占全部脑中风患者的85%,主要是由于脑部血流堵塞,导致供氧不足,线粒体功能障碍和最后神经细胞死亡而引起的疾病[1]。同时,因其具有发病迅猛、治疗窗短缺、病情复杂、高致残率以及高致死率等特点,为家庭和社会带来严重的负担[2]。
红景天(Rhodiold rosea L.)在我国具有悠久的药用历史,是生长于海拔3500米以上的天然植物。根据中国药典2015版描述,红景天具有“益气活血,通脉平喘”的药理作用[3],数种抗心肌缺血的中成药将红景天作为主成分。红景天苷(salidroside,Sal)是红景天的主要有效成分,也是其药用基础物质的标志。课题组前期研究发现,Sal能够降低暂时性大脑中动脉闭塞模型(temporary middle cerebral artery occlusion,tMCAO)大鼠的脑梗死体积,且具有神经保护作用[3-6]。课题组将根据最新国际脑卒中治疗学术产业圆桌会议关于临床前研究的建议,需要选择两种及以上动物模型,进行药效评价指标[7]。本文重点研究Sal对永久性大脑中动脉闭塞模型(permanent middle cerebral artery occlusion,pMCAO)大鼠的作用,探讨红景天苷神经保护的作用机制。
1 材料 1.1 实验动物SPF级健康成年♂ SD大鼠60只,体质量(260~280) g,购于上海斯莱克实验动物有限公司(合格证号:2015000509563,许可证号:SCXK(沪)2015-0002),由福建中医药大学实验动物中心饲养,许可证号:SYXK(闽)2015-0005。
1.2 药品与主要试剂红景天苷(纯度≥98%)由福建中医药大学药学院提供。TUNEL凋亡检测试剂盒(货号:G3250)购自Promega公司,NeuN抗体(货号:ab104224)购自英国Abcam公司,NGF抗体(sc-365944)购自Santa Cruz公司,Cleaved caspase-3抗体(9661s)、Caspase-3抗体(9662s)均购自Cell Signaling Technology公司,DAPI染色液(货号:C1006),鼠抗(货号:31430),兔抗(货号:31460)均购自Thermo Scientific公司,β-actin抗体(货号AF0003:)、超敏ECL化学发光试剂盒(货号:P0012A)抗荧光淬灭封片液(货号:P0126)均购自碧云天生物技术有限公司;PBS磷酸盐缓冲液粉末(货号:17032701),柠檬酸盐缓冲液粉末(货号:17021404)均购自迈新生物技术有限公司;尼氏染色液(货号:DK0022)购自北京雷根生物技术有限公司。
1.3 实验仪器核磁共振成像仪(Bruker公司,型号:7.0T),ChemiDoc XRS+凝胶成像系统(美国Biorad公司),3600AAA尼龙线栓(广州佳灵生物技术有限公司),激光共聚焦显微镜(德国Zeiss公司),基础电泳仪电源(美国Bio-Rad公司);石蜡切片机(Thermo Fisher公司,型号:HM325);生物组织石蜡包埋机(Thermo Fisher公司,型号:YB-6LF)。
2 方法 2.1 pMCAO模型大鼠制作采用线栓法制备pMCAO模型。SD大鼠采用2%戊巴比妥钠(2 mL·kg-1)腹腔注射麻醉后,沿颈部中线切开,暴露左侧的颈总动脉、颈外动脉、颈内动脉,用医用缝合线分别对颈总动脉和颈外动脉进行结扎,用动脉夹夹闭颈内动脉,在颈总动脉血管壁上剪一小口,将备好的线栓自颈总动脉切口插入,沿着颈总动脉向颈内动脉缓慢引入,待上行至大脑中动脉起始端即可停止,线栓固定后,按要求消毒后缝合切口即可。假手术组除不插入线栓外其余操作同模型组。待大鼠清醒对其进行神经功能评分,参照Longa法[8]进行神经功能功能缺损评价,在双盲条件下进行大鼠pMCAO模型鉴定,神经功能缺损评分在2~3分视为模型成功。
2.2 实验动物分组和给药健康成年♂SD大鼠60只,适应性喂养1周,随机分为假手术组(sham组)20只和造模组40只;造模组大鼠采用线栓法制作pMCAO模型,造模成功后,抽签法随机分为pMCAO模型对照组(pMCAO组)20只、红景天苷给药组(pMCAO+Sal组)20只。大鼠造模后正常饲养,评分后每天按时对sham组和pMCAO组大鼠按体质量腹腔注射0.9%生理盐水(10 mL·kg-1·d-1),pMCAO+Sal组按体质量组腹腔注射红景天苷(50 mg·kg-1·d-1)[6],连续给药6 d。末次给药后对各组存活的大鼠进行神经功能评分并进行MRI脑部扫描,扫描结束后将其麻醉处死后取材。
2.3 MRI大鼠脑部核磁共振成像扫描将待扫描的大鼠放入麻醉盒,通入麻醉气体异氟烷将其麻醉后将其转移至线圈内的支架轨道上固定并保持鼻腔一定流量的异氟烷的持续通入,腹部置一循环水加热垫以保持扫描期间的正常体温。颅脑线圈固定于大鼠头部,设置序列参数进行扫描,保存扫描数据待分析。T2序列参数Repetition time (TR)=2 738.308 ms, Echo time (TE) =33.00 ms, Echo spacing= 11.000 ms, Slice thickness (ST) =0.8 mm, Slices=24, Matrix size=256×256, Field of view (FOV) =30.00×30.00, Number of excitation (NEX)= 4.0。采用盲法对收集的各组T2成像数据通过图像处理软件ImageJ进行梗死体积计算。
2.4 Nissl染色法检测尼氏体的表达保存的脑组织进行石蜡包埋,蜡块5 μm厚度切片,经过脱蜡复水,在56 ℃温箱内于含有焦油紫的染缸中浸染30 min;酒精灯上加温至切片冒泡约10 min;去离子水洗去染液,尼氏分化液分化1~3 min;无水乙醇脱水;二甲苯透明;晾干后用中性树脂封片,在镜下观察结果并拍照留存,用图像分析软件Motic Med 6.0测定梗死体积。
2.5 免疫组织化学染色测定脑组织中TUNEL表达保存的脑组织石蜡包埋,厚5 μm切片,经脱蜡复水,抗原修复后,0.9%NaCl溶液液里浸泡5 min;PBS溶液浸泡5 min;4%多聚甲醇固定15 min;PBS溶液浸泡2次,每次5 min;滴加稀释的蛋白酶Κ工作液室温孵育8~10 min;PBS溶液浸泡5 min;4%多聚甲醇固定5 min;PBS溶液浸泡5 min,2次;滴加平衡酚冲液室温平衡5~10 min;滴加TdT酶反应液,37 ℃湿盒中避光孵育60 min;浸润2×SSC溶液,室温避光孵育15 min终止反应;PBS溶液浸泡3次,每次5min;DAPI室温避光染核8 min;PBS溶液浸泡3次,每次5 min;滴加抗淬灭剂后封片,使用荧光倒置显微镜观察、记录结果。各组随机选取5个视野计数细胞总数和阳性表达细胞数,阳性细胞百分比/%=阳性表达细胞数/总细胞×100%。
2.6 Western blot分析脑组织中蛋白的表达水平提取大鼠缺血侧大脑总蛋白,用SDS-聚丙烯酰胺凝胶电泳分离蛋白;转移凝胶上蛋白至PVDF膜上;5%BSA溶液室温封闭2 h;稀释后的一抗4 ℃摇床孵育孵育过夜;TBST洗涤3次,每次10 min;稀释1 000倍的二抗溶液室温孵育2 h;TBST洗涤3次,每次10 min;添加加ECL显色剂,显影。用凝胶图像处理系统Image Lab 6.0分析目标条带的灰度值,分别计算各组目的蛋白与内参β-actin灰度值的比值,并统计比较各组之间的差异。
2.7 统计学分析用SPSS 22.0统计软件进行统计学处理,数据采用x±s表示,各组间差异使用t检验和单因素方差分析。
3 结果 3.1 红景天苷对pMCAO大鼠脑梗死体积的影响与Sham组比较,pMCAO组大鼠脑组织缺血侧脑梗死体积显著增加(P < 0.01)。与pMCAO组相比,Sal连续给药6 d,能降低pMCAO大鼠缺血侧脑梗死体积(Fig 1),差异具有统计学意义(P < 0.01)。
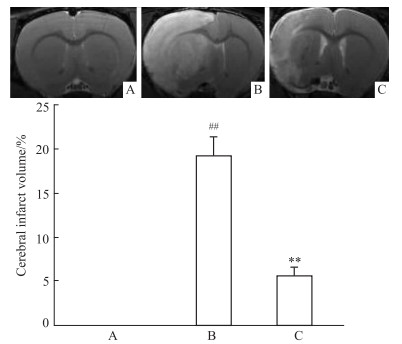
|
| Fig 1 Effect of salidroside on cerebral infarct volume in pMCAO rats (x±s, n=3) A:Sham; B:pMCAO; C: pMCAO +Sal; ##P < 0.01 vs sham, **P < 0.01 vs pMCAO |
与Sham组比较,Nissl染色镜检结果显示,pMCAO模型大鼠Nissl阳性细胞(即完整神经元)数目减少,经Sal作用后,Nissl阳性细胞数显著增多,且差异具有统计学意义(P < 0.01)(Fig 2)。
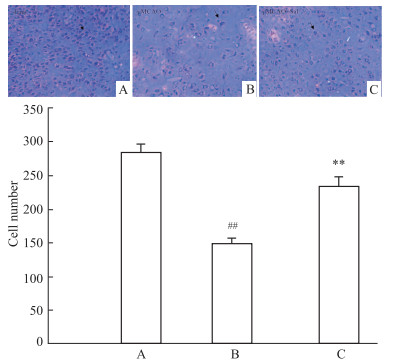
|
| Fig 2 Number of Nissl-positive cells on ischemic side of pMCAO model rats increased by salidroside (×400)(x±s, n=3) A:Sham; B:pMCAO; C: pMCAO +Sal; ##P < 0.01 vs sham, **P < 0.01 vs pMCAO |
与Sham组相比,TUNEL染色显示,pMCAO模型大鼠皮质细胞凋亡数目增多,经Sal连续给药6d后,皮质细胞凋亡数目显著减少,且差异具有统计学意义(P < 0.01)(Fig 3);与Sham组相比,Western blot结果表明,pMCAO模型大鼠缺血侧Cleaved caspase-3的蛋白表达明显升高(P < 0.01),经Sal连续给药6 d后,Cleaved caspase-3的蛋白表达降低(P < 0.01),但对总的Caspase-3的表达没有影响(Fig 4)。
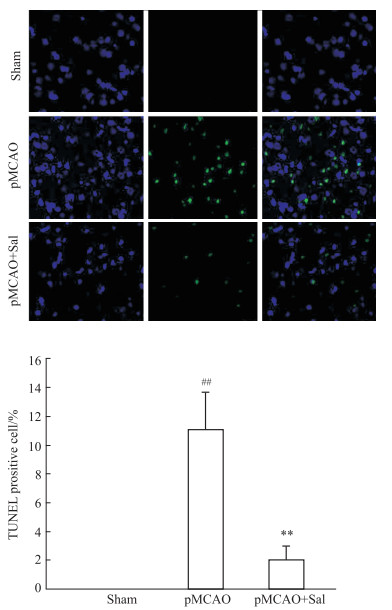
|
| Fig 3 Number of apoptotic cells in pMCAO model rats reduced by salidroside (x±s, n=3) ##P < 0.01 vs sham, **P < 0.01 vs pMCAO |
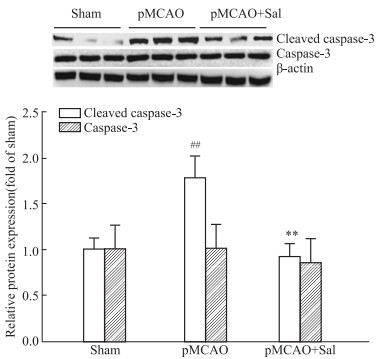
|
| Fig 4 Cleaved caspase-3 protein levels in ischemic side of pMCAO model rats reduced by salidroside (x±s, n=3) ##P < 0.01 vs sham, **P < 0.01 vs pMCAO |
与Sham组比较,Western blot结果表明,pMCAO模型大鼠缺血侧神经细胞标记物NeuN蛋白表达降低(P < 0.05),经Sal连续给药6 d后,能改善大鼠脑组织缺血侧神经细胞标记物NeuN蛋白表达,且差异有显著性(P < 0.05)。同时,与Sham组比较,pMCAO模型大鼠缺血侧脑组织神经营养因子家族成员NGF的蛋白表达明显降低(P < 0.01),经Sal连续给药6 d后,能逆转脑组织中NGF的蛋白表达,且差异具有显著性(P < 0.05), 见Fig 5。
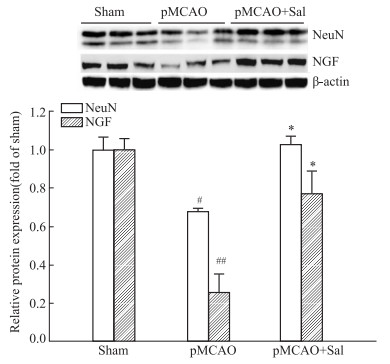
|
| Fig 5 Effect of salidroside on neuronal marker NeuN and neurotrophic factor NGF in ischemic side of pMCAO model rats (x±s, n=3) #P < 0.05, ##P < 0.01 vs sham, *P < 0.05 vs pMCAO |
中风始终是影响着人类健康最致命的疾病之一。在临床前的实验研究中常采用全脑缺血或局灶性脑缺血动物模型模拟临床上遇到的中风类型[9]。局灶性脑缺血是临床上最为常见的病例,故大多数实验研究中采用大脑中动脉闭塞模型模拟该疾病,大脑中动脉闭塞模型又分为短暂性大脑中动脉闭塞模型(tMCAO)和永久性大脑中动脉闭塞模型(pMCAO)[10]。课题组前期研究发现,在tMCAO模型中,Sal不仅具有良好的抗炎抗凋亡的神经保护作用,并且具备更优的治疗时间窗。根据最新国际脑卒中治疗学术会议,关于临床前研究的建议,需要选择多模型进行药效评价指标[7]。本实验动物造模采取研究脑缺血经典模型之一的pMCAO模型进行试验。使用线栓法制造模型后,大鼠表现出行走时原地转圈或向病灶对侧跌倒,自发行走困难,意识功能受损,经Sal连续给药6 d后,大鼠存活率得以改善,MRI检测发现,Sal能明显减少pMCAO模型大鼠脑梗死体积。尼氏体是神经元特征性的结构之一,主要功能是合成蛋白质,为神经活动所必需。尼氏体数量的多少和形态特征可以反映出神经元生长发育、物质转运及其功能活动正常与否[6]。实验发现pMCAO模型大鼠Nissl阳性细胞数目减少,经Sal作用后,能够有效抑制尼氏体损伤,起到神经保护作用。
脑缺血可以激活各种细胞死亡程序,例如坏死,凋亡或自噬相关细胞死亡,细胞凋亡被认为是脑缺血损伤的关键事件[10]。本研究通过TUNEL法标记凋亡细胞,发现pMCAO模型大鼠TUNEL阳性细胞数目增多,即细胞凋亡增加,经Sal作用后,TUNEL阳性细胞数目明显减少,表明Sal具有抑制神经细胞凋亡的作用。凋亡性细胞死亡由定型生化途径组成,涉及不同信号分子和caspase蛋白酶的激活。在大鼠中风或创伤性脑损伤后,活化的Caspase-3表达增加,即酶切以后的Caspase-3上调与健康神经胶质细胞的数量降低提示发生了细胞凋亡[11],这与我们的结果吻合。经Sal连续治疗6 d以后,能够减少pMCAO模型大鼠缺血侧Cleaved caspase-3的蛋白水平,但对总Caspase-3的的表达水平没有影响,表明Sal能抑制与Caspase-3相关的神经细胞凋亡。脑内促进神经生长因子与轴突的生长密切相关,神经元的存活及正常功能的维持依赖于神经营养因子,而NGF是神经营养因子家族中的重要成员[12],此外,增加的NGF表达可能有助于在急性脑损伤和中风早期观察到的神经炎症诱导的神经保护作用[13]。本研究结果表明,pMCAO模型大鼠缺血侧脑组织NGF的蛋白表达明显降低,同时,大鼠脑组织缺血侧神经细胞标记物NeuN[14]表达量也明显下降。经Sal连续治疗6 d以后,能够改善pMCAO模型大鼠脑组织缺血侧NeuN及NGF蛋白的表达,表明Sal对pMCAO模型大鼠具有神经保护作用,此作用与促进NGF蛋白的表达,进而提升神经细胞存活量有关。
综上,Sal通过下调Cleaved caspase-3的蛋白水平,促进NGF蛋白表达,进而改善神经细胞存活的的微环境,从而减轻pMCAO模型大鼠的脑梗死体积,改善神经细胞损伤,发挥神经保护的作用。该研究为Sal的临床前研究提供依据。
| [1] |
Zhang B, Saatman K E, Chen L. Therapeutic potential of natural compounds from chinese medicine in acute and subacute phases of ischemic stroke[J]. Neural Regen Res, 2020, 15(3): 416-24. doi:10.4103/1673-5374.265545 |
| [2] |
Barzegar M, Kaur G, Gavins F, et al. Potential therapeutic roles of stem cells in ischemia-reperfusion injury[J]. Stem Cell Res, 2019, 37: 101421. doi:10.1016/j.scr.2019.101421 |
| [3] |
黄鑫, 林昱, 杨泽霖, 等. 红景天苷抑制补体成分对脑缺血/再灌注大鼠的神经保护作用[J]. 中国药理学通报, 2019, 35(7): 967-72. Huang X, Lin Y, Yang Z L, et al. Neuroprotective effects of salidroside on complement composition in cerebral ichemia-reperfusion injury rats[J]. Chin Pharmacol Bull, 2019, 35(7): 967-72. doi:10.3969/j.issn.1001-1978.2019.07.016 |
| [4] |
宋百颖, 赖文芳, 苏燕青, 等. 红景天苷通过抑制补体C3的表达对MCAO大鼠缺血侧NeuN、Egr4影响的研究[J]. 中国药理学通报, 2017, 33(11): 1579-84. Song B Y, Lai W F, Su Y Q, et al. Effects of salidroside on expression of NeuN and Egr4 in ischemic side of MCAO Rats by inhibiting expression of C3[J]. Chin Pharmacol Bull, 2017, 33(11): 1579-84. doi:10.3969/j.issn.1001-1978.2017.11.020 |
| [5] |
赖文芳, 张小琴, 洪海棉, 等. 红景天苷对大鼠局灶性脑缺血/再灌注损伤的神经保护作用[J]. 中国药理学通报, 2015, 31(6): 775-80. Lai W F, Zhang X Q, Hong H M, et al. Neuroprotective effects of salidroside against focal celebral ischemia/reperfusion injury in rats[J]. Chin Pharmacol Bull, 2015, 31(6): 775-80. doi:10.3969/j.issn.1001-1978.2015.06.008 |
| [6] |
赖文芳.红景天苷对脑缺血再灌注损伤大鼠的保护作用及机制研究[D].福州: 福建中医药大学, 2016. Lai W F. Neurprotection of salidroside against middle cerebral artery occlusion injury in rats and its mechanism[D]. Fuzhou: Fujian Univ Tradit Chin Med, 2016. |
| [7] |
Fisher M, Feuerstein G, Howells D W, et al. Update of the stroke therapy academic industry roundtable preclinical recommendations[J]. Stroke, 2009, 40(6): 2244-50. doi:10.1161/STROKEAHA.108.541128 |
| [8] |
Longa E Z, Weinstein P R, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. |
| [9] |
Fluri F, Schuhmann M K, Kleinschnitz C. Animal models of ischemic stroke and their application in clinical research[J]. Drug Des Devel Ther, 2015, 9: 3445-54. |
| [10] |
Gong L, Tang Y, An R, et al. RTN1-C mediates cerebral Ischemia/Reperfusion injury via ER stress and mitochondria-associated apoptosis pathways[J]. Cell Death Dis, 2017, 8(10): e3080. doi:10.1038/cddis.2017.465 |
| [11] |
Glushakova O Y, Glushakov A A, Wijesinghe D S, et al. Prospective clinical biomarkers of caspase-mediated apoptosis associated with neuronal and neurovascular damage following stroke and other severe brain injuries: Implications for chronic neurodegeneration[J]. Brain Circ, 2017, 3(2): 87-108. |
| [12] |
Lang U E, Borgwardt S. Molecular mechanisms of depression: perspectives on new treatment strategies[J]. Cell Physiol Biochem, 2013, 31(6): 761-77. |
| [13] |
Song C, Zhang Y, Dong Y. Acute and subacute IL-1beta administrations differentially modulate neuroimmune and neurotrophic systems: possible implications for neuroprotection and neurodegeneration[J]. J Neuroinflammation, 2013, 10: 59. doi:10.1186/1742-2094-10-59 |
| [14] |
Belayev L, Hong S H, Menghani H, et al. Docosanoids promote neurogenesis and angiogenesis, blood-brain barrier integrity, penumbra protection, and neurobehavioral recovery after experimental ischemic stroke[J]. Mol Neurobiol, 2018, 55(8): 7090-106. doi:10.1007/s12035-018-1136-3 |