

2. 中国医学科学院药物研究所神经科学中心, 天然药物活性物质与功能国家重点实验室, 北京 100050
2. State Key Lab of Bioactive Substances and Functions of Natural Medicine, Neuroscience Center, Institute of Materia Medica, Chinese Academy of Medical Sciences, Beijing 100050, China
缺血性脑卒中由脑局部血供中断, 脑组织急性死亡及其诱发的一系列继发性神经损伤反应导致, 具有高致死、致残率[1]。因脑缺血导致的死亡人数占全世界死亡人数的9%, 其高致残率给社会及家庭带来巨大的经济负担。目前临床仅低于5%的患者可在缺血后3~4.5 h内接受溶栓治疗, 且由于出血转化风险较高, 溶栓治疗的临床应用受到极大的限制。提示我们对缺血性脑卒中内在机制的研究及寻找新的治疗药物极为迫切。
趋化素样因子1(chemokine-like factor 1, CKLF1)是我国科学家首次发现的新型趋化因子, 对单核细胞、淋巴细胞和中性粒细胞具有趋化活性, 参与多种炎症及免疫系统疾病的病理过程[2]。本课题组前期研究发现, 在大鼠短暂性大脑中动脉阻塞(middle cerebral artery occlusion, MCAO)造模后3 h, 损伤侧大脑中CKLF1的表达明显增加, 并在d 2达到峰值[3]。使用CKLF1抗体阻断可减少局灶性脑缺血大鼠的脑梗死面积, 具有神经保护功能[4]。CKLF1调节小胶质细胞/巨噬细胞向M1型极化, 并加重早期小鼠MCAO模型造成的缺血损伤[5-6]。提示我们, CKLF1在脑缺血损伤中发挥重要作用。
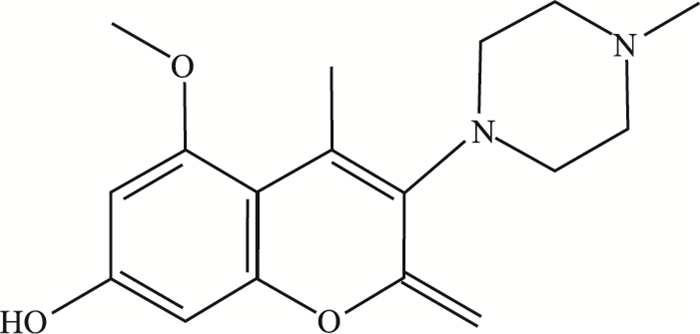
我们前期通过一系列化合物筛选及结构优化, 获得一种新型香豆素类衍生物IMM-H004(7-羟基-5-甲氧基-4-甲基-3-(4-甲基哌嗪-1-基)-香豆素), 其化合物结构如Fig 1所示。经体内、体外实验验证, IMM-H004在全脑缺血和脑缺血/再灌注模型造成的神经损伤中具有明显的神经保护作用[6]。且通过免疫共沉淀发现IMM-H004可抑制CKLF1与趋化因子受体4(C-C Motif chemokine receptor 4, CCR4)的结合[7], 但IMM-H004对CKLF1/CCR4在活细胞状态下的作用方式仍需进一步验证。
|
| Fig 1 Chemical structure of IMM-H004 |
双分子荧光互补技术(bimolecular fluorescence complementation, BiFC)通过将荧光蛋白分开, 与目标蛋白分别连接, 特定的条件下目标蛋白结合, 引起荧光蛋白重新组合, 恢复天然构象的特性来直观的反映蛋白间相互作用[8]。BiFC技术可用于监测活细胞中蛋白-蛋白相互作用, 可对基于蛋白受体、配体结合及调节蛋白质相互作用的药物进行有效的高通量筛选[9]。本文借助BiFC体系直观可视化CKLF1与CCR4的相互作用, 以及IMM-H004在神经元缺血损伤情况下对其结合的影响, 为研发以CKLF1/CCR4为靶点的药物提供进一步直观的证据, 并为其他基于蛋白相关作用的研究提供参考。
1 材料与方法 1.1 细胞本实验选用HEK293细胞株(购自ATCC, 本实验室长期留用)。
1.2 药品与试剂IMM-H004(本所合成室提供), 胰蛋白酶(Sigma, 批号:1596910), Lipofectamine 2000(Invitrogen, 批号:20280909), 限制性内切酶、T4连接酶及连接Buffer、10 × loading buffer(TaKaRa), Trans 5α感受态、Gelstain(全式金), 胎牛血清(批号:1652792)、DMEM培养基(批号:2043218)和OMEM培养基(批号:1869048)均购自美国Gibco公司, 其它各种化学试剂为进口或国产分析纯试剂。
1.3 主要仪器Thermo Forma 3110型二氧化碳培养箱, BD Spectra Max190酶标仪, Nikon Eclipse Ti倒置荧光显微镜。
1.4 细胞培养将HEK293细胞置于含10%胎牛血清的DMEM培养基, 于37 ℃、5% CO2的孵箱中培养。
1.5 氧糖剥夺/复氧模型(oxygen-glucose deprivation/reoxygenation, OGD/R)建立细胞处于对数生长期时, 将细胞以5×104个/孔接种于多聚赖氨酸包被的96孔板上, 培养24 h后换成终浓度为10 mmol·L-1 Na2S2O4无糖Earle’s培养液处理2 h后换回含血清DMEM培养基继续培养24 h。
1.6 CKLF1-BiFC载体构建 1.6.1 引物设计参照Genbank报道CCR4 N端的25个氨基酸和C27的CDS区设计寡核苷酸链, 分别添加SgfⅠ及MluⅠ酶切位点, 使用引物序列如Tab 1所示。
| Primer | Primer sequence (5′-3′) |
| hCCR4-N25-oligo1 | CGCATAACCCCACGGATATAGCAGACACCACCCTCGATG AAAGCATATACAGCAATTACTATCTGTATGAAAGTATCCA |
| hCCR4-N25-oligo2 | CGCGTGGATACTTTCATACAGATAGTAATTGCTGTATAT GCTTTCATCGAGGGTGGTGTCTGCTATATCCGTGGGGTT CATGCGAT |
| hCKLF1-c27-oligo1 | CGCGCCCTTATTTACCGGAAGCTTCTGTTCAATCCCAGC GGTCCTTACCAGAAAAAGCCTGTGCATGAAAAAAAAGA AGTTTTGTAAA |
| hCKLF1-c27-oligo2 | CGCGTTTACAAAACTTCTTTTTTTTCATGCACAGGCTTTT TCTGGTAAGGACCGCTGGGATTGAACAGAAGCTTCCGG TAAATAAGGGCGCGAT |
退火得到Oligo退火产物, 分别与SgfⅠ及MluⅠ双酶切pCMV6-VC155和pCMV6-VN173产物进行连接, 转化感受态Trans-5α, 提取质粒得pCMV6-CCR4-N25-VC155和pCMV6-C27-VN173, 以SgfⅠ及MluⅠ双酶切鉴定, CMV通用引物测序验证。
1.7 瞬时转染转染前1 d, 将细胞以5×104个每毫升接种于PLL包被的24孔板上d 2, 按照Invitrogen操作说明采用Lipofectamine 2000转染质粒。用OMEM培养基与质粒或Lipofectamine 2000单独混匀, 分别标为A、B管, 室温放置5 min。随后A、B管混匀, 室温静置20 min。吸弃原细胞培养基, 将混合液逐滴加入24孔板中, 放入培养箱中培养。转染6 h后换液。
采用共转染观察转染效率, 根据上述步骤, 24孔板中每个孔采用1μg pCMV6-C27-VN173和1 μg pCMV6-CCR4-N25-VC155共同转染HEK293细胞, 转染24 h后加入终浓度分别为0.1、1和10 μmol·L-1的IMM-H004, 置于37 ℃、5% CO2的孵箱中培养24 h, 采用倒置荧光显微镜观察各组荧光表达情况。
1.8 统计学分析数据采用Graph Pad Prism 7.0软件进行统计分析, 均以x±s形式表示, 两组以上差异采用单因素方差分析。
2 结果 2.1 CKLF1/CCR4 BiFC系统构建为构建基于BiFC的CKLF1/CCR4检测体系, 我们分别将CKLF1和CCR4的功能及结合区段克隆至BiFC系统的两个载体pCMV6-VN173和pCMV6-VC155。
CKLF1 C末端的27个氨基酸组成的分泌型肽段C27, 能与CCR4结合发挥作用, 具有类似于CKLF1的趋化活性[10], 其对γ干扰素(interferon-γ, IFN-γ)刺激的高表达CCR4的U937细胞以及在肺部炎症浸润情况下对嗜酸性粒细胞的作用都与CKLF1具有类似效应, 证明其可作为CKLF1模拟肽段。因此, 本研究中由C27代替CKLF1部分。
CCR4属于G蛋白偶联受体家族。CCR4结构的N端区域具有较高的保守性, 包括:P3-A7、D12-S14、S17和Y19, 是其主要的功能集中区[11], 且CCR4膜外N端是发挥与CKLF1结合功能的主要结构域, 因此本系统构建中采用CCR4 N端25个氨基酸代替全长CCR4。
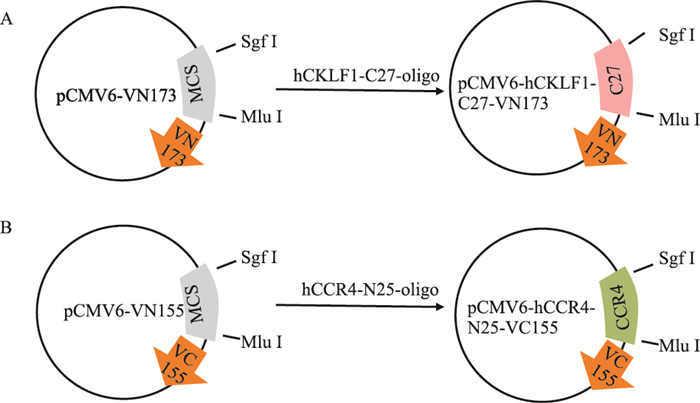
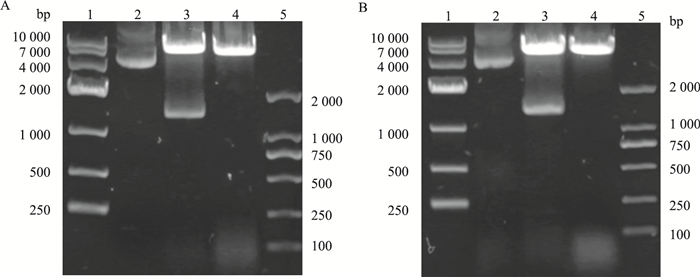
对BiFC系统的两个载体pCMV6-VN173和pCMV6-VC155进行结构改造, 将CKLF1 C27构建入pCMV6-VN173, 获得重组载体pCMV6-hCKLF1-C27-VN173;CCR4 N25构建入pCMV6-VC155载体中, 获得重组载体pCMV6-hCCR4-N25-VC155, 载体改造示意图如Fig 2所示。分别对重组载体进行SgfⅠ和MluⅠ双酶切鉴定, 目的片段较小, 仅80 bp左右, 且可看到与相应酶切后空载体琼脂糖电泳条带明显不同(Fig 3); 进一步对重组载体进行测序, 与hCKLF1-C27及CCR4-N25进行比对, 相似度100%(Fig 4), 证明重组载体构建成功。
|
| Fig 2 Construction of CKLF1/CCR4 BiFC system A: pCMV6-hCKLF1-C27-VN173;B: pCMV6-hCCR4-N25-VC155 |
|
| Fig 3 Restriction enzyme validation Electrophoresis of the vectors treated with or without SgfⅠ and MluⅠ. (A) 1: DL10000 DNA marker; 2: pCMV6-VN173; 3: pCMV6-VN173 with SgfⅠ and MluⅠ; 4: pCMV6-hCKLF1-C27-VN173 with SgfⅠ and MluⅠ; 5: DL2000 DNA marker. (B) 1: DL10000 DNA marker; 2: pCMV6-VC155; 3: pCMV6-VC155 with SgfⅠ and MluⅠ; 4: pCMV6-hCCR4-N25-VC155 with SgfⅠ and MluⅠ; 5: DL2000 DNA marker. |

|
| Fig 4 Sequencing results A: pCMV6-hCKLF1-C27-VN173. The horizontal line identifies the inserted hCKLF1-C27 sequence; B: pCMV6-hCCR4-N25-VC155. The horizontal line identifies the inserted hCCR4-N25 sequence. |
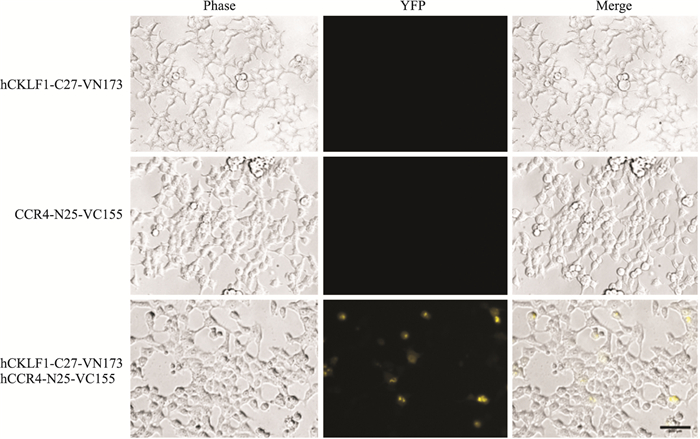
为验证CKLF1/CCR4-BiFC系统是否能够正常工作, 我们使用重组质粒转染HEK293细胞, 结果显示, 单独转染pCMV6-hCKLF1-C27-VN173以及pCMV6-hCCR4-N25-VC155载体后, 细胞无荧光表达, 而共转染pCMV6-C27-VN173和pCMV6-hCCR4-N25-VC155的细胞黄色荧光表达明显(Fig 5), 证明系统启动成功。
|
| Fig 5 BiFC signal of recombinant vector in HEK293 cells Scar bar=200 μm. |
本组前期文献报道, OGD/R损伤情况下, CKLF1与CCR4结合, 通过CKLF1/CCR4 BiFC系统可直观观察到相对于对照组, OGD/R造模后黄色荧光Venus的荧光强度增加(Fig 6), 表明OGD/R后CKLF1与CCR4的结合增加, 与之前结果相符。
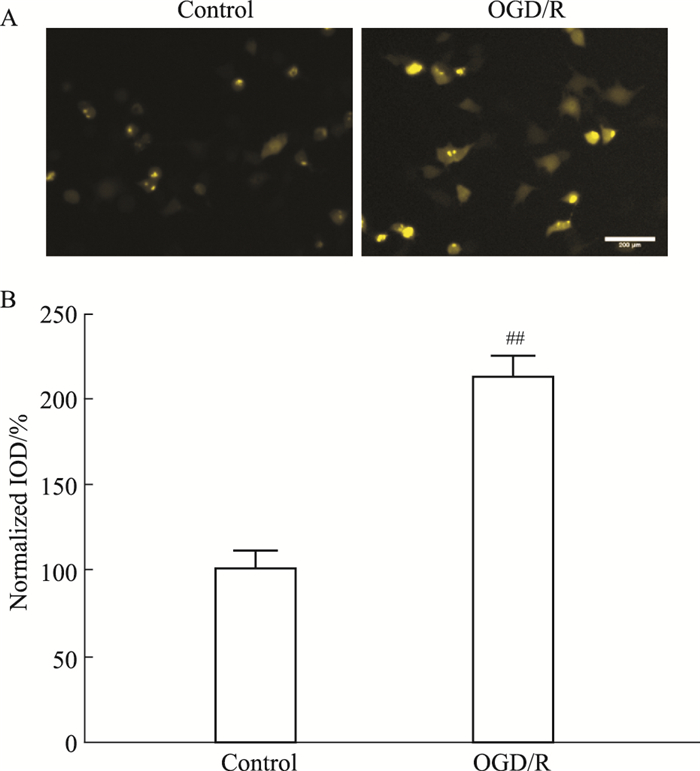
|
| Fig 6 System of CKLF1/CCR4 BiFC in OGD/R model Scar bar=200 μm (x±s, n=3 ##P < 0.01 vs Control group). |
为直观检测IMM-H004在OGD/R情况下对CKLF1及CCR4的影响, 在OGD/R造模后的各组分别加入溶剂对照或不同剂量IMM-H004, 观察Venus的荧光值。结果表明IMM-H004加入后可明显降低Venus的荧光水平(Fig 7), 直观证明IMM-H004可拮抗活细胞中OGD/R造模后CKLF1与CCR4的结合。
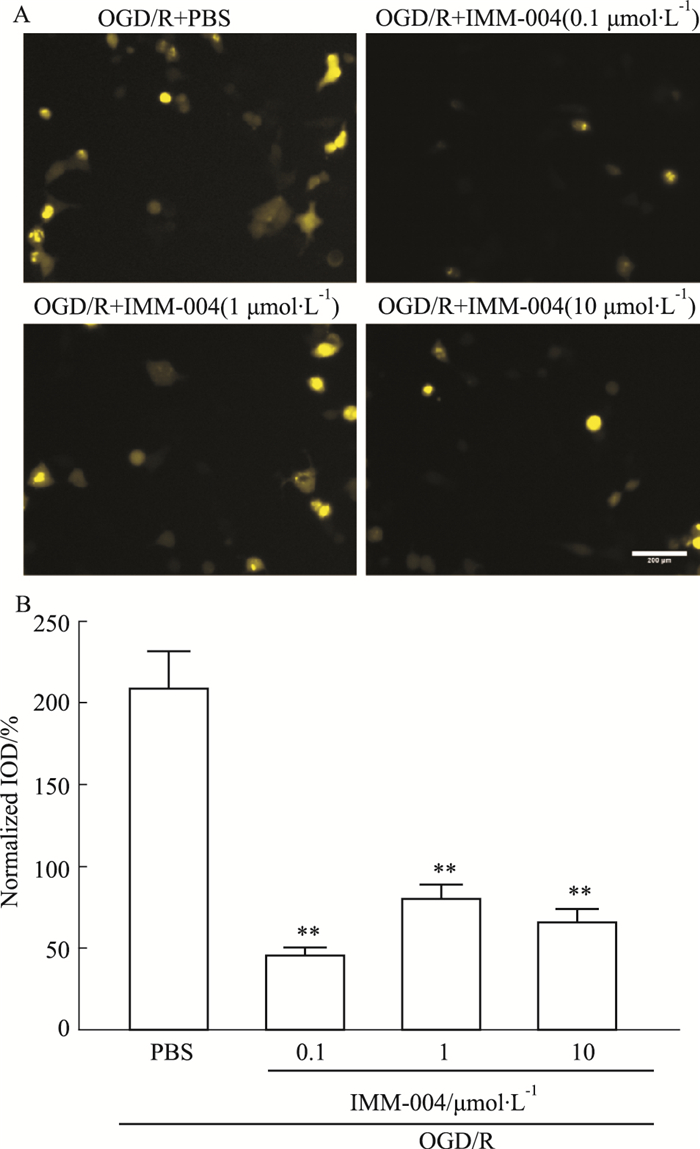
|
| Fig 7 System of CKLF1/CCR4 BiFC signal inhibited by IMM-H004 Scar bar=200 μm (x±s, n=3) **P < 0.01 vs PBS group). |
趋化因子属于一类具有多种免疫和神经功能的小分子分泌蛋白家族, 其在中枢神经系统中的受体与脑生理和病理相关, 参与许多中枢神经系统疾病的发生发展过程, CKLF1是我国科学家首次研究报道的新型趋化因子, 本组前期研究发现其在成人脑内生理状态下几乎无表达, 而在脑缺血后迅速表达, 与受体CCR4结合发挥损伤功能, 而CKLF1抗体阻断后可明显缓解脑损伤[4]。在此基础上本组合成并优化香豆素类衍生物IMM-H004, 发现其可能通过阻断CKLF1与CCR4结合发挥功能[7], 为了进一步在活细胞水平可视化验证, 我们构建了CKLF1/CCR4 BiFC系统, 对之前实验结果进一步验证。
BiFC技术可以在活细胞中直观的反映蛋白质与蛋白质之间的相互作用, 本研究采用的是基于Venus的BiFC系统。将正常的荧光蛋白Venus的N端173残基和C端155残基处截断, 获得两个荧光蛋白片段VN173和VC155, 文献报道, 相较于其他黄色荧光蛋白变体, 基于Venus的VN173和VC155组合具有更高的荧光强度和特异性[12], 是在生理条件下应用最广泛的荧光蛋白[8, 13]。其作用原理是由于偶联在VN173和VC155的目标蛋白发生相互作用, 拉近二者的距离, 使其受到激发后产生荧光, 从而实现在活细胞中蛋白质间的相互作用的可视化。我们将BiFC系统进行载体改造, 将CKLF1趋化活性类似肽段C27及其受体CCR4分别接入Venus的N端和C端, 实现直观可视化判断C27与CCR4在活细胞中的定位和相互作用。我们的结果证明成功构建CKLF1-CCR4-BiFC系统后, 进行OGD/R造模, C27与CCR4结合明显增加, 系统荧光表达增加, IMM-H004处理后, 荧光表达受到有效抑制, 提示CKLF1与CCR4结合明显降低, 在活细胞状态下验证IMM-H004可拮抗CKLF1/CCR4的结合。为IMM-H004的神经保护机制提供理论依据。为活细胞状态下蛋白结合可视化的检测提供参考。
| [1] |
张业昊, 姚明江, 刘建勋. 缺血性脑血管病的现代研究进展[J]. 中国药理学通报, 2019, 35(9): 1185-8. Zhang Y H, Yao M J, Liu J X. Advances in modern research on ischemic cerebrovascular diseases[J]. Chin Pharmacol Bull, 2019, 35(9): 1185-8. doi:10.3969/j.issn.1001-1978.2019.09.001 |
| [2] |
Han W, Lou Y, Tang J, et al. Molecular cloning and characterization of chemokine-like factor 1 (CKLF1), a novel human cytokine with unique structure and potential chemotactic activity[J]. Biochem J, 2001, 357(Pt 1): 127-35. |
| [3] |
Kong L L, Hu J F, Zhang W, et al. Expression of chemokine-like factor 1 after focal cerebral ischemia in the rat[J]. Neurosci Lett, 2011, 505(1): 14-8. doi:10.1016/j.neulet.2011.09.031 |
| [4] |
Kong L L, Wang Z Y, Han N, et al. Neutralization of chemokine-like factor 1, a novel C-C chemokine, protects against focal cerebral ischemia by inhibiting neutrophil infiltration via MAPK pathways in rats[J]. J Neuroinflammation, 2014, 11: 112. doi:10.1186/1742-2094-11-112 |
| [5] |
Chen C, Ai Q, Chu S, et al. IMM-H004 protects against oxygen-glucose deprivation/reperfusion injury to BV2 microglia partly by modulating CKLF1 involved in microglia polarization[J]. Int Immunopharmacol, 2019, 70: 69-79. doi:10.1016/j.intimp.2019.02.012 |
| [6] |
Chen C, Chu S F, Ai Q D, et al. CKLF1 aggravates focal cerebral ischemia injury at early stage partly by modulating microglia/macrophage toward M1 polarization through CCR4[J]. Cell Mol Neurobiol, 2019, 39(5): 651-69. doi:10.1007/s10571-019-00669-5 |
| [7] |
Ai Q D, Chen C, Chu S, et al. IMM-H004 therapy for permanent focal ischemic cerebral injury via CKLF1/CCR4-mediated NLRP3 inflammasome activation[J]. Transl Res, 2019, 212: 36-53. doi:10.1016/j.trsl.2019.05.007 |
| [8] |
Miller K E, Kim Y, Huh W K, Park H O. Bimolecular fluorescence complementation (BiFC) analysis: advances and recent applications for genome-wide interaction studies[J]. J Mol Biol, 2015, 427(11): 2039-2055. doi:10.1016/j.jmb.2015.03.005 |
| [9] |
Kerppola T K. Bimolecular fluorescence complementation (BiFC) analysis as a probe of protein interactions in living cells[J]. Annu Rev Biophys, 2008, 37: 465-87. doi:10.1146/annurev.biophys.37.032807.125842 |
| [10] |
Wang Y, Zhang Y, Han W, et al. Two C-terminal peptides of human CKLF1 interact with the chemokine receptor CCR4[J]. Int J Biochem Cell Biol, 2008, 40(5): 909-19. doi:10.1016/j.biocel.2007.10.028 |
| [11] |
赵芳.基于新型细胞因子CKLF1-CCR4小分子抑制剂的设计、合成与筛选[D].沈阳: 沈阳药科大学, 2009. Zhao F. Design, Synthesis and screening of CCR4 antagonists based on a novel cytokine CKLF1[D]. Shenyang: Shenyang Pharmaceutical University, 2009. |
| [12] |
Shyu Y J, Liu H, Deng X, Hu C D. Identification of new fluorescent protein fragments for bimolecular fluorescence complementation analysis under physiological conditions[J]. Biotechniques, 2006, 40(1): 61-6. doi:10.2144/000112036 |
| [13] |
Hu C D, Chinenov Y, Kerppola T K, et al. Visualization of interactions among bZIP and Rel family proteins in living cells using bimolecular fluorescence complementation[J]. Mol Cell, 2002, 9(4): 789-98. doi:10.1016/S1097-2765(02)00496-3 |

