

非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)疾病谱包括单纯性肝脂肪变, 非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH),肝硬化和肝细胞癌[1]。水飞蓟素(Silymarin)作为从水飞蓟果实中分离得到的一种黄酮类抗氧化剂被认为是治疗各种肝病的抗肝毒性药物[2]。NOD样受体家族3(NOD-likereceptorprotein3,NLRP3)炎症体在NASH中的重要作用在以往研究中受到了肯定[3],其中心作用是激活含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase-1,caspase-1/casp1 P45),产生具有活性的cleaved caspase-1(Casp1 p20),后者可以使促炎细胞因子IL-1β和IL-18被剪切而具有生物活性[4]。乙酰化的α-微管蛋白可促进NLRP3炎症体的激活,而NAD依赖的α-微管蛋白去乙酰化酶Sirtuin2(SIRT2)可以使乙酰化的α-微管蛋白去乙酰化[5]。在NASH研究中,核因子E2相关因子2(nuclear factor erythroid 2 related factor 2,Nrf2)越发受到关注,转录激活数十个细胞保护基因的表达,如半氧合酶-1(hemeoxygenase1,HO-1)和NAD(P)H-醌氧化还原酶-1(NAD(P)Hdehydrogenase[quinone]1,NQO1)的表达,以消除氧化应激和炎症[6]。有研究表明,活性氧簇(reactive oxygen species,ROS)连接Nrf2和NLRP3炎症激活,由于NLRP3炎症体的激活需要ROS,因此减少ROS产生可以对抗NLRP3炎症和炎症[7]。本文拟探讨Silymarin是否通过影响NLRP3来干预NASH的疾病进程和发展,并想进一步探究Silymarin是否可以通过上调Nrf2而减少ROS,以降低NLRP3的激活来干预NASH的进展。
1 材料 1.1 药物与试剂棕榈酸(PA)(86683-25-2)购自美国Sigma公司,脂多糖(LPS) (L8880)购自中国Solarbio公司,Silymarin(T6670)购自美国Target Mol公司,水飞蓟素胶囊购自德国马博士大药厂,Reverse Transcriptase kit(RR047A)、SYBR Premix Ex Taq TM(RR420A)购自日本TaKaRa公司,Western一抗稀释液与IP细胞裂解液购自江苏碧云天有限公司,Nrf2(16396-1-AP)、caspase-1/P20(22915-1-AP)、SIRT2(66410-1-Ig)抗体购自中国Proteintech公司,NLRP3(AF4620)抗体购自美国Affinity公司,Nrf2-siRNA及NC-siRNA购自上海吉玛公司,Lipofectamine2000转染试剂购自美国Invitrogen公司。
1.2 仪器酶标仪(深圳雷杜公司),分光光度计(美国Bio-Rad公司),ImageQuantLAS4000mini成像仪(美国GE公司),SDS-PAGE垂直电泳/电转系统(上海天能科技有限公司),普通PCR仪、Step OnePlus荧光定量PCR仪(美国Applied Biosystems公司)。
2 方法 2.1 细胞培养人肝癌细胞HepG2受赠于华侨大学。用含有10%胎牛血清的DMEM培养液,在5% CO2、37 ℃条件下培养。当细胞长至培养皿底部80%时,用胰酶消化并接种至孔板中,待细胞长至孔板底部80%时,弃去旧培养液,进行药物处理。
2.2 转染处理用胰酶消化并接种至孔板中,待细胞长至孔板底部50%时,弃去旧培养液,按100pmol siRNA(siNC/ siNrf2-1/ siNrf2-1)与5 μL lipo2000比例混匀孵育,加入已混合孵育好的lipo2000- siRNA,6 h后换液。24 h后用PCR评估转染效果,筛选出干扰效率最佳的一个siRNA,并用其进行后续药物处理实验。
2.3 药物处理CON组予溶剂对照处理24 h,PL组予PA(100 μmol·L-1)、LPS(1 mg·L-1)与溶剂对照处理24 h,SB组为Silymarin(50 μmol·L-1)预处理30 min后继续加PA、LPS处理24 h,PLsi组予Nrf2-siRNA处理6 h后换液继续予PA、LPS处理24 h,SBsi予Nrf2-siRNA处理6 h后换液予Silymarin(50 μmol·L-1)预处理30 min后继续加PA、LPS处理24 h。每次实验每组设3个重复孔,重复实验3次。
2.4 Western blot检测Nrf2、SIRT2、NLRP3、pro Caspase-1及cleaved caspase-1 P20蛋白蛋白表达内参选用β-actin,细胞分组培养24 h后,收集HepG2细胞提取蛋白。按BCA蛋白定量试剂盒说明书测定蛋白浓度,调至等蛋白总量后上样,恒压80 V电泳,30 min后改为恒压120 V至电泳结束; 将蛋白电转至PVDF膜上,5%脱脂奶粉室温封闭后洗膜,加入相应一抗,4 ℃孵育过夜后洗膜,加入相应二抗室温孵育2 h,洗膜后显色,使用凝胶成像系统拍照分析。
2.5 qPCR检测Nrf2、NQO-1、HO-1的mRNA表达水平mRNA内参选用GADPH,测定方法:以TRIzol裂解HepG2细胞,氯仿抽提,异丙醇沉淀,75%乙醇洗涤,以DEPC水溶解,后应用分光光度计测定总RNA水平与纯度,cDNA合成、PCR扩增具体步骤依据TakaRa试剂盒说明书进行。引物序列(正向和反向)为:GAPDH:5′ AAATGGTGAAGGTCGGTGTGAAC 3′和5′ CAACAATCTCCACTTTGCCACTG 3′;Nrf2:5′ ACGGTATGCAACAGGACATTGAGC 3′和5′ TTGGCTTCTGGACTTGGAACCATG 3′;HO-1:5′ CCTCCCTGTACCACATCTATGT 3′和5′ GCTCTTCTGGGAAGTAGACAG 3′;NQO-1:5′ GTCGGCAGAAGAGCACTGG 3′和5′ CGACTCCACCTCCCATCC 3′。
2.6 ROS检测细胞分组处理过后去除细胞培养液,加入适当体积稀释好的DCFH-DA。37 ℃细胞培养箱内孵育20分钟后用无血清细胞培养液洗涤细胞3次,用激光共聚焦显微镜直接观察,参数设置使用488 nm激发波长,525 nm发射波长,实时或逐时间点检测刺激前后荧光的强弱。
2.7 动物饲养与处理C57BL/6J小鼠18只,6~8周龄,均为雄性,体质量(18~22)g,购自北京华阜康生物科技股份有限公司,合格证号:SCXK(京)2014-0004。实验前适应性饲养1周,温度(20~25)℃,相对湿度40%~60%。分为3组,每组6只,CON组为对照组,普通饮食饮水,HFD组为模型组,高脂、高果糖饮食(HFD),SB组为用药组,同HFD喂养。饲养20周后,给予SB组水飞蓟素(100 mg·kg-1)灌胃,余组用同等体积溶剂对照灌胃,灌胃时间为12周。12周后取材。本实验中所涉及到的实验动物均符合伦理委员会的相关规定。
2.8 小鼠肝脏形态学观察将各组实验动物麻醉后手术打开腹腔,取出肝脏,制备肝脏组织石蜡切片,苏木精-伊红(HE)染色,在光镜下观察小鼠肝脏病理学改变。
2.9 IHC检测取小鼠左肝组织石蜡切片,滴加NLRP3一抗,孵育后滴加二抗生物素化山羊抗兔液,DAB显色,苏木精复染细胞核。用乙醇逐步脱水,中性树胶封片,显微镜观察。
2.10 统计学方法所有数据均用SPSS22软件进行统计分析计量资料以x±s表示,所有数据均进行方差齐性检验。两组间比较行独立样本t检验;多组间比较行单因素方差分析,显著性水准α取0.05,双侧。
3 结果 3.1 Silymarin对于HepG2中Nrf2,ROS以及NLRP3炎症小体通路的影响Fig 1与Fig 2的结果显示,与CON组相比,PL组在(PA+LPS)的干预后,HepG2细胞的Nrf2、SIRT2分别与内参β-actin蛋白表达量之比值是下降的,而NLRP3、Casp1 P20分别与内参蛋白表达量之比值和ROS的检测荧光IOD值是增加的,其中SIRT2、NLRP3与Casp1 P20相对表达量和ROS的检测荧光IOD值与CON组相比具有显著性的差异(P < 0.05)。与PL组相比,在同样(PA+LPS)的干预后,SB组加用Silymarin用药后,SB组HepG2细胞的Nrf2与SIRT2相对蛋白表达量上升,而NLRP3、Casp1 p20相对蛋白表达量和ROS的检测荧光IOD值下降,差异均具有显著性(P < 0.05)。提示Silymarin可增强HepG2中Nrf2抗氧化以及抑制NLRP3炎症小体来发挥抗细胞损伤作用。
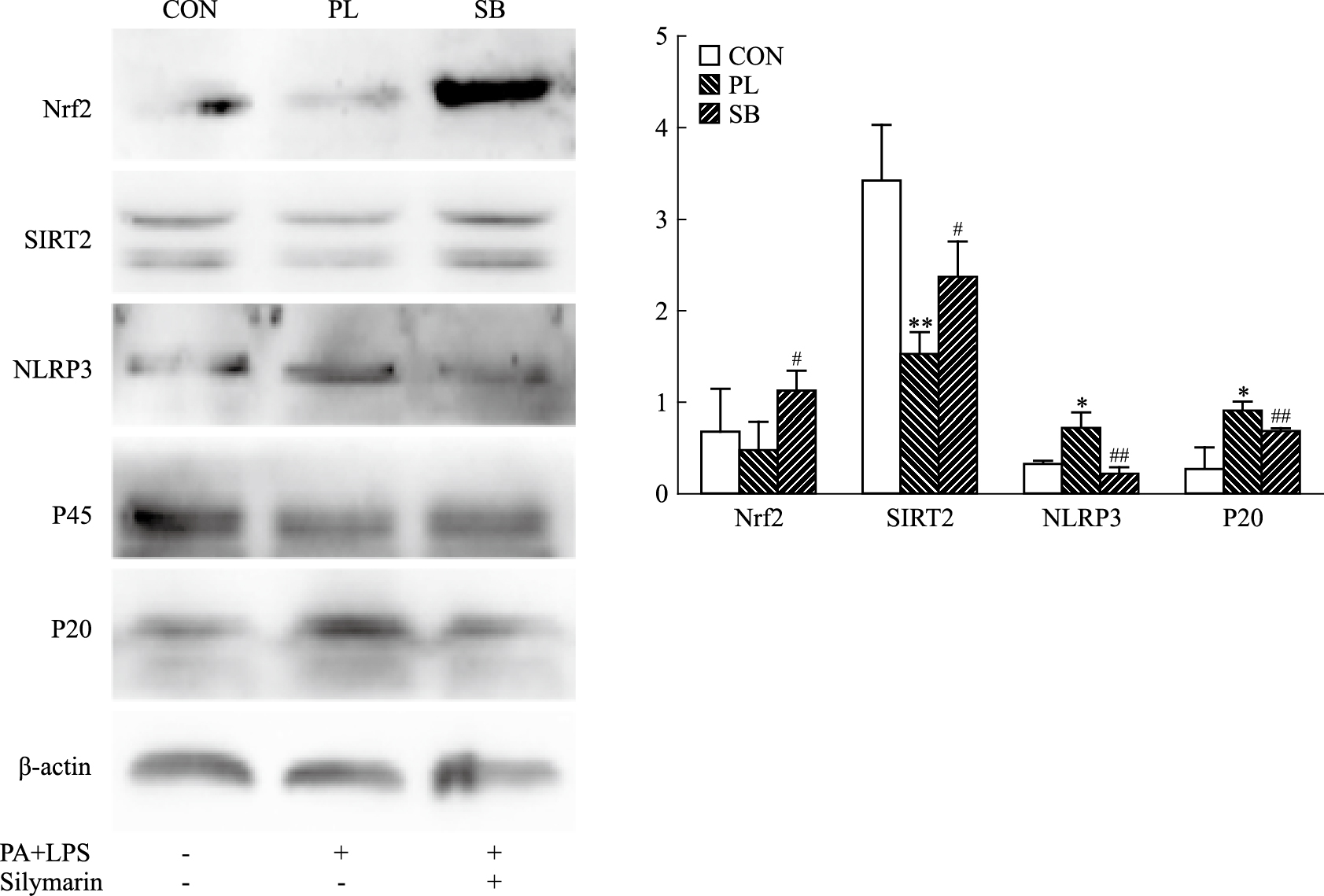
|
| Fig 1 Effect of Silymarin on Nrf2-ROS-NLRP3 axis related protein in(PA+LPS) induced HepG2 cells (x±s, n=3) *P < 0.05, **P < 0.01 vs CON group; #P < 0.05, ##P < 0.01 vs PL group |
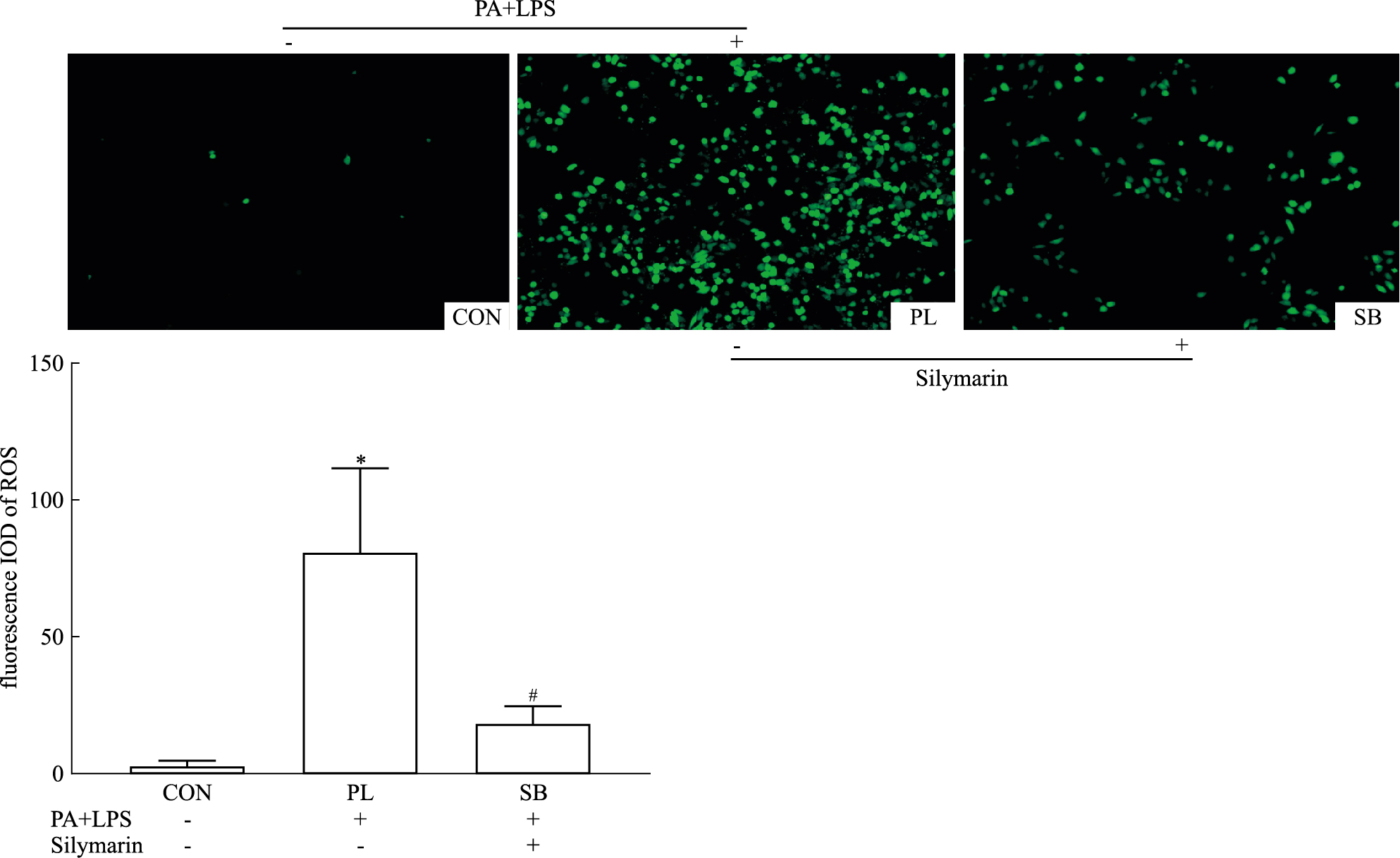
|
| Fig 2 Effect of Silymarin on ROS fluorescence in(PA+LPS) induced HepG2 cells (x±s, n=3) *P < 0.05 vs CON group; #P < 0.05 vs PL group |
Fig 3的结果显示,在转染中,siNrf2-2片段干扰后的Nrf2的mRNA表达量减少最明显,即沉默效果最好。故选取siNrf2-2用作后续实验,转染实验条件同前。在Fig 3的结果中,与PL组相比,SB组HepG2细胞的Nrf2、HO-1与NQO-1分别与内参GAPDH的mRNA表达量公式校准后得到的值上升,差异均具有显著性(P < 0.05)。与SB组相比,SBsi组HepG2细胞的Nrf2、HO-1与NQO-1的相对mRNA表达量是下降的,差异均具有显著性(P < 0.05)。提示Silymarin可增强HepG2中Nrf2抗氧化以及抑制NLRP3炎症小体来发挥抗细胞损伤作用,在用siRNA特异性抑制了Nrf2蛋白功能后,Silymarin对于NLRP3的抑制减弱,提示Silymarin通过调控Nrf2的功能来抑制NLRP3炎症小体。

|
| Fig 3 Effect of Silymarin and Nrf2-siRNA on Nrf2 pathwayrelated mRNA in(PA+LPS) induced HepG2 cells (x±s, n=3) *P < 0.05, **P < 0.01 vs CON group; #P < 0.05, ##P < 0.01 vs PL group; △P < 0.05, △△P < 0.01 vs SB group |
Fig 4与Fig 5的结果显示,与SB组相比,在用siRNA特异性抑制Nrf2之后,SBsi组的HepG2细胞的Nrf2与SIRT2的相对蛋白表达量下降,而NLRP3和Casp1 p20蛋白表达量以及ROS的检测荧光IOD值上升,差异均具有显著性(P < 0.05)。结果表明在特异性抑制了Nrf2蛋白功能后,Silymarin对于NLRP3的抑制减弱,提示Silymarin通过调控Nrf2的功能来抑制NLRP3炎症小体。
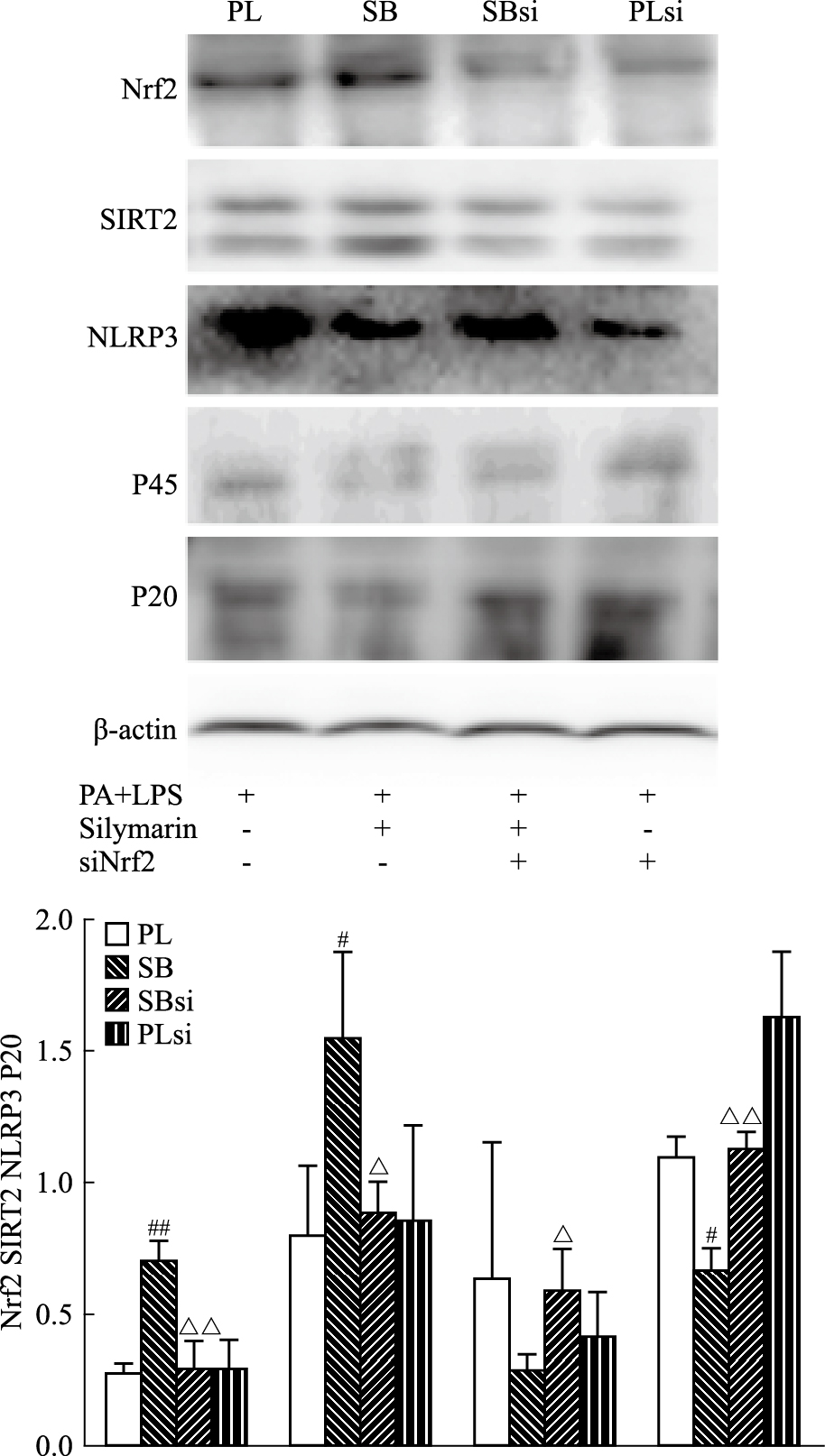
|
| Fig 4 Effect of Silymarin and Nrf2-siRNAon Nrf2-ROS-NLRP3 axis related proteinin(PA+LPS) induced HepG2 cells (x±s, n=3) #P < 0.05, ##P < 0.01 vs PL group; △P < 0.05, △△P < 0.01 vs SB group |
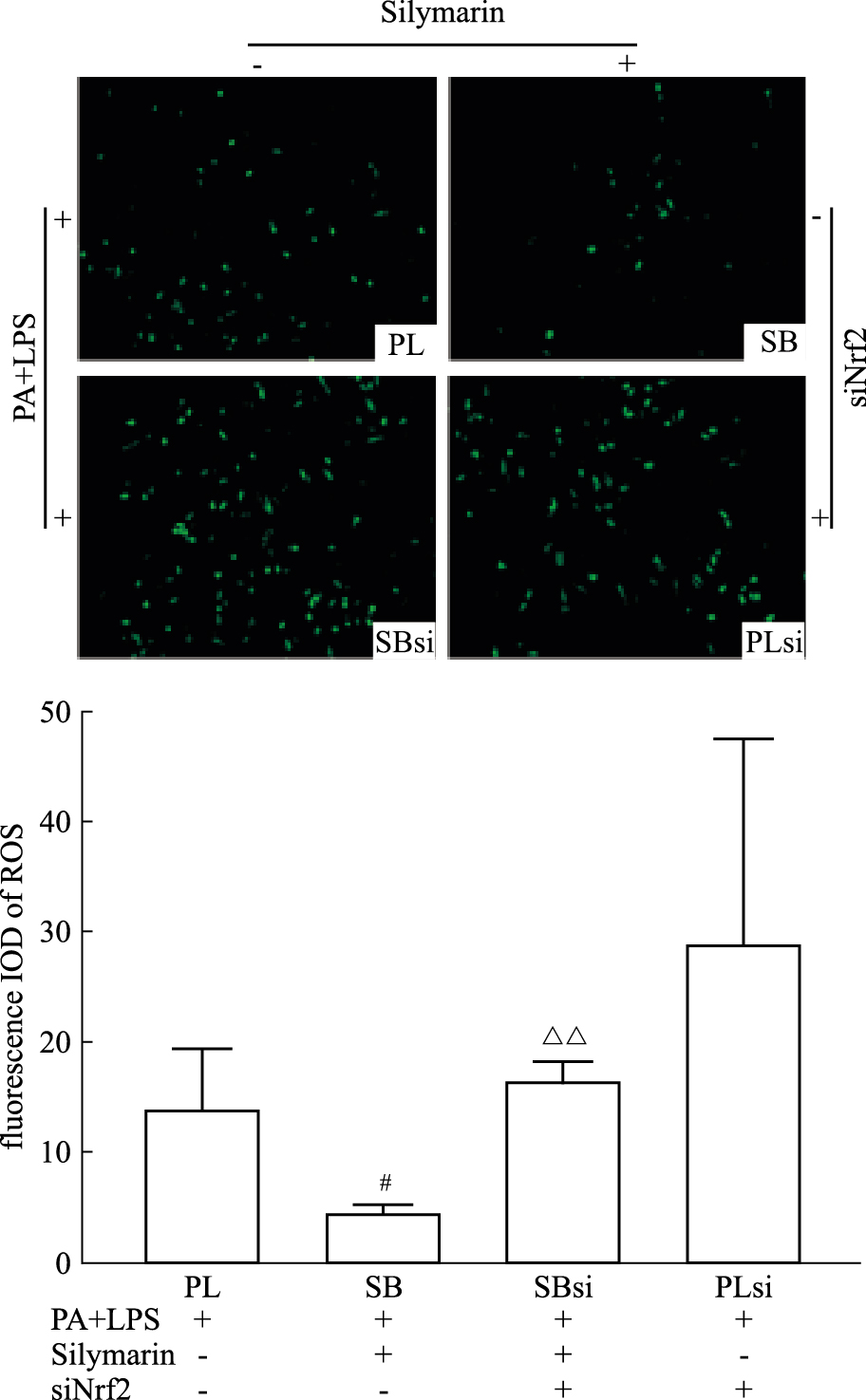
|
| Fig 5 Effect of Silymarin and Nrf2-siRNA on ROSfluorescence in(PA+LPS) induced HepG2 cells (x±s, n=3) #P < 0.05 vs PL group; △△P < 0.01 vs SB group |
Fig 6的结果显示,HFD干预小鼠后,HFD组小鼠体质量与CON组相比是增加的,差异具有显著性(P < 0.05),病理学主要表现有大量肝细胞脂肪样变,可见小叶内灶性炎性反应和肝细胞坏死以及肝细胞气球样变。这与临床上NASH病理特征相符,Silymarin干预后,SB组小鼠体质量相比较HFD组是下降的,差异具有显著性(P < 0.05),病理表现与HFD组相比,肝细胞脂肪样变及小叶内灶性炎性反应等病变均明显减少。证明疾病模型以及用药模型建模成功。

|
| Fig 6 Effect of Silymarin on HE and body weight and liver weight (x±s, n=6) **P < 0.01 vs CON group; ##P < 0.01 vs HFD group |
Fig 7的结果显示,在HFD干预之后,HFD组小鼠体肝脏石蜡切片的免疫组化实验显示肝脏组织中NLRP3蛋白表达量与CON组相比是上升的,差异均具有显著性(P < 0.05)。同样条件下的HFD干预再加用Silymarin的药物治疗后,SB组小鼠免疫组化实验显示肝脏组织中NLRP3蛋白表达量与HFD组相比是下降的,差异均具有显著性(P < 0.05)。提示Silymarin抑制小鼠肝脏中NLRP3炎症小体来发挥抗肝细胞损伤作用。

|
| Fig 7 Effect of Silymarin on NLRP3 protein in mouse liver (x±s, n=6) *P < 0.05, **P < 0.01 vs CON group; ##P < 0.01 vs HFD group |
NAFLD是世界范围内最重要的肝病病因之一,如有炎症或者纤维化被认为是晚期,晚期肝病中具有一定的进展,包括:NASH、肝硬化和肝细胞癌[8-9]。目前探讨更为安全有效的抗NAFLD发生、发展的药物是目前研究的热点之一。
水飞蓟素是1959年发现的一种草本乳蓟种子提取物中的主要活性成分,已被证明是一种具有减轻代谢综合征、保护肝脏等特性的药物[9-10]。有研究表明[11-12],Silymarin通过抑制NLRP3、NF-κB信号通路来保护LPS诱导的急性肺损伤,还有研究表明其可调节硫氧还蛋白/硫氧还蛋白相互作用蛋白复合物,从而抑制NLRP3炎症小体活化来减轻百草枯诱导的巨噬细胞毒性。但是其在NASH治疗过程中的机制有待更多探讨,NLRP3炎症小体在NASH中的重要作用在以往研究中受到了肯定,故其与NLRP3炎症同路的关系需进一步证实。
为了验证Silymarin在NASH上取得的治疗效果是通过抑制NLRP3炎症小体起作用的,本实验用(PA+LPS)干预HepG2细胞,再加Silymarin用药后,实验结果是ROS、NLRP3与Casp1 P20表达量相对于单用(PA+LPS)组下降,而Nrf2与SIRT2表达上升,差异均具有显著性(P < 0.05),这个实验结果提示Silymarin可增强HepG2中Nrf2抗氧化以及抑制NLRP3炎症小体来发挥抗细胞损伤作用。为了进一步论证Silymarin是否是通过Nrf2来抑制NLRP3,使用小干扰RNA特异性抑制Nrf2,实验结果表明,在特异性抑制了Nrf2后,HepG2细胞的Nrf2与SIRT2蛋白表达量上升,而NLRP3、Casp1 p20和ROS表达量下降,差异均具有显著性(P < 0.05),实验结果表明在特异性抑制了Nrf2后,Silymarin对于NLRP3炎症小体的抑制作用明显减弱,提示Silymarin通过调控Nrf2的功能来抑制NLRP3炎症小体。且在动物实验中,用药组NLRP3的表达下降,进一步证实了Silymarin能抑制NLRP3炎症小体功能来抑制NASH的疾病发展。综上所述,Silymarin可通过调控Nrf2的功能来抑制NLRP3炎症小体来发挥抗细胞损伤及抗组织损伤作用,从而发挥改善非酒精性脂肪性肝病病情的药效。
在以往研究中表明,NLRP3炎性小体可被多种危险信号激活,这些信号不仅来自微生物,还来自代谢失调。ROS的产生导致了NLRP3炎症小体的激活,通过释放其抑制剂硫氧还蛋白中对ROS敏感的NLRP3配体与硫氧还蛋白相互作用蛋白。而SIRT2的活性,可以使乙酰化的α-微管蛋白去乙酰化,而乙酰化的α-微管蛋白促进了NLRP3炎症体的激活,继而产生具有活性的Casp1 p20,后者继续促炎细胞因子IL-1β和IL-18被剪切并以成熟形式分泌,促进炎症过程。可以看出目前的研究表明ROS和SIRT2主要是参与NLRP3炎症小体的组装以及激活过程[5, 13-15],而NLRP3的促进以及抑制机制有待更多深入研究,故Silymarin和Nrf2在NLRP3炎症小体调控网络以及NASH疾病治疗中的具体作用也有待更多切入点的思考和实验探索、验证。并且Nrf2与NLRP3分别作为抗氧化与炎症进程中的明星分子,在NASH发病机制和进展过程的具体作用方式有待更多研究,以帮助减轻由氧化应激、炎症反应等因素给疾病进展带来的不良后果。
| [1] |
中华医学会肝病学分会脂肪肝和酒精性肝病学组, 中国医师协会脂肪性肝病专家委员会. 非酒精性脂肪性肝病防治指南(2018更新版)[J]. 现代医药卫生, 2018, 34(5): 641-9. Fatty liver and alcoholic liver disease group, hepatology branch of chinese medical association, Fatty liver disease expert committee of chinese physicians association. Guidelines for the prevention and treatment of non-alcoholic fatty liver disease(updated in 2018)[J]. Mod Med Health, 2018, 34(5): 641-9. doi:10.3969/j.issn.1009-5519.2018.05.001 |
| [2] |
Trappoliere M, Caligiuri A, Schmid M, et al. Silybin, a component of sylimarin, exerts anti-inflammatory and anti-fibrogenic effects on human hepatic stellate cells[J]. J Hepatol, 2009, 50(6): 1102-11. doi:10.1016/j.jhep.2009.02.023 |
| [3] |
Mridha A R, Wree A, Robertson A A B, et al. NLRP3 inflammasome blockade reduces liver inflammation and fibrosis in experimental NASH in mice[J]. J Hepatol, 2017, 66(5): 1037-46. doi:10.1016/j.jhep.2017.01.022 |
| [4] |
Shen H H, Yang Y X, Meng X, et al. NLRP3: a promising therapeutic target for autoimmune diseases[J]. Autoimmun Rev, 2018, 17(7): 694-702. doi:10.1016/j.autrev.2018.01.020 |
| [5] |
Misawa T, Takahama M, Kozaki T, et al. Microtubule-driven spatial arrangement of mitochondria promotes activation of the NLRP3 inflammasome[J]. Nat Immunol, 2013, 14(5): 454-60. doi:10.1038/ni.2550 |
| [6] |
Hu Q, Zhang T, Yi L, et al. Dihydromyricetin inhibits NLRP3 inflammasome-dependent pyroptosis by activating the Nrf2 signaling pathway in vascular endothelial cells[J]. Biofactors, 2017, 44(2): 123-36. |
| [7] |
Hennig P, Garstkiewicz M, Grossi S, et al. The crosstalk between Nrf2 and inflammasomes[J]. Int J Mol Sci, 2018, 19(2): 562. doi:10.3390/ijms19020562 |
| [8] |
Younossi Z, Anstee Q M, Marietti M, et al. Global burden of NAFLD and NASH: trends, predictions, risk factors and prevention[J]. Nat Rev Gastroenterol Hepatol, 2018, 15(1): 11-20. |
| [9] |
Zhang Y, Hai J, Cao M, et al. Silibinin ameliorates steatosis and insulin resistance during non-alcoholic fatty liver disease development partly through targeting IRS-1/PI3K/Akt pathway[J]. Int Immunopharmacol, 2013, 17(3): 714-20. doi:10.1016/j.intimp.2013.08.019 |
| [10] |
Cui C X, Deng J N, Yan L, et al. Silibinin capsules improves high fat diet-induced nonalcoholic fatty liver disease in hamsters through modifying hepatic de novo lipogenesis and fatty acid oxidation[J]. J Ethnopharmacol, 2017, 208(1): 24-35. |
| [11] |
Liu Z, Sun M, Wang Y, et al. Silymarin attenuated paraquat-induced cytotoxicity in macrophage by regulating Trx/TXNIP complex, inhibiting NLRP3 inflammasome activation and apoptosis[J]. Toxicol in Vitro, 2018, 46(2): 265-72. |
| [12] |
Zhang B, Wang B, Cao S H, et al. Silybin attenuates LPS-induced lung injury in mice by inhibiting NF-κb signaling and NLRP3 activation[J]. Int J Mol Med, 2017, 39(5): 1111-8. doi:10.3892/ijmm.2017.2935 |
| [13] |
Tschopp J, Schroder K. NLRP3 inflammasome activation: the convergence of multiple signalling pathways on ROS production[J]. Nat Rev Immunol, 2010, 10(3): 210-5. doi:10.1038/nri2725 |
| [14] |
Abais J M, Xia M, Zhang Y, et al. Redox regulation of NLRP3 inflammasomes: ROS as trigger or effector[J]. Antioxid Redox Signal, 2015, 22(13): 1111-29. doi:10.1089/ars.2014.5994 |
| [15] |
方晨, 梅咏玉, 王晶, 等. 消退素D1抑制NLRP3信号通路对DSS结肠炎小鼠的影响[J]. 中国药理学通报, 2019, 35(4): 580-5. Fang C, Mei Y Y, Wang J, et al. Resolvin D1 mitigates inflammatory response in DSS-induced colitis mice by inhibiting NLRP3 inflammasome activation[J]. Chin Pharmacol Bull, 2019, 35(4): 580-5. doi:10.3969/j.issn.1001-1978.2019.04.027 |

