

2. 厦门大学 医学院基础医学部,福建 厦门 361102;
3. 厦门大学 附属心血管病医院,福建 厦门 361014
戚智(1965-),男,博士,教授,博士生导师,研究方向:离子通道和心血管药理学,E-mail:qizhi@xmu.edu.cn。
2. Dept of Basic Medical Sciences, School of Medicine, Xiamen University, Xiamen 361102, China;
3. Xiamen Cardiovascular Hospital, Xiamen University, Xiamen 361014, China
实验性自身免疫性心肌炎(experimental autoimmune myocarditis, EAM)是由致敏性T淋巴细胞和多种自身抗体所介导的自身免疫性疾病[1]。我们前期应用猪心室肌球蛋白和完全弗氏佐剂免疫大鼠,成功制作EAM动物模型,该模型模拟心肌炎病人的临床发病进程,急性期出现充血性心衰,慢性期进展为扩张型心肌病,目前该模型已成为国际公认的研究心肌炎较理想的实验动物模型[2]。
血脂代谢与动脉粥样硬化性心血管病(atherosclerotic cardiovascular disease,ASCVD)的关系密切,尤其是高密度脂蛋白(high-density lipoprotein cholesterol,HDL-C)的水平及功能评估已成为预测ASCVD的重要指标[3],血浆HDL具有抗氧化、抗炎、抑血栓形成、促内皮修复等作用,还能介导胆固醇逆转运RCT来降低血管脂质的沉积,与动脉粥样硬化的发生发展呈负相关性,并与糖脂代谢、氧化应激及炎症损伤密切相关[4]。近年的研究显示,HDL在自身免疫性疾病中的作用也越来越受重视,关于HDL在类风湿性关节炎[5]、多发性硬化[6]、系统性红斑狼疮[7]等疾病中的相关报道已逐渐增多,由于心肌炎的发病机制与自身免疫反应密切相关,因此本研究拟对EAM及心肌炎病人的血脂代谢情况进行初步探讨,分析心肌炎中HDL的变化及与心肌炎的炎症程度的相关性,为深入探讨心肌炎的发病机制提供实验依据。
1 材料与方法 1.1 实验动物Lewis大鼠,♂,6~8周龄,体质量(180 ± 20) g,购自北京维通利华实验动物技术有限公司[动物生产许可证号SYXK 2018-0010]。所有大鼠均置于厦门大学动物实验中心SPF级动物饲养室,温度(16~25) ℃,湿度50%~70%,动物自由摄食水。本研究经厦门大学实验动物伦理委员会批准同意,且动物饲养及处理符合厦门大学动物伦理学标准。
1.2 试剂含结核杆菌H37Ra株的完全弗氏免疫佐剂(complete Freund’s adjuvant)(美国Difco公司),TRIzol (Invitrogen公司),逆转录试剂盒(Thermo fisher公司),SYBR荧光定量PCR试剂盒(TAKARA公司),Realtime PCR Master Mix试剂盒(TOYBO公司),Bio-Plex Pro human Th17 cytokine15-plex assay试剂盒(catalog No. 10023381,美国Bio-rad公司)。
1.3 仪器石蜡切片机、石蜡脱水机、石蜡包埋机(德国Leica公司), 高速低温离心机(德国Eppendorf公司),7600-020全自动生化分析仪(日本HITACHI公司),My Cycler梯度PCR仪(美国Bio-rad公司),7500实时荧光定量PCR仪(美国ABI公司), 电泳仪、电泳槽(美国Bio-rad公司),Vivid 7型彩色多普勒血流显像仪(美国GE公司),Bio-Plex 200蛋白悬液芯片系统(美国Bio-rad公司)。
1.4 建立大鼠EAM模型及血脂指标检测提纯猪心室肌球蛋白溶解于0.3 mol·L-1的KCL溶液中,配制成浓度为10 g·L-1,加入同等体积含结核杆菌H37Ra株的完全弗氏免疫佐剂,充分混合后,在大鼠双足底皮下注射上述混合液,每只0.1 mL,制备EAM模型。总计56只大鼠,其中8只在EAM的0、4、7、11、14、18、21、28、56、84 d的10个时间点(n=8),动物禁食不禁水,麻醉后眼眶採血0.5 mL,4 ℃ 3 000 r·min-1离心15 min分离血浆,放置于-80 ℃冰箱保存,全自动生化分析仪测定血脂水平。
1.5 心脏组织学评估及荧光定量PCR检测ApoA1在EAM各组织中的表达腹腔注射10%水合氯醛(3 mL·kg-1)麻醉后,在EAM的0、14、21、28、56、84 d的6个时间点处死大鼠(每组n=8,共48只大鼠),获取心脏组织,10%甲醛溶液固定,石蜡包埋,切成5 μm厚度的切片进行HE和Masson染色。获取EAM 0 d、14 d、21 d、28 d的心脏、肝脏、小肠、肌肉组织(股四头肌),TRIzol提取总RNA,逆转录后合成cDNA(2 μg,总计20 μL),荧光定量PCR法检测AopA1在EAM时程及在以上各组织中的表达水平,GAPDH作为内参。ApoA1引物序列: Sense primer: 5′-CTGTGTATGTGGATGCAGTCAAG-3′, anti-sense primer: 5′-GGTCCTTGTTCATCTCGTTT CT-3′; GAPDH引物序列, Sense primer:5′-ATCAC CATCTTCCAGGAGCGA-3′,anti-sense primer: 5′-AGCCTTCTCCATGGTGGTGGA-3′。荧光定量PCR扩增方法如我们前期的实验所述[8]。
1.6 临床心肌炎病例收集收集2013~2016年在厦门大学附属心血管病医院住院诊断明确的心肌炎患者(n=67),门诊健康体检者作为对照组(n=30)。所有入选心肌炎患者的诊断标准[9]:有≥1个临床表现,并有≥2项辅助检查异常:(1)临床表现:①急性的胸痛,②数天至3个月新出现的心衰或心衰症状,③心悸,无明显诱因而出现的心律失常、心源性猝死或晕厥,④不能解释的心源性休克;(2)辅助检查:①心电图的改变:ST-T的改变、异常Q波、房室传导阻滞、室上性心动过速等,②心肌损伤标志物升高:肌钙蛋白I或T的升高,③影像学检查(超声心动图或心脏磁共振)显示,心脏结构和功能出现异常,④心脏核磁共振证实,心肌组织学的炎症特征:T2WI示心肌水肿和(或)心肌延迟强化扫描呈强化信号。入选患者的排除标准:需同时排除其他病因导致的心脏扩大和心功能不全; 排除心、肺、肝、肾及其它脂质代谢相关的疾病; 排除肿瘤、内分泌疾病及合并自身免疫性疾病;近3个月内未行影响免疫功能的药物治疗。所有患者的病历资料及血液标本应用均符合相关伦理学规范和患者的知情同意,该研究获得厦门大学附属心血管病医院伦理委员会批准。
1.7 血脂及临床各指标检测并进行相关性分析收集血浆标本,所有受试者隔夜空腹12~14 h,晨取肘静脉血5mL,送检验科对炎症指标:血常规、C反应蛋白(CRP)、D-二聚体(D-Dimer),心肌坏死指标:磷酸肌酸激酶同工酶(CK-MB)、心肌肌钙蛋白T(cTNT)和心衰标记物B型脑利钠肽(NT-ProBNP)进行检测,全自动生化分析仪测定血脂各指标:总胆固醇(total cholesterol,TC 2.33~5.69 mmol·L-1氧化酶法)、甘油三酯(triglyceride,TG 0~1.7 mmol·L-1 GPO-PAP法)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C 1.04~1.96 mmol·L-1比色法)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C 0~3.37 mmol·L-1,比色法),ApoA1(1.04~2.02 g·L-1,比浊法),ApoB(0.66~1.33g·L-1,比浊法)。并对所有受试者进行心脏彩超检测。
1.8 Bio-Plex检测血清炎性因子的表达留取心肌炎患者(n=31)及门诊健康体检者(n=19)的血清(放置于-80 ℃冰箱保存),使用Bio-Plex Pro human Th17 cytokine15-plex assay试剂盒,按照试剂盒的操作步骤,应用Bio-Plex 200蛋白悬液芯片系统,同步检测血清中IL-1β、IL-4、IL-6、IL-10、IL-17A、IL-17F、IL-21、IL-22、IL-23、IL-25、IL-31、IL-33、IFN-γ、sCD40L、TNF-α 15种炎性因子的表达,应用系统的数据分析软件进行数据分析。
1.9 统计学处理实验结果以x±s表示,采用SPSS 13. 0统计分析软件完成,比较前先进行正态性检验及方差齐性检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,半定量资料采用秩和检验,参数间的相关性分析采用Pearson相关分析。
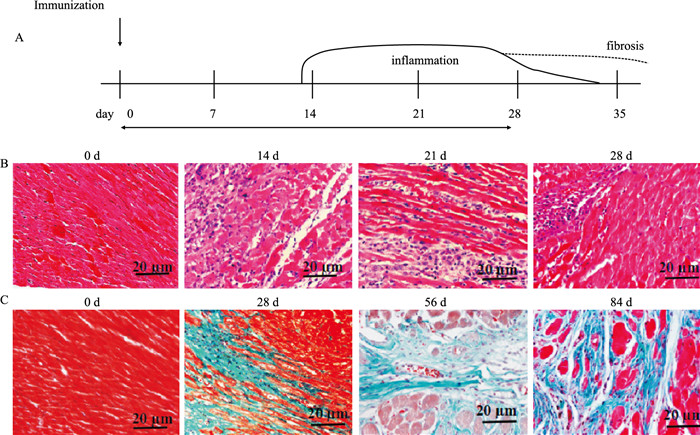
2 结果 2.1 大鼠EAM的时程改变EAM时程的炎症进展情况如Fig 1A所示,d 0免疫大鼠,d 11心肌炎症明显,d 14炎症达高峰,持续至d 28,之后心肌炎症逐渐消退转为纤维化阶段。心脏组织病理学切片HE染色如Fig 1B所示,d 0心肌纤维排列规整,d 14可见大量炎性细胞浸润,心肌细胞间质水肿被溶解破坏,心肌纤维断裂排列紊乱;d 21时炎性细胞浸润仍较多,心肌少量纤维化形成;d 28时炎性细胞逐渐减少并局限,以心肌纤维化为主。为进一步明确心肌纤维化的进展程度,Fig 1C Masson染色显示,d 28,d 56直至d 84,心肌纤维化逐渐明显。
|
| 图 1 Pattern of EAM time course and ventricle tissue sections stained by HE and Masson (×400) |
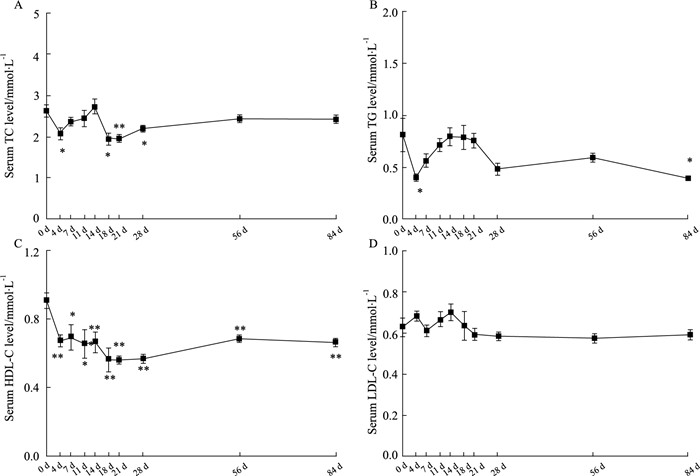
在EAM 0、4、7、11、14、18、21、28、56、84 d的时间点测定大鼠的血脂水平(每组n=8),如Fig 2所示,胆固醇TC从EAM d 18起开始明显下降(P < 0.05),d 21下降到最低点(P < 0.01),直至d 28仍维持在较低水平(P < 0.05),此后缓慢恢复至正常(Fig 2A);甘油三酯TG仅在d 4、d 84有降低,其余时间点均无明显变化(Fig 2B);HDL-C从EAM d 4即开始明显下降(P < 0.01),之后持续处于低水平状态,在d 21时降低至最低点,持续至d 84仍处于较低水平(Fig 2C);而LDL-C的水平在EAM的整个病程中变化不明显(Fig 2 D)。由此发现血脂指标中的HDL-C在EAM的病程中发挥重要作用。
|
| 图 2 Serum lipids levels of EAM time course (x±s,n=8) *P < 0.05, **P < 0.01 vs 0 d |
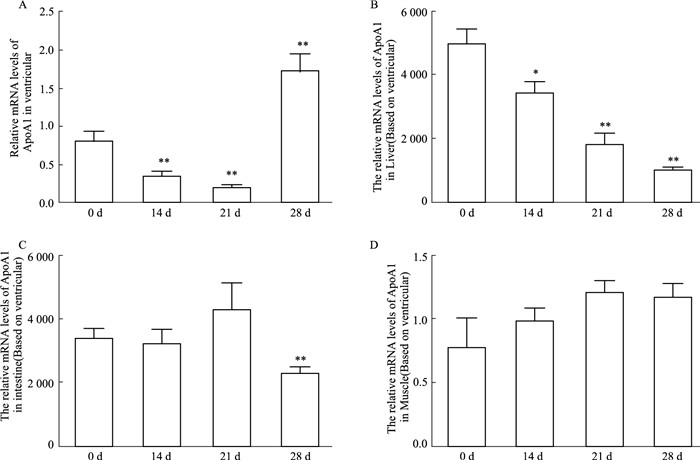
为进一步明确HDL-C在EAM中的作用,我们检测了HDL的主要结构蛋白AopA1在EAM各组织中的表达情况。为明确ApoA1在EAM中的表达是否具有组织特异性,所以除了心肌以外,我们还检测了AopA1在肝脏、小肠和肌肉中的表达情况。如Fig 3所示,ApoA1在肝脏和小肠中的表达量(Fig 3B, 3C)要明显高于心肌和肌肉组织(Fig 3A, 3D),与d 0相比,ApoA1在EAM心肌中d 14和d 21,即炎症程度最重的时候其表达是明显降低的(P < 0.01),d 28炎症逐渐局限时明显升高(P < 0.01)(Fig 3A);ApoA1在EAM肝脏中d 14时表达明显降低(P < 0.05),d 21持续降低直至d 28降至最低水平(Fig 3B)。而ApoA1在小肠和肌肉中的表达在EAM各时程中改变不明显(Fig 3C, 3D)。
|
| 图 3 Relative mRNA levels of ApoA1 in different tissues of EAM rats (x±s, n=8) *P < 0.05, **P < 0.01 vs 0 d |
如Tab 1所示,与对照组比较,两组的年龄、性别无差异,心肌炎患者的一般炎症指标:白细胞计数(WBC)、CRP明显升高(P < 0.01);心肌坏死指标:CK-MB、cTNT和心衰标记物NT-ProBNP明显升高(P < 0.01);心脏彩超显示:心肌炎患者的室间隔厚度(IVS)(P < 0.01)和左心室收缩期内径(LVS)明显升高(P < 0.01),射血分数(LVEF)明显降低(P < 0.01),这些结果提示了心肌炎患者有较严重的急性炎症损伤和心肌坏死,
| Healthy(n=30) | Myocarditis(n=67) | |
| Age/Year | 36.03±1.282 | 34.41±1.655 |
| Male/% | 18(60%) | 45(65.2%) |
| WBC/109·L-1 | 6.585±0.3084 | 9.833±0.7125** |
| CRP/mg·L-1 | 0.8891±0.5284 | 45.54±9.72** |
| CK-MB/U·L-1 | 9.408±2.192 | 50.88±4.921** |
| cTNT/ng·L-1 | 4.686±0.4628 | 2613±514.1** |
| BNP/ng·L-1 | 43.59±18.45 | 2033±689.2** |
| IVS/mm | 8.63±0.3022 | 9.961±0.433** |
| LVD/mm | 46.22±0.9575 | 47.55±0.862* |
| LVS/mm | 28.57±1.009 | 33.53±1.333** |
| LVEF/% | 70.24±0.9025 | 56.85±1.441** |
| TC/mmol·L-1 | 4.235±0.1282 | 3.617±0.1175** |
| TG/mmol·L-1 | 1.144±0.1135 | 1.075±0.062 |
| HDL-C/mmol·L-1 | 1.283±0.5482 | 0.9459±0.039** |
| LDL-C/mmol·L-1 | 2.431±0.117 | 2.263±0.096 |
| APOA1/g·L-1 | 1.311±0.0365 | 1.042±0.0349** |
| APOB/g·L-1 | 0.779±0.037 | 0.7293±0.0346 |
| *P<0.05,**P<0.01 vs Healthy | ||
心肌炎导致了心脏功能下降,心脏结构可表现为代偿性的扩大,并出现急性心衰。血脂指标中总胆固醇(TC)的水平明显降低(P < 0.01),甘油三酯(TG)轻度降低;高密度脂蛋白(HDL-C)和ApoA1的水平明显降低(P < 0.01);而低密度脂蛋白(LDL-C)和ApoB的水平改变不明显,提示心肌炎患者除了出现心肌坏死和心衰外,还存在脂质代谢紊乱,尤其表现以HDL-C的降低为主。
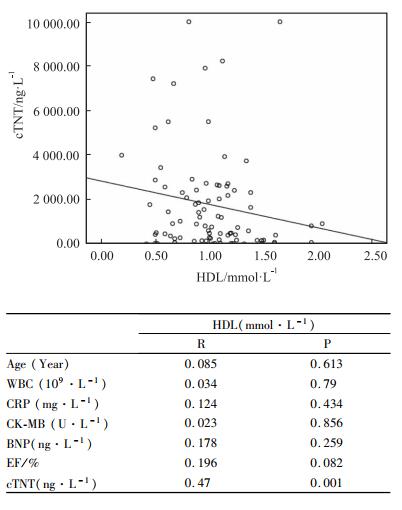
2.5 相关性分析如Fig 4所示,直线相关分析结果显示,HDL-C的水平与cTnT呈负相关(P < 0.05),即随着HDL-C水平的降低,cTnT的水平升高,心肌坏死的程度更严重;而HDL-C的水平与WBC、CRP、CK-MB、BNP、EF的相关性无统计学意义。
|
| 图 4 Correlation analysis between HDL and cTNT(n=67) |
为进一步明确HDL在心肌炎中的作用,我们将心肌炎患者分为HDL>1 mmol·L-1和HDL≤1 mmol·L-1两组,如Tab 2所示,与对照组比较,HDL>1 mmol·L-1的心肌炎患者组WBC、CRP明显升高,CK-MB和cTNT明显升高(P < 0.01),心脏超声中射血分数(LVEF)明显降低(P < 0.01);而与HDL>1 mmol·L-1的心肌炎患者组比较,HDL≤1 mmol·L-1的心肌炎患者组CRP (P < 0.05)和cTNT升高更明显(P < 0.01),心脏彩超中的室间隔厚度(IVS)升高更明显(P < 0.05),射血分数(LVEF)降低也更明显(P < 0.05),这说明在心肌炎患者中,随着HDL水平的降低,心肌损伤和心衰程度进一步加重。
| Healthy(n=30) | Myocarditis | ||
| HDL>1 mmol·L-1(n=31) | HDL≤1 mmol·L-1(n=36) | ||
| Age/Year | 36.03±1.282 | 32.73±2.25 | 36.65±2.295 |
| Male/% | 18(60%) | 24(67%) | 21(58%) |
| WBC/109·L-1 | 6.585±0.3084 | 9.626±0.7768** | 10.27±0.9414 |
| RBC/1012·L-1 | 4.482±0.2229 | 4.397±0.1582 | 4.353±0.1239 |
| PLT/109·L-1 | 191.1±13.94 | 203.6±19.23 | 210.6±18.21 |
| CRP/mg·L-1 | 0.8891±0.5284 | 22.54±8.709** | 67.59±12.81# |
| D-Dimer/mg·L-1 | 0.21±0.06 | 5.436±2.112 | 2.11±1.572 |
| CK-MB/U·L-1 | 9.408±2.192 | 47.63±6.139** | 59.08±7.805 |
| cTNT/ng·L-1 | 4.686±0.4628 | 1209±186.4** | 3341±485.8 ## |
| BNP/ng·L-1 | 43.59±18.45 | 1083±414.5 | 2214±676.6 |
| IVS/mm | 8.63±0.3022 | 9.104±0.3620 | 10.16±0.613 # |
| LVD/mm | 46.22±0.9575 | 49.74±0.7782 | 48.07±1.113 |
| LVS/mm | 28.57±1.009 | 33.23±1.246 | 35.65±0.9401 |
| LVEF/% | 70.24±0.9025 | 60.15±1.139** | 54.7±1.827# |
| **P<0.01 vs Healthy,##P<0.05, ##P<0.001 vs HDL>1 mmol·L-1 | |||
为明确心肌炎病程中HDL与炎性因子的关系,我们应用Bio-Plex悬液芯片系统检测血清15种炎性因子的表达水平。如Tab 3所示,与对照组比较,HDL>1 mmol·L-1的心肌炎患者组的IL-1β、TNF-α的表达水平明显升高(P < 0.05),IL-6、IL-17A,IL-31,sCD40L的表达水平显著升高(P < 0.01);而与HDL>1 mmol·L-1的心肌炎患者组比较,HDL≤1 mmol·L-1组的IL-6、TNF-α的表达水平升高更明显(P < 0.05)。而IL-4、IL-10、IL-17F、IL-21、IL-22、IFN-γ的表达水平3组间无明显差异。血清中IL-23、IL-25、IL-33的表达水平在3组间均未检测到。
| Healthy (n=19) |
Myocarditis | ||
| HDL>1 mmol·L-1 (n=11) |
HDL≤1 mmol·L-1 (n=20) |
||
| IL-1β | 8.904±1.75 | 15.21±3.104* | 14.07±1.134 |
| IL-4 | 285.2±112.7 | 165.4±111.7 | 245.6±112.5 |
| IL-6 | 132.6±25.72 | 163.4±28.82** | 249.4±22.56# |
| IL-10 | 428.7±170.3 | 457.2±237 | 597.3±187.8 |
| IL-17A | 261.1±119.3 | 534±225.6** | 978±134.5 |
| IL-17F | 81.67±81.67 | 174.3±174.3 | 77.59±77.59 |
| IL-21 | 513.8±353.9 | 536.4±536.4 | 763.1±427.9 |
| IL-22 | 1216±378.1 | 957.3±508.5 | 1820±384.3 |
| IL-23 | OOR < | OOR < | OOR < |
| IL-25 | OOR> | OOR> | OOR> |
| IL-31 | 867.4±307.6 | 1844±443.5** | 2146±292.1 |
| IL-33 | OOR < | OOR < | OOR < |
| IFN-γ | 45.86±11.7 | 46.68±17.05 | 64.23±11.86 |
| CD40L | 1854±354.4 | 2768±547.1** | 3381±247.3 |
| TNF-α | 168.9±42.29 | 205.9±53.59* | 349.7±33.05# |
| Concentration: ng·L-1, OOR < : Out of Range below,OOR>: Out of Range Above. *P<0.05,**P<0.01 vs Healthy,#P<0.05 vs HDL>1 mmol·L-1 | |||
心肌炎是一种严重危害人类健康的心血管疾病,多累及儿童和青壮年,迁延不愈者可导致扩张型心肌病、慢性心衰、甚至猝死。血脂代谢在动脉粥样硬化中所发挥的关键作用已被广泛报道,但血脂代谢在心肌炎中的作用研究还较少,本实验从动物水平和临床水平对EAM大鼠及心肌炎病人的血脂代谢情况进行了初步探讨,结果显示,EAM和心肌炎病人中存在血脂代谢紊乱,胆固醇TC在EAM d 18至d 28,即炎症程度最重的时候明显降低;甘油三酯TG仅在d 4、d 84有降低,在心肌炎最严重阶段无明显变化,这提示心肌炎症未影响TG的代谢;HDL-C从EAM d 4即开始明显下降,在心肌炎最严重阶段持续处于低水平状态持续至d 84。以上结果提示,血脂指标中TC和HDL-C的变化显著且与EAM的炎症程度有相关性。与大鼠EAM一致的是,我们检测到心肌炎病人中HDL-C的水平也明显降低,这提示血脂指标中HDL-C在心肌炎的病程中发挥重要作用,由于血脂水平的异常导致了炎症异常,心肌炎症也进一步参与了血脂代谢的异常,两者之间的因果关系目前还不明确,后续我们将进行深入探讨。
ApoA1是HDL-C的主要结构蛋白,在胆固醇逆转运RCT和细胞胆固醇稳态中起着重要的作用[10],本研究我们检测了ApoA1在EAM各组织(心脏、肝脏、小肠和肌肉)中的表达,结果显示,ApoA1不仅在心肌中有表达,在其他各组织中均有表达,并不具有心肌组织特异性。在d 14和d 21,也就是在EAM炎症程度最重的时候,ApoA1在心肌中的表达明显降低,在d 28表达是升高的,而血浆HDL-C的水平仍是降低的,ApoA1与HDL-C变化的不一致可能与随着EAM炎症程度的逐渐减轻,ApoA1在心肌组织中蓄积,从而在血液中分泌减少有关。另外,心肌炎病人ApoA1的水平下降而EAM大鼠d 28 ApoA1升高,考虑因我们没对心肌炎病人的血脂指标进行连续时程监测,所以与EAM大鼠的时程进展没办法完全对应有关,后续也需要我们进一步完善。
近来的研究显示,HDL在多种自身免疫性疾病中发挥重要作用,Du等[5]的研究显示, 类风湿性关节炎(rheumatoid arthritis,RA)患者的HDL水平显著低于正常组和骨关节炎组,而且RA并发功能障碍的患者血清HDL水平比并发症轻的患者水平低,因此推测HDL水平的下降引起了RA患者的预后不良。多发性硬化症(multiple sclerosis,MS)是一种以中枢神经系统白质脱髓鞘病变为特点的自身免疫性疾病,MS患者的乏力程度与HDL的水平密切相关,因此HDL水平可以反映MS的病情严重程度[6]。系统性红斑狼疮(systemic lupus erythematosus,SLE)患者并发动脉硬化和心血管疾病的发生率较高,其原因与HDL水平的降低及其成分改变密切相关,因此HDL的功能异常已成为SLE患者并发动脉硬化的重要生物标记物[7]。我们的结果显示,心肌炎也被认为是一种自身免疫性疾病,心肌炎患者的HDL与ApoA1的水平明显低于对照组,而且HDL的降低水平与肌钙蛋白cTnT呈负相关,也就是说随着HDL水平的降低,心肌炎的炎症损伤程度更重,这与Lippi等[11]的研究结果是一致的。
EAM被认为是CD4+T细胞介导的免疫反应,在抗原的刺激下, 初始CD4+T细胞活化、增殖和分化为不同的效应亚型: Th1、Th2、Th17和Treg亚群。在Th1/Th2经典的模式理论中, Th1细胞产生IL-1、TNF-α、INF-γ等炎性细胞因子启动免疫反应, Th2细胞分泌IL-4、IL-10等细胞因子是一些抗体生成和消除细胞外病原体的必需条件[12]。Th17细胞是CD4+T细胞的效应性T细胞,起源于幼稚性T细胞,被认为是一类独立的辅助T细胞亚群,并以分泌IL-17为主要特征。调控Th17细胞分化的细胞因子主要有TGF-β、IL-6、IL-21、IL-22、IL-23,另外还有少量粒细胞-巨噬细胞集落刺激因子(GM-CSF)、TNF-α、IL-27等[13]。我们前期的研究已显示,抑制CD4+T细胞分化的Th1细胞因子IL-1、TNF-α、INF-γ和Th17细胞因子IL-17、IL-21、IL-23可以有效缓解EAM的炎症程度[2]。本研究我们检测了心肌炎患者血清中15种炎性因子的表达,结果显示,IL-1β、TNF-α、IL-6、IL-17A,IL-31,sCD40L的表达水平明显升高,尤其是随着HDL的降低,IL-6、TNF-α的表达水平升高更明显,IL-6是很重要的炎性细胞因子,可以诱导B细胞及单核细胞的分化,并诱导IL-2及其受体的表达。IL-6可以与IL-1、TNF-α一起协同促进T细胞的增殖,还可以诱导机体合成急性期蛋白从而参与炎症反应,这与Myers等[14]和Wang等[15]的研究结果是一致的。综上所述,本研究的实验结果显示,大鼠EAM和心肌炎患者中存在以HDL降低为主的血脂代谢紊乱,而且随着HDL水平的降低,心肌损伤坏死程度加重,炎性因子分泌增多,HDL的水平与心肌坏死程度及炎症因子的分泌具有相关性,这将为深入理解心肌炎的发病机制提供新的思路。
| [1] |
Comarmond C, Cacoub P. Myocarditis in auto-immune or auto-inflammatory diseases[J]. Autoimmun Rev, 2017, 16(8): 811-6. doi:10.1016/j.autrev.2017.05.021 |
| [2] |
Chang H, Wang Y, Li G, et al. Effect of hydrodynamics-based delivery of IL-18BP fusion gene on rat experimental autoimmune myocarditis[J]. Clin Exp Med, 2014, 14(4): 397-408. doi:10.1007/s10238-013-0260-7 |
| [3] |
Hafiane A, Favari E, Daskalopoulou S S, et al. High-density lipoprotein cholesterol efflux capacity and cardiovascular risk in autoimmune and non-autoimmune diseases[J]. Metabolism, 2020, 104: 154141. doi:10.1016/j.metabol.2020.154141 |
| [4] |
覃陆慧, 吴兴春, 周幸, 等. 杨桃根苯醌对链脲佐菌素致糖尿病小鼠糖脂代谢、氧化应激和炎症损伤的影响[J]. 中国药理学通报, 2019, 35(12): 1720-4. Qin L H, Wu X C, Zhou X, et al. Effects of benzoquinone of Averrhoa carambola L. root on glucose and lipid metabolism, oxidative stress and inflammatory injury in diabetic mice[J]. Chin Pharmacol Bull, 2019, 35(12): 1720-4. doi:10.3969/j.issn.1001-1978.2019.12.019 |
| [5] |
Du J P, Yuan Y, Chen S Y, et al. Serum bilirubin and the risk of rheumatoid arthritis[J]. J Clin Lab Anal, 2017, 31(6): 1-6. doi:10.1002/jcla.22118 |
| [6] |
Browne R W, Jakimovski D, Ziliotto N, et al. High-density lipoprotein cholesterol is associated with multiple sclerosis fatigue: A fatigue-metabolism nexus[J]. J Clin Lipidol, 2019, 13(4): 654-63. doi:10.1016/j.jacl.2019.06.003 |
| [7] |
Kim S Y, Yu M, Morin E E, et al. High-density lipoprotein in lupus: Disease biomarkers and potential therapeutic strategy[J]. Arthritis Rheumatol, 2020, 72(1): 20-30. doi:10.1002/art.41059 |
| [8] |
周晓霞, 张建情, 刘春晓, 等. 白花前胡有效成分Pd-Ia对急性肺损伤的作用及机制研究[J]. 中国药理学通报, 2016, 32(8): 1165-9. Zhou X X, Zhang J Q, Liu C X, et al. Protective effect of Pd-Ia on LPS-induced mouse acute lung injury and its mechanism[J]. Chin Pharmacol Bull, 2016, 32(8): 1165-9. doi:10.3969/j.issn.1001-1978.2016.08.026 |
| [9] |
Heymans S, Eriksson U, Lehtonen J, et al. The quest for new approaches in myocarditis and inflammatory cardiomyopathy[J]. J Am Coll Cardiol, 2016, 68(21): 2348-64. doi:10.1016/j.jacc.2016.09.937 |
| [10] |
卓俊城, 曾晓会, 曾巧煌, 等. Triton WR-1399通过影响VLDL-C代谢通路和RCT诱导急性HLP小鼠模型的研究[J]. 中国药理学通报, 2017, 33(3): 433-9. Zhuo J C, Zeng X H, Zeng Q H, et al. Study on hyperlipidemia mice models induced by Triton WR-1399 via VLDL-C metabolic pathway and reverse cholesterol transport[J]. Chin Pharmacol Bull, 2017, 33(3): 433-9. doi:10.3969/j.issn.1001-1978.2017.03.026 |
| [11] |
Lippi G, Lo Cascio C, Brocco G, et al. High-density lipoprotein cholesterol values independently and inversely predict cardiac troponin T and I concentration[J]. Ann Transl Med, 2016, 4(10): 188. doi:10.21037/atm.2016.03.03 |
| [12] |
Jiang Y, Wang X, Dong C. Molecular mechanisms of T helper 17 cell differentiation: Emerging roles for transcription cofactors[J]. Adv Immunol, 2019, 144: 121-53. doi:10.1016/bs.ai.2019.09.003 |
| [13] |
Cui X, Mino T, Yoshinaga M, et al. Regnase-1 and roquin nonredundantly regulate Th1 differentiation causing cardiac inflammation and fibrosis[J]. J Immunol, 2017, 199(12): 4066-77. doi:10.4049/jimmunol.1701211 |
| [14] |
Myers J M, Cooper L T, Kem D C, et al. Cardiac myosin-Th17 response promote heart failure in human myocarditis[J]. JCI Insight, 2016, 1(9): 85851. |
| [15] |
Wang D, Li T, Cui H, et al. Analysis of the indicating value of cardiac troponin I, tumor necrosis factor-alpha, interleukin-18, Mir-1 and Mir-146b for viral myocarditis among children[J]. Cell Physiol Biochem, 2016, 40(6): 1325-33. doi:10.1159/000453185 |

