

2. 怀化市第一人民医院临床药学研究室,湖南 怀化 418000
2. Dept of Clinical Pharmacy, the First People's Hospital of Huaihua, Huaihua Hunan 418000, China
2型糖尿病(type 2 diabetes mellitus,T2DM)是由遗传、免疫、环境等因素引起的以高血糖为特征的慢性代谢综合征, 2017年成人糖尿病和糖尿病前期患病率分别为10.9%和35.7%,其中T2DM占90%以上[1]。骨骼肌是机体运动、物质代谢、能量转换的重要器官。T2DM会导致糖代谢紊乱和骨骼肌损伤,但分子机制尚不明确。
自噬作为机体维持物质稳态的重要代偿机制,广泛存在真核生物中,其功能是当机体营养受限等情况下降解细胞原有受损组分,提供新生原料,以便维持细胞正常功能[2]。许多研究显示,过度激活或抑制自噬都会造成多种疾病发生,例如代谢综合征、糖尿病以及肿瘤等。
适度有氧运动对机体调节作用可能与自噬有关。研究发现耐力运动可提高正常小鼠骨骼肌自噬水平,并明显改善高脂饮食引起的骨骼肌糖耐量下降和血脂过高;但Bcl-2AAA自噬缺陷小鼠运动后不仅不会上调自噬水平,反而致使葡萄糖摄取受阻,胰岛素抵抗加重[3]。但运动、自噬和2型糖尿病之间的关系尚不明确,因此,本研究旨在从自噬角度探索适度游泳运动对T2DM小鼠骨骼肌功能改善的内在机制。
1 材料与方法 1.1 材料 1.1.1 实验动物50只昆明种小鼠购于长沙市天勤生物技术有限公司,许可证号为SCXK(湘)2014-0011,SPF级、♂、4~5周龄,体质量为(22~27) g,分笼饲养,每笼10只,室温为(20~25) ℃,相对湿度为40%~70%,保持12 h昼夜节律,给予充足饮食饮水。
1.1.2 主要试剂胰岛素检测试剂盒(上海纪宁);链脲佐菌素(V900890-1G,Sigma);LC3B抗体(ab51520,Abcam)、P62抗体(18420-1-AP,Proteintech Group)、GAPDH抗体(10494-1-AP,Proteintech Group);二甲双胍片(批号170353,京丰制药公司);BCA蛋白定量试剂盒(碧云天)。
1.1.3 主要仪器酶联免疫检测仪(Bio Tek);Alphalmager TM2200凝胶成像系统(Alpha Innotech);显微镜(zeiss);血糖仪(三诺生物);电热恒温干燥箱(上海跃进);5810R低温高速离心机(德国Eppendorf);ME203E电子分析天平(Mettler-Toledo)。
1.2 方法 1.2.1 实验动物及分组采用高脂高糖饲料喂养4周后注射链脲佐菌素(STZ)的方法建立2型糖尿病小鼠模型[4]。建模2周后以空腹血糖高于11.1 mmol·L-1作为纳入标准,剔除成模后死亡和血糖回落的小鼠后,将其分为正常对照组(CG)、正常运动组(CEG),糖尿病组(DG)、糖尿病运动组(DEG)、糖尿病二甲双胍组(DMG),每组各8只小鼠。
1.2.2 干预方案所有运动组小鼠均采用适度无负重游泳训练6周,每周5 d。小鼠置于水深约15 cm的桶中,水温36 ℃左右。小鼠进行适应性游泳训练:d 1, 小鼠游泳30 min, 分两段进行,每段15 min,中途休息5 min;d 2, 小鼠游泳40 min,每段20 min, 中途休息5 min;d 3, 小鼠游泳60 min,每段30 min,中途休息10 min;之后6周均以每日运动60 min为标准。糖尿病二甲双胍组小鼠采用每天按200 mg·kg-1的剂量给予二甲双胍溶液灌胃,持续时间为6周。
1.2.3 体质量、饮水饮食量、空腹血糖、血清胰岛素及HOMA-IR测定所有干预完成后对各组小鼠体质量、饮水量、饮食量进行测定。各组小鼠均禁食12 h,取尾静脉血测空腹血糖,按血清胰岛素ELISA试剂盒说明书测血清胰岛素含量,计算胰岛素抵抗指数(HOMA-IR)。计算公式:(HOMA-IR)=(FBG×FINS)/22.5。FBG和FINS分别为空腹血糖值和空腹血清胰岛素含量。
1.2.4 骨骼肌样本采集游泳运动和二甲双胍干预结束后,采用颈椎脱臼处死小鼠,取后腿双侧腓肠肌,使用生理盐水洗净组织,剥离包膜后漂洗,将组织分成两份,一份放入-80 ℃冰箱保存,另一份用10%福尔马林浸泡备用。
1.2.5 组织学观察取组织用10%福尔马林中固定,由低到高浓度梯度乙醇脱水,石蜡包埋冷却后切成5~8 μm薄片,烘干,脱蜡,苏木精染色4 min,水洗,1%盐酸乙醇分化5 s,伊红染色3 min,水洗后再次乙醇脱水,二甲苯透明,中性树脂封片,显微镜观察组织结构变化。
1.2.6 免疫印迹法测定自噬蛋白LC3、P62的相对表达从-80 ℃冰箱取出肌肉组织,提取蛋白后采用BCA法测定蛋白浓度。加入1/4倍样品体积的蛋白缓冲液,沸水浴10 min使蛋白完全变性。制好电泳凝胶后上样,每孔加入40 μg上样蛋白,进行电泳。蛋白分离后转模,TBST洗膜3次、10 min/次,5%脱脂牛奶封闭2 h,分别加入LC3B (1 :1 000)、P62 (1 :1 000)、GAPDH (1 :4 000)一抗,4 ℃过夜。TBST洗膜3次、10 min/次,二抗孵育1.5 h。ECL化学试剂显色,通过凝胶成像系统显影,并进行灰度值分析,计算LC3-Ⅱ/LC3-Ⅰ比值和P62蛋白表达。
1.2.7 统计学分析采用Graphpad prism 5软件进行分析,所有数据均采用x±s表示,多组间比较采用单因素的方差分析(One-Way ANOVA)进行检验。
2 结果 2.1 体质量、饮水饮食量、空腹血糖、血清胰岛素和HOMA-IR值测定干预结束后,对各组小鼠分别进行体质量、饮水量、饮食量、空腹血糖、血清胰岛素和HOMA-IR值的测定结果显示(Tab 1):与CG组比较,DG组体质量下降(P < 0.05),饮食饮水量、空腹血糖和HOMA-IR值则明显增加(P < 0.05)。与DG组比较,DEG组饮食量和饮水量均增加(P < 0.05),但空腹血糖、血清胰岛素和HOMA-IR下降不显著。与DG组比较,DMG组饮食量明显下降(P < 0.05),而体质量、饮水量、血清胰岛素和HOMA-IR略有下降,但差异无统计学意义。说明糖尿病小鼠“三多一少”症状明显,适度游泳运动和二甲双胍可轻微改善胰岛素抵抗。
| Group | Body mass/g | Water intake/g | Diet intake/g | Fasting blood glucose/mmol·L-1 | Serum insulin/mIU·L-1 | HOMA-IR |
| CG | 53.6±2.3 | 10.7±2.1 | 8.8±0.8 | 8.1±1.5 | 30.4±1.7 | 12.4±3.6 |
| CEG | 48.7±3.3 | 11.2±2.5 | 10.4±0.6 | 8.8±1.4 | 29.9±1.5 | 12.9±2.9 |
| DG | 45.1±5.3* | 25.6±7.5* | 11.7±1.9* | 23.2±4.6* | 33.6±1.6 | 34.6±3.4* |
| DEG | 43.7±3.0 | 51.0±7.0# | 15.6±1.2# | 24.6±3.2 | 30.9±1.7 | 32.5±1.6 |
| DMG | 42.0±4.4 | 21.4±6.8 | 6.9±0.8# | 24.5±2.3 | 31.8±1.9 | 33.4±1.8 |
| *P < 0.05 vs CG; #P < 0.05 vs DG. | ||||||
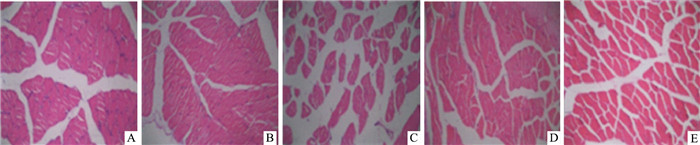
各组小鼠在6周的运动干预后骨骼肌(腓肠肌)HE染色后细胞病理变化结果如下(Fig 1):CG组腓肠肌细胞呈有规则的多边形块状,排列紧密,核位于细胞边缘,肌束界限清晰整齐;CEG组骨骼肌细胞排列紧密,细胞界限清晰;DG组肌细胞排列疏松,肌细胞严重变形并呈萎缩样改变,个别细胞肿大伴有间质水肿;DEG组和DMG组肌细胞呈不规则块状,排列较为紧密,细胞间质水肿情况介于CG组与DG组之间。说明适度游泳运动对糖尿病骨骼肌细胞结构有一定的保护作用。
|
| 图 1 Skeletal muscle cell recovery of type 2 diabetes mellitus promoted by moderate swimming(HE ×200) A: Control group; B: Control exercise group; C: Diabetes group; D: Diabetes exercise group; E:Diabetes metformin group. |
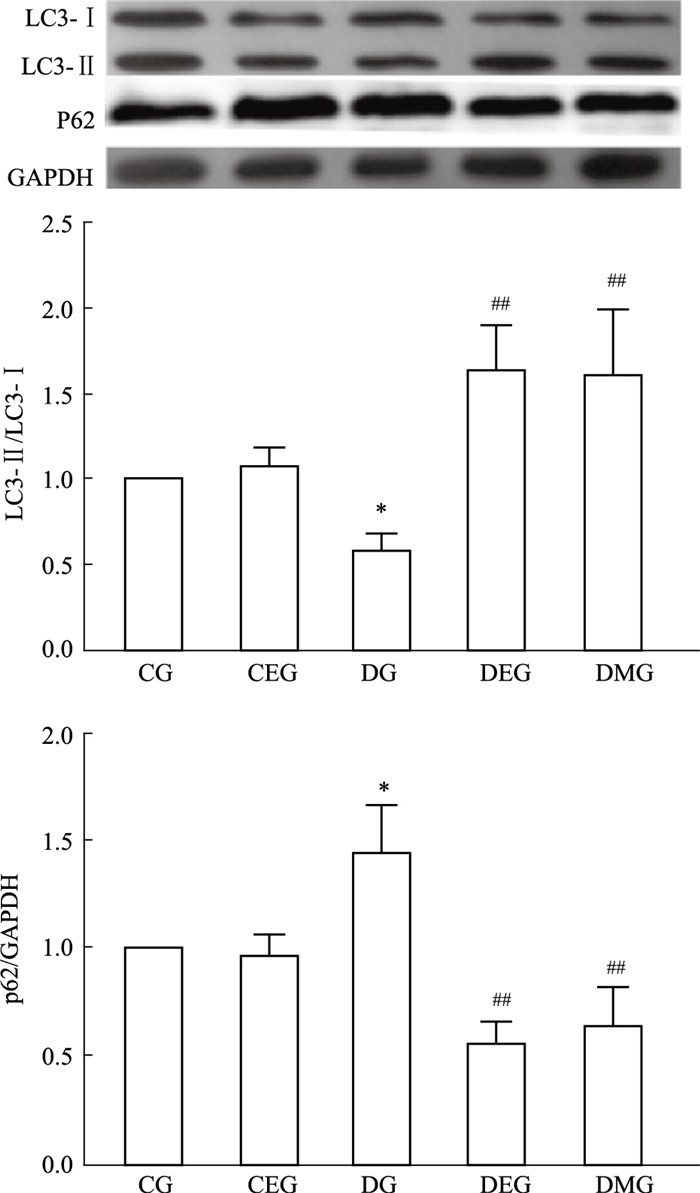
LC3-Ⅱ/LC3-Ⅰ比值和P62表达程度作为判断自噬发生强弱的标准,LC3-Ⅱ/LC3-Ⅰ比值与自噬强度呈正相关,P62蛋白表达则相反。Western blot法结果显示(Fig 2):与CG组比较,DG组LC3-Ⅱ/LC3-Ⅰ比值明显降低(P < 0.05);与DG组比较,DEG组和DMG组LC3-Ⅱ/LC3-Ⅰ比值明显增加(P < 0.01);与CG组比较,DG组P62蛋白表达量有明显增加(P < 0.05);与DG组比较,DEG组和DMG组P62蛋白表达量显著降低(P < 0.01)。说明2型糖尿病可以抑制骨骼肌细胞自噬发生,而适度游泳和二甲双胍可以激活骨骼肌细胞自噬发生。
|
| 图 2 2 Autophagy in skeletal muscle of type 2 diabetes mellitus increased by moderate swimming (x±s,n=3) CG: Control group; CEG: Control exercise group; DG: Diabetes group; DEG: Diabetes exercise group. DMG:Diabetes metformin group. *P < 0.05 vs CG; ##P < 0.01 vs DG |
2型糖尿病是胰岛素抵抗和胰岛素分泌相对不足所引起的代谢疾病,而1型糖尿病(type 1 diabetes mellitus,T1DM)是由于胰岛功能丧失导致胰岛素绝对不足,两者症状与机制都有很大区别。之前对糖尿病骨骼肌自噬的研究往往建立在T1DM模型基础上,有报道发现,在直接注射STZ所造的T1DM大鼠模型中,骨骼肌自噬是过度激活的,而通过有氧游泳运动可使自噬下调至正常水平[4]。而本实验利用高脂高糖饲料加注射小剂量STZ的方法成功复制了2型糖尿病小鼠模型,成模小鼠均不仅出现高血糖和“三多一少”症状,而且伴有胰岛素代偿性增高和严重的胰岛素抵抗,与许芳芳等[5]研究一致,符合人类T2DM发病特征。实验发现T2DM会导致骨骼肌损伤,可能与抑制自噬有关,而适度游泳运动却能明显改善T2DM导致的骨骼肌细胞形态和激活自噬。
胰岛素抵抗是从代谢综合征发展到2型糖尿病的重要原因,而自噬抑制可能与胰岛素抵抗加重有关。研究发现[6]:脂质过载可引起自噬下调或缺失,而自噬过分抑制会进一步导致脂解能力下降,从而造成脂肪堆积、线粒体紊乱、炎症激活和胰岛β细胞质量下降,最终引发胰岛素抵抗和2型糖尿病。另外,自噬下调会导致P62增高,P62过度表达可增加NF-κB,NF-κB过度转入细胞核可促使GLUT4基因表达下调,从而阻碍骨骼肌葡萄糖转运与摄取,最终出现胰岛素抵抗[7]。其中,骨骼肌损伤作为2型糖尿病并发症之一,其机制可能与自噬缺失有关。研究发现:特异性敲除小鼠骨骼肌自噬基因ATG7会导致肌节瓦解、肌肉萎缩和肌力下降,故推测自噬下调可能是诱发2型糖尿病及其并发症的重要原因[8]。
适度运动作为一种简单易行的代谢调节方式,已成为治疗2型糖尿病及糖尿病前期的首选方案之一。本实验发现适度游泳运动可上调T2DM骨骼肌自噬水平,结合相关文献推测其机制可能通过多种途径实现。(1)AMP依赖的蛋白激酶(AMP-activated protein kinase,AMPK)途径:运动引起的骨骼肌收缩会导致肌肉耗氧量增加,从而激活AMPK,AMPK可通过激活结节性硬化复合物1/2(Tuberous sclerosis complex1/2,TSC1/2)来抑制雷帕霉素靶蛋白复合物1 (mammalian target of rapamycin complex 1,mTORC1)活性,从而激活自噬。除此之外,运动引起的AMPK活化可通过直接激活自噬相关蛋白ULK1(Unc-51 like autophagy activating kinase 1,ULK1)来诱发自噬[9]。(2)自噬相关蛋白BECLIN1途径:He等研究发现,运动导致抗凋亡因子(B-cell lymphoma-2,BCL2)磷酸化增加,从而使BECLIN1从BECLIN1-BCL2复合物中解离出来,游离BECLIN1可诱导自噬小体的形成和延伸[3]。(3)叉头框蛋白O3(forkhead box O3,FOXO3)途径:有研究表明,敲除FOXO3基因,抑制FOXO3蛋白表达,可明显降低肝激酶B1(liver kinase B1,LKB1)活性,减少AMPK磷酸化[10]。有报道运动可通过激活AMPK促使FOXO3去磷酸化和转移至细胞核,入核FOXO3可促使LC3、BECLIN1等表达增加,从而增强自噬[11]。(4)活性氧簇(reactive oxygen species,ROS)途径:骨骼肌收缩引起线粒体产生的ROS增多,通过调控ROS-FOXO3-LC3/BNIP3、ROS-NRF2-P62和ROS-HIF1-BNIP3/NIX等途径促使自噬发生[12]。(5)转录因子EB (transcription factor EB,TFEB)途径:运动可通过抑制糖原合成酶激酶活性或增强钙调磷酸酶活性等方式促使TFEB转移至细胞核,继而促进溶酶体合成和诱导自噬[13-15]。
综上所述,T2DM会造成骨骼肌严重损伤,而适度游泳运动对该损伤的恢复有益。并且,进一步研究发现此增益效果的内在机制可能与自噬激活有关。为了给运动治疗T2DM提供更多理论依据,更深入地探明运动对自噬信号通路的调节作用将是今后工作重点。
| [1] |
Wang L, Gao P, Zhang M, et al. Prevalence and ethnic pattern of diabetes and prediabetes in China in 2013[J]. Jama, 2017, 317(24): 2515-23. doi:10.1001/jama.2017.7596 |
| [2] |
丁煌, 唐映红, 黄小平. 自噬在脑缺血性损伤中的作用[J]. 中国药理学通报, 2015, 31(8): 1048-52. Ding H, Tang Y H, Huang X P. Effects of autophagy in cerebral ischemic injury[J]. Chin Pharmacol Bull, 2015, 31(8): 1048-52. doi:10.3969/j.issn.1001-1978.2015.08.004 |
| [3] |
He C, Bassik M C, Moresi V, et al. Exercise-induced BCL2-regulated autophagy is required for muscle glucose homeostasis[J]. Nature, 2012, 481(7382): 511-5. doi:10.1038/nature10758 |
| [4] |
Gao Q J, Bai H P, Wang Y W. Effects of aerobic exercise on autophagy-induced muscle atrophy in diabetic rats[J]. Chin J Rehabil Med, 2016, 31(7): 739-45. |
| [5] |
Xu F F, Wang N, Li G Q, et al. Establishment and assessment of mice models of type 2 diabetes mellitus[J]. Acta Acad Med Sine, 2017, 39(3): 324-29. |
| [6] |
Kim J, Cheon H, Jeong Y T, et al. Amyloidogenic peptide oligomer accumulation in autophagy-deficient beta cells induces diabetes[J]. J Clin Invest, 2014, 124(8): 3311-24. doi:10.1172/JCI69625 |
| [7] |
Jiang H, Ma Y, Yan J, et al. Geniposide promotes autophagy to inhibit insulin resistance in HepG2 cells via P62/NFkappaB/GLUT4[J]. Mol Med Rep, 2017, 16(5): 7237-44. doi:10.3892/mmr.2017.7503 |
| [8] |
Vainshtein A, Grumati P, Sandri M, et al. Skeletal muscle, autophagy, and physical activity: the menage a trois of metabolic regulation in health and disease[J]. J Mol Med, 2014, 92(2): 127-37. doi:10.1007/s00109-013-1096-z |
| [9] |
张洁, 傅力. AMPK在机体骨骼肌运动代谢适应方面的研究进展[J]. 生理科学进展, 2016, 47(5): 391-4. Zhang J, Fu L. Progress of AMPK in metabolic adaptation of skeletal muscle[J]. Progr Physiolog Sci, 2016, 47(5): 391-4. |
| [10] |
徐俊, 黄秀兰. SIRT1-FoxO-自噬通路研究进展[J]. 中国药理学通报, 2014, 30(7): 901-4. Xu J, Huang X L. Research progress on SIRT1-FoxO-autophagy pathway[J]. Chin Pharmacol Bull, 2014, 30(7): 901-4. doi:10.3969/j.issn.1001-1978.2014.07.004 |
| [11] |
Mammucari C, Milan G, Romanello V, et al. FoxO3 controls autophagy in skeletal muscle in vivo[J]. Cell Metab, 2007, 6(6): 458-71. |
| [12] |
Li L, Tan J, Miao Y, et al. ROS and autophagy: interactions and molecular regulatory mechanisms[J]. Cell Mol Neurobiol, 2015, 35(5): 615-21. |
| [13] |
Mansueto G, Armani A, Viscomi C, et al. Transcription factor EB controls metabolic flexibility during exercise[J]. Cell Metab, 2017, 25(1): 182-96. |
| [14] |
Medina D L, Di Paola S, Peluso I, et al. Lysosomal calcium signalling regulates autophagy through calcineurin and TFEB[J]. Nat Cell Biol, 2015, 17(3): 288-99. doi:10.1038/ncb3114 |
| [15] |
Parr C, Carzaniga R, Gentleman S M, et al. Glycogen synthase kinase 3 inhibition promotes lysosomal biogenesis and autophagic degradation of the amyloid-beta precursor protein[J]. Mol Cell Biol, 2012, 32(21): 4410-18. doi:10.1128/MCB.00930-12 |

