


骨组织细胞包括成骨细胞(osteoblasts,OBs)、破骨细胞(osteoclasts,OCs)、骨原细胞和骨细胞。一些骨关节疾病涉及到骨重建过程,骨重建是调节骨结构和骨重塑的一种重要代谢过程,与OCs吸收旧骨和OBs形成新骨之间的动态平衡有关。核因子受体激活因子-κB配体(receptor activator for nuclear factor-κB ligand,RANKL)是由位于人染色体13q14上的基因Tnfsf11编码的可溶性蛋白,存在于OBs、T淋巴细胞、B淋巴细胞及骨髓间充质干细胞膜上,是骨代谢重要的调节分子。骨髓中的髓系祖细胞可通过分化,产生不同形态结构、功能特征的细胞类群。其主要由RANKL介导分化,得到的多个单核巨噬细胞再经相互融合可形成多核巨细胞即OCs。OCs通过产生盐酸溶解骨中的矿物质,随后分泌金属蛋白酶,分解胶原基质,启动骨吸收,形成骨窝陷。在骨代谢过程中,OBs形成新骨填补骨窝陷,启动骨形成。OCs的过度激活,导致骨吸收超过骨形成,使骨重建代谢失衡,最终导致骨破坏[1]。本文通过在中国知网、PubMed数据库上检索OCs、分化、RANKL、骨吸收、信号通路等关键词并梳理相应文献,综述了RANKL介导OCs分化与多条信号通路的关系。
1 OPG/RANK/RANKL核因子κB受体活化因子(receptor activator for nuclear factor-κ,RANK)为NF-κB在OCs细胞膜的受体激活剂,由Tnfrfs11a编码,是一种Ⅰ型、616个氨基酸构成的同源三聚跨膜蛋白,含有4个富含半胱氨酸的胞外假重复序列,主要表达于活化的T细胞、OCs、B细胞和树突细胞。RANKL与位于OCs及其前体细胞表面的RANK结合,促进OCs与其前体细胞的分化与形成,且能抑制OCs的代谢凋亡[2]。巨噬细胞集落刺激因子(macrophage colony-stimulating factor,C-MCSF)是另一种参与单核/巨噬细胞增殖和分化的重要细胞因子,在调节OCs前体细胞和成熟OCs的存活和增殖方面发挥巨大作用,可以上调骨髓巨噬细胞中RANKL水平[3]。
骨保护素(osteoprotegerin,OPG)是一种可溶性蛋白质,属于肿瘤坏死因子受体超家族。OPG前肽含401个氨基酸残基,经翻译加工后,去除21个氨基酸残基得到成熟的OPG。OPG含有7个功能区(D1-D7),其中N端的D1-D4功能区对RANKL/RANK的结合起到抑制作用,与抑制OCs的分化直接相关。OPG/RANK/RANKL通路在骨重建过程中发挥着重要的作用,对OCs和OBs的形成皆有影响。此外,OPG/RANK/RANKL也参与糖尿病、肿瘤和心血管疾病的发生发展[4]。
2 TRAF6/RANKLRANKL有关的多条信号通路需要肿瘤坏死因子受体相关因子6 (tumor necrosis factor receptor associated factor 6,TRAF6)参与。TRAF6作为肿瘤坏死因子受体相关因子家族的一员,常被认为行使信号开关的功能。TRAF6为非常规E3泛素连接酶活性的蛋白质,其C端含有1个高度保守的TRAF结合结构域、N端含有5个锌指结构域和1个保守的RING环指结构域。RANKL与RANK结合后,触发TRAF6,随后诱导OCs前体中TRAF6-NF-κB、TRAF6-MAPKs信号通路的激活(Fig 1)。
|
|
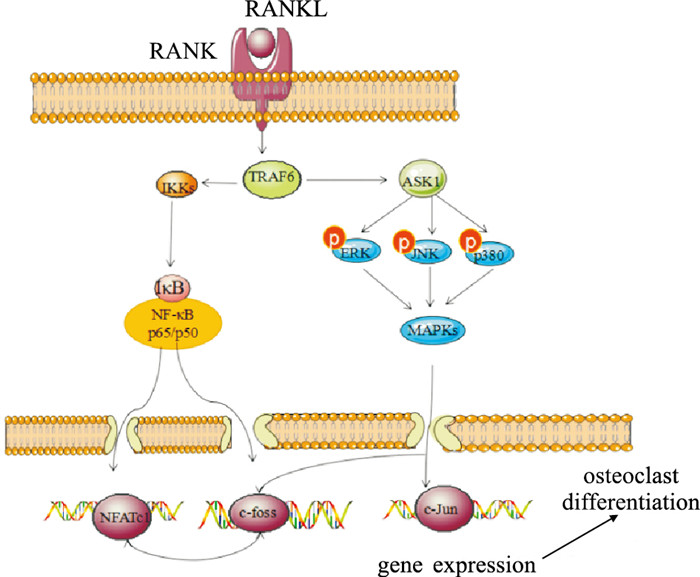
图 1 Mechanism of NF-κB and MAPK signaling pathway
Combining RANKL and RANK, TRAF6 turns on the NF-κB signaling pathway. IKKs are activated, and phosphorylate IκB with serine at specific site. The activated NF-κB is transferred into the nucleus, p50 and p65 increase the expression of c-fos and NFATc1. NFATc1 interacts with c-fos, which results in the transcription and expression of OCs gene and the differentiation of OCs. TRAF6 opens the MAPKs signaling pathway after the combination of RANKL and RANKs. ASK1 kinase is activated, JNK, ERK and p38 are phosphorylated. Then MAPKs signal is activated, c-Jun and c-fos are phosphorylated to promote the formation of osteoclasts. |
NF-κB可与多种基因的启动子或增强子结合促进基因转录,调节免疫与炎症反应中的重要转录因子之一。由TRAF6/RANKL/NF-κB信号通路介导的OCs分化,需要下游活化T细胞核因子(nuclear factor of activating T cell,NFAT)和c-fos参与。NFAT是在活化T细胞中首次发现的转录因子,是巨噬细胞活化相关的主要转录因子之一,由NFATc1-5几个成员组成。其中NFATc1是体内破骨发生的主要调节因子,调控OCs特异性基因抗酒石酸酸性磷酸酶、降钙素受体、组织蛋白酶K表达,受钙振荡信号通路影响[5]。c-fos是原癌基因,属于即早基因。c-fos与和另一个原癌基因c-Jun构成OCs分化过程中的另一个转录因子-活化蛋白-1 (activator protein 1,AP-1)。
当RANKL与RANK相结合后,TRAF6可特异性结合到RANKL胞浆区域。NF-κB抑制物激酶(inhibitor of NF-κB kinases,IKKs)被激活,活化的IKKs (IKKα和IKKβ)可使NF-κB特异性抑制因子IκB特定部位的丝氨酸磷酸化,激活NF-κB。活化的NF-κB转移到细胞核内,p50和p65引起c-fos、NFATc1表达增加,c-fos与NFATc1相互作用,引起OCs基因的转录与表达,导致OCs分化。
过氧化物酶体增殖物激活受体γ共激活因子1β (peroxisome proliferator-activated receptor γ coactiva-tor-1β,PGC-1β)做为NFATc1上游信号分子,能提高外周血CD14单核细胞中NFATc1的mRNA水平,并与NFATc1启动子区结合,激活NFATc1转录,PGC-1β可以通过NFATc1途径促进破骨作用[6]。而OCs的负调控因子NIP45 (45 ku的NFAT相互作用蛋白),其与TRAF6和NFATc2相互作用,抑制细胞中NFATc2表达,影响RANKL介导的NF-κB信号通路[7]。在RANKL刺激下,NF-κB的转录活性显著提高。NF-κB调节多种基因的表达,诱发各种炎性细胞因子分泌,释放细胞存活信号而减少细胞凋亡,导致关节滑膜异常增生[8]。
2.2 TRAF6-MAPKs丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)是细胞内的一类丝氨酸/苏氨酸蛋白激酶,主要由3条信号转导途径组成:细胞外信号调节激酶1/2 (extracellular signal-regulated kinase,ERK1/2)、氨基末端激酶(Jun N-terminal kinase,JNK)和p38-MAPK[9]。MAPKs信号通路可控制各种细胞活性,包括基因表达、有丝分裂、分化和细胞存活和凋亡等。其中ERK对OCs分化至关重要,p38、JNK磷酸化以响应RANKL的刺激,参与OCs的分化、生长、功能以及其他生理活动。实验证明RANKL刺激巨噬细胞分化成OCs过程中,ERK、JNK和p38的磷酸化水平明显升高[10]。
与RANKL/TRAF6/NF-κB途径相同,RANK和RANKL结合后,TRAF6被激活,激活ASK1激酶,磷酸化JNK、ERK和p38,激活MAPKs信号,通过调节AP-1的表达,磷酸化c-Jun和c-foss的转录,促进OCs生成[11]。
氧化应激是外界刺激或病理条件下, 体内氧化与抗氧化失衡,导致体内活性氧(reactive oxygen species,ROS)含量增加的一种状态。氧化应激状态通过体内一系列的细胞信号传导来影响骨代谢,常表现为OCs异常活跃而OBs功能受限。ROS是体内一类氧的单电子还原产物,作为生理第二信使并氧化酪氨酸磷酸酶,抑制MKPs并激活MAPKs,对OCs的分化产生影响。维生素B5可以通过清除ROS,抑制RANKL诱导的OCs生成。强调了ROS与MAPK信号通路的关系,以及对OCs的作用[12]。
用6, 7, 4′-三羟基黄酮处理RAW264.7细胞后,p-JNK和JNK的上游因子p-c-Jun的表达受到抑制,MAPKs通路受到影响。发现通过抑制MAPKs信号通路,可以达到抑制RANKL诱导OCs分化的目的,并通过破坏成熟OCs中的肌动蛋白环来抑制骨吸收[13]。中药落新妇中的提取物落新妇苷可以通过阻断钙离子振荡和抑制p65和IKKβ,影响NF-κB信号通路和MAPKs途径抑制OCs的生成[14],表明NF-κB信号通路和MAPK信号通路能共同发挥作用。
3 JAK2/STAT3/RANKLJAK激酶(Janus kinase, JAK)家族是一类非受体酪氨酸激酶家族,有4个成员:JAK1、JAK2、JAK3及TYK1。除TYK1主要存在于造血干细胞中外,JAK1、JAK2及JAK3广泛存在各种细胞内,由多个细胞因子传递信号并介导多种反应。信号传导及转录激活蛋白(signal transducer and activator of transcription,STAT)是JAK家族下游底物,由7个不同基因编码的成员构成,分别为STAT1-4、STAT5A、STAT5B及STAT6。刺激后的STAT蛋白会发生不同程度的活化,在细胞增殖、生长、分化及凋亡等多种生理过程中发挥重要作用。JAK/STAT信号通路,广泛用于多种炎症性疾病,如:结肠癌、类风湿关节炎(rheumatoid arthritis,RA)、阿尔茨海默病、肺癌等。该信号通路能够将受体接收到的膜外刺激信号传导入细胞内,进而调控下游相关基因的表达,实现受体-JAK-STAT-靶基因激活的高效信号传导反应,其中RANKL的表达与JAK2/STAT3信号通路关系密切。
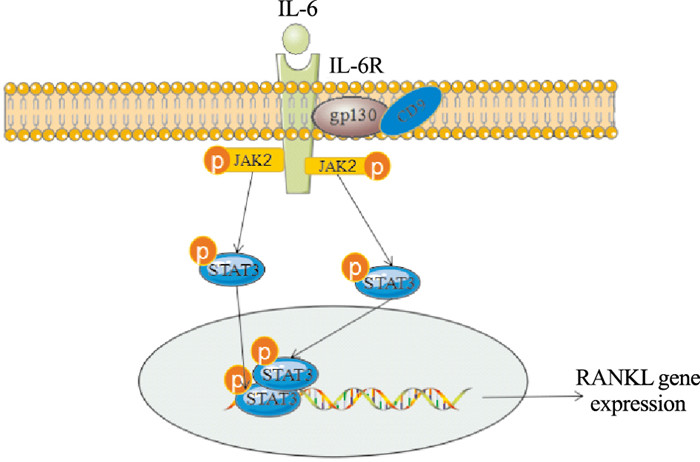
由IL-6/IL-6R复合物诱导的RANKL需要STAT3激活,JAK2/STAT3是IL-6的下游信号通路,IL-6与IL-6R结合后,形成由两分子IL-6、两分子IL-6Rα和两分子gp130组成的三元六聚体复合物,并向胞内转导信号,活化胞内的JAK激酶。活化的JAK激酶磷酸化gp130胞内侧的酪氨酸激酶残基,招募并活化信号转导因子STAT3,磷酸化的STAT3转位至胞核内,结合相应的DNA反应元件,激活RANKL基因转录,从而大量表达RANKL[15]。其他的细胞因子也可以通过JAK/STAT信号通路参与OCs的调节,在RANKL诱导下,IL-24转染后的RAW264.7细胞中JAK2和STAT3 mRNA的表达水平增高[16] (Fig 2)。
|
| 图 2 Mechanism of JAK2/STAT3/RANKL signaling pathway After IL-6 combines with IL-6R and gp130, JAK kinase is activated.The signal transduction factor STAT3 is phosphorylated. The phosphorylated STAT3 is translocated into the nucleus, which activates the transcription of RANKL gene and results in the expression of RANKL. |
缺氧是氧需求大于氧供应时一个重要的微环境参数,与肿瘤生长、侵袭和血管生成有关。在缺氧条件下,OCs分化受到影响[17]。在缺氧微环境中,缺氧诱导因子1α (hypoxia-inducible factor-1α,HIF-1α)水平明显提高,通过JAK2/STAT3信号通路,上调RANKL的表达,在骨形成、重塑和稳态中起着重要作用。采用JAK2抑制剂AG490,通过JAK2/STAT3途径,抑制NFATc1的产生和OCs分化,以及抑制HIF-1α与RANKL的过度表达,影响OCs的形成[18]。靶向STAT3治疗是治疗RA等与OCs相关性疾病的一种策略。他汀类药物stattic是一种常见STAT3小分子抑制剂,能使磷酸肽与STAT 3的SH2结构域的结合在体外受到抑制,有效抑制STAT3激活和核移位,抑制RANKL介导的OCs生成[19]。
4 Wnt/RANKLWnt信号通路包括经典Wnt/β-catenin信号途径和非经典Wnt信号通路。其中Wnt/β-catenin信号通路被广泛研究,Wnt配体是分泌脂质修饰的信号糖蛋白家族成员,其与受体Frizzled和低密度脂蛋白受体相关蛋白5/6 (low-density lipoprotein receptor-related protein 5/6,LRP5/6)结合,形成Axin相互作用区域,减弱β-catenin的磷酸化,以此达到稳定细胞质内β-catenin的目的。当β-catenin达到一定量的时候,β-catenin蛋白进入细胞核与TCF/LEF转录因子结合,激活下游靶基因完成转录,上调骨靶基因Runx2的表达,促进OBs增殖、分化。Wnt/β-catenin通路联合OPG/RANK/RANKL途径,从OBs和OCs两方面影响骨代谢平衡。通过促进OBs的生长分化,上调OPG含量,降低RANKL/OPG比值,抑制OCs分化,从而诱导骨形成[20]。
Dickkopf-1作为内源性Wnt通路的负调控蛋白,是Wnt信号通路的可溶性拮抗剂。Dickkopf-1通过LPR5/6结合,通过与单次跨膜蛋白Kream2结合,形成三聚体复合物,从而快速启动细胞内吞,除去表面LRP蛋白受体,干扰Wnt信号通路,抑制β-catenin的生成[21]。研究发现,在RA患者血清中,Dickkopf-1水平明显提高,干扰RANKL/OPG比值。Dickkopf-1促进M-CSF和RANKL的表达,下调OPG的表达,加剧OCs分化[22]。
值得关注的是,Wnt/β-catenin信号通路可以促进炎性细胞因子TNF-α、白介素家族的分泌,这些炎性细胞因子不仅在免疫方面发挥作用,也会使骨重建失衡。TNF-α可以通过提高巨噬细胞和干细胞中RANKL和RANK的水平,刺激RANKL与其受体RANK结合,从而激活RANKL调控的其他信号通路,介导OCs的增殖和分化。同时,TNF-α也可以参与非经典途径,与其他细胞因子如TGF-β结合或直接诱导OCs的分化[23]。
Wnt信号通路中的配体Wnt 5a可以促进OBs分泌炎性细胞因子IL-6、IL-15,促进RANKL的表达。Wnt3a不会直接影响IL-6的产生,但可抑制TNF-α刺激IL-6释放过程,IL-6的减少会降低OCs的生成。Wnt3a甚至可以通过抑制RANKL介导的NF-κB诱导的NFATc1表达来限制OCs的形成。在非经典Wnt信号通路中,Wnt4参与TAK1和NF-κB的激活,NF-κB被激活可引起OCs分化基因的表达,进而增加骨吸收[24-25]。
5 总结与展望近年来,人们对骨相关性疾病越来越重视。骨质疏松、骨关节炎、骨硬化病、原发性骨肿瘤、溶骨性骨转移,已严重危害人体健康。在骨细胞微环境中,OBs与OCs复杂的生物学功能相互联系,源于OBs的RANKL介导的多条信号通路与OCs的分化密切相关。OCs过度分化导致骨吸收与骨形成失衡是骨相关性疾病的诱因之一。因此,研究RANKL介导的诱导破骨细胞分化的相关经典信号通路具有一定意义。通过调研相关文献,了解到RANKL联合多通路、多靶点,参与OCs的分化。此外,多种炎性细胞因子也参与了RANKL介导的经典信号通路,在骨免疫学方面,RANKL调控OPG/RANK/RANKL、TRAF6/RANKL/NF-κB、TRAF6/RANKL/MAPKs、JAK2/STAT3/RANKL、Wnt/RANKL经典信号通路影响OCs的分化。目前,用于治疗骨相关性疾病抗RANKL的人单克隆抗体已被FDA批准。RANKL介导的诱导OCs分化的相关信号通路将成为未来研究的热点。
| [1] |
Park J, Zhang X, Lee S K, et al. CCL28-induced RARβ expression inhibits oral squamous cell carcinoma bone invasion[J]. J Clin Invest, 2019, 129(12): 5381-99. doi:10.1172/JCI125336 |
| [2] |
Ikebuchi Y, Aoki S, Honma M, et al. Coupling of bone resorption and formation by RANKL reverse signalling[J]. Nature, 2018, 561(7722): 195-200. doi:10.1038/s41586-018-0482-7 |
| [3] |
Chen X, Wang C, Qiu H, et al. Asperpyrone A attenuates RANKL-induced osteoclast formation through inhibiting NFATc1, Ca signalling and oxidative stress[J]. J Cell Mol Med, 2019, 23(12): 8269-79. doi:10.1111/jcmm.14700 |
| [4] |
Pieralice S, Vigevano F, Del Toro R, et al. Lifestyle management of diabetes: Implications for the bone-vascular axis[J]. Curr Diab Rep, 2018, 18(10): 84. doi:10.1007/s11892-018-1060-y |
| [5] |
Liu Y, Wang C, Wang G, et al. Loureirin B suppresses RANKL-induced osteoclastogenesis and ovariectomized osteoporosis via attenuating NFATc1 and ROS activities[J]. Theranostics, 2019, 9(16): 4648-62. doi:10.7150/thno.35414 |
| [6] |
Ma J D, Jing J, Wang J W, et al. Activation of the peroxisome proliferator-activated receptor γ coactivator 1β/NFATc1 pathway in circulating osteoclast precursors associated with bone destruction in rheumatoid arthritis[J]. Arthritis Rheumatol, 2019, 71(8): 1252-64. doi:10.1002/art.40868 |
| [7] |
Shanmugarajan S, Haycraft C J, Reddy S V. NIP45 negatively regulates RANK ligand induced osteoclast differentiation[J]. J Cell Biochem, 2012, 113(4): 1274-81. doi:10.1002/jcb.23460 |
| [8] |
He Y, Zhang Q, Shen Y, et al. Schisantherin A suppresses osteoclast formation and wear particle-induced osteolysis via modulating RANKL signaling pathways[J]. Biochem Biophys Res Commun, 2014, 449(3): 344-50. doi:10.1016/j.bbrc.2014.05.034 |
| [9] |
刘亭, 毕竟, 王盼, 等. MAPK/ERK信号通路参与褪黑素对阿尔茨海默病大鼠小脑的神经保护作用[J]. 中国药理学通报, 2019, 35(3): 402-7. Liu T, Bi J, Wang P, et al. Neuroprotective effect of melatonin in cerebellums in Alzheimer's disease animal models via MAPK/ERK signaling pathway[J]. Chin Pharmacol Bull, 2019, 35(3): 402-7. doi:10.3969/j.issn.1001-1978.2019.03.021 |
| [10] |
Zhou F, Mei J, Yuan K, et al. Isorhamnetin attenuates osteoarthritis by inhibiting osteoclastogenesis and protecting chondrocytes through modulating reactive oxygen species homeostasis[J]. J Cell Mol Med, 2019, 23(6): 4395-7. doi:10.1111/jcmm.14333 |
| [11] |
Zhang Q, Tang X, Liu Z, et al. Hesperetin prevents bone resorption by inhibiting RANKL-induced osteoclastogenesis and Jnk mediated Irf-3/c-Jun activation[J]. Front Pharmacol, 2018, 9: 1028. doi:10.3389/fphar.2018.01028 |
| [12] |
Ma Q, Liang M, Tang X, et al. Vitamin B5 inhibit RANKL induced osteoclastogenesis and ovariectomy induced osteoporosis by scavenging ROS generation[J]. Am J Transl Res, 2019, 11(8): 5008-18. |
| [13] |
Kim E N, Kim Y G, Lee J H, et al. 6, 7, 4'-Trihydroxyflavone inhibits osteoclast formation and bone resorption in vitro and in vivo[J]. Phytother Res, 2019, 33(11): 2948-59. doi:10.1002/ptr.6468 |
| [14] |
Jin H, Wang Q, Chen K, et al. Astilbin prevents bone loss in ovariectomized mice through the inhibition of RANKL-induced osteoclastogenesis[J]. J Cell Mol Med, 2019, 23(12): 8355-68. doi:10.1111/jcmm.14713 |
| [15] |
Choe JY, Park KY, Park SH, et al. Regulatory effect of calcineurin inhibitor, tacrolimus, on IL-6/sIL-6R-mediated RANKL expression through JAK2-STAT3-SOCS3 signaling pathway in fibroblast-like synoviocytes[J]. Arthritis Res Ther, 2013, 15(1): R26. doi:10.1186/ar4162 |
| [16] |
孟庆阳, 孙宏晨, 史册, 等. 白细胞介素-24通过Jak-Stat通路对破骨细胞影响的实验研究[J]. 口腔医学研究, 2015, 31(8): 779-82. Meng Q Y, Sun H C, Shi C, et al. Effect of IL-24 on osteoclasts through Jak-Stat signaling pathway[J]. J Oral Sci Res, 2015, 31(8): 779-82. |
| [17] |
Zhong W Q, Li Z Z, Jiang H, et al. Elevated ATF4 Expression in odontogenic keratocysts epithelia: Potential involvement in tissue hypoxia and stromal M2 macrophage infiltration[J]. J Histochem Cytochem, 2019, 67(11): 801-12. doi:10.1369/0022155419871550 |
| [18] |
Zhu J, Tang Y, Wu Q, et al. HIF-1α facilitates osteocyte-mediated osteoclastogenesis by activating JAK2/STAT3 pathway in vitro[J]. J Cell Physiol, 2019, 234(11): 21182-92. doi:10.1002/jcp.28721 |
| [19] |
Li C H, Xu L L, Jian L L, et al. Stattic inhibits RANKL-mediated osteoclastogenesis by suppressing activation of STAT3 and NF-κB pathways[J]. Int Immunopharmacol, 2018, 58: 136-44. doi:10.1016/j.intimp.2018.03.021 |
| [20] |
Hong G, He X, Shen Y, et al. Chrysosplenetin promotes osteoblastogenesis of bone marrow stromal cells via Wnt/β-catenin pathway and enhances osteogenesis in estrogen deficiency-induced bone loss[J]. Stem Cell Res Ther, 2019, 10(1): 277. |
| [21] |
Karam N, Lavoie J F, St-Jacques B, et al. Bone-specific overexpression of PITX1 induces senile osteoporosis in mice through deficient self-renewal of mesenchymal progenitors and Wnt pathway inhibition[J]. Sci Rep, 2019, 9(1): 3544. doi:10.1038/s41598-019-40274-6 |
| [22] |
Honsawek S, Tanavalee A, Yuktanandana P, et al. Dickkopf-1 (Dkk-1) in plasma and synovial fluid is inversely correlated with radiographic severity of knee osteoarthritis patients[J]. BMC Musculoskelet Disord, 2010, 11: 257. doi:10.1186/1471-2474-11-257 |
| [23] |
Kanazawa K. TRAF2 is essential for TNF-alpha-induced osteoclastogenesis[J]. J Bone Miner Res, 2005, 20(5): 840-7. |
| [24] |
Tian F, Mauro T M. The pathological role of Wnt5a in psoriasis and psoriatic arthritis[J]. J Cell Mol Med, 2019, 23(9): 5876-83. doi:10.1111/jcmm.14531 |
| [25] |
Sun T, Yan Z, Cai J, et al. Effects of mechanical vibration on cell morphology, proliferation, apoptosis, and cytokine expression/secretion in osteocyte-like MLO-Y4 cells exposed to high glucose[J]. Cell Biol Int, 2019. doi:10.1002/cbin.11221 |

