

根据禽痛风临床症状不同分为关节型痛风和内脏型痛风,内脏型痛风是由于禽类动物尿酸产生过多兼或尿酸排泄障碍导致血液中尿酸含量显著升高,形成高尿酸血症,进而以尿酸盐沉积胸腹腔及各种脏器表面和其他间质组织中的一种疾病[1]。
引发禽内脏型痛风的诱因大多为高嘌呤或高钙饮食,郭小权[2]使用高蛋白质饲粮和高钙饲粮成功复制了鸡内脏型痛风病例,证实了饲粮蛋白质和钙对禽内脏型痛风发生的重要影响。这与人类因饮酒、大量进食海鲜类及动物内脏等嘌呤过多的食物从而诱发痛风的临床发病病因极为相似,且禽类的嘌呤代谢途径与人类相似,饲料摄入的蛋白质和嘌呤也以尿酸为代谢终产物排出体外。因此本研究则选用体积较小便于实验操作的鹌鹑为研究对象,以高嘌呤高钙饮食结合限制饮水来诱导鹌鹑禽内脏型痛风模型,以期为禽类、人类痛风的发病机制及防治药物的筛选提供实验依据。
1 材料与方法 1.1 动物40日龄,♂, 迪法克鹌鹑30只,体质量(130±10) g,购自北京市德岭鹌鹑厂,合格证号: 1100368967。
1.2 饲料选用酵母浸膏粉和牛骨粉添加至普通饲料中作为高嘌呤高钙食饵。在实验室前期基础上,高嘌呤高钙饲料配比为,基础饲料:酵母浸膏粉:牛骨粉为5 :2 :3。其中正常组饲喂普通饲料其钙含量为1%,模型组饲喂高嘌呤高钙饲料其钙含量为24%;正常组普通饲料中嘌呤含量为79.28 mg·kg-1,模型组高嘌呤高钙饲料中嘌呤含量为424.83 mg·kg-1。日粮中其余营养成分均符合美国NRC家禽营养需要标准[3]。日粮组成见Tab 1。
| Diet composition | Normal group | Model group |
| Corn | 55 | 26 |
| Soybean meal | 33 | 15.6 |
| Fish meal | 2 | 1 |
| Stone powder | 5 | 2.4 |
| Bovine bone meal | - | 30 |
| Yeast extract powder | - | 20 |
| Premix | 5 | 5 |
| Total | 100 | 100 |
| Note: Guarantee value of component analysis of premixtures (per kg): vitamin A 200 000 IU, vitamin D3 60 000 IU, vitamin E 380 mg, vitamin K3 56 mg, vitamin B1 56 mg, vitamin B2 200 mg, vitamin B6 60 mg, vitamin B12 300 μg, biotin 3 mg, nicotinic acid 600 mg, calcium pantothenate 240 mg, folate 30 mg, copper 0.2 g, iron 1.8 g, manganese 1.4 g, zinc 1.1 g, selenium 6 mg, iodine 8.5 mg, phosphorus 15~60 g, calcium 100~250 g, sodium chloride 50~150 g, amino acid 28 g. | ||
普通饲料,批号:20180625,购自北京市德岭鹌鹑厂; 酵母浸膏粉,批号:1424987-02,购自英国Oxoid公司; 牛骨粉,批号:20180715,购自衡水爱宠商贸有限公司; 尿素氮测定试剂盒(Urea nitrogen determination kit,BUN),批号:20180908,肌酐测定试剂盒(Creatinine determination kit,Cr),批号:20180921,黄嘌呤氧化酶试剂盒(Xanthine oxidase Kit,XOD),批号:201812016,腺苷脱氨酶试剂盒(Adenosine deaminase Kit,ADA),批号:20180911,均购自南京建成生物技术公司; 尿酸测定试剂盒(Uric acid determination kit,UA),批号:171314,购自中生北控生物科技股份有限公司; 尿酸盐染色试剂盒,批号:20180604;购自北京索莱宝科技有限公司。
1.4 仪器与设备3K1S低温高速离心机,德国Sigma公司; sunrise酶标仪,瑞士TECAN公司; DHG-9070A电热恒温鼓风干燥箱,北京鸿达天矩试验设备有限公司; Reichert Histo STAT石蜡组织切片机,美国AO公司; Olmpus BX53显微镜,日本奥林巴斯。
1.5 分组与造模40日龄♂迪法克鹌鹑30只,适应性饲养3~5 d,按体质量随机分为3组,分别为正常组、模型A组和模型B组,每组各10只。实验期间各组鹌鹑均给予清水,正常组、模型A组饮水不限量,模型B组饮水150 mL·d-1。且正常组和模型组均按照Tab 1进行饲料配制,摄食不限量,每天记录摄食量。实验周期为40 d,d 40鹌鹑颈静脉取血1.5 mL后处死,取各组鹌鹑肾脏组织固定、制作石蜡切片。控制动物房室温(20~25) ℃,湿度40%~60%。
1.6 检测指标分别于实验d 10、20、30、40,禁食不禁水12 h,颈静脉取血,3 500 r·min-1离心10 min,分离血清,取上清以备用。检测血清尿酸(SUA)、黄嘌呤氧化酶(XOD)、腺苷脱氨酶(ADA)、尿素氮(BUN)、肌酐(Cr)水平。
1.7 统计学处理使用SAS9.0软件进行统计分析,数据均x±s表示,多组间数据比较根据各组正态及方差齐与否选择单因素方差分析或是Kruskal-Wallis轶和检验,组间两两比较根据方差齐与否选择采用Dunnett-t检验或Dunnett’s T3检验。
2 结果 2.1 鹌鹑摄食量和体质量变化实验期间,与正常组比,d 20、d 30模型A组、模型B组摄食量出现极显著增多(P < 0.01),d 40模型A组摄食量出现显著增多(P < 0.05)。具体变化见Tab 2;各组鹌鹑体质量呈平稳上升趋势,模型B组与模型A组相比,实验d 20,鹌鹑体质量显著增加(P < 0.05),见Tab 3。
| Group | 10 d | 20 d | 30 d | 40 d |
| Normal | 23.91±2.64 | 28.96±2.01 | 27.11±2.31 | 32.09±1.57 |
| Model A | 23.36±3.83 | 31.74±1.96** | 33.83±1.84** | 34.34±2.07* |
| Model B | 22.23±6.17 | 32.12±1.41** | 32.76±1.45** | 32.39±3.26 |
| *P < 0.05, **P < 0.01 vs normal | ||||
| Group | 0 d | 10 d | 20 d | 30 d | 40 d |
| Normal | 137.00±6.86 | 151.15±7.70 | 155.89±9.31 | 157.71±10.41 | 152.73±10.42 |
| Model A | 132.33±10.53 | 148.88±11.25 | 152.99±14.21 | 159.60±15.47 | 154.16±13.11 |
| Model B | 138.17±7.60 | 154.99±8.06 | 165.81±11.82# | 170.68±16.22 | 166.56±13.12 |
| #P < 0.05 vs model A | |||||
与正常组相比,实验d 10、20、30,模型A和B组鹌鹑血尿酸水平极显著升高(P < 0.01)。d 40,模型A和B组动物血尿酸水平显著升高(P < 0.05);与模型A组比,实验d 20,模型B组血尿酸水平极显著升高(P < 0.01),d 30,模型B组显著降低(P < 0.05),见Tab 4。
| Group | 10 d | 20 d | 30 d | 40 d |
| Normal | 164.32±69.57 | 196.52±56.99 | 186.37±81.90 | 254.79±98.55 |
| Model A | 308.80±86.34** | 368.32±103.53** | 389.55±114.50** | 392.95±103.50* |
| Model B | 365.3±101.12** | 504.55±110.71**# | 277.30±58.36**# | 379.06±96.45* |
| *P < 0.05, **P < 0.01 vs normal, #P < 0.05 vs model A | ||||
与正常组相比,实验d 20,模型A组血清黄嘌呤氧化酶活性水平显著降低(P < 0.05);d 10、30、40,与正常组相比,其余两组动物血清黄嘌呤氧化酶活性水平无明显变化。见Tab 5。
| Group | 10 d | 20 d | 30 d | 40 d |
| Normal | 3.44±0.35 | 3.79±1.09 | 3.40±0.65 | 3.62±1.20 |
| Model A | 3.47±1.08 | 2.75±0.53* | 3.19±0.62 | 3.12±0.80 |
| Model B | 3.90±1.27 | 3.08±0.60 | 3.08±0.78 | 3.34±1.10 |
| *P < 0.05 vs normal | ||||
实验d 10,与正常组相比,模型A组、模型B组血清腺苷脱氨酶活性极显著升高(P < 0.01);实验d 30,与正常组相比,模型A组、模型B组血清腺苷脱氨酶活性显著升高(P < 0.05)。见Tab 6。
| Group | 10 d | 20 d | 30 d | 40 d |
| Normal | 35.64±22.88 | 46.38±17.25 | 31.25±10.76 | 58.17±38.04 |
| Model A | 73.52±24.94** | 54.25±11.55 | 47.32±8.48** | 81.50±47.54 |
| Model B | 98.71±32.35** | 29.48±8.64 | 46.07±14.13* | 63.64±44.52 |
| *P < 0.05, **P < 0.01 vs normal | ||||
实验d 20,与模型A组相比,模型B组动物血肌酐水平均显著升高(P < 0.05)。实验d 30、40,与正常组相比,模型A和B组动物血肌酐水平均显著升高(P < 0.05)。见Tab 7。
| Group | 10 d | 20 d | 30 d | 40 d |
| Normal | 40.50±11.70 | 73.22±17.19 | 55.52±10.25 | 54.83±9.79 |
| Model A | 45.21±6.04 | 72.92±7.52 | 67.38±10.54* | 73.90±21.26* |
| Model B | 47.09±7.26 | 88.76±14.44# | 82.76±24.77* | 73.78±19.15* |
| *P < 0.05 vs normal, #P < 0.05 vs model A | ||||
实验d 10、20,与正常组相比,模型A、B各组鹌鹑血清尿素氮水平显著升高(P < 0.05),见Tab 8。
| Group | 10 d | 20 d | 30 d | 40 d |
| Normal | 0.42±0.13 | 0.51±0.09 | 0.96±0.21 | 1.61±0.43 |
| Model A | 0.81±0.36* | 0.78±0.30* | 1.08±0.35 | 1.89±0.61 |
| Model B | 0.58±0.16* | 0.69±0.18* | 1.10±0.37 | 1.55±0.45 |
| *P < 0.05 vs normal | ||||
鹌鹑肾脏病理切片HE染色400倍光学显微镜下可见正常组鹌鹑肾组织结构清晰,细胞核蓝染,胞质均匀红染,肾小球、肾小管结构正常。模型A、B组肾组织结构未见明显异常,组织结构清晰,肾小管上皮细胞形态正常。见Fig 1。
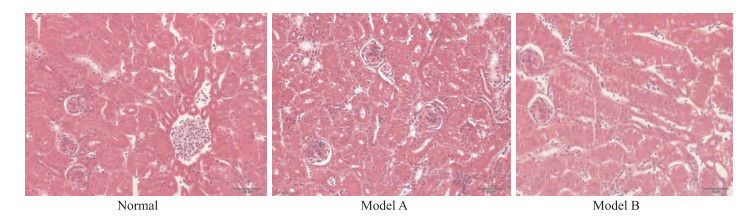
|
| Fig 1 Observation of HE staining in renal histopathological sections (×400) |
鹌鹑肾脏病理切片尿酸盐染色400倍光学显微镜下可见,正常组鹌鹑肾组织中未见黑色尿酸盐结晶沉积,模型组鹌鹑肾组织明显可见黑色的尿酸盐结晶沉积于肾小管,且近曲小管和远曲小管均有分布。模型B组因结合限水,结果相较于模型A组明显可见较大量黑色的尿酸盐结晶沉积于肾小管。见Fig 2。
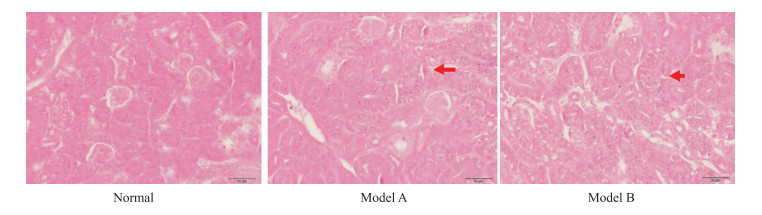
|
| Fig 2 Urate staining of renal histopathological sections(×400) |
实验结果显示,高嘌呤高钙饮食结合限水会持续升高动物体内血尿酸水平,其原因可能是通过调节动物体内腺苷脱氨酶(ADA)活性来增加尿酸在体内的合成,从而使动物机体保持高尿酸的状态,同时会对动物肾脏功能造成一定的损伤,进一步加剧尿酸盐在体内的沉积。实验中模型组以酵母浸膏粉作为高嘌呤食饵饲喂鹌鹑,为尿酸的合成提供了更多的原料,进而引发鹌鹑高尿酸血症。由于鹌鹑体内缺乏尿酸酶,摄入的嘌呤都以尿酸为代谢终产物排出体外,当血尿酸水平过高超过了排泄限值时,极易与血液中钙、钠离子结合,以尿酸盐的形式存在而堵塞肾小管[4]。肾组织钙化和肾小管堵塞则会加重尿酸排泄障碍,最终诱发痛风的发生。
水维系着动物机体内环境的稳定,保证组织器官及各类细胞的正常活动[5]。在禽的饲养过程中,若饮水不足,会造成机体脱水,促使尿浓缩,机体的代谢产物不能及时排出体外[6]。有学者推测限制饮水量不利于尿酸排出,易引起尿酸肾结石,加速肾脏进行性损害。肾脏在动物排泄尿酸时发挥着主要作用,肾脏损伤会影响尿酸的排泄,肾小管分泌减少,导致尿酸蓄积,与离子结合形成尿酸盐,发生尿酸盐沉积[7]。
3.2 鹌鹑内脏型痛风模型的特点 3.2.1 模型与人体病生理具有相似性动物模型和人体的生物相似性是开展动物实验的理论基础。本实验选用鹌鹑作为实验动物,原因为鹌鹑在生理特点及病理特点方面与人类有较高的相似性。①生理特点:鹌鹑缺乏尿酸酶,与人类代谢途径相似,摄入的核酸类物质在体内降解后产生的尿酸无法进一步分解,尿酸作为嘌呤代谢的终产物直接排出体外,其体内尿酸浓度能较确切的反应体内嘌呤核苷酸代谢水平[8]。②病理特点:采用添加酵母浸膏粉和骨粉配制的高嘌呤高钙食饵进行模型诱导,该造模剂与临床饮食结构改变类似。造模d 10模型组动物血清尿酸水平升高,动物表现为高尿酸血症,并可持续到d 40。同时,鹌鹑肾脏病理切片尿酸盐染色(阳性反应时尿酸盐结晶被染成黑色)发现,正常组鹌鹑肾脏病理切片未见黑色尿酸盐沉积,而模型组肾脏组织病理切片肾小管周围散布黑色尿酸盐结晶沉积,且模型B组结合限制饮水量后,肾脏中尿酸盐沉积量较模型A组明显。
本实验模型组鹌鹑采食高嘌呤高钙食饵与临床的致病因素饮食不节、过食肥甘厚味类似; 病机方面分析认为过食高嘌呤高钙饮食,可损伤脾胃,使脾运化失健,湿浊停留体内,浊毒不得外泄,形成高尿酸血症。且在实验过程中发现个别鹌鹑踝关节肿大、畸形。可见,该模型在病因病机与临床痛风患者的病因病机十分相似。
3.2.2 模型具有稳定性、可重复性黄丽霞等[9]通过饲喂鸡高蛋白、高钙造模饲料, 并控制每只鸡每日进水量100 mL,来复制鸡痛风症动物模型,结果显示:模型组鸡血尿酸水平显著高于正常对照组。匡红艳等[10]对鸡持续高尿酸血症模型的制备方法研究中,同样在高钙高蛋白饮食的基础上对每只鸡每日限水50 mL,结果显示,模型动物血尿酸值显著升高。应用高钙高蛋白饲料制作禽高尿酸血症模型是一种比较成熟的方法。高嘌呤饮食为尿酸在体内的合成提供了前提物质,高钙饮食则增加了血液中钙离子的浓度,当体内血尿酸水平过高时,两者极易以尿酸盐的形式存在而堵塞肾小管,联合限水则会进一步减少尿酸的排泄,促使尿酸水平在体内急剧上升,从而加速尿酸盐在体内的沉积。
3.2.3 模型具有适用性、经济性该方法诱导的鹌鹑内脏型痛风模型属饮食诱导法,模拟临床饮食结构改变,成功建立动物内脏型痛风模型。适用于作为营养代谢性疾病的病理药理研究及痛风的中医药基础研究。王巍等[11]采用鹌鹑作为高血脂血症模型,有研究采用鹌鹑作为高尿酸血症模型[12-13],鹌鹑作为实验动物已逐渐应用于生物学与医学研究。日本学者Tsudzuki及Mizutani提出鹌鹑可作为一种新型实验动物,由于鹌鹑是鸡形目中最小的品种,体型适中,性成熟早,易于饲养管理,饲料消耗少,占空间小,目前已逐渐应用于生物学与医学研究[14-15]。本实验采用酵母粉和骨粉诱导的鹌鹑内脏型痛风模型,造模剂配制简单,价格合理,模型稳定时间长,实验操作方便,取血方法简单,便于动态观察且可减少动物使用数量,经济性较好。
综上,本实验以鹌鹑为实验对象,通过高嘌呤高钙饮食结合限水研究,结果显示其可明显升高动物体内血清尿酸水平,且能对动物肾脏产生明显的病理变化,使尿酸盐沉积于肾脏,为禽类内脏型痛风模型的建立提供了条件。模型研究不足之处:未观察其他脏器是否出现尿酸盐沉积现象。且研究应进一步深入,对模型的中医证候及应用范围加以研究,以期为该病的防治及药物研发提供参考。
| [1] |
呙于明. 家禽营养[M]. 北京: 中国农业大学出版社, 2004: 287-9. Guo Y M. Poultry Nutrition[M]. Beijing: China Agricultural University Press, 2004: 287-9. |
| [2] |
郭小权.高钙日粮致鸡痛风的机制研究[D].南京: 南京农业大学, 2005. Guo X Q. Mechanism of chicken gout induced by high calcium diet[D]. Nanjing: Nanjing Agricultural University, 2005. |
| [3] |
NRC.Nutrient requirements of poultry[S]. Washington, D.C.: National Academy Press, 1994.
|
| [4] |
骆建兵.高钙高蛋白日粮对鸡肝肾功能与酸碱平衡的影响及痛风形成机理研究[D].南京: 南京农业大学, 2006. Luo J B. Effects of high calcium and protein diet on liver and kidney function and acid-base balance in chickens and mechanism of gout formation[D]. Nanjing: Nanjing Agricultural University, 2006. |
| [5] |
徐惠亮. 畜禽对水的需要[J]. 中国畜禽种业, 2018, 14(10): 66. Xu H L. Water needs of livestock and poultry[J]. Chin Livest Poultry Breeding, 2018, 14(10): 66. doi:10.3969/j.issn.1673-4556.2018.10.052 |
| [6] |
张红军. 鸡痛风症的诊治[J]. 兽医导刊, 2017(11): 53-4. Zhang H J. Diagnosis and treatment of chicken gout[J]. Vet Ori, 2017(11): 53-4. |
| [7] |
王海鸽, 张冰, 林志健, 等. 高蛋白高钙日粮对鹌鹑尿酸代谢及痛风发生的影响[J]. 中国家禽, 2018, 40(19): 22-7. Wang H G, Zhang B, Lin Z J, et al. Effects of high protein and high calcium diet on uric acid metabolism and gout occurrence in quails[J]. Chin Poultry, 2018, 40(19): 22-7. |
| [8] |
Campbell C E, Braun E J. Cecal degradation of uric acid in Gambel quail[J]. Am J Physiol Regul Integr Comp Physiol, 1986, 251(1): 59-62. doi:10.1152/ajpregu.1986.251.1.R59 |
| [9] |
黄丽霞, 张慧, 黄承初, 等. 通痹祛风汤对鸡痛风病模型血尿酸代谢的影响[J]. 中外医疗, 2008(27): 59. Huang L X, Zhang H, Huang C C, et al. Effect of Tongbi Qufeng Decoction on blood uric acid metabolism in chicken gout model[J]. Chin Foreign Med Treat, 2008(27): 59. doi:10.3969/j.issn.1674-0742.2008.27.046 |
| [10] |
匡红艳, 程太平, 胡建兵, 等. 鸡持续高尿酸血症模型的制备方法研究[J]. 四川动物, 2008(4): 554-8. Kuang H Y, Cheng T P, Hu J B, et al. Study on the preparation method of chicken model of persistent hyperuricemia[J]. Sichuan J Zoo, 2008(4): 554-8. |
| [11] |
王巍, 王晋桦, 石体仁, 等. 首乌对老年鹤鹑寿命和脂质代谢的影响[J]. 中西医结合杂志, 1988, 8(2): 223-5. Wang W, Wang J H, Shi T R, et al. Effects of Shouwu on longevity and lipid metabolism of old quail[J]. Chin J Integr Tradit West Med, 1988, 8(2): 223-5. |
| [12] |
刘小青, 张冰, 刘春梅, 等. 鹌鹑高尿酸血症模型建立初探[J]. 中国病理生理杂志, 2001, 17(10): 1038-40. Liu X Q, Zhang B, Liu C M, et al. Preliminary study on the establishment of quail hyperuricemia model[J]. Chin J Pathophysiol, 2001, 17(10): 1038-40. doi:10.3321/j.issn:1000-4718.2001.10.035 |
| [13] |
张冰, 刘小青, 丁正磊, 等. 鹌鹑高尿酸血症模型发病机理研究[J]. 北京中医药大学学报, 2006, 29(9): 595-9. Zhang B, Liu X Q, Ding Z L, et al. Pathogenesis of quail hyperuricemia model[J]. J Beijing Univ Tradit Chin Med, 2006, 29(9): 595-9. doi:10.3321/j.issn:1006-2157.2006.09.005 |
| [14] |
Tsudzuki M. Excalfactoria quail as a new laboratory research animal[J]. Poul Sci, 1994, 73: 763-8. doi:10.3382/ps.0730763 |
| [15] |
Mizutani M. Establishment of inbred strains of chicken and Japanese quail and their potential as animal models[J]. Exp Anim, 2002, 51: 417-29. doi:10.1538/expanim.51.417 |

