


缺血性脑卒中是当今常见的高危疾病之一,因缺血后易造成永久性的损伤,且临床治疗手段有限,难以恢复死亡的神经元,所以具有预后不佳、致死、致残率高的特点[1]。近年研究发现神经细胞受损后可以通过神经干细胞(neural stem cells,NSCs)移植来弥补或拯救神经元[2],成为缺血性脑卒中的新型治疗候选者[3]。Notch信号通路能够调控细胞分化、增殖、凋亡、迁移和血管生成,在决定细胞命运中具有核心作用[4]。研究发现,激活状态下的Notch信号通路主要通过调节下游效应分子Hes1和Hes5来调控NSCs的增殖和分化[5]。补阳还五汤是王清任《医林改错》中的经典方剂,在临床中被广泛用于治疗缺血性脑卒中。补阳还五汤对神经干细胞移植后脑缺血/再灌注大鼠的神经保护作用是本课题组的前期研究结果,并且Notch信号通路抑制剂可以通过影响该通路促进脑缺血/再灌注大鼠NSCs移植后的神经再生。但是,补阳还五汤对脑缺血/再灌注大鼠NSCs移植后的脑保护作用是否是通过调控Notch信号通路起作用的,鲜有报导。因此,本研究以脑缺血/再灌注大鼠模型(middle cerebral artery occlusion,MCAO)为研究对象,探讨补阳还五汤是否通过调控Notch信号通路增强神经干细胞移植对脑缺血/再灌注大鼠的脑保护作用。
1 材料与方法 1.1 实验动物SD大鼠80只,♂,清洁级,自北京维通利华公司购买,体质量均在(275±2) g。公司生产许可证号为:SCXK(京)2016-0011。
1.2 试剂及药品戊巴比妥钠购于北京化学试剂公司(批号020402);培养基的组成包括购于Gibco公司的DMEM/F-12(1 :1)(批号8119014)、B-27(批号1865349)和购于PeproTech公司的碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)(批号1210432-1)、表皮生长因子(epidermal growth factor,EGF)(批号1009390);Notch1(批号5)、Hes1(批号3)抗体购于CST公司,Hes5抗体购于Abcam公司(批号GR214854-7)。DAPI染液(批号180118)、Nestin兔抗大鼠单克隆抗体(批号AF12261998)、Actin抗体(批号LS190312)、以及其他分析纯试剂均购于赛维尔有限公司。补阳还五汤由黄芪120 g,赤芍5 g,当归尾6 g,红花3 g,地龙3 g,桃仁3 g,川芎3 g组成,药材购自河北乐仁堂药业有限公司,煎药浓缩至100 mL(1 mL约含1.43 g生药)。
1.3 主要仪器超净工作台SW-CJ-2FD型、Heal Force二氧化碳培养箱HF240型、Stoelting全自动脑立体定位仪51700型; Leica包埋机EG11508、轮转切片机RM2255、生物显微镜DMI3000B、光学显微镜DM5000B型; Eppendorf离心机; UVP凝胶成像机; Bio-Rad电泳仪、半干转膜仪。
1.4 提取、培养及鉴定NSCs[6]培养基由DMEM/F-12、B27、EGF、bFGF、配置而成。取购自维通利华公司的孕14 d大鼠,麻醉并酒精消毒后,剥出子宫,在超净台内取胎鼠大脑皮质,用眼科剪剪碎后,用手动吹打法使较大的组织变化为细胞悬浊液,并在吹打后使用细胞筛滤过以保证悬液均匀。离心5 min后取出,速率为1 000 r·min-1,倾倒上清液后加培养基,再次吹打悬浮,接种在25 cm2培养瓶,培养于CO2培养箱,密度1.0×109·L-1,恒温37 ℃。在放有多聚赖氨酸包被盖玻片的6孔板中接种已传至第3代的细胞悬液,4 h后显微镜下观察到神经球已粘附于盖玻片,贴孔板侧壁轻柔吸去多余悬液,并用体积分数0.04多聚甲醛固定,15 min后PBS轻柔冲洗3次,每次5 min(后续PBS冲洗均为3次,每次5 min); 室温下质量浓度3 g·L-1TritionX-100孵育,20 min后PBS冲洗; 室温下山羊血清封闭,30 min后PBS冲洗。之后滴加Nestin抗体(1 :200),在4 ℃环境中孵育,过夜后在室温避光环境下加入二抗(FITC)孵育,1 h后PBS冲洗; 滴加DAPI染液孵育,10 min后PBS冲洗; 取片加抗荧光淬灭封片剂进行封片,并检测Nestin的表达。
1.5 模型制作及评价大鼠在造左侧MCAO模型前禁食水,术前麻醉使用质量浓度为40 g·L-1的戊巴比妥钠(1 mL·kg-1)根据重量计算后腹腔注射,操作台上固定、消毒、备皮。颈总、颈内和颈外动脉在颈部正中切开2 cm后,分离暴露; 结扎3次颈外动脉后在前中结扎点间做一切口,用合适的线栓斜行插入,将颈总、颈内动脉用血管夹夹闭,剪断颈外动脉于后侧结扎点前,借助中部结扎线使颈外离断端与颈内动脉入颅方向一致,松颈内血管夹,插线栓至大脑中动脉, 稍有阻力感后停止,线栓进入约(19±1) mm。2 h后拔栓并系死前侧结扎点, 碘伏消毒,依次缝合切口, 术后动物给与保暖至苏醒[7]。术后24 h,做神经功能评分确定模型是否成功,按Zea Longa 5分制处理:行为无改变为0分; 右前爪无法舒展为1分; 向右侧行走转圈为2分; 行走向右侧歪倒为3分; 丧失自发活动与意识为4分。0分、4分动物死亡为模型失败,不予选取,将1~3分大鼠纳入实验对象。
1.6 分组及给药实验分组为假手术组(Sham)、模型组(Model)、补阳还五汤组(BYHWT)、移植组(Transplant)、补阳还五汤+移植组(BYHWT+Transplant),每组各16只; 其中假手术组只分离血管,其余4组随机平均分配64只模型成功大鼠。BYHWT组与BYHWT+Transplant组于手术麻醉清醒2 h后,灌胃给予补阳还五汤,给药剂量为14.8 g·kg-1·d-1,每日灌药量分两次给予,连续灌胃14 d,其余3组给予等体积蒸馏水。各组大鼠于NSCs移植后第14 d进行取材。
1.7 NSCs移植[8]模型制作24 h后进行NSCs移植,麻醉消毒,固定大鼠于脑立体定位仪上, 以前囟为坐标零点定位:AP=0.36 mm, ML=3.15 mm, DV=5.5 mm, 微量注射器注射速度:1 μL·min-1,细胞浓度为1.0×106·L-1,注入NSCs 10 μL于大鼠左侧纹状体区,完毕后留针10 min拔针,消毒缝合。
1.8 TTC染色检测大鼠迅速断头取脑,在置于质量浓度20 g·L-1的TTC染液前,放在-20 ℃环境15 min, 并于取出后的脑槽内做5片,2 mm厚冠状切片; 37 ℃恒温箱中避光孵育, 10 min后翻面1次, 20 min后在体积分数0.04的多聚甲醛中固定。24 h后拍照,脑梗死体积图片的分析使用Image-Pro Plus 6.0软件。
1.9 HE染色观察梗死区脑组织细胞体积分数为0.04的多聚甲醛灌注取脑,脑组织石蜡包埋,做冠状切片,厚5 μm。60 ℃烘烤石蜡切片2 h后,依次于二甲苯溶液Ⅰ、Ⅱ中脱蜡,每次15 min,然后于梯度乙醇脱水,每次5 min,依次为体积分数1的乙醇Ⅰ、Ⅱ和体积分数0.8的乙醇; 蒸馏水复水、苏木素染液染色各5 min,流动水轻洗数秒,分化3 s,水洗反蓝少于30 s,过洗2 s,伊红染液浸染1~3 min,蒸馏水轻洗1~2 s; 再次梯度乙醇脱水,二甲苯透明处理,树胶封片,镜下拍照,进行细胞计数,并观察脑组织神经细胞损伤情况。
1.10 Western blot法检测各组大鼠快速在冰上断头,取缺血侧脑组织; 称重后,加入裂解液匀浆,取上清(组织总蛋白)。BCA法进行蛋白浓度测定。加样后,用SDS-PAGE凝胶电泳,传至PVDF膜; 室温下,质量浓度50 g·L-1脱脂奶粉封闭,2 h后分别加入兔抗大鼠Actin(1 :2 000)、Notch1、Hes1、Hes5(1 :1 000)抗体,4 ℃孵育过夜; 室温下加入二抗(1 :2 000)孵育,1 h后洗膜,避光并滴加ECL显影,于化学发光成像系统观察。以β-actin作内参照,以目的条带灰度值与内参照条带灰度值之比分析蛋白质的相对表达。
1.11 统计学应用实验数据处理应用SPSS19.0统计软件,用x±s形式表示,组间比较采用单因素方差分析。
2 结果 2.1 神经干细胞的证明如Fig 1所示,在倒置显微镜下对培养6 d的新生大鼠脑组织原代细胞进行观察,观察发现:视野中存在多个悬浮、规则、无突起的桑葚状致密细胞球和大量单细胞。免疫荧光染色检测结果显示:具有荧光特性的FITC标记的Nestin发出绿色荧光; 细胞核被DAPI核染,发出蓝色荧光,表明Nestin表达呈阳性,提示培养的细胞为NSCs。
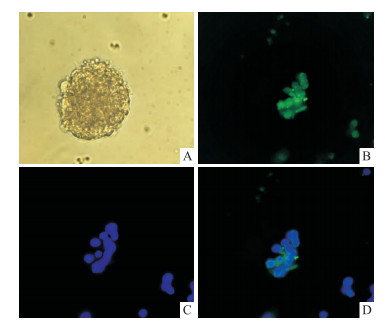
|
| Fig 1 Immunofluorescence identification of neural stem cells A: 6 d neural stem cells; B: Positive cells were stained with nestin immunofluorescence; C: DAPI; D.Merge |
如Fig 2,Sham组为0分。Model组较Sham组评分增加(P < 0.05);BYHWT组、Transplant组和BYHWT+Transplant组较Model组评分均降低(P < 0.05);BYHWT+Transplant组较Transplant组评分进一步降低(P < 0.05)。
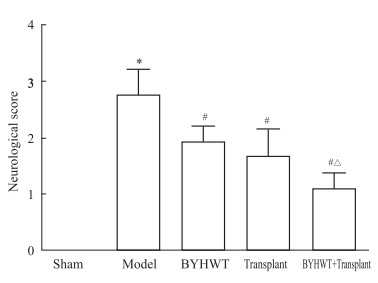
|
| Fig 2 Neurological score of each group (x±s, n=12) *P < 0.05 vs sham group; #P < 0.05 vs model group; △P < 0.05 vs transplant group. |
如Fig 3所示,Sham组无白色梗死灶形成。与Sham组比较,Model组缺血侧梗死区体积较大(P < 0.05); BYHWT组、Transplant组和BYHWT+Transplant组较Model组相比,梗死体积均缩小(P < 0.05);BYHWT+Transplant组较Transplant组梗死体积进一步缩小(P < 0.05)。
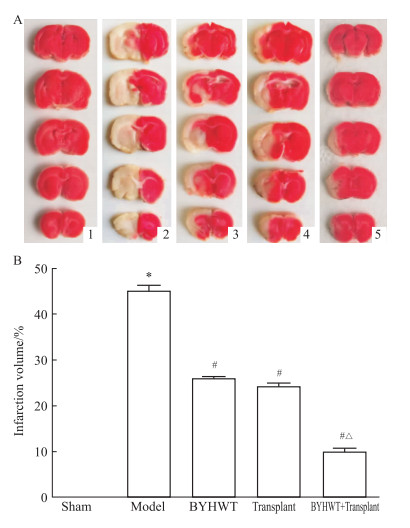
|
| Fig 3 TTC staining results of each group A:Photos stained with TTC.1:Sham; 2:Model; 3:BYHWT; 4:Transplant; 5:BYHWT+Transplant; B:Percentage of infarct volume(x±s, n=6).*P < 0.05 vs sham group; #P < 0.05 vs model group; △P < 0.05 transplant group. |
如Fig 4所示,Sham组大鼠脑组织神经细胞大小形态基本一致,分布均匀、致密,结构正常,胞质充盈,核仁清晰,未见空泡状水肿和变性,未见明显核固缩与核溶解; 与Sham组比较,Model组大鼠脑组织大量细胞受损严重,分布稀疏,出现较多空泡状水肿、变性,以及核固缩和核溶解,皱缩细胞核数量增多(P < 0.05);BYHWT组、Transplant组和BYHWT+Transplant组分别与Model组比较,细胞状态表现出不同程度的减轻,核收缩和溶解的细胞数有一定程度的降低(P < 0.05);BYHWT+Transplant组较Transplant组损伤程度进一步减轻(P < 0.05)。
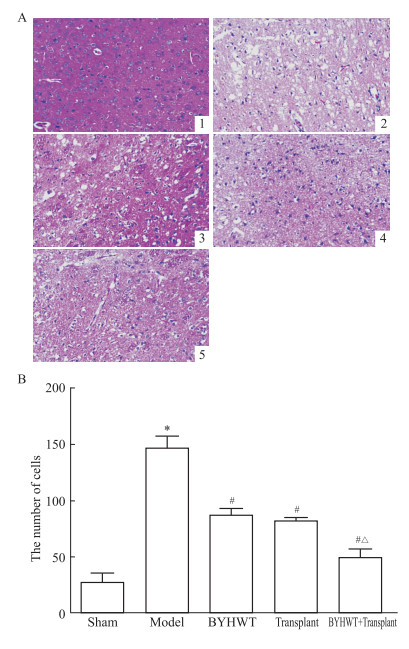
|
| Fig 4 HE staining of brain tissues in each group of rats (Bar=100 μm) A:HE staining photographs of each group. 1: Sham; 2: Model; 3: BYHWT; 4: Transplant; 5: BYHWT+Transplant; B:Number of nuclear pyknosis in each group (x±s, n=5). *P < 0.05 vs sham group; #P < 0.05 vs model group; △P < 0.05 vs transplant group. |
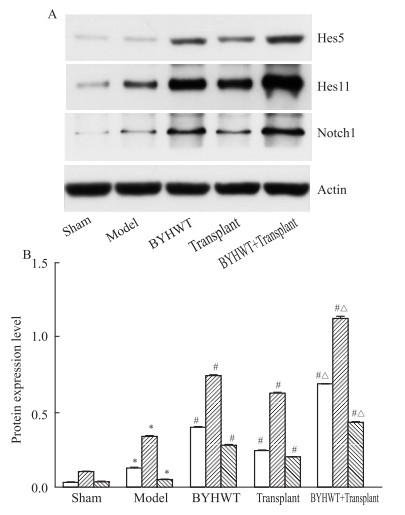
如Fig 5所示,Sham组Notch1、Hes1、Hes5蛋白均有一定量的表达,与Sham组比较,Model组Notch1、Hes1、Hes5蛋白表达水平均上调(P < 0.05);BYHWT组、Transplant组、BYHWT+Transplant组较Model组,各项蛋白表达均有所上调(P < 0.05);BYHWT+Transplant组较Transplant组各项表达上调(P < 0.05)。
|
| Fig 5 Western blot results A:Western blotting bands of Notch1, Hes1 and Hes5 in brain tissues of each group of rats; B: The protein expression histograms of Notch1, Hes1 and Hes5 in brain tissues of each group of rats (x±s, n=5). *P < 0.05 vs sham group; #P < 0.05 vs model group; △P < 0.05 vs transplant group. |
缺血性脑卒中的治疗是当今备受关注和亟待解决的关键问题,如何有效缓解脑损伤成为治疗的首要关注点。脑损伤的修复受到多种因素的调控,其中通过经典的Notch信号通路调节NSCs的增殖和分化被多数研究认可[9]。Notch通路受体蛋白(Notch1~4)激活后与相邻配体结合,经过多次介导启动下游碱性螺旋-环-螺旋基因:Hes1和Hes5效应分子转录。研究证明,机体调控NSCs的增殖、分化与Notch1、Hes1和Hes5的活化密切相关。NSCs细胞周期的退出以及过早分化与Notch1受体表达减弱有关; Hes1与抑制NSCs分化有关; 而Hes5可以促进NSCs的增殖,它们共同参与维持神经细胞数量与种类的稳定[10]。
脑卒中属于中医中风病的范畴,缺血性脑卒中的主要病机为气虚血瘀。针对病机治疗的补阳还五汤在长期临床实践中证明疗效卓越。现代医学研究发现补阳还五汤可以从抑制神经细胞凋亡、抑制细胞毒性、抑制炎症介质等方面负向调控; 也可以从促进NSCs增殖分化、促进相关生长蛋白表达、促进信号通路激活等多个方面正向调控,共同发挥对神经细胞的保护作用[11]。
本研究结果显示在脑缺血/再灌注损伤发生后,MCAO大鼠脑组织Notch1、Hes1、Hes5表达显著升高,表明机体内源性激活Notch1、Hes1、Hes5,参与修复受损部位,与涂建锋等[12]的研究结果一致。单纯进行补阳还五汤与单纯进行外源性NSCs移植治疗14 d后,Notch1、Hes1、Hes5表达增加,脑组织细胞与神经功能有所恢复,说明Notch信号通路被激活并对脑缺血/再灌注损伤有保护作用[13-14]。然而前期研究结果显示,外源性NSCs移植治疗7 d后Notch相关蛋白表达减少,神经保护作用与Notch通路促进外源性NSCs的分化有关[8],结合本实验我们猜测NSCs移植对Notch信号通路的影响可能是动态的,结果的差异性可能是因为NSCs移植在抑制Notch通路而促进外源性NSCs分化的同时,还参与了脑组织内环境与炎症反应的改变[15],故表现为前期外源性NSCs分化程度较内源性NSCs增殖程度明显,但是随着时间的增加,外源性NSCs分化逐渐稳定,炎症反应降低,内环境相对稳定,使Notch信号通路被激活,促进内源性NSCs增殖。随后我们研究脑缺血/再灌注损伤的修复作用是否能在NSCs移植与补阳还五汤的共同作用下,通过调控Notch信号通路而提高。研究结果证实:BYHWT+Transplant组各项蛋白明显上调,脑组织与细胞的恢复明显优于Transplant组。由此我们认为补阳还五汤可能是通过上调Notch信号通路,为移植后的内源性NSCs长期保持增殖水平提供了保障,提高了内源性NSCs增殖的潜能,弥补了移植后快速分化带来的治疗短暂性,从而增加了NSCs移植对脑缺血/再灌注损伤治疗的持续性,并发挥更持久的脑保护作用。
| [1] |
Lee R H C, Lee M H H, Wu C Y C, et al. Cerebral ischemia and neuroregeneration[J]. Neural Regen Res, 2018, 13(3): 373-85. doi:10.4103/1673-5374.228711 |
| [2] |
Liao L Y, Lau B W, Sánchez-Vidaña D I, Gao Q. Exogenous neural stem cell transplantation for cerebral ischemia[J]. Neural Regen Res, 2019, 14(7): 1129-37. doi:10.4103/1673-5374.251188 |
| [3] |
Ma J, Gao J, Hou B, et al. Neural stem cell transplantation promotes behavioral recovery in a photothrombosis stroke model[J]. Int J Clin Exp Pathol, 2015, 8(7): 7838-48. |
| [4] |
Falk R, Falk A, Dyson M R, et al. Generation of anti-Notch antibodies and their application in blocking Notch signalling in neural stem cells[J]. Methods, 2012, 58(1): 69-78. |
| [5] |
Grandbarbe L, Bouissac J, Rand M, et al. Delta-Notch signaling controls the generation of neurons/glia from neural stem cells in a stepwise process[J]. Development, 2003, 130(7): 1391-402. doi:10.1242/dev.00374 |
| [6] |
吴增, 李媛, 靳晓飞, 等. 神经干细胞提取与培养方法的比较研究[J]. 中国药理学通报, 2018, 34(5): 729-34. Wu Z, Li Y, Jin X F, et al. A comparative study on the extraction and culture methods of neural stem cells[J]. Chin Pharmacol Bull, 2018, 34(5): 729-34. doi:10.3969/j.issn.1001-1978.2018.05.027 |
| [7] |
Luis C R, Costamilam W B, Guilherme R, et al. Transient middle cerebral artery occlusion in rats as an experimental model of brain ischemia[J]. Acta Cir Bras, 2010, 25(5): 428-33. doi:10.1590/S0102-86502010000500008 |
| [8] |
刘宗秀, 张紫微, 周晓红, 等. γ-分泌酶抑制剂对脑缺血大鼠神经干细胞移植后神经保护作用[J]. 解剖学报, 2019, 50(2): 145-51. Liu Z X, Zhang Z W, Zhou X H, et al. Neuroprotective effects of gamma-secretase inhibitors after transplantation of neural stem cells in rats with cerebral ischemia[J]. Acta Anatomica Sinica, 2019, 50(2): 145-51. |
| [9] |
郭红梅, 王晓梅. Notch信号通路在神经干细胞分化与再生的研究进展[J]. 中国临床神经科学, 2013, 21(4): 463-7. Guo H M, Wang X M. Notch signaling pathway in differentiation and regeneration of neural stem cells[J]. Chin J Clin Neurosci, 2013, 21(4): 463-7. doi:10.3969/j.issn.1008-0678.2013.04.018 |
| [10] |
Liu T L, Liu M N, Xu X L, et al. Differential gene expression profiles between two subtypes of ischemic stroke with blood stasis syndromes[J]. Oncotarget, 2017, 8(67): 111608-22. doi:10.18632/oncotarget.22877 |
| [11] |
Zhang H, Gao W, Qian T, et al. Transcription factor changes following long term cerebral ischemia/reperfusion injury[J]. Neural Regen Res, 2013, 8(10): 916-21. |
| [12] |
涂建锋, 魏良浩, 周晟昂, 等. Notch信号传导系统在补阳还五汤对局灶性脑缺血再灌注大鼠神经修复中的调节作用[J]. 中华中医药学刊, 2015(3): 675-8. Tu J F, Wei L H, Zhou S A, et al. Regulation of Notch signal transduction system in Buyang Huanwu Decoction on nerve repair in rats with focal cerebral ischemia-reperfusion[J]. Chin Archives Tradit Chin Med, 2015(3): 675-8. |
| [13] |
孙桂芳.神经干细胞移植治疗血管性痴呆大鼠的研究[D].郑州大学, 2014: 35-49. Sun G F. Study on transplantation of neural stem cells for vascular dementia rats[D]. Zhengzhou University, 2014, 35-49. |
| [14] |
吴增, 高维娟. 补阳还五汤通过Notch信号通路修复缺血性脑损伤的研究进展[J]. 河北中医药学报, 2018, 33(2): 55-8. Wu Z, Gao W J. Research progress of Buyanghuanwu decoction in repairing ischemic brain injury through notch signaling pathway[J]. J Hebei Tradit Chin Med Pharmacol, 2018, 33(2): 55-8. |
| [15] |
温艺超, 陈伟燕, 谢富华, 等. DAPT阻断Notch通路对动脉粥样硬化型缺血性脑卒中大鼠的保护作用[J]. 中国病理生理杂志, 2018, 34(11): 2031-6. Wen Y C, Chen W Y, Xie F H, et al. The protective effect of DAPT blocking Notch pathway on atherosclerotic ischemic stroke rats[J]. Chin J Pathophysiol, 2018, 34(11): 2031-6. doi:10.3969/j.issn.1000-4718.2018.11.017 |

