

2. 台州市立医院 泌尿外科,浙江 台州 318000;
3. 台州市立医院 药剂科,浙江 台州 318000
2. Dept of Urology Surgery, Taizhou Municipal Hospital, Taizhou Zhejiang 318000, China;
3. Dept of Pharmacy, Taizhou Municipal Hospital, Taizhou Zhejiang 318000, China
肺癌是世界上最常见的恶性肿瘤之一,死亡率居恶性肿瘤之首。由于早期缺乏常规检查,多数患者被确诊时已处于中晚期阶段,很难通过手术完全根治[1]。经典的细胞毒性药物仍然是临床上治疗肺癌的主要选择。在这一系列的细胞毒性药物中,顺铂为代表的铂类药物是常见的化学治疗药物[2]。顺铂是目前临床上治疗肺癌的一线化学治疗药物,能够诱导DNA损伤,抑制肺癌细胞生长[3]。然而,顺铂会损害正常细胞,导致严重的副作用,从而限制了其临床疗效[3]。为了降低顺铂的副作用,肿瘤学家根据经验开发了联合化疗方案。小檗碱(berberine,BBR)是从中药黄连根茎中提取的一种异喹啉类生物碱,研究发现BBR具有抗微生物和抗炎等多种药理活性[4]。目前,研究表明BBR对肝癌、前列腺癌、胶质细胞瘤、卵巢癌、白血病和乳腺癌等表现抗肿瘤作用[5]。目前BBR对肺癌的研究有部分报道,但顺铂联合BBR对肺癌的抗肿瘤作用和机制尚无报道。因此,本文主要研究顺铂联合BBR体外对肺癌A549细胞增殖、凋亡的影响,并探讨其可能存在的抗肺癌作用机制。
1 材料与方法 1.1 材料 1.1.1 细胞株人肺癌A549细胞,购自于上海中国科学院典型培养物保藏委员会细胞库。
1.1.2 药物与试剂顺铂(货号:P4394,Sigma公司); 小檗碱和N-乙酰半胱氨酸(N-acetyl-L-cysteine, NAC)(货号:B107342和A105422,上海阿拉丁有限公司); MTT、结晶紫、Triton X-100、多聚甲醛、DCFH-DA和DAPI(上海碧云天生物技术有限公司); PBS缓冲液、0.25%胰蛋白酶(含EDTA)和0.25%胰蛋白酶(不含EDTA)和胎牛血清(Gibico公司); AnnexinV binding buffer、FITC AnnexinV Apoptosis及PI染色液(BD Biosciences Clontech); γH2AX、Bcl-2、caspase-3、cleaved-caspase-3和GAPDH(Cell Signaling Technology)。
1.1.3 仪器Spectra Max M2多功能酶标仪(Molecular Device公司); CO2培养箱(Thermo美国热电集团); 倒置显微镜(日本尼康公司); 低温高速离心机(Thermo美国热电集团); 凝胶成像系统(Bio-Rad公司); 细胞流式仪(Bio-Rad公司)。
1.2 方法 1.2.1 细胞培养人肺癌A549细胞用含90% RPMI 1640培养基,10%胎牛血清,100 U·mL-1链霉素和100 U·mL-1青霉素培养。所有进行实验的细胞复苏后传代应少于20代,且置于37 ℃、5% CO2的恒温二氧化碳细胞培养箱中。
1.2.2 MTT检测A549细胞活力情况取100 μL对数生长期A549细胞接种于96孔板(细胞数约每孔8 000个),置于37 ℃细胞培养箱中培养过夜,以让细胞贴壁。次日更换新鲜培养基,加入不同浓度的BBR(0、3、6、12、25、100、200 μmol·L-1),BBR(8 μmol·L-1)与不同浓度的顺铂(0、2.5、5、7.5、10、15 μmol·L-1),并且设置DMSO为阴性对照组。24 h后每孔加20 μL MTT。4 h后每孔再加150 μL DMSO,酶标仪波长设置为490 nm测得OD值。生存率/%=给药组OD/阴性对照组OD值×100%。
1.2.3 细胞集落实验检测A549集落形成情况取对数生长期A549细胞1 mL分别接种到6孔板中,每孔含5×105个细胞,放入细胞培养箱中培养过夜。次日更换新鲜培养基,设置对照组、BBR(8 μmol·L-1)组、顺铂(10 μmol·L-1)组和(BBR+顺铂)组。用正常培养基培养细胞约8 d。用PBS清洗2次,用4%多聚甲醛固定细胞30 min,加入结晶紫染色液,用PBS清洗5次,并用相机拍照获得图像。
1.2.4 流式细胞仪检测A549细胞凋亡情况取对数生长期A549细胞,1 mL接种到6孔板中,每孔含5×105个细胞,放入细胞培养箱中培养过夜。次日更换新鲜培养基,设置对照组、BBR(8 μmol·L-1)组、顺铂(10 μmol·L-1)组和(BBR+顺铂)组。加NAC组(5 mmol·L-1)需要提前孵育1 h再加药,六孔板置37 ℃、5% CO2细胞培养箱中培养24 h。收集细胞上清液,用PBS洗1次,用0.5 mL胰蛋白酶(不含EDTA)消化细胞,1 100 r·min-1离心4 min,弃上清用1 mL PBS重悬细胞,洗涤,1 100 r·min-1离心4 min,弃上清用Binding buffer重悬细胞,加入至流式管中。每个流式管避光加入Annexin V,染色10 min后,再加PI染色5 min,然后加入Binding Buffer,最后用流式细胞仪进行收集检测。
1.2.5 免疫荧光检测A549细胞DNA损伤情况取对数生长期A549细胞,将每孔约1×105个细胞置于免疫荧光小皿中至细胞贴壁,弃去旧培养液,设置对照组、BBR(8 μmol·L-1)组、顺铂(10 μmol·L-1)组和(BBR+顺铂)组,作用时间为12 h。用预冷PBS洗3次,每次3 min; 用4%的多聚甲醛固定细胞10 min,PBS洗3次,每次3 min; 0.5% Triton X-100室温通透10 min,PBS洗3次,每次3 min; 在小皿中滴加正常山羊血清,室温封闭30 min; 弃封闭液,不洗,每个小皿滴加足够量一抗并放入湿盒,4 ℃孵育过夜; PBST洗3次,每次3 min; 加荧光二抗湿盒中室温孵育1 h,PBST洗3次,每次3 min; 滴加DAPI避光孵育5 min,对细胞进行染核,PBST洗3次,每次3 min; 加入抗荧光猝灭剂,倒置荧光显微镜拍照。
1.2.6 流式细胞仪检测A549细胞内ROS情况取对数生长期A549细胞1 mL,含5×105个细胞,分别接种到6孔板中,放入细胞培养箱中培养过夜。次日更换新鲜培养基,设置对照组、BBR(8 μmol·L-1)组、顺铂(10 μmol·L-1)组和(BBR+顺铂)组。弃上清培养基,用PBS洗1次,用饥饿培养基比例为1 :2 000稀释加入DCFH-DA荧光探针,在细胞培养箱中孵育30 min,吸掉探针染色液,PBS洗涤,胰酶消化,加入培养基收集细胞。1 100 r·min-1离心3 min,弃上清用PBS重悬细胞,1 100 r·min-1离心3 min,吸掉离心后液体,再加入PBS重悬。最后用流式细胞仪进行收集检测。
1.2.7 Western blot法检测A549细胞内相关蛋白表达取对数生长期A549细胞1 mL,含5×105个细胞,分别接种到6孔板中,放入细胞培养箱中培养过夜。次日更换新鲜培养基,设置对照组、BBR(8 μmol·L-1)组、顺铂(10 μmol·L-1)组和(BBR+顺铂)组。弃上清液,加入PBS洗涤,加入细胞裂解缓冲液,摇匀后放在冰上裂解5 min,用蛋白刮刀刮取蛋白混悬液并收集在预冷的EP管中。4 ℃、12 000 r·min-1离心10 min, 测定蛋白浓度,制蛋白样品。取蛋白,凝胶电泳,转膜90 min。用5 %牛奶封闭1.5 h; 用0.1% TBST洗膜3次,加入适当比例稀释的一抗,4 ℃摇床过夜; 用0.1% TBST洗膜3次,加入辣根过氧化物酶标记的二抗室温摇床孵1 h; 用0.1% TBST洗膜3次,在ECL孵育显影凝胶成像系统中成像。
1.3 统计学分析用SPSS 22.0版、GraphPad和Prism 6.01版统计学软件对数据进行分析。本研究数据以x±s表示,多组比较采用单因素方差分析,两组比较采用t检验。
2 结果 2.1 顺铂联合BBR增强抑制A549细胞增殖如Fig 1A所示,相对于对照组,BBR能够浓度依赖性地抑制A549生长(P < 0.01)。同时,我们发现当8 μmol·L-1的BBR与不同浓度的顺铂联合后也呈浓度依赖性地抑制细胞生长(P < 0.01)。其中,进一步实验表明,BBR(8 μmol·L-1)与10 μmol·L-1的顺铂联用可显着提高细胞毒性,细胞抑制率达到80%(Fig 1B)。因此,选择8 μmol·L-1的BBR与10 μmol·L-1顺铂作为A549细胞联合作用的浓度。
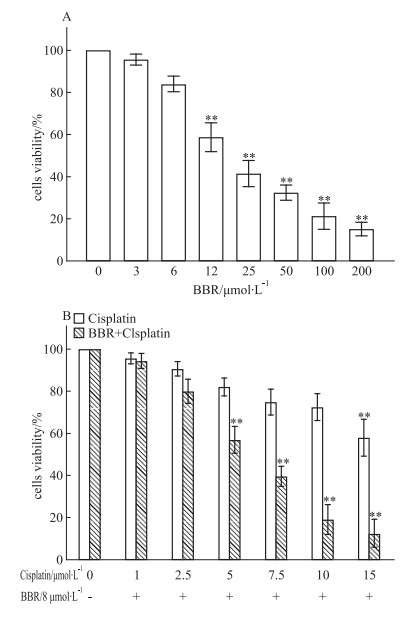
|
| Fig 1 Effect of cispaltin combined with BBR on viability of A549 cells(x±s, n=3) **P < 0.01 vs control group |
细胞集落实验发现,相对于对照组和单药组,联合组能有效抑制A549细胞集落的形成(P < 0.01)(Fig 2)。
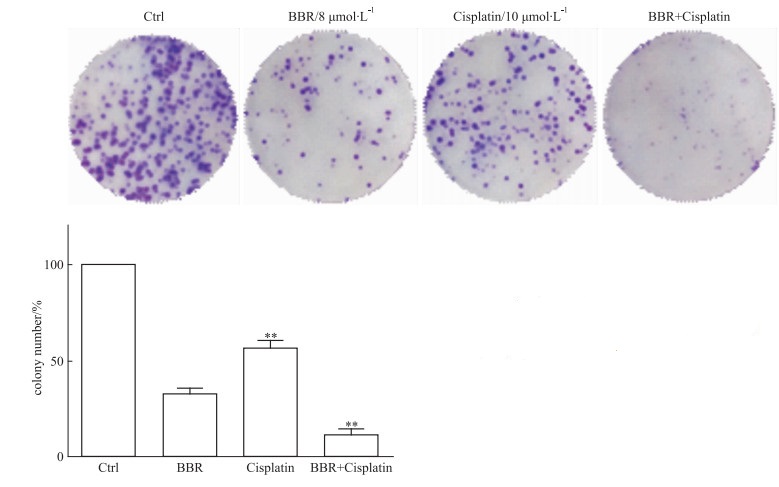
|
| Fig 2 Effect of cispaltin combined with BBR on colony-formation ability of A549 cells(x±s, n=3) **P < 0.01 vs control group |
流式细胞术实验发现,相对于对照组,8 μmol·L-1的BBR和10 μmol·L-1顺铂均能诱导A549细胞凋亡,其中凋亡率分别为25.2%和15.2%。但当两药联合作用后,能明显提高A549细胞的凋亡,凋亡率达到41.2%(P < 0.01)(Fig 3A,3B)。为了进一步说明联合后对细胞凋亡的影响,Wwestern blot检测Bcl-2和cleaved-caspase-3的表达。结果表明,相对于单药组,联合作用后能明显抑制Bcl-2的表达和提高cleaved-caspase-3的表达(Fig 3C, 3D)。
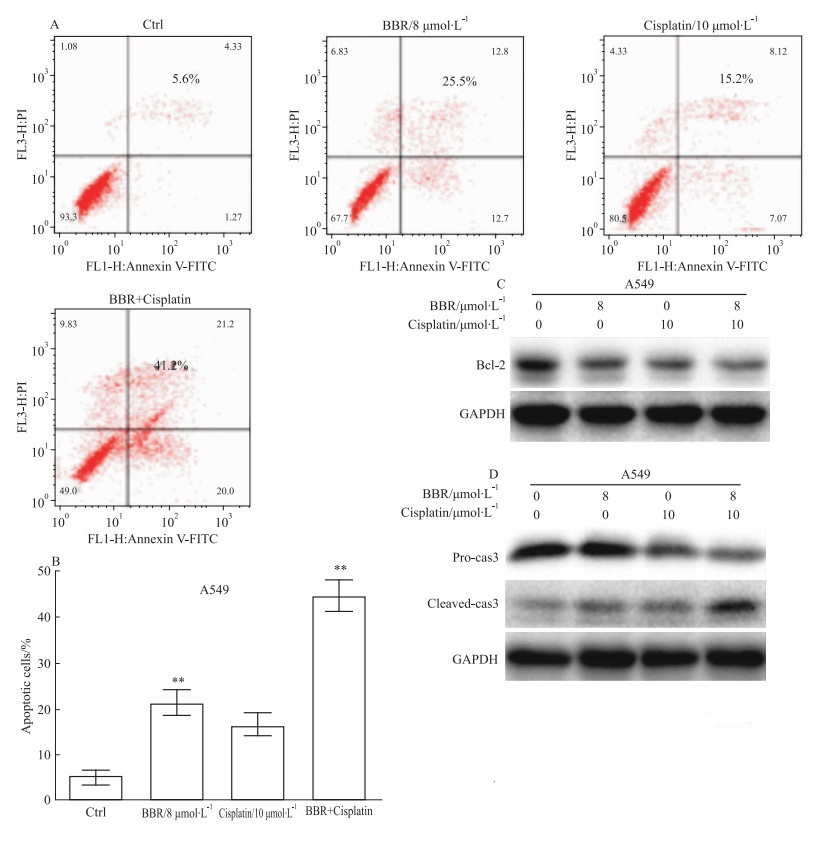
|
| Fig 3 Effect of cispaltin combined with BBR on apopotosis and expression of Bcl-2, cleaved caspase-3 of A549 cells(x±s, n=3) **P < 0.01 vs control group |
为进一步说明两药联合后的抗肿瘤机制,本实验对诱导DNA损伤进行研究。结果如Fig 4A,4B,相对于对照组和单药组,联合作用后能明显提高γH2AX蛋白的表达(P < 0.01)。同时,相应的免疫荧光实验也发现,顺铂和BBR联合作用后,能够明显提高γH2AX聚焦,见Fig 4C。
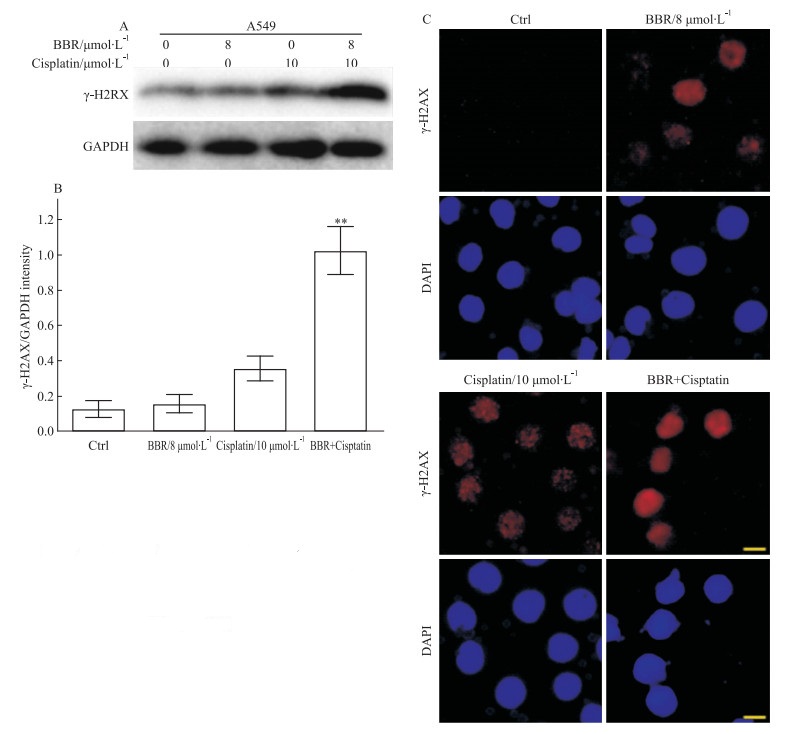
|
| Fig 4 Effect of cispaltin combined with BBR on expression of γH2AX and γH2AX foci formation of A549 cells(x±s, n=3) **P < 0.01 vs control group |
流式细胞术实验进一步发现,如Fig 5A, 5B,相对于对照组和单药组,两药联合作用后能明显提高细胞内的ROS水平(P < 0.01)。
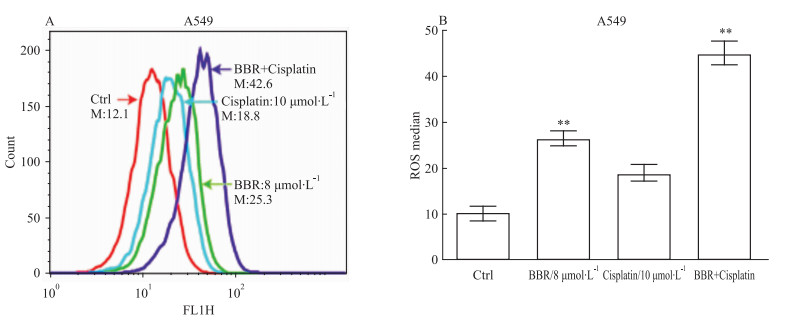
|
| Fig 5 Effect of cispaltin combined with BBR on ROS formation of A549 cells(x±s, n=3) **P < 0.01 vs control group |
为了说明联合用药后升高的ROS能够增强A549细胞凋亡,细胞流式术实验发现,相对于对照组和单药组,顺铂联合BBR明显提高细胞凋亡率。但当两药联合ROS清除剂NAC后,细胞的凋亡率明显下降(P < 0.01)(Fig 6A, 6B)。并且,Western blot实验也表明,相对于联合组,使用NAC能够提高Bcl-2的表达和降低cleaved-caspase-3的表达,说明了ROS介导顺铂联合BBR的抗肿瘤作用(Fig 6C,6D)。
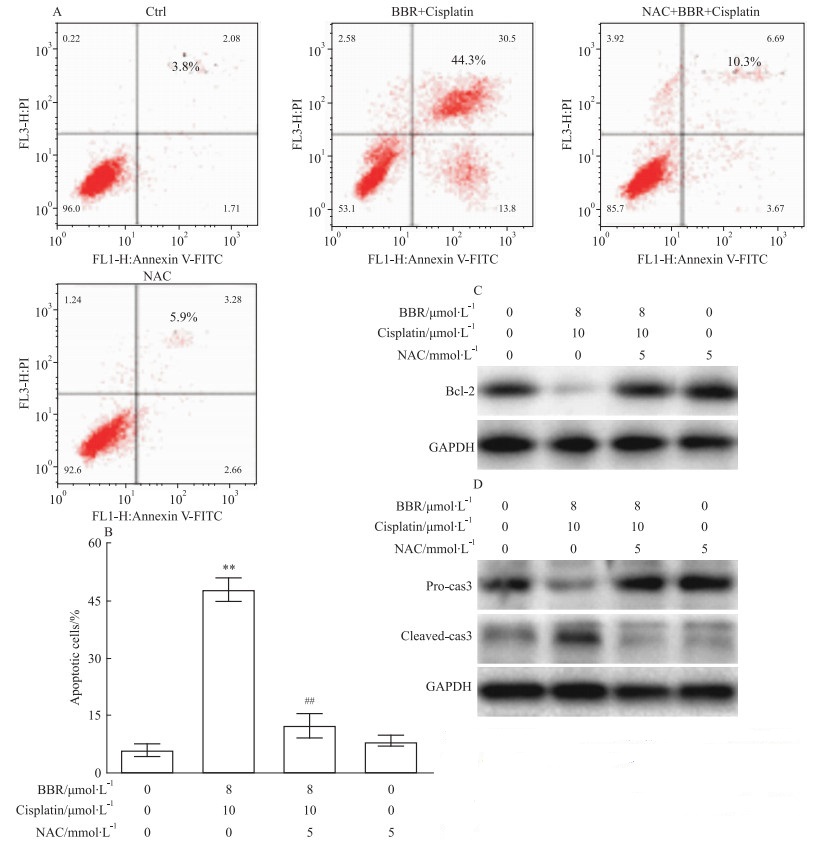
|
| Fig 6 Effect of cispaltin combined with BBR on ROS-induced apopotosis and expressions of Bcl-2, cleaved caspase-3 of A549 cells(x±s, n=3) **P < 0.001 vs control group; ##P < 0.01 vs cispaltin+BBR group |
肺癌是世界上最常见的恶性肿瘤之一,死亡率居恶性肿瘤之首,全球范围内,肺癌发生率不断上升,危害日益严重,给人们的健康带来了越来越多的压力[1]。由于缺乏有效的早期诊断方法和明显的早期症状,大多数肺癌患者被确诊时已经处于晚期,不能通过手术切除等手段治疗,化疗是他们最主要的临床治疗策略[1]。目前随着各种癌症特异性分子生物标志物的发现,针对肿瘤特异性靶点的个体化治疗逐渐成为肺癌药物的开发热点[5]。但靶向治疗过程中不仅频繁出现耐药性,而且靶向药物的治疗费用昂贵,这导致了靶向治疗的受限[6-7]。另外,对于一些没有潜在可行的分子靶点的肺癌患者,靶向药物也不能用于治疗[8-9]。因此,经典的细胞毒性药物已经成为靶向治疗受限及无效患者的首选。然而,细胞毒性药物如顺铂具有胃肠道反应、肝功能不全、肾衰竭、心血管并发症等不良反应[3]。因此,为了降低细胞毒性药物的副作用,联合用药是目前研究的热点。
在本文中,我们探讨顺铂和BBR联合后对人肺癌A549细胞的抗肿瘤作用及相应的抗肿瘤机制。我们初步使用MTT实验研究联合用药对A549细胞生存率的影响。结果表明,联用相对较低剂量的BBR和顺铂可增强对A549细胞的细胞毒性作用。细胞集落形成实验发现联合能有效降低A549细胞集落的形成。细胞凋亡是基因介导的程序性细胞死亡方式之一,对于消除各种生物系统中的有害细胞至关重要,并且是细胞毒性药物的关键抗肿瘤机制[10]。我们的研究表明,相对于对照组和单药组,顺铂和BBR联合后能有效地诱导A549细胞凋亡。Bcl-2和caspase-3被公认是在肿瘤发生中起重要作用的凋亡相关基因。本研究的Western blot结果表明,相对于单药组,两药联合能够明显抑制Bcl-2的表达,同时提高cle-caspase3的表达,说明顺铂联合BBR后通过增强相关凋亡蛋白的表达起到协同作用。
研究表明,顺铂是细胞周期非特异性药物,能够诱导DNA损伤从而促进肿瘤细胞死亡。同时,相关报道发现,BBR也能够直接与DNA结合后干扰DNA复制,从而诱导细胞死亡[11],因此,BBR联合顺铂可能通过增强DNA损伤,从而促进A549细胞死亡。γH2AX是DNA双链断裂的标记物,在识别细胞内DNA损伤、保持相关基因组的完整性和稳定中发挥着至关重要的作用[12]。本文研究表明,BBR与顺铂联合能够增强γH2AX蛋白的表达,免疫荧光实验也发现联合组的γH2AX荧光亮度增强。以上结果说明。BBR能够增强顺铂对A549细胞内DNA的损伤,这或许是BBR增敏顺铂抗肿瘤的机制之一。
研究发现,氧化应激与癌症的发生和发展密切有关[13]。其中,高水平的ROS能够损伤脂质、蛋白质和DNA,最终导致肿瘤细胞死亡[13]。同时,肿瘤细胞内ROS的水平明显高于正常细胞,这使得肿瘤细胞更加依赖抗氧化系统来维持自身的氧化平衡状态,也使得肿瘤细胞对ROS的上升更为敏感,故通过升高肿瘤细胞内ROS的水平能够在对正常细胞损伤较小的情况下,选择性杀伤肿瘤细胞[14]。本研究发现,顺铂和BBR联用后明显提高A549细胞内ROS水平。这与Youn等[15]报道顺铂和BBR联用后提高Hela细胞内ROS水平结果一致。我们也发现在联合使用NAC后,ROS被明显降低。相应的细胞流式实验也表明,在使用NAC后,顺铂和BBR联用后A549细胞的凋亡率明显降低。Western blot实验也发现,相对于联合组,使用NAC能够有效提高Bcl-2的表达和降低cleaved-caspase-3的表达,以上结果都说明了ROS参与顺铂联合BBR的抗肿瘤作用。
综上所述,本研究表明,顺铂和BBR联合后协同抑制A549细胞的生长,此作用主要与增强细胞凋亡、诱导细胞内DNA损伤和提高细胞内的ROS水平有关。但目前本文主要在细胞层面上研究顺铂和BBR的联合抗肺癌作用,需要进一步在动物实验探索顺铂和BBR联合的抗肿瘤作用和机制。
| [1] |
Wang J B, Yun D, Yao J L, et al. Design, synthesis and QSAR study of novel isatin analogues inspired Michael acceptor as potential anticancer compounds[J]. Eur J Med Chem, 2018, 144: 493-503. doi:10.1016/j.ejmech.2017.12.043 |
| [2] |
Lv J, Zhang F, Zhai C, et al. Bag-1 silence sensitizes non-small cell lung cancer cells to cisplatin through multiple gene pathways[J]. Onco Targets Ther, 2019, 12: 8977-89. doi:10.2147/OTT.S218182 |
| [3] |
Gao Y Y, Dorn P, Liu S C, et al. Cisplatin-resistant A549 non-small cell lung cancer cells can be identified by increased mitochondrial mass and are sensitive to pemetrexed treatment[J]. Cancer Cell Int, 2019, 19: 317-30. doi:10.1186/s12935-019-1037-1 |
| [4] |
Mortazavi H, Nikfar B, Esmaeili S A, et al. Potential cytotoxic and anti-metastatic effects of berberine on gynaecological cancers with drug-associated resistance[J]. Eur J Med Chem, 2019, 187: 111951. |
| [5] |
Liu D, Meng X, Wu D L, et al. A natural isoquinoline alkaloid with antitumor activity: studies of the biological activities of berberine[J]. Front Pharmacol, 2019, 10: 9-28. doi:10.3389/fphar.2019.00009 |
| [6] |
Hirsch F R, Scagliotti G V, Mulshine J L, et al. Lung cancer: Current therapies and new targeted treatments[J]. Lancet, 2017, 389(10066): 299-311. doi:10.1016/S0140-6736(16)30958-8 |
| [7] |
Wood S L, Pernemalm M, Crosbie P A, et al. Molecular histology of lung cancer: From targets to treatments[J]. Cancer Treat Rev, 2015, 41(4): 361-75. doi:10.1016/j.ctrv.2015.02.008 |
| [8] |
Zakowski M F. Analytic inquiry: Molecular testing in lung cancer[J]. Cancer Cytopathol, 2017, 125: 470-6. doi:10.1002/cncy.21866 |
| [9] |
Boros A, Lacroix L, Lacas B, et al. Prognostic value of tumor mutations in radically treated locally advanced non-small cell lung cancer patients[J]. Oncotarget, 2017, 8: 25189-99. doi:10.18632/oncotarget.15966 |
| [10] |
董易, 褚冬青, 马春宇, 等. 积雪草酸对人舌癌TCA-8113细胞增殖、凋亡的影响[J]. 中国药理学通报, 2019(11): 1596-601. Dong Y, Chu D Q, Ma C Y, et al. Inhibitory effect of asiatic acid on proliferation and apoptosis of TCA-8113 human tongue carcinoma cells[J]. Chin Pharmacol Bull, 2019(11): 1596-601. doi:10.3969/j.issn.1001-1978.2019.11.021 |
| [11] |
Liu Q, Jiang H, Liu Z J, et al. Berberine radiosensitizes human esophageal cancer cells by downregulating homologous recombination repair protein RAD51[J]. Plos One, 2011, 6: e23427. doi:10.1371/journal.pone.0023427 |
| [12] |
Florean C, Song S M, Dicato M, et al. Redox biology of regulated cell death in cancer: A focus on necroptosis and ferroptosis[J]. Free Radic Biol Med, 2019, 134: 177-89. doi:10.1016/j.freeradbiomed.2019.01.008 |
| [13] |
Reczek C R, Chandel N S. ROS promotes cancer cell survival through calcium signaling[J]. Cancer Cell, 2018, 33(6): 949-51. doi:10.1016/j.ccell.2018.05.010 |
| [14] |
El-Kenawi A, Ruffell B. Inflammation, ROS, and mutagenesis[J]. Cancer Cell, 2017, 32(6): 727-9. doi:10.1016/j.ccell.2017.11.015 |
| [15] |
Youn M J, So H S, Cho H J, et al. Berberine, a natural product, combined with cisplatin enhanced apoptosis through a mitochondria/caspase-mediated pathway in HeLa cells[J]. Biol Pharm Bull, 2008, 31: 789-95. doi:10.1248/bpb.31.789 |

