

2. 中南大学湘雅药学院药理学系,湖南 长沙 410078
2. Dept of Pharmacology, Xiangya School of Pharmaceutical Sciences, Central South University, Changsha 410078, China
糖尿病(diabetes mellitus,DM)是一种慢性代谢性疾病,是继心血管疾病、肿瘤之后的第三大健康杀手,预计到2030年,全球糖尿病患者将达到4亿3900万,约占世界人口的7.7%[1]。糖尿病易引发血管并发症,可导致心、脑、肾等器官功能损伤和衰竭[2]。血管内皮损伤被认为是糖尿病血管病变的起始阶段,内皮细胞凋亡是导致内皮损伤的主要原因。因此,如何阻止和减少血管内皮细胞凋亡,对于改善糖尿病患者血管内皮功能,预防和治疗糖尿病血管病变具有重要意义。
细胞凋亡是以caspase-3诱导细胞主动的程序性、非炎症性细胞死亡,主要表现为细胞质和细胞核固缩、DNA及核酸酶裂解、凋亡小体形成,但是保留细胞质膜的完整性[3]。研究表明,高糖可通过上调Bax蛋白,下调Bcl-2蛋白,诱导血管内皮细胞凋亡,进而导致血管内皮损伤[4]。盘状结构域受体1(discoidin domain receptor 1,DDR1)是一种非整合素胶原受体,为受体酪氨酸激酶家族成员之一,由胞外区、跨膜区和胞内激酶区3部分组成,参与包括细胞炎症、增殖、分化在内的病理生理过程[5-6]。研究表明[7],DDR1在上皮细胞和平滑肌细胞中呈现高表达,可促进E钙粘蛋白介导细胞间黏附,维持上皮细胞的完整以及促进平滑肌细胞增殖。但是关于DDR1在糖尿病血管内皮损伤中的研究尚不清楚。本研究拟从动物和细胞水平,探究DDR1在糖尿病血管内皮损伤中的作用及其对内皮细胞凋亡的影响。
1 材料 1.1 实验动物购自中南大学湘雅医学院动物学部,体质量为(200±20) g,♂,SPF级Sprague-Dawley(SD)大鼠40只(合格证号:43004700029598)。
1.2 实验细胞人脐静脉内皮细胞株(human umbilical vein endothelial cells,HUVECs)购自美国模式菌种收集中心(ATCC)(货号:CAL-1730)。
1.3 抗体与试剂DDR1(#3917)、caspase-3(#9662)、Bax(#2772)和Bcl-2(#3498)抗体购自美国Cell Signaling Technology公司; β-actin抗体(AF0003)、HRP标记兔二抗(A0277)和鼠二抗(A0286)均购自江苏碧云天公司; 一抗稀释液(P0023A-100ml)、二抗稀释液(P0023D-100ml)以及Hoechst 3342染色试剂盒(C1026)均购自江苏碧云天公司; 兔SP试剂盒(兔链卵白素-生物素法检测系统)(SP-9001)购自北京中杉生物技术公司; D-glucose溶液(G3285)购自美国Sigma公司; DMEM低糖培养基(C11885500BT)购自以色列BI公司。
1.4 仪器小动物超声成像系统(加拿大Visual Sonics公司); 倒置相差荧光显微镜(日本尼康公司); ChemiDoc XRS+成像系统(美国Bio-Rad公司); Western blot装置(美国Bio-Rad公司); 组织匀浆仪(武汉维塞尔生物科技有限公司); 恒温CO2细胞培养箱(美国Thermo公司); 高速冷冻离心机(美国Beckman-Coulter公司); 细胞裂解破碎仪(宁波新芝生物科技有限公司)。
2 方法 2.1 糖尿病大鼠模型构建健康♂,SD大鼠,体质量为(200 ±20)g,适应性喂养1周后,一次性腹腔内注射链脲佐菌素(streptozotocin,STZ)(60 mg·kg-1,用0.05 mol·L-1柠檬酸钠-柠檬酸缓冲液新鲜配制),对照组的大鼠腹腔注射等容积的柠檬酸缓冲液。在注射STZ后d 3检测血糖,大鼠尾静脉取血,血糖连续3 d≥16.7 mmol·L-1归为糖尿病模型组。实验期间定期检测体重、血糖、血脂、空腹胰岛素等。
2.2 血管多普勒超声对正常组大鼠(n=6)和糖尿病大鼠(n=6)进行主动脉血管多普勒超声检测。获取大鼠二维主动脉M型超声、彩色血流、血流频谱图像。测定M型血管超声图像中内中膜厚度(IMT)和管腔内径大小(AD),血流频谱图像中主动脉收缩最大血流速度(PSV)和主动脉舒张末期血流速度(EDV)大小,并对血管阻力指数(RI=PSV-EDV/PSV)进行计算。以上实验开展均由同一人员进行操作,所有实验参数测定3次,取平均值为最终检测结果。
2.3 苏木精-伊红(HE)染色大鼠心脏取血完成后,剪开左心耳并采用4%多聚甲醛持续灌流至心脏、肺呈乳白色,随后完全打开大鼠胸腔并沿连接心脏主动脉弓位置处紧贴着大鼠脊柱方向剪取主动脉,随后放置于预冷的生理盐水内并剔除血管外周结缔组织,主动脉组织4%多聚甲醛固定,梯度酒精脱水,二甲苯透明,石蜡包埋,切片,HE染色。
2.4 免疫组化主动脉血管切片经过脱蜡、清洗后按照北京中杉金桥公司兔SP-9001检测试剂盒说明书进行操作:①组织抗原修复:于90 ℃条件下,水浴25 min; ②阻断:室温条件下,滴加3% H2O2溶液阻断剂,孵育15 min; ③封闭:5% BSA溶液封闭30 min; ④孵育一抗:4 ℃条件下,DDR1一抗(1:200)孵育过夜; ⑤孵育二抗:室温条件下,孵育二抗约30 min; ⑥显色,拍照:滴加DAB显色液,染色约5 min,显微镜下观察DDR1表达与分布并拍照。
2.5 细胞培养与处理HUVECs用含10% FBS的DMEM低糖培养基(5.5 mmol·L-1)培养,隔天换液,待细胞生长融合至90%时采用胰酶(含0.25%胰酶和0.01% EDTA)消化、传代、种板。在CO2含量5%,温度为37 ℃条件下,培养细胞。待培养板内细胞生长密度达到40%~50%时,同步化(含1% FBS的DMEM低糖培基)处理24 h。实验分组、处理情况如下:①高糖处理HUVECs实验:Control组(5.5 mmol·L-1)、HG组(33 mmol·L-1 D-glucose); ② DDR1 siRNA干扰处理实验:Control组(5.5 mmol·L-1)、HG组(33 mmol·L-1 D-glucose)、DDR1 siRNA+HG组(转染DDR1 siRNA 24 h,后高糖处理48 h)、NC+Control组(转染DDR1无关片段24 h,后正常糖浓度下培养48 h)。
2.6 Hoechst染色采用Hoechst法检测HUVECs凋亡,按照江苏碧云天公司Hoechst染色试剂盒说明书进行操作:① 24孔板培养的HUVECs,处理结束后,去除细胞培养液,PBS润洗2次,每次3 min; ②加入细胞固定液,室温固定10 min; ③去除细胞固定液,PBS润洗2次,每次3 min; ④吸尽液体,每孔加入250 μL Hoechst 3342染色液,避光染色5 min; ⑤去除染色液,PBS润洗2次,每次3 min,倒置荧光显微镜下观察并拍照。
2.7 Western blot大鼠主动脉血管组织和HUVECs使用组织细胞裂解液裂解后,高速离心机4 ℃,12 000×g离心15 min,收集各自上清液,采用BCA法进行蛋白质浓度定量检测。按照每孔上样量为30 μg进行蛋白质凝胶电泳实验。根据目的蛋白分子量大小以及蛋白marker指示进行切胶,湿转转膜法将蛋白转移至PVDF膜上,脱脂牛奶封闭2 h,孵育对应一抗(1 :1 000)4 ℃过夜,含吐温磷酸盐缓冲液(TPBS)洗涤3次,每次5 min,孵育二抗(1 :5 000)1 h,TPBS洗膜后加入发光聚合物(ECL),使用胶片曝光,图片扫描后用Image J软件计算各条带的灰度值,以各目标条带灰度值与内参β-actin条带灰度值的比值表示目标蛋白的相对表达量。
2.8 统计学分析实验数据均采用x±s表示。两组均数分析比较采用独立样本t检验法,用于多组间均数分析比较采用One -way ANOVA检验法,SPSS 18.0软件用于统计分析。
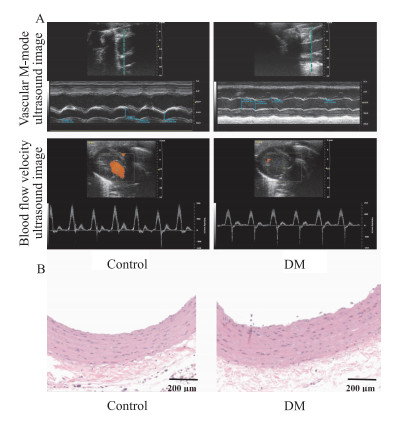
3 结果 3.1 糖尿病血管内皮损伤模型建立为了探究高血糖对血管内皮损伤的影响,我们通过大鼠腹腔注射STZ造模12周。结果显示,糖尿病大鼠血糖异常增高(P < 0.01)、血浆胰岛素含量和体重均显著降低(P < 0.01)(Tab 1)。血管多普勒超声结果显示,糖尿病大鼠主动脉血管IMT和RI显著增加(P < 0.01),AD、PSV和EDV均显著降低(P < 0.01)(Tab 1、Fig 1A)。HE染色结果显示,糖尿病大鼠主动脉内皮粗糙,出现明显隆起,褶皱且排列紊乱,呈现波浪形(Fig 1B)。以上研究表明,糖尿病血管内皮损伤模型建立成功。
| Control | DM | |
| Weight(g) | 658.52±28.40 | 234.03±20.20** |
| Blood glucose concentration(mmol·L-1) | 4.88±0.77 | 28.53±3.44** |
| Plasma insulin concentration(m U·L-1) | 16.86±1.09 | 6.91±1.12** |
| IMT(mm) | 0.31±0.05 | 0.47±0.09** |
| AD(mm) | 2.80±0.15 | 2.21±0.30** |
| PSV(mm·s-1) | 520.88±28.97 | 365.34±11.59** |
| EDV(mm·s-1) | 123.03±12.03 | 45.15±9.57** |
| RI | 0.76±0.02 | 0.88±0.01** |
| **P < 0.01 vs control | ||
|
| Fig 1 Effects of hyperglycemia on vascular endothelial structure and function in rats(x±s, n=6) A: Detection of rat aortic endothelial function by vascular Doppler ultrasound. B: Detection of rat aortic vascular endothelial structure by HE staining. |
为探究糖尿病血管内皮损伤时,是否有内皮细胞凋亡发生。我们通过动物与细胞实验相结合进行验证。Western blot检测结果显示,糖尿病大鼠主动脉组织Bax和caspase-3表达均显著增加(P < 0.01,P < 0.05),Bcl-2表达显著降低(P < 0.05)(Fig 2A)。高糖处理HUVECs 48 h可诱导Hoechst阳性细胞增加(P < 0.01),促进Bax和caspase-3表达(P < 0.01),抑制Bcl-2表达(P < 0.05)(Fig 2B、2D、2E、2F)。上述结果表明,细胞凋亡参与了糖尿病血管内皮损伤过程。

|
| Fig 2 Effect of high glucose on vascular endothelial apoptosis(x±s, n=3~6) A: Expression of apoptosis-related proteins(Bax, Bcl-2, caspase-3) in rat aortic tissues(x±s, n=6). B: Effect of high glucose on the expression of apoptosis-related proteins(Bax, Bcl-2, caspase-3) in HUVECs(x±s, n=3). C: Quantification of A. D: Quantification of B. E: High glucose on apoptosis of HUVECs. F: Percentage of Hoechst positive cells.*P < 0.05, **P < 0.01 vs control. |
为探究血管内皮凋亡的发生机制,我们通过Western blot和免疫组化检测DDR1表达与分布情况。结果显示,糖尿病大鼠主动脉组织DDR1蛋白表达显著增加(Fig 3A、3B)(P < 0.01)。通过体外细胞实验发现,高糖处理HUVECs 48 h可显著上调DDR1蛋白表达(Fig 3D)(P < 0.01)。提示DDR1可能参与高糖诱导的血管内皮损伤。

|
| Fig 3 Effect of hyperglycemia on DDR1 protein expression in vascular endothelial cells(x±s, n=3~6) A: Immunohistochemistry for detection of DDR1 protein expression in vascular tissues. B: Detection of DDR1 protein expression in vascular tissues by Western blot(x±s, n=6). C: Quantification of B. D: High glucose treatment of HUVECs for 48 h to detect DDR1 protein expression(x±s, n=3). E: Quantification of D.**P < 0.01 vs control. |
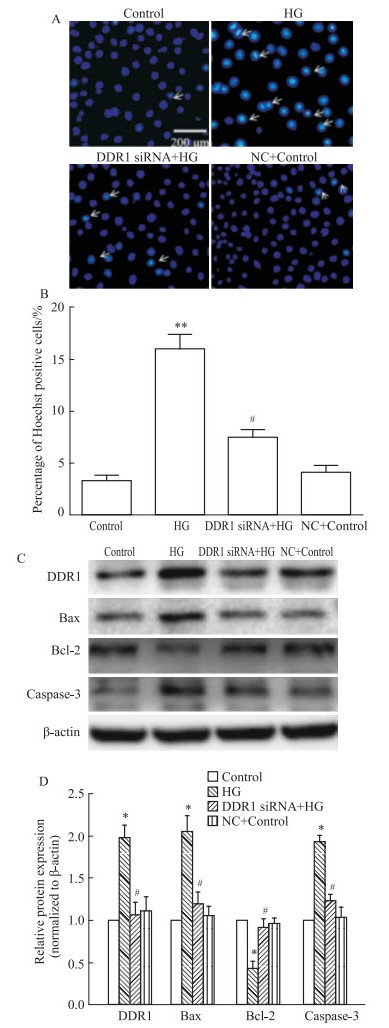
为确证DDR1与高糖诱导血管内皮细胞凋亡之间的关系,我们通过转染DDR1 siRNA 24 h后,高糖处理HUVECs 48 h。Hoechst染色法检测细胞凋亡情况,Western blot检测凋亡相关蛋白表达。结果显示,抑制DDR1可显著降低高糖诱导HUVECs Hoechst阳性细胞率增加(P < 0.05)(Fig 4A、4B),Bax和caspase-3表达的上调(P < 0.05),Bcl-2表达的下调(P < 0.05)(Fig 4C、4D)。提示抑制DDR1可以降低高糖诱导的血管内皮凋亡,缓解内皮损伤。
|
| Fig 4 Inhibition of DDR1 on high glucose-induced apoptosis of endothelial cells(x±s, n=3) A: Effect of DDR1 siRNA on the rate of apoptosis induced by high glucose in HUVECs. B: Percentage of Hoechst positive cells. C: Effect of DDR1 siRNA on high glucose-induced apoptosis-related proteins(Bax, Bcl-2, caspase-3) in HUVECs. D: Quantification of C. NC: DDR1 negative control.*P < 0.05, **P < 0.01 vs control; #P < 0.05 vs HG |
糖尿病的微血管和大血管并发症可引起心、脑、肾、眼底、下肢等重要组织器官供血不足和功能丧失,是导致糖尿病患者高致残率和高死亡率的主要原因[8]。血管内皮损伤是糖尿病血管病变的始动因素。内皮细胞是血液与血管壁之间最重要的一层保护屏障,高糖可加速内皮细胞凋亡,引发血管病变[9-11]。在本研究中,我们通过STZ诱导糖尿病大鼠和高糖处理HUVECs 48 h,观察糖尿病环境下血管内皮凋亡情况。在STZ诱导的糖尿病大鼠(12周),我们通过主动脉血管多普勒超声和HE染色检测血管内皮损伤情况,Western blot检测大鼠主动脉组织凋亡相关蛋白caspase-3、Bax和Bcl-2表达变化。结果显示,相比正常对照组大鼠,糖尿病组大鼠主动脉内中膜厚度增厚、管腔内径变小、主动脉收缩最大血流速度和主动脉舒张末期血流速度明显减小,同时出现血管内膜粗糙,褶皱显著且排列紊乱,表明血管内皮功能损伤; Western blot结果显示,Bax和caspase-3表达显著上调,Bcl-2表达显著下调。进一步细胞实验发现,高糖处理HUVECs 48 h可增加Hoechst阳性细胞率,且Bax和caspase-3表达显著上调,Bcl-2表达显著下调。上述动物和细胞实验结果共同证实,高糖环境可诱导血管内皮细胞凋亡,进而导致糖尿病血管内皮损伤。
DDR1为受体酪氨酸蛋白激酶,广泛存在于脑、肺、肾、脾和胎盘等多种组织中,参与了包括细胞迁移、增殖、生存、分化以及细胞外基质重构在内的一系列生理和病理过程[12]。研究证实,在颈动脉球囊损伤内皮的小鼠模型,颈动脉中DDR1表达明显上调,并伴随平滑肌细胞增殖、迁移和胶原(I和VIII型)合成增加[13]。在基底膜成分α5(IV)敲除的人脑微血管内皮细胞,DDR1表达降低,并伴随着内皮细胞增殖、迁移和小管形成的减少[14]。在人胚肾细胞膜上,高糖可促进DDR1蛋白的表达[15]。既往研究提示DDR1可能参与高糖诱导的血管内皮损伤。因此,在本研究中,我们通过Western blot和免疫组化共同检测12周糖尿病大鼠主动脉组织DDR1蛋白表达与分布,结果显示,相比正常对照组大鼠,糖尿病大鼠主动脉组织DDR1表达显著升高。在培养的HUVECs,高糖处理48 h, 结果显示,相比对照组,高糖处理组可以显著上调DDR1。基于本实验结果高糖可诱导内皮细胞凋亡,促进DDR1表达。我们推测,糖尿病发生时,DDR1可能通过诱导内皮细胞凋亡,引起血管内皮功能损伤。为了确定DDR1在高糖诱导的血管内皮细胞凋亡中的作用,在本实验中,我们进一步检测siRNA DDR1对高糖诱导血管内皮细胞凋亡的影响。结果显示,在培养的内皮细胞,DDR1 siRNA能显著降低高糖诱导的Hoechst阳性细胞率增加,抑制Bax、caspase-3表达上调和Bcl-2表达下调。
综上所述,本研究通过探讨DDR1对高糖诱血管内皮凋亡的影响。结果发现,高糖可通过促进DDR1表达,诱导内皮细胞凋亡,进而导致血管内皮功能损伤。以上研究结果揭示了糖尿病血管内皮损伤的部分分子机制,为进一步靶向DDR1药物治疗奠定了理论基础。
| [1] |
Zhang P, Zhang X, Brown J, et al. Global health care expenditure on diabetes for 2010 and 2030[J]. Diabetes Res Clin Pract, 2010, 87(3): 293. doi:10.1016/j.diabres.2010.01.026 |
| [2] |
Shi Y, Vanhoutte P M. Macro- and microvascular endothelial dysfunction in diabetes[J]. J Diabetes, 2017, 9(5): 434-49. doi:10.1111/1753-0407.12521 |
| [3] |
Zhang Y, Chen X, Gueydan C, et al. Plasma membrane changes during programmed cell deaths[J]. Cell Res, 2018, 28(1): 9-21. |
| [4] |
Zhang J, Guo Y, Ge W, et al. High glucose induces apoptosis of HUVECs in a mitochondria-dependent manner by suppressing hexokinase 2 expression[J]. Exp Ther Med, 2019, 18(1): 621-9. |
| [5] |
Leitinger B. Discoidin domain receptor functions in physiological and pathological conditions[J]. Int Rev Cell Mol Biol, 2014, 310: 39-87. doi:10.1016/B978-0-12-800180-6.00002-5 |
| [6] |
Moll S, Desmoulière A, Moeller M J, et al. DDR1 role in fibrosis and its pharmacological targeting[J]. Biochim Biophys Acta Mol Cell Res, 2019, 1866(11): 118474. doi:10.1016/j.bbamcr.2019.04.004 |
| [7] |
Eswaramoorthy R, Wang C K, Chen W C, et al. DDR1 regulates the stabilization of cell surface E-cadherin and E-cadherin-mediated cell aggregation[J]. J Cell Physiol, 2010, 224(2): 387-97. doi:10.1002/jcp.22134 |
| [8] |
左红, 王述进, 冯佳, 等. 血清总胆红素、糖化白蛋白、糖化血红蛋白与糖尿病血管并发症的关系[J]. 中国动脉硬化杂志, 2019, 27(9): 787-90. Zuo H, Wang S J, Feng J, et al. The relationship between serum total bilirubin, glycated albumin, glycated hemoglobin and diabetic vascular complications[J]. Chin J Arterioscler, 2019, 27(9): 787-90. doi:10.3969/j.issn.1007-3949.2019.09.011 |
| [9] |
李吉萍, 袁野, 张文友. 西洋参茎叶皂苷对糖尿病大鼠氧化损伤和血管内皮功能的影响[J]. 中国药理学通报, 2017, 33(12): 1698-702. Li J P, Yuan Y, Zhang W Y. Influence of Panax quinquefolium saponins on oxidative damage and function of vascular endothelium in diabetic rats[J]. Chin Pharmacol Bull, 2017, 33(12): 1698-702. doi:10.3969/j.issn.1001-1978.2017.12.014 |
| [10] |
Krüger-Genge A, Blocki A, Franke R P, Jung F. Vascular endothelial cell biology: An update[J]. Int J Mol Sci, 2019, 20(18): pii:E4411. doi:10.3390/ijms20184411 |
| [11] |
陈坤, 张明, 陈北冬, 等. 银杏内酯B抑制高糖诱导内皮细胞凋亡及机制研究[J]. 中国药理学通报, 2017, 33(3): 378-83. Chen K, Zhang M, Chen B D, et al. Ginkgolide B inhibits apoptosis in high glucose-stimulated human umbilical vein endothelial cells[J]. Chin Pharmacol Bull, 2017, 33(3): 378-83. doi:10.3969/j.issn.1001-1978.2017.03.017 |
| [12] |
Borza C M, Pozzi A. Discoidin domain receptors in disease[J]. Matrix Biol, 2014, 34: 185-92. doi:10.1016/j.matbio.2013.12.002 |
| [13] |
Hou G, Vogel W, Bendeck M P. The discoidin domain receptor tyrosine kinase DDR1 in arterial wound repair[J]. J Clin Invest, 2001, 107(6): 727-35. doi:10.1172/JCI10720 |
| [14] |
Xiao Q, Jiang Y, Liu Q, et al. Minor type IV collagen α5 chain promotes cancer progression through discoidin domain receptor-1[J]. PLoS Genet, 2015, 11(5): e1005249. doi:10.1371/journal.pgen.1005249 |
| [15] |
Phan T N, Wong E L, Sun X, et al. Low stability and a conserved N-glycosylation site are associated with regulation of the discoidin domain receptor family by glucose via post-translational N-glycosylation[J]. Biosci Biotechnol Biochem, 2013, 77(9): 1907-16. doi:10.1271/bbb.130351 |

