

2. 湖北科技学院糖尿病心脑血管病变湖北省重点实验室,湖北 咸宁 437100
2. Hubei Key Lab of Diabetes and Angiopathy, Hubei University of Science and Technology, Xianning Hubei 437100, China
2017年,国际糖尿病联盟公布了一组数据,目前全球共有4.25亿成人糖尿病患者。中国成人糖尿病患者人数高达1.14亿,位居世界第一,占总数的1/4以上。中国糖尿病的患病率也很惊人,2017年中国糖尿病患病率为10.9%,略低于美国(13%)。糖尿病性心肌病是一种发生于糖尿病患者,不能用高血压性心脏病、冠状动脉粥样硬化性心脏病及其他心脏病变来解释的心肌疾病[1-3]。据报道[4-5],脂毒性在糖尿病早期就对心肌产生不良影响,其危害明显大于糖毒性。目前,有研究表明脂毒性心肌损伤与内质网应激(endoplasmic reticulum stress,ERS)或线粒体凋亡通路之间存在一定联系[6-7]。
和厚朴酚属于烯丙基和羟基引入苯环上的联苯类化合物[8-10],据报道,和厚朴酚是在糖脂代谢、保肝护肝、氧化应激等方面的功效与机制研究逐渐受到关注。但和厚朴酚对心肌细胞脂毒性损伤的保护作用及其机制目前尚无报道。基于此,本研究将以ERS-线粒体凋亡通路为切入点,探讨和厚朴酚对心肌细胞脂毒性损伤的保护作用及其与ERS-线粒体凋亡通路的相关性。
1 材料与方法 1.1 材料 1.1.1 试剂GRP78(#3177)、CHOP(#2895)、PERK(#5683)、pPERK(#3179)、Bcl-2(#15071)、Bax(#5023)、cleaved caspase-3(#9661)、β-actin(#3700)抗体购自美国CST公司;IRE1(ab37073)、p-IRE1(ab124945)抗体购自美国Abcam公司;棕榈酸(palmitic acid,PA,#292125)、和厚朴酚(#4914)购自美国Sigma公司;DMEM培养基,购自美国HyClone公司;胎牛血清,购自浙江天杭生物科技股份有限公司;BCA蛋白定量试剂盒,购自VazymE公司;活性氧(reactive oxygen species,ROS)检测试剂盒购自大连美仑生物技术有限公司;细胞凋亡检测试剂盒试剂盒购自贝博生物;MTT检测试剂盒及线粒体膜电位检测试剂盒购自碧云天公司。H9c2大鼠心肌细胞,购自上海通派生物有限公司。
1.1.2 仪器恒温空气浴摇床(上海福玛实验设备有限公司);超净工作台(苏州净化公司);细胞CO2培养箱(Thermo公司);CKX41倒置相差显微镜(日本Olympus公司);电泳槽、电转膜仪(Bio-Rad公司);多功能酶标仪(美国Bio-Tek公司);化学发光凝胶成像系统(英国Syngene公司)。
1.2 方法 1.2.1 PA及和厚朴酚的配制用0.1 mol·L-1的NaOH溶液,在70 ℃水浴中溶解一定量的PA,振荡混匀10 min,过滤,配成100 mmol·L-1的PA储存液。在55 ℃水浴中,用去离子水配制50 g·L-1的牛血清白蛋白(bovine serum albumin,BSA)溶液,过滤。用PA储存液和BSA溶液制备混合液,体积比值为1 :19,经振荡和水浴后,室温下冷却过滤后,用细胞培养基稀释制备工作液。和厚朴酚则溶解于DMSO,使母液浓度达到100 mmol·L-1,使用前将其融于DMEM(含血清、双抗)达到工作液浓度,涡旋混匀后使用。
1.2.2 细胞培养DMEM培养基中加入双抗、10%胎牛血清,用于培养H9c2心肌细胞,当细胞的贴壁密度处于70%~80%时,用含有0.25% EDTA的胰酶轻轻吹打消化、传代至所需培养皿中进行实验。
1.2.3 实验分组1) MTT实验分组:① PA浓度梯度: control组(空白对照组加入同等体积的PBS)、PA(0.1、0.2、0.4、0.8 mmol·L-1)刺激24 h组,进行MTT检测。② PA时间梯度: control组(空白对照组加入同等体积的PBS)、PA(0.4 mmol·L-1)刺激0、12、24、48 h组,进行MTT检测。③和厚朴酚作用实验:control组(空白对照组加入同等体积的PBS)、PA 0.4 mmol·L-1组、PA 0.4 mmol·L-1+和厚朴酚5 μmol·L-1组、PA 0.4 mmol·L-1+和厚朴酚10 μmol·L-1组、PA 0.4 mmol·L-1+和厚朴酚20 μmol·L-1组、和厚朴酚20 μmol·L-1组,含和厚朴酚培养基预处理1 h后吸出培养基,再加入含PA+和厚朴酚的培养基。2)试剂盒及免疫印迹实验分组:Control组、PA 0.4 mmol·L-1组、PA 0.4 mmol·L-1+和厚朴酚5 μmol·L-1组、PA 0.4 mmol·L-1+和厚朴酚10 μmol·L-1组、PA 0.4 mmol·L-1+和厚朴酚20 μmol·L-1组、和厚朴酚20 μmol·L-1组,含和厚朴酚培养基预处理1 h后吸出培养基,再加入含PA+和厚朴酚的培养基。
1.2.4 MTT检测细胞增殖MTT检测采用96孔板接种细胞,细胞密度为1×106个/孔,培养24 h后给药,进行孵育,每孔加入20 μL MTT(5 g·L-1),在37 ℃细胞培养箱孵育4 h,吸除上清,每孔加入150 μL DMSO,振荡混匀后,用酶标仪检测570 nm处的各孔OD值。细胞增殖率/%=OD处理孔/OD阴性对照孔×100%。
1.2.5 ROS水平检测ROS水平检测采用6孔板接种细胞,分组给药后,在37 ℃细胞培养箱放置24 h,加入PBS后洗涤5 min,重复3次后,每孔加入DHE(10 mmol·L-1),在37 ℃细胞培养箱放置30 min,吸除上清,加入PBS后洗涤5 min,重复3次后,荧光显微镜的激发波长设置为480~535 nm,发射波长设置为590~610 nm,并用ImageJ 1.41软件分析红色荧光强度。
1.2.6 线粒体膜电位检测线粒体膜电位检测采用6孔板接种细胞,分组给药后,在37 ℃细胞培养箱放置24 h,加入PBS后洗涤5 min,重复3次后,每孔加入4%多聚甲醛,固定10 min后,吸除上清,用PBS洗涤细胞3次,每次5 min。每孔加入500 μL培养液,再向每孔加入500 μL JC-1染色工作液,放入细胞培养箱等待20 min。孵育后,吸除上清,加入PBS后洗涤5 min,重复3次后进行封片,加入2 mL培养液运用荧光显微镜检测荧光。
1.2.7 细胞凋亡检测细胞凋亡检测采用6孔板接种细胞,分为以下几组:control组、PA 0.4 mmol·L-1组、PA 0.4 mmol·L-1+和厚朴酚5 μmol·L-1组、PA 0.4 mmol·L-1+和厚朴酚10 μmol·L-1组、PA 0.4 mmol·L-1+和厚朴酚20 μmol·L-1组、和厚朴酚20 μmol·L-1组,含和厚朴酚培养基预处理1 h后吸出培养基,再加入含PA+和厚朴酚的培养基。分组给药后,在37 ℃细胞培养箱放置24 h,加入PBS后洗涤5 min,重复3次后,每孔加入4%多聚甲醛,固定10 min后,用PBS洗涤细胞3次,每次5 min。每孔加入400 μL反应液,再向每孔加入10 μL PI,放入细胞培养箱等待10 min,加入PBS后洗涤5 min,重复3次后进行封片,用荧光显微镜检测荧光,PI为红色荧光。
1.2.8 免疫印迹法检测蛋白表达细胞凋亡检测采用培养皿接种细胞,分组给药后,在37 ℃细胞培养箱放置24 h,加入PBS后洗涤5 min,重复3次后,每皿细胞进行裂解,将细胞刮下,离心收集沉淀,蛋白含量采用BCA试剂盒检测。定量后的蛋白样品取20 μL进行上样,采用5%~15%的SDS-PAGE分离胶进行蛋白电泳,采用PVDF膜进行2 h转模,室温下采用5%的脱脂奶粉进行1 h的封闭,4 ℃下加入一抗孵育24 h,加入PBS后洗涤5 min,重复3次后,室温下加入HRP标记的二抗孵育1 h,用ECL化学发光显影,然后凝胶成像系统检测GRP78、CHOP、pPERK、p-IRE1、Bcl-2、Bax、cleaved caspase-3、β-actin的表达水平。
1.3 统计学方法以x±s表示数据,GraphPad Prism 5软件用于数据的统计分析,采用t检验和单因素方差分析比较组间差异。
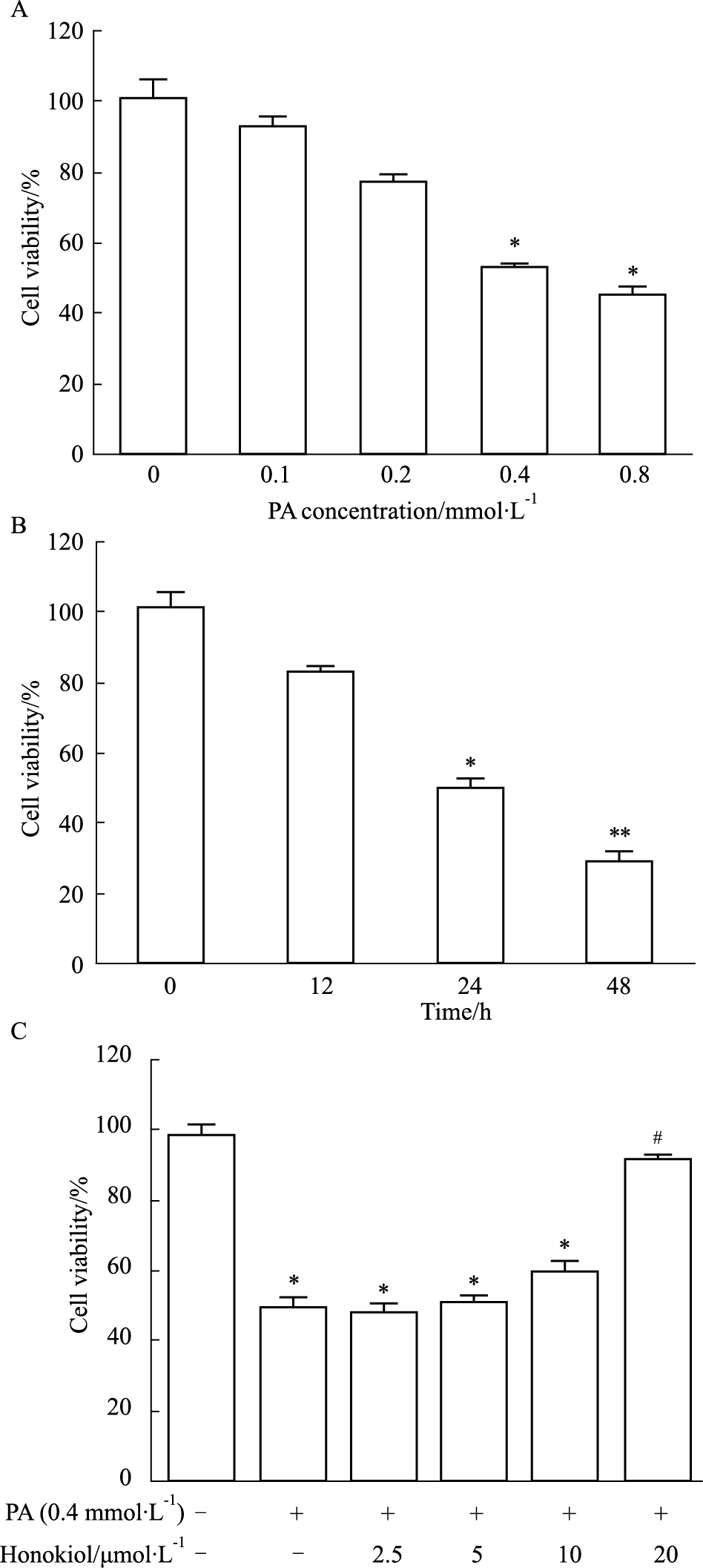
2 结果 2.1 和厚朴酚对高脂诱导的心肌细胞增殖能力低下的影响体外培养H9c2心肌细胞,用含PA(0.1、0.2、0.4、0.8 mmol·L-1)的DMEM培养基刺激24 h。如Fig 1A所示,心肌细胞增殖率随着PA浓度的增加呈现下降趋势,PA浓度在0.4 mmol·L-1时,降低明显(P<0.05)。Fig 1B结果显示,含PA 0.4 mmol·L-1的DMEM培养基刺激细胞0、12、24、48 h后,心肌细胞增殖率随着PA刺激时间的延长呈现下降趋势,尤其在24 h时,细胞增殖率开始明显降低(P<0.05)。因此,我们将PA浓度定为0.4 mmol·L-1,刺激时间定为24 h开展下一步实验。如Fig 1C所示,PA组心肌细胞增殖率明显下降,随着预处理的和厚朴酚浓度的升高,PA+和厚朴酚组的细胞增殖率呈现浓度依赖性升高趋势。尤其和厚朴酚在20 μmol·L-1时,细胞增殖率明显恢复至正常水平,因此在下一步实验中和厚朴酚浓度设置为20 μmol·L-1。
|
| Fig 1 Viability of H9c2 cells treated with PA alone or combination of PA and honokiol(x±s, n=5) A:Concentration-dependent cell damage induced by PA at 24 h stimulation time.*P<0.05 vs 0 mmol·L-1 group. B:Time-dependent cell damage induced by PA at 0.4 mmol·L-1 concentration. *P<0.05, **P<0.01 vs 0 h group. C:Viability of cells treated with varied drugs (culture time:24 h). *P<0.05 vs control group; #P<0.05 vs PA group. |
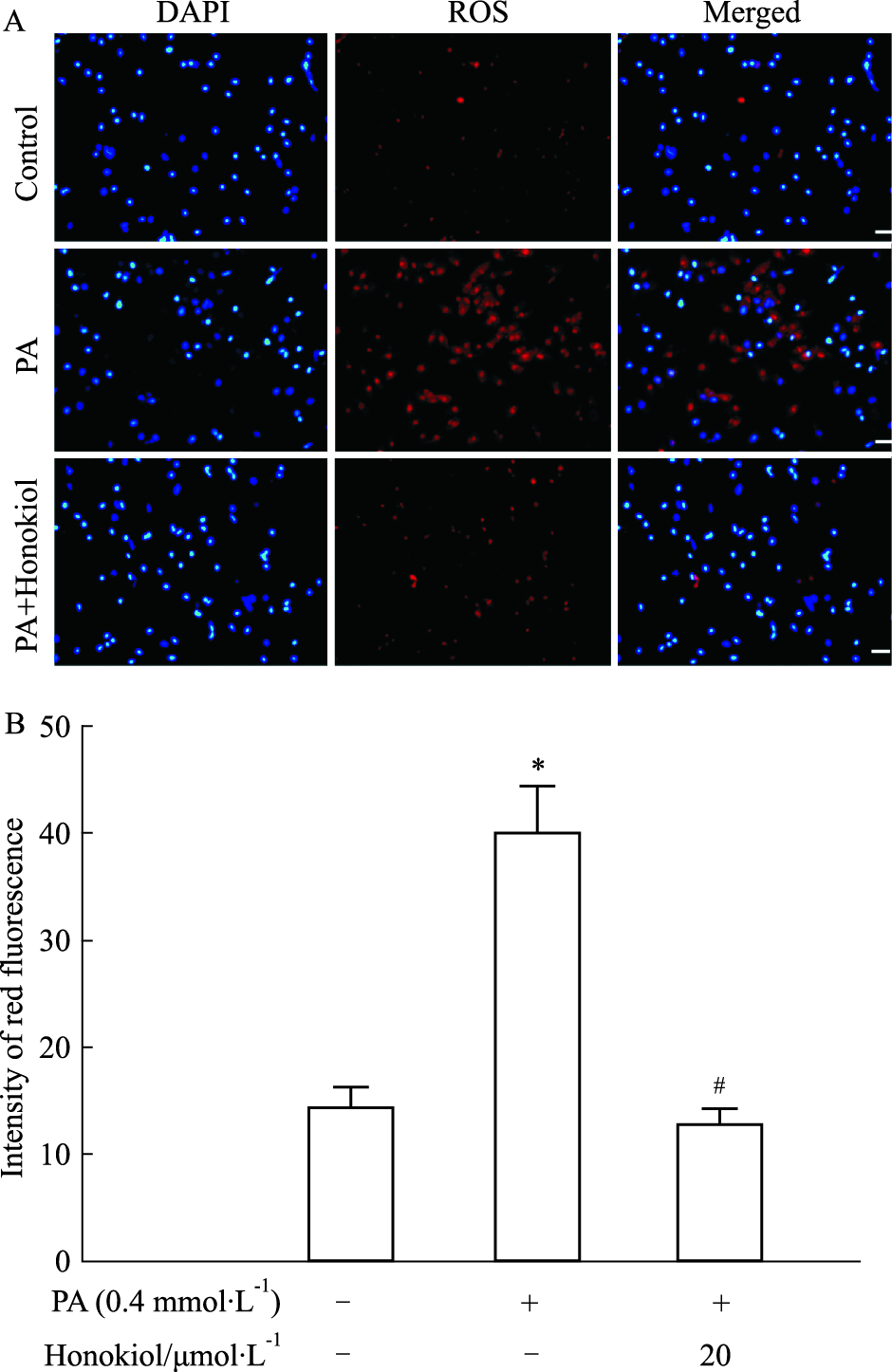
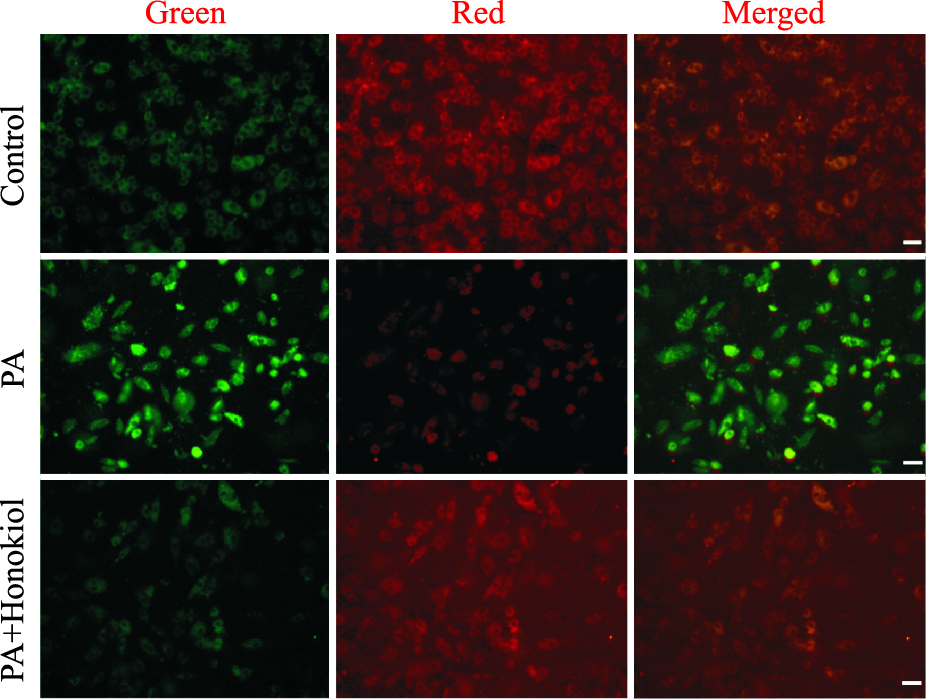
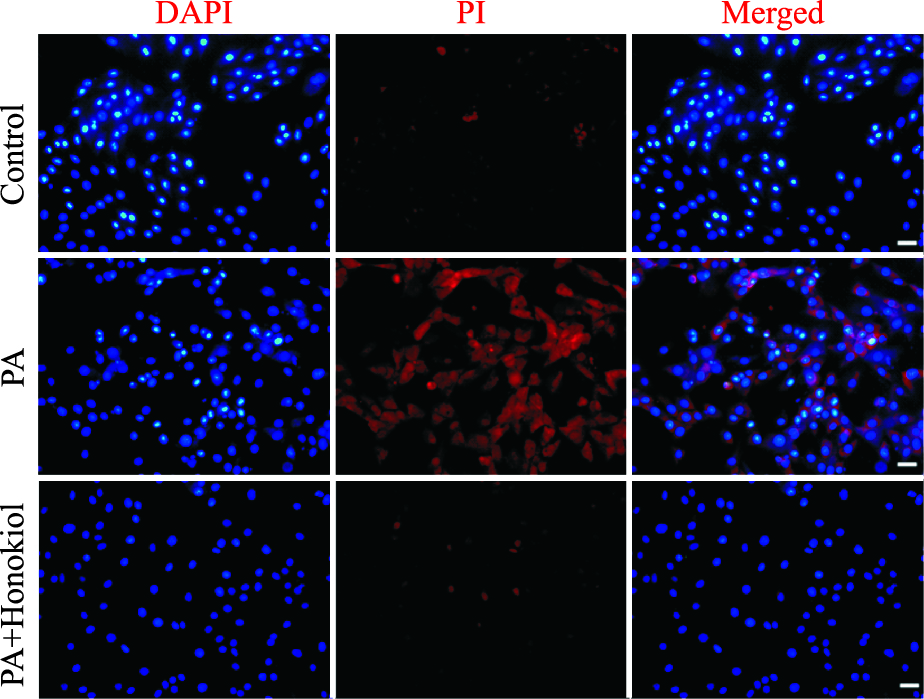
如Fig 2所示,PA组的红色荧光明显增强,而PA+和厚朴酚组的红色荧光显著弱于PA组,接近正常组。如Fig 3所示,PA组红色荧光显著减弱,绿色荧光显著增强,而PA+和厚朴酚组的红色荧光明显强于PA组且绿色荧光弱于PA组,接近正常组。如Fig 4所示,0.4 mmol·L-1 PA刺激24 h后,细胞内PI标记的红色荧光明显增强,而预处理和厚朴酚组可以明显逆转上述荧光改变。
|
| Fig 2 Effect of honokiol on PA-induced cardiomyocyte oxidative damage(scale bar:50 μm) A:The intracellular level of ROS in H9c2 was estimated by DHE, a fluorescent probe; B:Fluorescence intensity of red fluorescence(x±s, n=3). *P<0.05 vs control group; #P<0.05 vs PA group. |
|
| Fig 3 Effect of honokiol on PA-induced reduction of cardiomyocyte mitochondrial membrane potential(scale bar:50 μm) The intracellular level of mitochondrial membrane potential in H9c2 was estimated by JC-1, a fluorescent probe. |
|
| Fig 4 Effect of honokiol on PA-induced cardiomyocyte apoptosis(scale bar:50 μm) The intracellular apoptosis level in H9c2 was estimated by PI labelled fluorescent probe. |
如Fig 5A所示,用含0.4 mmol·L-1 PA的DMEM培养基刺激H9c2心肌细胞24 h时,GRP78及CHOP表达明显升高(P<0.05),且p-PERK及p-IRE1蛋白表达明显升高;预处理和厚朴酚组可以明显逆转心肌细胞内高脂诱导的ERS相关蛋白GRP78、CHOP、p-PERK及p-IRE1表达的升高(P<0.05)。如Fig 5B所示,用含0.4 mmol·L-1 PA的DMEM培养基刺激H9c2心肌细胞24 h时,Bcl-2水平明显下降(P<0.05),而如Fig 6所示,Bax、cleaved caspase-3等蛋白的表达均明显升高(P<0.05)。而预处理和厚朴酚组可以明显逆转上述改变(P<0.05)。
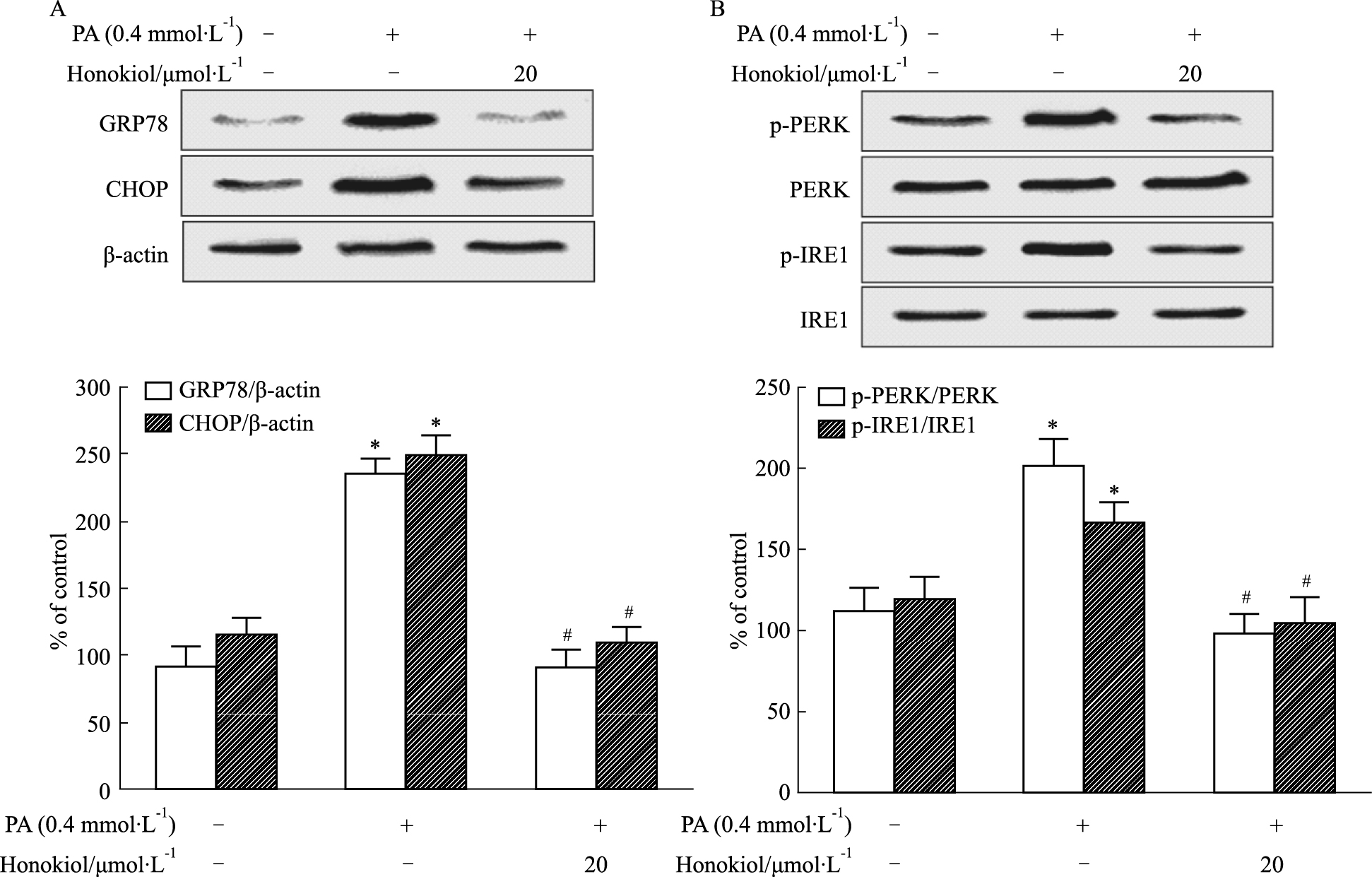
|
| Fig 5 Effect of honokiol on expression of ERS pathway related proteins(A:GRP78 and CHOP; B:p-PERK/PERK and p-IRE1/IRE1) in cardiomyocytes induced by PA(x±s, n=3) *P < 0.05 vs control group; #P < 0.05 PA group |

|
| Fig 6 Effect of honokiol on expression of mitochondrial apoptotic pathway related proteins in cardiomyocytes induced by PA(x±s, n=3) *P < 0.05 vs control group; #P < 0.05 vs PA group |
糖尿病心肌病的发病因素较多,其中高脂毒性是重要原因之一[11]。高脂毒性是指血游离脂肪酸水平增高[6, 12],以三酰甘油的形式在脂肪组织、非脂肪组织过度沉积,引起脂质异位贮存。血游离脂肪酸高可使细胞的葡萄糖摄入、利用及糖原合成减少,可损害胰岛素受体信号通路的活性,激活炎症因子,引起胰岛素抵抗,促进血胰岛素水平升高;可使线粒体产生ROS增多,激活终末糖基化产物通路、PKC通路、己糖胺通路等,导致损伤细胞。动物实验也证实,高脂血症可以导致心肌脂质沉积、心室壁增厚、心室重构、心脏收缩功能降低。本研究证实,高脂可以诱发心肌细胞增殖率明显下降,细胞内活性氧生成增多,凋亡增加,而和厚朴酚可以显著逆转高脂所示心肌细胞增殖能力低下,并降低活性氧的产生,缓解细胞脂毒性损伤。
心肌细胞脂毒性损伤的发病机制复杂,与多条信号通路相关,尤其是ERS信号通路与线粒体凋亡通路已成为近年来的研究热点。内质网是真核细胞中最重要的细胞器之一[13],基本生理功能包括钙调节、蛋白质的合成加工及脂质和胆固醇的合成。研究表明,ERS是一种自我保护性机制,但是过强或时间过长的ERS可能会导致细胞死亡。在非应激条件下,ER跨膜蛋白的ER腔内区域与伴侣蛋白GRP78相结合,ERS时,GRP78分别与PERK、IRE1等ER跨膜蛋白解离,转位至内ER内,促进蛋白折叠,同时使ERS的下游信号通路激活,上调凋亡相关转录因子C/EBP同源蛋白CHOP的表达[14],最终促使细胞凋亡。有报道也提出上调的CHOP诱发细胞凋亡与线粒体通路相关,例如下调线粒体外膜上的抗凋亡蛋白Bcl-2的表达,上调促凋亡蛋白Bax的表达,从而引起线粒体外膜孔径变大,线粒体膜通透性增加,促进线粒体中细胞色素C的释放及凋亡诱导因子的高表达,出现凋亡蛋白caspase-3的大量表达,最终导致细胞凋亡。本研究结果提示,高脂刺激可以明显诱发心肌细胞内ERS相关蛋白GRP78、p-PERK、p-IRE1和CHOP的表达明显升高,促凋亡蛋白BAX及cleaved caspase-3的表达也明显升高,抗凋亡蛋白Bcl-2的表达明显降低,而和厚朴酚预处理可以明显逆转上述变化。这些结果表明,和厚朴酚可以调控细胞内ERS-线粒体凋亡信号通路,保护心肌细胞出现脂毒性损伤。
综上所述,和厚朴酚能成功逆转高脂所致的心肌细胞增殖力下降,缓解氧化应激损伤及线粒体功能紊乱,通过调控ERS信号通路,最终减少线粒体介导的心肌细胞凋亡,起到保护心肌细胞的作用,目前和厚朴酚对心肌细胞脂毒性损伤的保护作用及其机制国内外尚无报道,本研究为和厚朴酚治疗心肌细胞脂毒性损伤奠定了理论和实践基础。
| [1] |
张景怡, 鲍翠玉, 李晶. AMPK信号通路在糖尿病心肌病中的研究进展[J]. 中国药理学通报, 2017, 33(11): 1496-9. Zhang J Y, Bao C Y, Li J. Research progress of AMPK pathway in diabetic cardiomyopathy[J]. Chin Pharmacol Bull, 2017, 33(11): 1496-9. doi:10.3969/j.issn.1001-1978.2017.11.005 |
| [2] |
Jaquenod De Giusti C, Blanco P G, Lamas PA, et al. Carbonic anhydrase II/sodium-proton exchanger 1 metabolon complex in cardiomyopathy of ob-/-type 2 diabetic mice[J]. J Mol Cell Cardiol, 2019, 136: 53-63. doi:10.1016/j.yjmcc.2019.09.005 |
| [3] |
Xing R, Liu D, Cheng X, et al. MiR-207 inhibits autophagy and promotes apoptosis of cardiomyocytes by directly targeting LAMP2 in type 2 diabetic cardiomyopathy[J]. Biochem Biophys Res Commun, 2019, 520(1): 27-34. doi:10.1016/j.bbrc.2019.09.092 |
| [4] |
赵一楠, 周迎生. 糖尿病性心肌病的研究进展[J]. 中国糖尿病杂志, 2016, 24(4): 381-4. Zhao Y N, Zhou Y S. Research progress of diabetic cardiomyopathy[J]. Chin J Diabetes, 2016, 24(4): 381-4. doi:10.3969/j.issn.1006-6187.2016.04.023 |
| [5] |
莫雷同, 吴铿. 脂毒性在糖尿病心肌病发病机制中的作用研究进展[J]. 现代医药卫生, 2015(10): 1489-91. Mo L T, Wu K. Research progress on the role of lipotoxicity in the pathogenesis of diabetic cardiomyopathy[J]. J Mod Med Health, 2015(10): 1489-91. doi:10.3969/j.issn.1009-5519.2015.10.018 |
| [6] |
陈丹, 吴基良, 李晶. 内质网应激信号通路在高脂诱导的心肌细胞损伤中的作用[J]. 中国药理学通报, 2017, 33(7): 966-71. Chen D, Wu J L, Li J. Role of endoplasmic reticulum stress in high fattyacid induced injury in cardiomyocytes[J]. Chin Pharmacol Bull, 2017, 33(7): 966-71. doi:10.3969/j.issn.1001-1978.2017.07.016 |
| [7] |
刘涛, 李晶, 鲍翠玉. 高脂通过线粒体通路诱导H9c2心肌细胞损伤[J]. 中国药理学通报, 2019, 35(4): 494-9. Liu T, Li J, Bao C Y. High fatty acid induced H9c2 cardiomyocytes injury through mitochondrial pathways[J]. Chin Pharmacol Bull, 2019, 35(4): 494-9. doi:10.3969/j.issn.1001-1978.2019.04.010 |
| [8] |
Oufensou S, Scherm B, Pani G, et al. Honokiol, magnolol and its monoacetyl derivative show strong anti-fungal effect on Fusarium isolates of clinical relevance[J]. PLoS One, 2019, 14(9): e0221249. doi:10.1371/journal.pone.0221249 |
| [9] |
Jiraviriyakul A, Songjang W, Kaewthet P, et al. Honokiol-enhanced cytotoxic T lymphocyte activity against cholangiocarcinoma cells mediated by dendritic cells pulsed with damage-associated molecular patterns[J]. World J Gastroenterol, 2019, 25(29): 3941-55. doi:10.3748/wjg.v25.i29.3941 |
| [10] |
Guo S, Xu J J, Wei N, et al. Honokiol attenuates the memory impairments, oxidative stress, neuroinflammation, and GSK-3β activation in vascular dementia rats[J]. J Alzheimers Dis, 2019, 71(1): 97-108. |
| [11] |
陈蔚, 鞠婧, 孙奇林, 等. 黄芪多糖改善db/db糖尿病肥胖小鼠心肌脂毒性的机理研究[J]. 国际心血管病杂志, 2018, 45(2): 79-83. Chen W, Ju J, Sun Q L, et al. Mechanism of astragalus polysaccharide therapy in improving myocardial lipid toxicity in db/db diabetic obese mice[J]. Int J Cardio Dis, 2018, 45(2): 79-83. doi:10.3969/j.issn.1673-6583.2018.02.005 |
| [12] |
Fang K, Wu F, Chen G, et al. Diosgenin ameliorates palmitic acid-induced lipid accumulation via AMPK/ACC/CPT-1A and SREBP-1c/FAS signaling pathways in LO2 cells[J]. BMC Complement Altern Med, 2019, 19(1): 255. |
| [13] |
Khatun H, Ihara Y, Takakura K, et al. Role of endoplasmic reticulum stress on developmental competency and cryo-tolerance in bovine embryos[J]. Theriogenology, 2019, 142: 131-7. |
| [14] |
Yu L, Xie R, Tian T, et al. Suberoylanilide hydroxamic acid upregulates histone acetylation and activates endoplasmic reticulum stress to induce apoptosis in HepG2 liver cancer cells[J]. Oncol Lett, 2019, 18(4): 3537-44. |

