

近年来,主动吸烟和被动吸烟的人数在全世界范围内增加,女性暴露于二手烟的现象非常普遍,育龄期妇女吸烟率呈明显上升趋势[1]。在吸烟时,烟草烟雾(cigarette smoke,CS)中的有害物质会通过呼吸道的粘膜进入人体的各个器官和组织造成全身性的伤害,例如CS中的有毒物质通过降低胚胎植入率,减少卵巢中类固醇激素的生成和卵泡数量等,影响女性生殖的各个阶段[2]。CS混合物中的有毒物质也可导致子宫发育受损,子宫是哺乳动物重要的生殖器官,主要由3种类型的细胞(上皮细胞,基质细胞和子宫肌层细胞)组成。研究发现,口服尼古丁会导致大鼠子宫腔上皮和腺上皮形态学改变[3],CS暴露可导致子宫基质金属肽酶9(matrix metalloproteinase 9,MMP-9),4型CXC趋化因子受体(recombinant chemokine C-X-C-motif receptor 4,CXCR4)和雌激素受体(estrogen receptor,ER)的表达增加[4]。曲古抑菌素A(trichostatin A,TSA)能够改变蛋白质乙酰化水平,对多种疾病都有治疗作用,例如TSA能够缓解肾上腺嗜铬细胞瘤造成的缺血性损伤[5]。在我们先前的研究中,CS暴露通过激活组蛋白脱乙酰基酶1/2(histone deacetylase,HDAC)导致子宫组织形态发生变化,TSA通过抑制HDAC 1/2和mTOR的激活,重新激活自噬,从而引起子宫组织形态改变[6]。由于CS含有多种复杂的有害成分,CS暴露对子宫损伤的机制尚未完全清楚。
嘌呤受体(purinergic receptor P2X,ligand-gated ion channel,7,P2RX7)是由细胞外三磷酸腺苷(eATP)激活的离子通道,在与天然配体胞外ATP(eATP)结合后介导细胞内钠和钙的内流以及钾的外流。在子宫组织中,P2RX7主要在子宫内膜,子宫颈内膜和外宫颈的上皮细胞中表达[7]。在大鼠子宫肌层细胞中ATP诱导的电流通过P2RX7受体穿过细胞膜导致子宫收缩[8]。P2RX7受体可以引起Ca2+的强烈增加和胱冬肽酶(cysteinyl aspartate-specific proteases,caspase)的裂解来启动细胞凋亡,也可以诱导NLRP3炎性体和caspase-1的激活导致促炎因子的分泌,最终发生细胞焦亡。研究发现,P2X7-NLRP3/ASC-caspase1/11-IL-1β/IL-18轴在CS暴露导致的小鼠过敏性气道炎症中发挥重要作用[9]。此外,P2RX7受体还可通过caspase-9介导的线粒体途径诱导人宫颈上皮细胞凋亡[10]。综上所述,P2RX7受体在子宫组织中发挥重要的作用,而P2RX7受体介导的细胞焦亡和凋亡是否参与了CS暴露导致的子宫损伤?P2RX7受体是否参与TSA对CS暴露导致的子宫组织损伤的缓解作用?目前尚需要进一步探索。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级60 d C57 BL/6小鼠36只,♀,体质量(20±0.5)g,购自辽宁长生生物技术有限公司[SCXK(辽)2015-0001]。实验在中国医科大学附属盛京医院动物中心SPF级动物饲养室[SYXK(辽)2017-0004]进行,实验动物饲养在室温(22 ±3)℃,相对湿度(50±20)%,暗循环,噪声 < 60 dB,氨≤1.5×10-6的SPF级房间中,自由喂食实验动物饲料和水。针对实验动物的所有操作流程关注动物福利,并通过中国医科大学附属盛京医院医学伦理委员会批准(2013PS06K;2019PS263K)。实验前词养1周,观察无明显全身疾病及其他异常后开始实验。CS暴露期间每2 d测量1次小鼠体重。
1.1.2 试剂雄狮牌香烟(每支含0.7 mg尼古丁和8 mg焦油); TSA(Sigma; 批号:T1952,规格:200 μL); 一抗来源:GAPDH(康成生物; 批号:KC-5G4,规格:100 μL); P2RX7(proteintech; 批号:11144-1-AP,规格:150 μL); NLRP3(abcam; 批号:ab214185,规格:100 μL); ASC(万类生物; 批号:WL02462,规格:50 μL); cleaved caspase-1(万类生物; 批号:WL02996a,规格:50 μL); IL-1β(万类生物; 批号:WLH3903,规格:50 μL); cleaved caspase-3(万类生物; 批号:WL02117,规格:50 μL); cleaved caspase-9(CST; 批号:9509S,规格:100 μL); 羊抗兔二抗(Abbkine; 批号:A23620,规格:50 μL); 羊抗鼠二抗(Abbkine; 批号:A25012,规格:50 μL)
1.2 研究方法 1.2.1 烟草烟雾暴露小鼠模型将36只体质量年龄大小相近的C57 BL/6小鼠按随机分组的方法分为对照组、CS暴露组和CS+TSA组,每组12只,对每组内的小鼠进行编号,列表记录它们的初始体质量以及精神活动状态。自制实验性CS暴露装置,CS暴露方法参照本课题组前期实验[6]。CS暴露组和CS+TSA组小鼠CS暴露时间为30 d,每天2次CS暴露,每次CS暴露给2支烟持续暴露2 h,CS暴露时间间隔为5 h。每次进行CS暴露时取1支烟点燃,使烟雾进入CS暴露组小鼠所处的箱子内,CS暴露组箱子放在无风环境中,保持一定的空气流通。对照组小鼠吸入空气。药物TSA(将TSA溶于DMSO,再用生理盐水将其配制成浓度为1.98×10-5 mol·L-1的溶液),按0.6 μg·g-1体质量的剂量,每2 d 1次,腹腔内注射给CS+TSA组小鼠。CS暴露30 d后,对处于发情期的雌性小鼠实施安乐死,并从每组中至少收集了5个子宫用于进一步研究。
1.2.2 HE染色CS暴露30 d后,取CS暴露组和对照组小鼠的子宫组织,用4%多聚甲醛固定24 h,再经梯度酒精的洗涤、脱水、二甲苯透明,浸蜡,进行组织包埋,以4 μm厚度连续切片,HE染色,中性树脂封片后置于光学显微镜下观察并拍照。
1.2.3 Western blot分析提取对照组、CS暴露组和CS+TSA组小鼠子宫组织总蛋白,然后将提取的各组子宫组织的总蛋白进行SDS-PAGE电泳,用P2RX7(1 :2 000稀释)、ASC(1 :2 000稀释)、IL-1β(1 :2 000稀释)、GAPDH(1 :5 000稀释)、cleaved caspase1(1 :2 000稀释)、NLRP3(1 :500稀释)、cleaved caspase3(1 :2 000稀释)和cleaved caspase-9(1 :2 000稀释)抗体孵育。实验结束后用Image-J软件对光密度值进行定量检测,对不同分子量蛋白的表达情况进行分析。
1.2.4 Real time-PCR使用TRIzol试剂从子宫中分离总RNA(n=3~4/组),并用oligo(dT)引物和SuperScript Ⅱ反转录RNA(1 mg)。在具有SYBR Green的Roche 480 PCR系统上进行实时定量PCR。将GAPDH作为内源性对照,并使用2-ΔΔct方法计算每个样品的基因表达相对水平。基因的引物序列。
| Gene | Forward(5′ to 3′) | Reverse(5′ to 3′) | Length |
| Gapdh | ATGTTTGTGATGGGTGTGAA | ATGCCAAAGTTGTCATGGAT | 122 bp |
| P2rx7 | TGTGTGCATTGACTTGCTC | CATACTTCAACGTCGGCTT | 158 bp |
| Asc | GGAGTCGTATGGCTTGGA | AGTGCTTGCCTGTGCTG | 177 bp |
| Il-β | TCTCCACCTCAATGGACAG | TGCCGTCTTTCATTACACA | 146 bp |
应用GraphPad Prism 7.00统计软件分析数据,2组比较采用独立样本t检验,3组比较采用单因素方差分析。
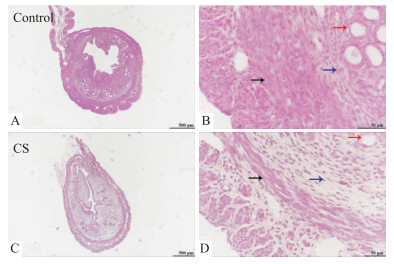
2 结果 2.1 CS暴露导致子宫组织结构改变CS暴露导致子宫组织形态学改变。Fig 1C结果显示,CS暴露后的小鼠比暴露于室内空气的小鼠的子宫肌层(中环肌和内纵肌)和子宫内膜更薄。Fig 1D结果显示,CS暴露后小鼠子宫腺体组织和间质细胞明显减少。我们先前的研究结果发现,TSA有效抑制了CS暴露引起的小鼠子宫肌层变薄以及腺体组织和间质细胞的减少[6]。
|
| 图 1 Histomorphologic alterations in uterine caused by CS exposure A: The morphology of uterine tissues of mice in the optical microscope (HE, ×40) Control group; B: The enlarged optical microscope image of the myometrial region in Fig A (HE, ×400); C: The morphology of uterine tissues of mice in the optical microscope (HE, ×40) CS group; D: The enlarged optical microscope image of the myometrial region in Fig C (HE, ×400). Blue arrows point to interstitial cells, black arrows to myometrium and red arrows to glandular tissues. |
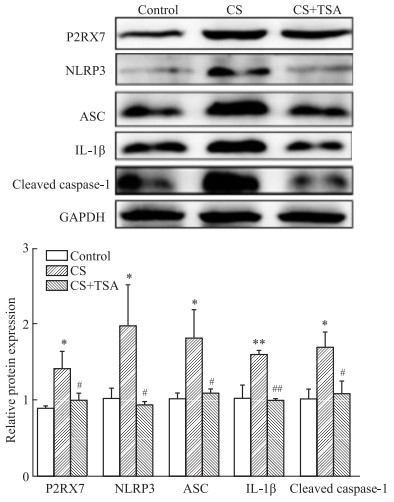
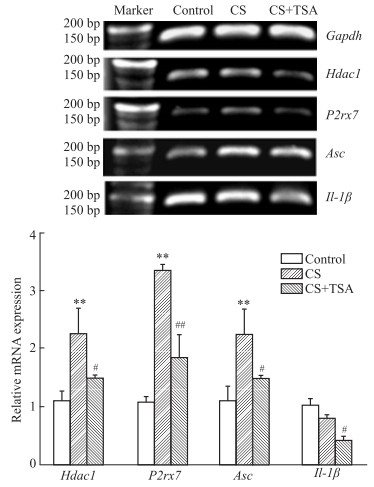
我们前期的研究表明,CS暴露能够引起小鼠子宫组织形态学改变,TSA能够改善CS暴露引起的小鼠子宫组织形态学改变[6]。因此,我们进一步探索了TSA是否能够通过抑制P2RX7介导的细胞焦亡缓解CS暴露引起的子宫组织形态学改变。首先,我们采用Western blot技术检测了各组(对照组、CS暴露组和CS+TSA组)小鼠子宫组织中P2RX7和细胞焦亡相关蛋白的表达水平,细胞焦亡相关蛋白包括核苷酸结合寡聚化结构域样受体3(NACHT-LRRPYD-containing proteins 3 inflammasome,NLRP3),白细胞介素1β (interleukin 1β,IL-1β),凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)和cleaved caspase 1。结果表明,CS暴露后小鼠子宫组织P2RX7和细胞焦亡相关蛋白表达水平明显升高,TSA有效抑制了CS暴露诱导的小鼠子宫组织P2RX7和细胞焦亡相关蛋白的表达。此外,我们通过Real time-PCR检测了小鼠子宫组织中Hdac1,IL-1β,P2rx7和Asc的mRNA转录水平。结果表明,CS暴露后小鼠子宫组织中Hdac1,P2rx7和Asc的mRNA转录活性升高,并且TSA明显抑制了CS暴露后小鼠子宫组织中Hdac1,Il-1β,P2rx7和Asc的mRNA转录活性。因此,我们的结果表明, TSA能够通过抑制P2RX7介导的细胞焦亡改善CS暴露引起的子宫组织形态改变。
|
| 图 2 Activation of markers of pyroptosis activation induced by CS exposure inhibited by TSA (x±s,n=3) Blots of expression of P2RX7 and pyroptosis related proteins in three groups. *P < 0.05, **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs CS |
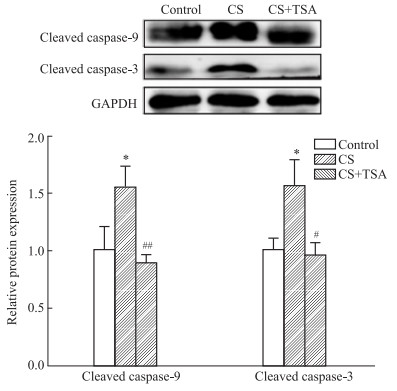
为了进一步探索TSA能否通过抑制P2RX7介导的细胞凋亡,缓解CS暴露导致的小鼠子宫损伤,我们使用Western blot技术检测了各组(对照组、CS暴露组和CS+TSA组)小鼠子宫组织中细胞凋亡相关蛋白(cleaved caspase-3和cleaved caspase-9)的表达水平。结果表明,CS暴露后小鼠子宫组织细胞凋亡相关蛋白的表达水平增加,TSA抑制了CS暴露诱导的小鼠子宫组织细胞凋亡相关蛋白的表达。因此,我们的研究结果证实TSA也能够通过抑制P2RX7介导的细胞凋亡改善CS暴露引起的子宫组织形态改变。
|
| 图 3 Transcriptional activity of Hdac1, P2rx7 and Asc inhibited by TSA (x±s, n=3) Electrophoresis results of PCR products of Gapdh, Hdac1, P2rx7, Asc and Il-1β. The mRNA levels of Hdac1, P2rx7 and Asc increased and Il-1β decreased in the uterus after CS exposure, and TSA significantly inhibited the transcriptional activity of Hdac1, P2rx7 and Asc. Data are shown as means±SEM.**P < 0.01 vs control; #P < 0.05 vs CS |
|
| 图 4 Activation of markers of apoptosis activation induced by CS exposure inhibited by TSA (x±s, n=3) Blots of expression of apoptosis related proteins in three groups. *P < 0.05 vs control; #P < 0.05; ##P < 0.01 vs CS |
CS混合物中含有碳氢类化合物,醇类,酚类,醛类,酮类,生物碱类,酸类和重金属等多种有害的化学物质,这些有害物质能够导致女性生殖功能受损。有研究报道,CS暴露可通过AMP激活的蛋白激酶(adenosine 5’-monophosphate-activated protein kinase,AMPK)途径诱导自噬级联反应,以及抑制抗自噬相关蛋白AKT和mTOR的表达,导致卵巢卵泡丢失[11],同时,临床研究表明,CS暴露后可能通过多种途径导致卵巢雌激素合成减少[12],因此,CS暴露能够损伤女性卵巢功能。虽然关于CS暴露导致卵巢损伤使女性生育能力受损的报道很多,但是关于CS暴露导致子宫损伤的作用和机制的研究较少。子宫在女性生育过程中发挥重要的作用,如果子宫组织发生结构改变,可影响受精卵的着床,胚胎发育和激素分泌等多个过程,进而使女性生育能力受损。仅有的文献证实,口服尼古丁可以导致大鼠子宫组织重量减少、使上皮组织、子宫肌层和子宫内膜变薄[4]。本实验使用CS暴露30 d的方法建立了小鼠子宫损伤模型,研究发现,CS暴露导致C57 BL/6小鼠子宫组织结构形态学改变,包括子宫肌层和子宫内膜变薄,子宫腺体组织和间质细胞也明显减少。本研究CS暴露30 d后C57 BL/6小鼠子宫组织发生的结构变化和文献报道的CS暴露导致的大鼠子宫组织结构改变相似。TSA是一种泛去乙酰化酶抑制剂,可以通过改变蛋白质的乙酰化水平调节蛋白质的功能。关于TSA的治疗作用已经有多篇文献进行了报道,例如TSA可以改善大鼠肾上腺嗜铬细胞瘤导致的PC12细胞缺血性损伤[5]。我们的前期研究结果发现CS暴露能够通过激活HDAC1/2导致子宫肌层和子宫内膜变薄,而TSA可以抑制HDAC1/2和mTOR的活化重新激活自噬,从而缓解CS暴露引起的子宫组织形态改变[6]。因此,我们的CS暴露方法可以成功制作出子宫损伤的小鼠动物模型,为进一步揭示CS暴露导致子宫损伤的机制提供了很好的前期基础。由于CS含有多种复杂的有害成分,所以,关于CS暴露导致的子宫损伤的机制还需要我们进一步探索,为临床治疗吸烟引起的女性不孕提供新的靶标。
在本研究中我们发现CS暴露导致小鼠子宫组织中P2RX7、细胞焦亡相关蛋白(ASC、NLRP3、IL-1β和cleaved caspase-1)和细胞凋亡相关蛋白(cleaved caspase-3和cleaved caspase-9)的表达水平升高。因此,CS暴露可能通过P2RX7介导的细胞焦亡和凋亡导致子宫组织形态学改变。细胞焦亡是一种主要由炎性小体介导的程序性细胞死亡方式,通过切割GSDMD蛋白在细胞膜上打孔,改变细胞渗透压使细胞膨胀,释放内容物和相关炎症因子导致机体炎症反应的发生,在机体免疫调节中发挥重要作用。细胞凋亡也是一种程序性细胞死亡方式,它的发生主要依赖于半胱天冬酶caspase-3、6、8等,伴随着凋亡小体的形成,由细胞膜对细胞内容物进行包裹,再由巨噬细胞对其进行非炎症性吞噬,进而维持机体内环境的稳定[13]。研究发现,细胞焦亡和凋亡在子宫的某些病理损伤变化中发挥着重要作用。例如金黄色葡萄球菌通过诱导子宫组织发生细胞焦亡和凋亡引起子宫内膜炎[14],顺铂在雌性大鼠卵巢和子宫组织中能够参与氧化应激、炎症反应和细胞凋亡的发生等[15]。以上发现均表明细胞焦亡和凋亡在子宫组织的发育过程中发挥了重要作用,因此,抑制炎症反应和细胞凋亡都有可能治疗子宫的病理损伤变化。P2RX7受体是同源三聚体配体门控阳离子通道,其特征在于有2个跨膜结构域,这种受体已在全身多种细胞中发现,但是在免疫细胞中表达最多。ATP是P2RX7受体的天然配体,胞外ATP激活受体会引起Ca2+、Na+和K+在质膜上的流动。P2RX7受体可以引起Ca2+的强烈增加和caspase的裂解来启动细胞凋亡,还可通过激活caspase-1和NLRP3来启动细胞焦亡。P2RX7参与了很多疾病的发展过程,研究发现P2RX7抑制剂具有治疗多种疾病的潜力,包括神经退行性疾病、精神疾病、癫痫和肌肉骨骼疾病等[16]。关于CS暴露后P2RX7介导的细胞焦亡导致慢性阻塞性肺病肺组织损伤的报道很多[9]。但是P2RX7受体在子宫中相关功能的研究很少,仅有的文献证实,P2RX7受体能够介导人宫颈上皮细胞凋亡[10]。迄今为止,CS暴露后P2RX7受体在子宫组织中的作用尚未有人进行研究。关于P2RX7介导的细胞焦亡和凋亡在CS暴露所致的子宫损伤中是否发挥作用尚不清楚。本研究证实了P2RX7介导的细胞焦亡和凋亡参与了CS暴露导致的雌性小鼠子宫损伤。然而,P2RX7受体是否参与TSA对CS暴露导致的子宫组织损伤的缓解作用还未有人进行研究。本研究发现,TSA抑制了CS暴露导致的P2RX7、细胞焦亡相关蛋白(ASC、NLRP3、IL-1β和cleaved caspase-1)和细胞凋亡相关蛋白(cleaved caspase-3和cleaved caspase-9)的表达水平升高,并且TSA抑制了CS暴露导致的子宫组织Hdac1、P2rx7、Asc mRNA转录水平升高。因此,本研究证实P2RX7介导的细胞焦亡和凋亡参与了TSA缓解的CS暴露所致的小鼠子宫损伤过程。CS暴露后子宫组织Il-1β的mRNA转录水平与蛋白表达水平不一致,我们推测可能存在其它复杂的转录调控机制影响Il-1β的mRNA转录水平,未来我们会进一步进行探索。
综上所述,P2RX7介导的细胞焦亡和凋亡参与TSA缓解的烟草烟雾暴露所致的小鼠子宫损伤过程。本研究为TSA靶向治疗烟草烟雾暴露导致的女性生育能力受损提供了依据,为阐明烟草烟雾暴露导致女性不孕的机制奠定了基础,对未来治疗吸烟引起的女性不孕提供一定的指导意义。
( 致谢: 感谢中国医科大学附属盛京医院实验研究中心提供实验平台 )
| [1] |
Paixão L L, Gasparreis R P, Gonzalez G P, et al. Cigarette smoke impairs granulosa cell proliferation and oocyte growth after exposure cessation in young Swiss mice: an experimental study[J]. J Ovarian Res, 2012, 5(1): 25. doi:10.1186/1757-2215-5-25 |
| [2] |
Dechanet C, Anahory T, Mathieu Daude J C, et al. Effects of cigarette smoking on reproduction[J]. Hum Reprod Update, 2011, 17(1): 76-95. doi:10.1093/humupd/dmq033 |
| [3] |
Halder S, Trauth S, Pearce A R. Oral nicotine alters uterine histo-morphology but does not disrupt the estrous cycle in female rats[J]. Nicotine Tob Res, 2016, 18(5): 590-5. doi:10.1093/ntr/ntv134 |
| [4] |
Kim S M, Hwang K A, Go R E, et al. Exposure to cigarette smoke via respiratory system may induce abnormal alterations of reproductive organs in female diabetic rats[J]. Environ Toxicol, 2019, 34(1): 13-21. |
| [5] |
越茂松, 黄琼, 王进京, 等. 曲古抑菌素A对缺糖/缺氧损伤PC12细胞的保护作用[J]. 中国药理学通报, 2013, 29(5): 688-92. Yue M S, Huang Q, Wang J J, et al. Protective effect of TSA on PC12 cell injury induced by the deprivation of oxygen/glucose[J]. Chin Pharmacol Bull, 2013, 29(5): 688-92. doi:10.3969/j.issn.1001-1978.2013.05.021 |
| [6] |
Ding J, Liu B, Han P, et al. Trichostatin A inhibits uterine histomorphology alterations induced by cigarette smoke exposure in mice[J]. Life Sci, 2019, 228: 112-20. doi:10.1016/j.lfs.2019.04.069 |
| [7] |
Li X, Zhou L, Feng Y H, et al. The P2X7 receptor: A novel biomarker of uterine epithelial cancers[J]. Cancer Epidemiol Biomarkers Prev, 2006, 15(10): 1906-13. doi:10.1158/1055-9965.EPI-06-0407 |
| [8] |
Miyoshi H, Yamaoka K, Urabe S, et al. Functional expression of purinergic P2X7 receptors in pregnant rat myometrium[J]. Am J Physiol Regul Integr Comp Physiol, 2010, 298(4): R1117. doi:10.1152/ajpregu.00507.2009 |
| [9] |
Eltom S, Belvisi M G, Stevenson C S, et al. Role of the inflammasome-caspase1/11-IL-1/18 axis in cigarette smoke driven airway inflammation: an insight into the pathogenesis of COPD[J]. PLoS One, 2014, 9(11): e112829. doi:10.1371/journal.pone.0112829 |
| [10] |
Wang Q, Wang L, Feng Y H, et al. P2X7 receptor-mediated apoptosis of human cervical epithelial cells[J]. Am J Physiol Cell Physiol, 2004, 287(5): C1349-58. |
| [11] |
Furlong H C, Stampfli M R, Gannon A M, et al. Cigarette smoke exposure triggers the autophagic cascade via activation of the AMPK pathway in mice[J]. Biol Reprod, 2015, 93(4): 93. |
| [12] |
Marom-Haham L, Shulman A. Cigarette smoking and hormones[J]. Curr Opin Obstet Gynecol, 2016, 28(4): 230. doi:10.1097/GCO.0000000000000283 |
| [13] |
杨祥, 开钧, 王志敏, 等. 细胞焦亡在慢性肝脏疾病中作用的研究进展[J]. 中国药理学通报, 2018, 34(12): 1638-42. Yang X, Kai J, Wang Z M, et al. Advances in role of pyroptosis for chronic liver disease[J]. Chin Pharmacol Bull, 2018, 34(12): 1638-42. doi:10.3969/j.issn.1001-1978.2018.12.003 |
| [14] |
Wang X, Yuan T, Yin N, et al. Luteoloside protects the uterus from staphylococcus aureus-induced inflammation, apoptosis, and injury[J]. Inflammation, 2018, 41(5): 1702-16. doi:10.1007/s10753-018-0814-7 |
| [15] |
Kaygusuzoglu E, Caglayan C, Kandemir F M, et al. Zingerone ameliorates cisplatin-induced ovarian and uterine toxicity via suppression of sex hormone imbalances, oxidative stress, inflammation and apoptosis in female wistar rats[J]. Biomed Pharmacother, 2018, 102: 517-30. doi:10.1016/j.biopha.2018.03.119 |
| [16] |
Geoffrey B. Purinergic signalling: Therapeutic developments[J]. Front Pharmacol, 2017, 8: 661. doi:10.3389/fphar.2017.00661 |

